HPLC-DAD法同时测定八珍颗粒中五种成分
吕佳佳,陈 庆,王 森,陈 莉,满雪玉,熊永爱
(1.遵义医学院 药学院药剂学教研室,贵州 遵义 563099;2.遵义医学院 国家药学实验教学示范中心,贵州 遵义 563099)
技术与方法
HPLC-DAD法同时测定八珍颗粒中五种成分
吕佳佳1,陈 庆1,王 森1,陈 莉1,满雪玉2,熊永爱1
(1.遵义医学院 药学院药剂学教研室,贵州 遵义 563099;2.遵义医学院 国家药学实验教学示范中心,贵州 遵义 563099)
目的 建立HPLC-DAD法用于同时测定八珍颗粒中芍药苷、毛蕊花糖苷、甘草苷、阿魏酸和甘草酸铵的方法。方法 采用Diamonsil Plus C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-0.1%磷酸水溶液梯度洗脱,检测波长为237 nm,流速1.0 mL/min,柱温37 ℃,进样量10 μL。结果 芍药苷、毛蕊花糖苷、甘草苷、阿魏酸和甘草酸铵在上述色谱条件下具有良好的分离度;其线性范围分别为9.905~138.670 μg/mL(r=0.999 8)、2.632~36.848 μg/mL(r=0.999 5)、1.372~19.208 μg/mL(r=0.999 8)、1.596~22.344 μg/mL(r=0.999 7)、9.828~137.585 μg/mL(r=0.999 4);方法精密度RSD值<1.0%,重复性RSD值<3.0%,待测样品在室温下放置24 h内稳定;平均加样回收率在96.71%~100.36%,RSD值<3.0%;不同厂家的6批八珍颗粒中芍药苷、毛蕊花糖苷、甘草苷、阿魏酸和甘草酸铵质量分数分别为1.462 6~2.254 0 mg/g、0.253 3~0.274 9 mg/g、0.142 7~0.305 4 mg/g、0.062 3~ 0.084 6 mg/g、80.642 3~1.138 7 mg/g。结论 该方法分离度好,简便易行,重现性好,可用于八珍颗粒的质量控制。
八珍颗粒;HPLC-DAD;芍药苷;毛蕊花糖苷;甘草苷
八珍颗粒(Bazhen granule,BG)收载在2015年版《中国药典》中药成方制剂中,具有补气益血作用,用于气血两虚、面色萎黄、食欲不振、四肢乏力和月经过多等症状[1]。原方出自于明朝的《正体类要》,为四物汤和四君子汤的复方。因本方集两方为一方,且主方中八味药物皆为补气养血之珍品,故名“八珍汤”[2]。现代药理研究发现,扶正中药对肿瘤化疗有增效减毒的作用[3],八珍颗粒除了治疗妇科疾病外[4],在化疗引起的细胞免疫功能低下方面具有显著作用[5-9]。魏开建等[10]研究表明,八珍颗粒能促进中晚期气血两虚型恶性肿瘤患者免疫功能的恢复和提高。郭经锋等[11]研究表明,八珍颗粒联合紫杉醇、卡铂治疗晚期非小细胞肺癌,在降低毒性反应、增强细胞免疫方面具有较好优势。处方中主要由党参、炒白术、茯苓、炙甘草、当归、炒白芍、川芎和熟地黄8味药材组成。其中甘草苷和甘草酸为炙甘草的主要化学成分;阿魏酸为当归和川芎的主要化学成分;芍药苷为白芍的主要化学成分;毛蕊花糖苷为熟地黄的主要化学成分。
目前,《中国药典》2015版中对于八珍颗粒的质量标准在含量测定项下仅用芍药苷一种成分的量来衡量该药物的质量。通过文献检索发现[12-16],为更加合理地控制制剂质量,同时测定制剂中不同成分含量的研究已有报道,而关于八珍颗粒的制备工艺研究或成分的含量研究中仍主要以芍药苷1种成分进行定量测定,未发现同时测定八珍颗粒中多种成分的报道。针对八珍颗粒的质量控制标准,本实验利用HPLC-DAD法对其中5种成分进行同时测定。
1 材料与方法
1.1 药品与试剂 党参、炒白术、茯苓、炙甘草、当归、炒白芍、川芎和熟地黄8味处方饮片均购自成都新荷花饮片有限公司,由遵义医学院生药学杨建文教授鉴定上述药材均为《中国药典》2015版记载正品。对照品芍药苷(批号151120,质量分数98.50%)、毛蕊花糖苷(批号160526,质量分数98.26%)、阿魏酸(批号16011402,质量分数98.06%)、甘草苷(批号160421,质量分数97.88%)、甘草酸铵(批号151013,质量分数97.52%),均购于成都普菲德生物技术有限公司。八珍颗粒,批号151102、151412、160127由四川禾邦阳关制药股份有限公司提供;批号160519、160723、160108由宁波立华制药有限公司提供。甲醇、乙睛为色谱纯,水为超纯水,其余试剂均为分析纯。
1.2 仪器 Agilent 1260型高效液相色谱仪,包括四元泵、DAD检测器、在线真空脱气机、Chemstation工作站(美国Agilent 公司);BT125D型分析天平,十万分之一[赛多利斯科学仪器(北京)有限公司];T9CS双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);DL-820D型智能超声波清洗器(上海之信仪器有限公司);DURA12纯水机(上海和泰仪器有限公司)。
1.3 方法
1.3.1 色谱条件 采用Diamonsil Plus C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-0.1%磷酸水溶液,梯度洗脱:0~5 min,5%~10%乙睛;5~30 min,10%~60%乙睛;30~40 min,60%~80%乙睛;40~48 min,80%~5%乙睛;检测波长:237 nm;流速为1.0 mL/min;柱温37 ℃;进样量10 μL。
1.3.2 对照品溶液的制备 精密称取芍药苷、毛蕊花糖苷、甘草苷、阿魏酸和甘草酸铵对照品适量,分别置于10 mL容量瓶中,加甲醇溶解并定容至刻度,制备成质量浓度分别为甘草苷0.196 mg/mL、甘草酸铵1.433 mg/mL、芍药苷1.415 mg/mL、毛蕊花糖苷0.376 mg/mL、阿魏酸0.228 mg/mL的对照品储备液,备用。再精密吸取各对照品储备液3.5 mL于25 mL量瓶中,加甲醇定容至刻度,制得混合对照品溶液,4 ℃避光保存,备用。
1.3.3 供试品溶液的制备 将八珍颗粒研细后称取约0.5 g,精密称定,置于具塞锥形瓶中,精密加入50%甲醇25 mL,密塞,称定重量,超声处理(功率120 W,频率59 kHz)30 min,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,过滤,取续滤液,即得。
1.3.4 阴性对照溶液的制备 按照八珍颗粒的处方比例和制备工艺,分别制备缺少党参、茯苓、炒白术药材的阴性对照样品;缺少炙甘草药材的阴性对照样品;缺少当归和川芎药材的阴性对照样品;缺少白芍药材的阴性对照样品;缺少熟地黄药材的阴性对照样品;并按照“1.3.3”项下方法制备各阴性对照溶液。
1.3.5 专属性实验 分别精密吸取“1.3.2”项下混合对照品溶液、“1.3.3”项下供试品溶液、“1.3.4”项下阴性对照溶液,按照“1.3.1”项下色谱条件进行分析。
1.3.6 线性关系的考察 精密吸取上述对照品储备液0.5、1.0、1.5、2.0、3.0、5.0、7.0 mL于10 mL容量瓶中,加甲醇定容至刻度,摇匀,得系列混合对照品溶液,按照“1.3.1”项下色谱条件进行测定。
1.3.7 精密度试验 精密吸取混合对照品溶液10 μL,按照“1.3.1”项下色谱条件重复进样6次,测定峰面积,分别计算各组分峰面积的RSD值。
1.3.8 重复性试验 称取同一批八珍颗粒(批号:151102)6份,每份0.5 g,精密称定,按“1.3.3”项下方法平行制备6份样品。HPLC进样测定,计算各待测成分的平均质量浓度和RSD值。
1.3.9 稳定性试验 称取八珍颗粒(批号:151102)0.5 g,按“1.3.3”项下方法制备供试品溶液,再按“1.3.1”项下色谱条件分别于0、2、4、8、12、24 h进样测定,测定各成分峰面积。
1.3.10 加样回收率试验 取已知含量的八珍颗粒(批号:151102)6份,每份约0.25 g,精密称定,置具塞锥形瓶中,每份中分别精密加入芍药苷对照品3.67 mL(质量浓度为0.203 2 mg/mL),毛蕊花糖苷对照品0.36 mL(质量浓度为0.376 mg/mL),甘草苷对照品0.49 mL(质量浓度为0.295 2 mg/mL),阿魏酸对照品0.185 mL(质量浓度为0.228 mg/mL),甘草酸铵对照品2.525 mL(质量浓度为0.221 6 mg/mL),按“1.3.3”项下方法制备供试品溶液,“1.3.1”项下色谱条件进行测定,分别计算各待测成分的回收率。
1.3.11 样品含量测定 分别取不同厂家不同批次的八珍颗粒,按“1.3.3”项下方法制备供试品溶液,制备好后按“1.3.1”项下色谱条件进样,记录色谱图并计算样品中5个成分的含量。
2 结果
2.1 专属性实验 分别精密吸取混合对照品溶液、供试品溶液、以及阴性对照溶液,按照“1.3.1”项下色谱条件进行分析,供试品中各待测成分色谱峰的分离度均大于1.5,峰形良好,各阴性对照溶液在相应位置没有出现色谱峰,表明方法专属性良好。色谱图见图1。
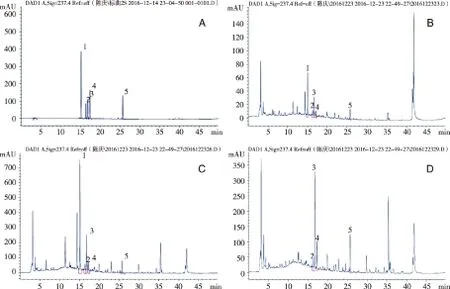
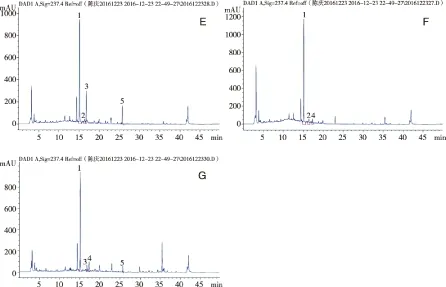
A:混合对照品;B:八珍颗粒供试品;C:缺党参、炒白术、茯苓阴性对照;D:缺白芍阴性对照;E:缺当归、川芎阴性对照;F:缺甘草阴性对照;G:缺熟地黄阴性对照。1:芍药苷;2:毛蕊花糖苷;3:甘草苷;4:阿魏酸;5:甘草酸铵。图1 HPLC-DAD色谱图
2.2 线性关系的考察 将系列混合对照品溶液按照“1.3.1”项下色谱条件进行测定,以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得到5个成分的标准曲线方程,相关系数(r)和线性范围(见表1)。
表1 八珍颗粒中5种成分的线性关系

成分线性方程r线性范围(μg/mL)芍药苷Y=11.941X-6.01110.99989.905~138.670毛蕊花糖苷Y=9.512X-1.90730.99952.632~36.848甘草苷Y=24.632X-2.93080.99981.372~19.208阿魏酸甘草酸Y=34.359X-4.8533Y=4.585X-35.0240.99970.99941.596~22.3449.828~137.585
2.3 精密度、稳定性、重复性试验 根据各测定结果计算芍药苷、毛蕊花糖苷、甘草苷、阿魏酸和甘草酸铵的RSD(n=6)值和平均质量浓度。结果(见表2)表明,仪器精密度良好,同时供试品溶液在24 h内稳定性良好,该方法的稳定性良好。
表2 精密度、稳定性、重复性试验结果(n=6)
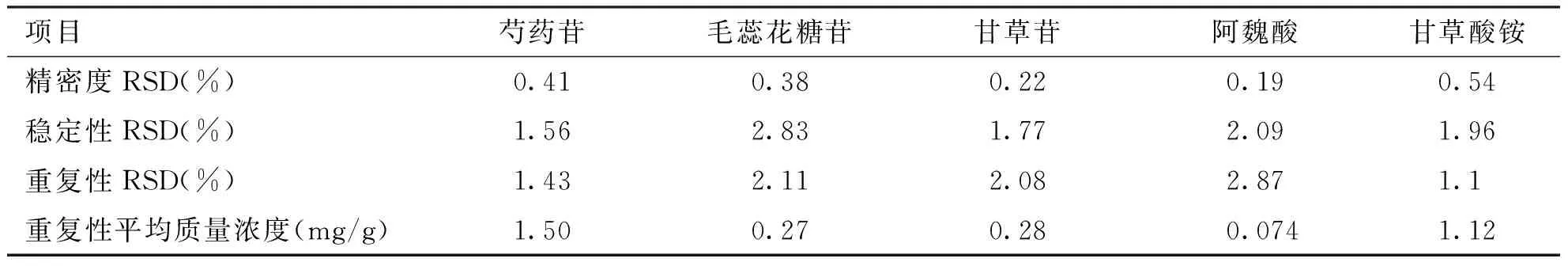
项目芍药苷毛蕊花糖苷甘草苷阿魏酸甘草酸铵精密度RSD(%)0.410.380.220.190.54稳定性RSD(%)1.562.831.772.091.96重复性RSD(%)1.432.112.082.871.1重复性平均质量浓度(mg/g)1.500.270.280.0741.12
2.4 加样回收率试验 将“1.3.10”项下加样回收率试验供试品溶液进行测定和计算,结果(见表3)表明,方法的准确性良好。
表3 加样回收率试验结果
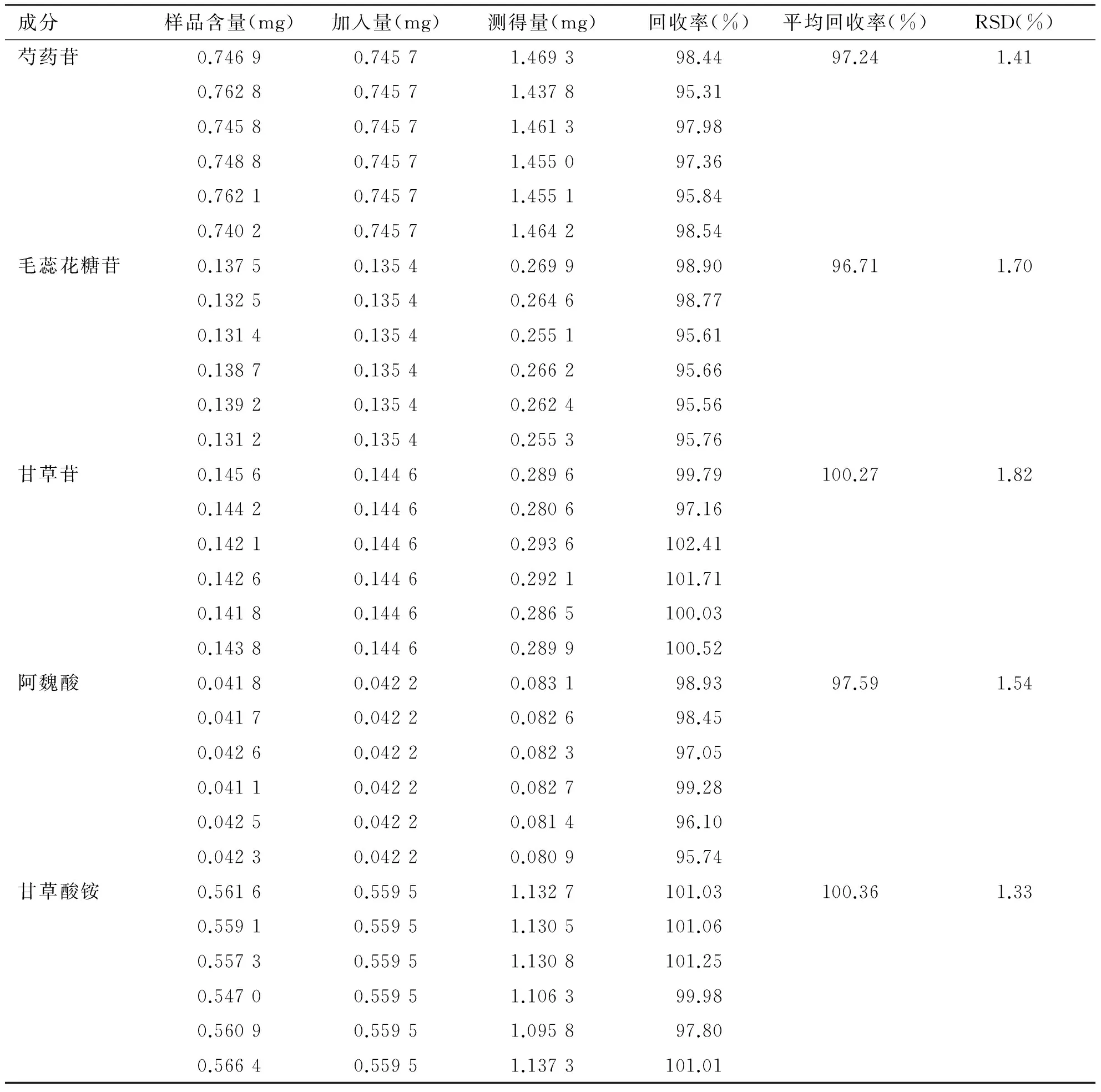
成分样品含量(mg)加入量(mg)测得量(mg)回收率(%)平均回收率(%)RSD(%)芍药苷0.74690.74571.469398.4497.241.410.76280.74571.437895.310.74580.74571.461397.980.74880.74571.455097.360.76210.74571.455195.840.74020.74571.464298.54毛蕊花糖苷0.13750.13540.269998.9096.711.700.13250.13540.264698.770.13140.13540.255195.610.13870.13540.266295.660.13920.13540.262495.560.13120.13540.255395.76甘草苷0.14560.14460.289699.79100.271.820.14420.14460.280697.160.14210.14460.2936102.410.14260.14460.2921101.710.14180.14460.2865100.030.14380.14460.2899100.52阿魏酸0.04180.04220.083198.9397.591.540.04170.04220.082698.450.04260.04220.082397.050.04110.04220.082799.280.04250.04220.081496.100.04230.04220.080995.74甘草酸铵0.56160.55951.1327101.03100.361.330.55910.55951.1305101.060.55730.55951.1308101.250.54700.55951.106399.980.56090.55951.095897.800.56640.55951.1373101.01
2.5 样品含量测定 计算样品中5个成分的含量,结果(见表4)。
表4 八珍颗粒中5种成分的测定结果(n=3)
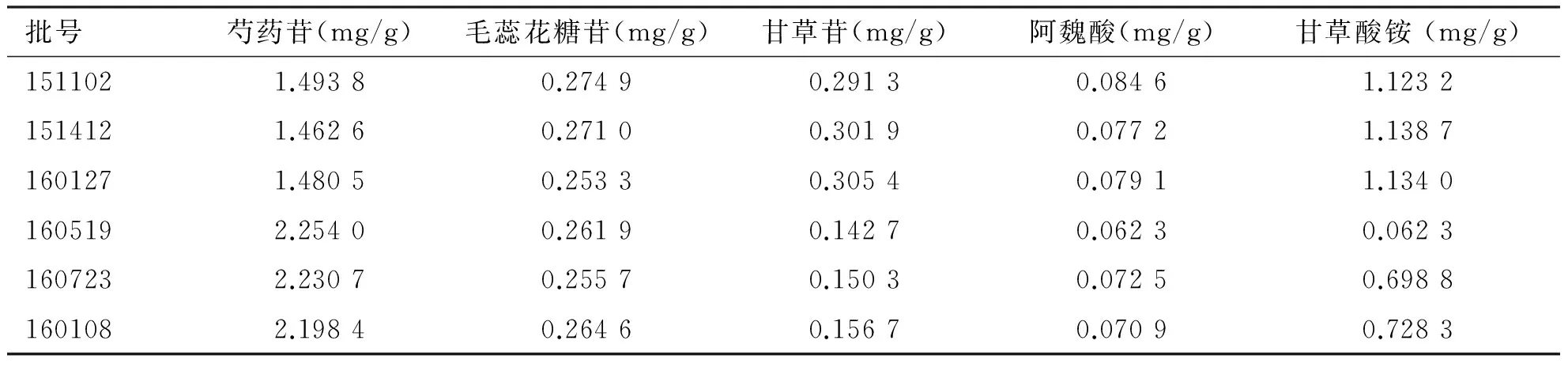
批号芍药苷(mg/g)毛蕊花糖苷(mg/g)甘草苷(mg/g)阿魏酸(mg/g)甘草酸铵(mg/g)1511021.49380.27490.29130.08461.12321514121.46260.27100.30190.07721.13871601271.48050.25330.30540.07911.13401605192.25400.26190.14270.06230.06231607232.23070.25570.15030.07250.69881601082.19840.26460.15670.07090.7283
3 讨论
根据八珍颗粒中5种主要成分的理化性质与色谱行为,分别比较了甲醇-水、乙睛-水、乙睛-0.1%磷酸水溶液、甲醇-0.1%磷酸水溶液作为流动相梯度洗脱,结果表明,以甲醇-水或甲醇-0.1%磷酸水溶液作为流动相时,整体峰形较差,对称性不好,样品中甘草苷和阿魏酸分离度也不好,改为乙睛-0.1%磷酸水溶液后,样品中各成分分离效果明显改善,且峰形较好。
通过查阅文献及紫外扫描可知,芍药苷在230 nm处有最大吸收,甘草苷、甘草酸铵最大吸收为237 nm,毛蕊花糖苷最大吸收为332 nm,阿魏酸的最大吸收为316 nm,初期实验中毛蕊花糖苷和阿魏酸的检测波长定为330 nm,其余3个成分的检测波长定为237 nm,但实验过程中发现237 nm处同时能检测出毛蕊花糖苷和阿魏酸2个色谱峰,并且峰面积与330 nm处相当,因此本实验将5个成分的检测波长都定为237 nm。
在样品含量测定中发现,各批次的八珍颗粒中5种指标性成分的含量存在差异,但同一厂家的不同批次含量差异明显小于不同厂家之间的含量差异,如立华制药的八珍颗粒中芍药苷含量明显高于禾邦制药的八珍颗粒,而其余4种成分均比禾邦低,产生这一现象可能与原药材产地、采收季节以及生产工艺等差异所致。
本实验首次建立HPLC-DAD法同时测定八珍颗粒中5种成分的含量,该方法灵敏度高、简便易行、结果准确,可作为八珍颗粒多指标定量测定方法,对八珍颗粒的质量控制提供理论依据。
[1] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2015:463-464.
[2] 尚雨嫣.基于代谢组学的四君子汤、四物汤、八珍汤对14月龄雌性小鼠的作用[D].哈尔滨:黑龙江中医药大学,2016.
[3] 黄茜,祝彼得.八珍汤临床应用及实验研究进展[J].检验医学与临床,2011,8(19):2377-2379.
[4] 黄飞华,裘维焰,陆传宝,等.八珍颗粒治疗气血两虚型月经不调61例临床观察[J].中国中医药科技,2009,16(3):236-237.
[5] 孙卓.八珍颗粒联合化疗治疗晚期乳腺癌30例临床观察[J].中医中药,2009,16(11):121-122.
[6] 李小军,冯春兰,罗海亮,等.八珍汤辅助化疗治疗中晚期食管癌45例临床观察[J].中医杂志,2016,57(5):416-419.
[7] 陈俊强,刘健,钟莲花,等.食管癌术后放化疗联合中药八珍颗粒的疗效观察[J].肿瘤基础与临床,2010,23(5):405-407.
[8] 高尚峰,王新胤,潘婧.八珍颗粒配合腹腔化疗对进展期胃癌患者术后的影响[J].华北煤炭医学院学报,2006,8(2):199-200.
[9] 魏开建,杜建.八珍颗粒对中晚期气血两虚型恶性肿瘤患者微量元素、免疫功能影响的临床研究[J].福建中医药大学学报,2011,21(2):11-13.
[10] 魏开建,杜建.八珍颗粒对中晚期气血两虚型恶性肿瘤患者免疫功能的影响[J].中医药导报,2010,16(12):25-28.
[11] 郭经锋,吴锋,邢辉,等.八珍颗粒联合紫杉醇、卡铂方案治疗老年晚期非小细胞肺癌的疗效观察[J].临床和实验医学杂志,2015,14(6):449-452.
[12] 胡双丰.反相高效液相色谱法测定八珍颗粒中芍药苷含量研究[J].中国现代应用药学杂志,2005,22(6):491-493.
[13] 谢静,雷灼雨,蒋万浪.高效液相色谱法测定八珍颗粒中芍药苷含量[J].中国药业,2008,17(13):26-27.
[14] 洪梅,施法.HPLC法测定加味八珍益母颗粒中盐酸水苏碱的含量[J].中国药事,2009,23(11):1113-1114.
[15] 李顺意,蔡敏,韩凤梅,等.高效液相色谱法测定八珍益母颗粒中芍药苷和阿魏酸的含量[J].中国中药杂志,2001,26(9):631-632.
[16] 张艳,周旭美,姚晓东,等.HPLC-ELSD测定绥阳山银花中绿原酸和灰毡毛忍冬皂苷乙的含量[J].遵义医学院学报,2013,36(6):575-577.
[收稿2016-12-12;修回2017-02-27]
(编辑:谭秀荣)
Simultaneous determination of five constituents in Bazhen Granule by HPLC-DAD
LyuJiajia1,ChenQing1,WangSen1,ChenLi1,ManXueyu2,XiongYongai1
(1.Department of Pharmacy,Pharmacy School of Zunyi Medical University,Zunyi Guizhou 563099,China;2.National Experimental Teaching Demonstration Center of Pharmacy,Zunyi Medical University,Zunyi Guizhou 563099,China)
Objective To establish an HPLC-DAD method for the simultaneous determination of paeoniflorin,verbascoside,liquiritin,ferulic acid,and ammonium glycyrrhetate in Bazhen granules (BG).Methods The chromatographic separation was performed on a Diamonsil Plus C18column (250 mm×4.6 mm,5 μm),adopting gradient elution of acetonitrile-0.1% phosphate acid solution and the column temperature was 37 ℃.The detection wavelength was set at 237 nm and the flow rate was 1.0 mL/min.The injection volume was 10 μL.Results The five components were well separation under the determined chromatographic conditions.The linear ranges of paeoniflorin,verbascoside,liquiritin,ferulic acid,and ammonium glycyrrhetate were 9.905-138.670 μg/ml (r=0.999 8),2.632-36.848 μg/ml (r=0.999 5),1.372-19.208 μg/ml (r=0.999 8),1.596-22.344 μg/ml (r=0.999 7) and 9.828-137.585 μg/mL(r=0.999 4),respectively.The RSD of precision was less than 1% and the RSD of repeatability was less than 3%.Tthe sample solution was stable during 24 h.The average recoveries (n=6) were between 96.71%-100.36% and the RSDs were all less than 3.0%.The content ranges of paeoniflorin,verbascoside,liquiritin,ferulic acid,and ammonium glycyrrhetate in different manufactures of BG were 1.462 6-2.254 0 mg/g,0.253 3-0.274 9 mg/g,0.142 7-0.305 4 mg/g,0.062 3-0.084 6 mg/g,0.642 3-1.138 7 mg/g,respectively.Conclusion The method is simple and convenient with good separating capacity,and could be used for the quality control of BG with satisfactory repeatability.
Bazhen granules;HPLC-DAD;paeoniflorin;verbascoside;liquiritin
遵义医学院硕士启动基金资助项目(NO:F-751)。
熊永爱,男,博士,副教授,研究方向:药物新剂型与新技术,E-mail:625221174@qq.com。
R917
A
1000-2715(2017)02-0208-06

