内毒素耐受状态下胸腺细胞TCRβ链CDR3区多态性和长度的变化
贾 力,陶弋婧,赵娟娟,郭萌萌,陈 超,褚风云,王海嵘,刘 云,罗军敏,姚新生,徐 林
(1.遵义医学院 免疫学教研室暨贵州省生物治疗人才基地,贵州 遵义 563099;2.遵义医学院 贵州省普通高等学校特色药物肿瘤防治特色重点实验室,贵州 遵义 563099)
基础医学研究
内毒素耐受状态下胸腺细胞TCRβ链CDR3区多态性和长度的变化
贾 力1,2,陶弋婧1,2,赵娟娟1,2,郭萌萌1,2,陈 超1,2,褚风云1,2,王海嵘1,2,刘 云2,罗军敏1,2,姚新生1,2,徐 林1,2
(1.遵义医学院 免疫学教研室暨贵州省生物治疗人才基地,贵州 遵义 563099;2.遵义医学院 贵州省普通高等学校特色药物肿瘤防治特色重点实验室,贵州 遵义 563099)
目的 研究内毒素耐受状态下小鼠胸腺T细胞TCRβ链CDR3多态性和长度的变化,并探讨其意义。方法 以5 mg/kg浓度LPS腹腔注射C57BL/6小鼠建立内毒素耐受模型,5 mg/kg浓度生理盐水腹腔注射72 h后为对照组,提取对照组、模型后72 h实验组和8 d实验组的小鼠胸腺组织RNA,并逆转录为cDNA;以22条TRBV基因家族序列设计上游引物,TRBJ1-1基因家族序列设计下游引物,PCR扩增出完整的TCRβ链CDR3区;毛细管电泳技术分析TCRβ链CDR3区的多态性和长度。结果 正常小鼠胸腺样本多数呈现中间高两边低的正态性分布的TCRβ链CDR3谱型峰图,少数呈现偏峰、寡峰或低峰;LPS注射后72 h胸腺样本TCRβ链CDR3区呈现数量不等的偏峰、寡峰和低峰;模型8 d胸腺样本大多呈现多峰。此外,与正常组相比,模型72 h和8 d胸腺样本TCRβ链CDR3区产物长度均发生了不同程度的变化。结论 内毒素耐受状态下,小鼠胸腺细胞TCRβ链CDR3区的多态性和长度均发生了明显改变,为后续进一步研究该状态下胸腺细胞发育及功能变化提供前期实验基础。
内毒素;胸腺;TCRβ链CDR3区;小鼠
内毒素血症通常可导致全身炎症反应综合征、致死性感染性休克、多器官功能衰竭、弥漫性血管内凝血等的产生,导致高死亡率,严重威胁人类的生命健康[1]。现有研究表明,内毒素耐受在内毒素血症的发展过程中对机体起到重要保护作用[2-4]。近来文献进一步报道,内毒素耐受不仅与固有免疫细胞有关[5-7],而且T细胞等适应性免疫细胞同样参与了内毒素耐受的形成过程[8-9]。例如,Bommireddy等[9]发现,清除体内的T淋巴细胞能够抑制TGF-β敲除小鼠的炎症反应,减弱对LPS的敏感性,提高小鼠生存率。然而,在内毒素耐受状态下,T淋巴细胞等适应性免疫细胞的发育、抗原识别的变化及其意义仍鲜见报道。因此,本研究拟在前期建立小鼠内毒素耐受模型的基础上[10],进一步利用毛细管电泳技术,初步研究内毒素耐受状态下胸腺中T细胞TCR互补决定区3(Complementarity-determining regions-3,CDR3)多态性和长度的变化及其意义,以期为后续研究内毒素耐受状态下胸腺T细胞发育、抗原识别,以及与耐受关系提供新的实验基础。
1 材料与方法
1.1 材料与仪器 SPF级C57BL/6小鼠饲养于遵义医学院生物医学实验动物中心;Lipopolysaccharides购自Sigma公司;Legend Micro 21R型低温离心机购自Thermo公司;分析纯级氯仿、异丙醇、无水乙醇购自重庆川东化工公司;Premix Ex Taq Version2.0购自TaKaRa公司;PCR引物由Invitrogen(上海)生物技术有限公司合成。
1.2 方法
1.2.1 实验分组 用5 mg/kg LPS腹腔注射小鼠72 h、8 d后为内毒素耐受实验组,并以相同剂量生理盐水腹腔注射小鼠72 h后为对照组。
1.2.2 小鼠胸腺组织总RNA提取和逆转录 按上述方式建立对照组和实验组,分别取出3组小鼠胸腺后至于PBS中浸润清洗,称其重量。运用高通量组织研磨器,70 Hz,15 s研磨组织,重复3次,将组织制备成匀浆液。以50~100 mg/mL匀浆液加入1 mL TRIzol,涡旋 15 s,室温静置5 min。然后将匀浆样品于4 ℃,12 000 rpm离心10 min,取澄清匀浆液,加入200 μL氯仿,涡旋 15 s,室温静置3 min。4 ℃,12 000 rpm离心15 min,吸取上层无色水相至新EP管中,加入等体积异丙醇,充分混匀,室温静置10 min,4 ℃,12 000 rpm离心10 min,弃上清;加入75%乙醇洗涤RNA沉淀,室温静置2 min。4 ℃,7 500 rpm离心5 min,彻底弃上清,室温放置10~15 min。每管加入50 μL焦碳酸二乙酯(DEPC)水溶解RNA沉淀。使用BioMate3S紫外分光亮度计测定RNA浓度和纯度。根据逆转录试剂盒说明,以总RNA为模板,Oligo(dt)为引物,逆转为cDNA。
1.2.3 引物设计与合成 引物参照文献[11]设计,合成小鼠TRBV基因家族上游引物22条,5'端带FAM标记的TRBJ1-1下游引物1条,由Invitrogen(上海)生物技术有限公司合成。
1.2.4 PCR扩增完整的CDR3区域 以上述逆转录产物cDNA为模板进行PCR扩增(按照Premix Ex Taq Version 2.0试剂盒说明书进行),反应体系如下:cDNA模板1 μL,TRBV各上游引物(10 mmol/L)0.5 μL,TRBJ1-1下游引物(10 mmol/L)0.5 μL,ddH2O 8 μL,Premix Ex Taq 10 μL,总体积20 μL。反应条件:①94 ℃ 3 min,1个循环;②94 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min,35个循环;③72 ℃ 10 min,1个循环。-20 ℃保存备用。扩增产物进行1%琼脂糖凝胶电泳分析。
1.2.5 CDR3区域长度及多态性分析 PCR扩增产物送Invitrogen(上海)生物技术有限公司进行毛细管电泳STR扩增产物扫瞄分析,利用GeneMapper 4.1软件分析CDR3区的谱型和多态性的变化。
2 结果
2.1 小鼠胸腺组织CDR3区扩增电泳图 分别对对照组和72 h、8 d实验组小鼠胸腺组织的TRBV1至TRBV31-TRBJ 1-1 CDR3各家族PCR产物进行电泳分析(见图1)。PCR产物均在100~350 bp出现明显扩增条带。
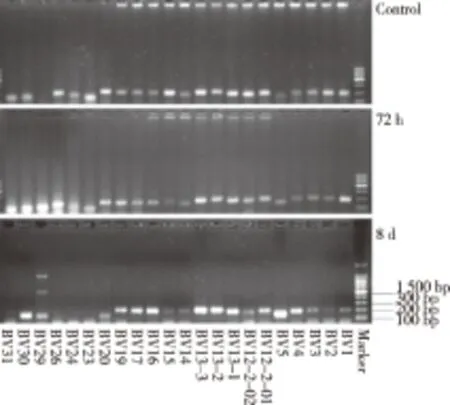
图1 内毒素耐受状态下C57BL/6小鼠胸腺TRBV1至TRBV31-TRBJ 1-1CDR3谱系的PCR产物电泳图
2.2 小鼠胸腺组织TRBV-1至TRBV-31-TRBJ1-1 CDR3区谱型分析 利用GeneMapper 4.1软件对毛细管电泳基因扫描结果进行分析(见图2),对照组胸腺样本多数呈现中间高两边低的正态性分布的TCRβ链CDR3谱型峰图,少数呈现偏峰、寡峰或低峰,如:BV2、BV13.2、BV17、BV23和BV30显示为偏峰;BV15显示为寡峰;BV12-2-02和BV29显示为低峰;此外,BV12-2-02和BV13.2家族出现两区段峰群,BV29呈现三区段峰群,提示个别家族存在差异。72 h实验组胸腺样本TCRβ链CDR3区则呈现出数量不等的偏峰、寡峰和低峰,如:BV3、BV4、BV13.2和BV29显示为偏峰;BV1和BV17显示为寡峰;BV12-2-02为低峰;BV16和BV31表现出多克隆性。8 d实验组胸腺样本的峰型大多呈多峰,提示T细胞为多克隆性;此外BV14显示为低峰。

图2 内毒素耐受状态下C57BL/6小鼠胸腺TRBV1至TRBV31~TRBJ1~1 CDR3区谱型图
2.3 各组胸腺样本TCR CDR3区长度分析 如图3所示,对照组的CDR3长度方面,各家族CDR3区最长和最短比较,表现为相差3-96个碱基(1-32个氨基酸),其中有10个BV基因家族的CDR3区呈现相差3个碱基的标准框架内重排;72 h实验组中,CDR3区最长和最短比较相差3~108个碱基(1~36个氨基酸),且大多数CDR3出现相邻的2个CDR31或2个碱基差异,均呈非正态分布;而BV24、BV29和BV31家族产物均为标准的3个碱基差异,进一步分析发现BV12-2-02、BV13.3、BV23和BV26出现两区段,且第二区段呈现相差3个碱基的标准峰群。8 d实验组中大多数BV家族呈现相差3个碱基的标准差异,且长度介于9~90个碱基(3~30个氨基酸),如:BV1、BV2、BV3、BV4、BV12-2-02、BV13.1、BV13.2等。
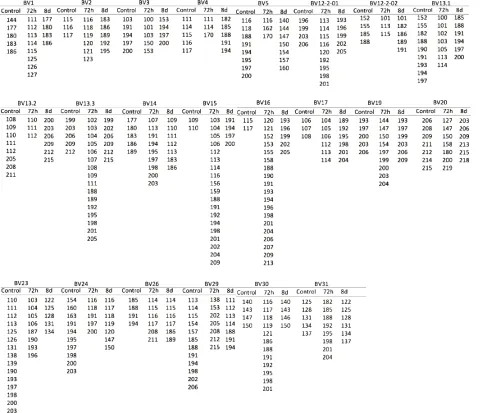
图3 内毒素耐受状态下C57BL/6小鼠胸腺TRBV1至TRBV31-TRBJ1-1各家族的TCR CDR3长度和多态性分析
3 讨论
胸腺是重要的中枢免疫器官,T细胞是胸腺中的主要细胞群体之一。TCR是T细胞表面关键的受体分子,属于免疫球蛋白超家族,是与抗原肽—MHC-Ⅰ/Ⅱ结合的关键部位,现已知约95%的TCR由α链和β链组成[12]。结构方面:TCR由可变区(variable,V)和恒定区(constant,C)构成。其中,编码可变区(V区)的基因包括V基因片段、D基因片段、J基因片段,编码恒定区(C区)基因为C基因片段。α链由AV、AJ、AC重排形成,β链由BV、BD、BJ、BC重排形成,且β链的重排先于α链。其中,BV基因片段末端、BD、BJ基因片段前端组成了TCR β链CDR3区,此外,在DJ、V-D-J、VJ连接时插入或剪切一定数量的核苷酸则造成了TCR的多样性[13-14]。在TCR抗原识别结构中,CDR3区的长度和序列决定了TCR的特异性,进而产生不同的T细胞克隆[15],而不同克隆的T细胞与抗原识别及免疫应答密切相关。因此,对T细胞的TCR长度和多态性的检测不仅有利于研究特定免疫状态下的T细胞应答情况,且对于包括感染性疾病、自身免疫性疾病和肿瘤等疾病发生机制研究及治疗策略开发均具有积极意义[16-18]。
近来研究表明,包括T细胞在内的多种免疫细胞参与了内毒素耐受过程[19-20]。例如,Melo等[19]研究发现,内毒素耐受状态下,T淋巴细胞凋亡途径的基因表达显著改变,并且LPS耐受使T细胞更倾向于向Th1型分化,这些改变对维持机体耐受起重要作用。我们在前期研究中也发现,内毒素耐受状态下,小鼠脾脏中Tregs的比例和功能均明显变化[21]。有意思的是,我们进一步发现胸腺中CD4+SP细胞绝对数显著减少,提示内毒素耐受状态下T淋巴细胞的发育也存在改变[10]。本研究中,我们发现,对照组小鼠胸腺细胞TCR谱型大多呈中间高两边低的正态分布,这与以往研究报道一致[11]。然而,内毒素耐受72 h时,胸腺细胞TCR谱型出现数量不等的寡峰、偏峰和低峰。如,BV3家族出现明显的偏峰图,提示LPS刺激后72 h后胸腺中该单峰家族的T细胞可能为LPS刺激后产生的仅针对某一特定抗原的T细胞克隆。进一步观察发现,8 d实验组的胸腺细胞TCRβ链CDR3区谱型图像大多为多峰图像,且产物大小不均,即CDR3长度不一,提示耐受模型恢复过程中,胸腺内针对不同抗原的T细胞克隆增多。CDR3区长度方面:研究发现,尽管LPS耐受72 h组胸腺细胞TCR CDR3区长度跨度最大,但相邻的2个CDR3的PCR产物相差1或2个bp,提示多为无功能性T细胞克隆。值得注意的是,随着胸腺的恢复,8 d实验组中胸腺细胞TCR CDR3区长度跨度减少,且多呈相差3个碱基的标准框架内重排,提示形成了针对不同抗原的功能性T细胞。然而,该现象的确切机制,以及与胸腺T细胞抗原应答等的关系仍有待后续研究阐明。
综上,我们首次发现内毒素耐受状态下小鼠胸腺T细胞TCRβ链CDR3区长度和谱型均发生了显著变化,为后续进一步研究内毒素耐受状态下小鼠胸腺细胞的发育和功能提供了新的实验基础。
[1] Stearns-Kurosawa D J,Osuchowski M F,Valentine C,et al.The pathogenesis of sepsis[J].Annu Rev Pathol,2011,6(4):19-48.
[2] Biswas S K,Lopez-Collazo E.Endotoxin tolerance:new mechanisms,molecules and clinical significance[J].Trends Immunol,2009,30(10):475-487.
[3] Yoza B K,McCall C E.Facultative heterochromatin formation at the IL-1 beta promoter in LPS tolerance and sepsis[J].Cytokine,2011,53(2):145-152.
[4] Cavaillon J M,Adib-Conquy M.Bench-to-bedsidereview:endotoxin tolerance as a model of leukocyte reprogramming in sepsis[J].Crit Care,2006,10(5):233-233.
[5] Zhang S,Yang N,Ni S,et al.Pretreatment of lipopolysaccharide (LPS) ameliorates D-GalN/LPS induced acute liver failure through TLR4 signaling pathway[J].Int J Clin Exp Pathol,2014,7(10):6626-6634.
[6] Zhang S N,Yang N B,Ni S L,et al.Splenic CD11clowCD45RBhighdendritic cells derived from endotoxin-tolerant mice attenuate experimental acute liver failure[J].Scientific Reports,2016,6:33206.
[7] Pena O M,Pistolic J,Raj D,et al.Endotoxin tolerance represents a distinctivestate of alternative polarization (M2) in human mononuclear cells[J].J Immunol,2011,186(12):7243-7254.
[8] Muthukuru M,Cutler C W.Antigen capture of Porphyromonasgingivalis by human macrophages is enhanced but killing and antigen presentation are reduced by endotoxin tolerance[J].Infect Immun,2008,76(2):477-485.
[9] Bommireddy R,Engle S J,Ormsby I,et al.Elimination of both CD4+and CD8+T cells but not B cells eliminates inflammation and prolongs the survival of TGFbeta1-deficient mice[J].Cell Immunol,2004,232(1-2):96-104.
[10] 陶弋婧,郑文,胡燕,等.内毒素耐受状态下胸腺 CD4+SP 细胞比例变化及意义[J].现代免疫学,2015,35(6):460-464.
[11] 贺晓燕,王鹏,马锐,等.1月龄Balb/c小鼠胸腺、脾脏、肝脏、小肠和血液TRBV-TRBJ1-1 CDR3谱型分析[J].免疫学杂志,2012,28(10):842-847.
[12] Yao X S,Diao Y,Sun W B,et al.Analysis of the CDR3 length repertoire and the diversity of TCR alpha chain in human peripheral blood T lymphocytes[J].Cell Mol Immunol,2007,4(3):215-220.
[13] Davis M M,Bjorkman P J.T-cell antigen receptor genes and T-cell recognition[J].Nature ,1988,334(6181):395-402.
[14] Rowen L,Koop B F ,Hood L.The complete 685-ki lobase DNA sequence of the human beta T cell receptor locus[J].Science,1996,272(5269):1755-1762.
[15] 姚新生.TCRβ链CDR3谱序与疾病研究概况及进展[J].国际免疫学杂志,2007,30(4):240-244.
[16] Xue S A,Gao L,Ahmadi M,et al.Human MHC Class I-restricted high avidity CD4+T cells generated by co-transfer of TCR and CD8 mediate efficient tumor rejection in vivo[J].Oncoimmunology,2013,2(1):e22590.
[17] Tzifi F,Kanariou M,Tzanoudaki M,et al.Flow cytometric analysis of the CD4+TCR Vβ repertoire in the peripheral blood of children with type 1 diabetes mellitus,systemic lupus erythematosus and age-matched healthy controls[J].BMC immunology,2013,14(1):33.
[18] Geiger T,Zhao Y,Nguyen P,et al.Autoimmune susceptibility imposed by public TCRβ chains (BA2P.125)[J].The Journal of Immunology,2014,192(1):12-45.
[19] Melo E S,Goloubkova T,Barbeiro D F,et al.Endotoxin tolerance:selective alterations in gene expression and protection against lymphocyte death[J].Immunobiology,2010,215(6):435-442.
[20] Duan W,So T,Croft M.Antagonism of airway tolerance by endotoxin/lipopolysaccharide through promoting OX40L and suppressing antigen-specific Foxp3+ T regulatory cells[J].The Journal of Immunology,2008,181(12):8650-8659.
[21] 卢佳,陶弋婧,贾力,等.内毒素耐受状态下脾脏 CD4+Foxp3+调节性T细胞的比例变化及意义[J].现代免疫学,2016,36(4):289-293.
[收稿2016-12-16;修回2017-02-10]
(编辑:王静)
Change of polymorphism and length of TCRβ chain CDR3 region of thymus T cells in the condition of endotoxin-induced tolerance
JiaLi1,2,TaoYijing1,2,ZhaoJuanjuan1,2,GuoMengmeng1,2,ChenChao1,2,ChuFengyun1,2,WangHairong1,2,LiuYun2,LuoJunmin1,2,YaoXinsheng1,2,XuLin1,2
(1.Department of Immunology and Immunology Innovation Base of Postgraduate Education,Zunyi Medical University,Zunyi Guizhou 563099,China;2.Guizhou Provincial College-Based Key Lab for Tumor Prevention and Treatment With Distinctive Medicines,Zunyi Medical University,Zunyi Guizhou 563099,China)
Objective To observe the change of polymorphism and length of TCRβ chain CDR3 region of thymus T cells in murine endotoxin-induced tolerance and explore its significance.Methods Endotoxin-induced tolerance model in C57/BL6 mice was established by intraperitoneal injection of LPS (5 mg/kg),while the normal mice were intraperitoneally injected with NS (5 mg/kg).The total RNA of the thymus tissue was extracted at 72 hours and 8 days of post LPS injection and reverse transcribed into cDNA,resepectively.Upstream primer sequence was designed according to 22 TRBV gene families separately and TRBJ1-1 gene families sequence was used to design the downstream primer.PCR assay was used to amplify the complete TCRβ chain CDR3 region.The CDR3 length and diversity were analyzed by capillary electrophoresis.Results Most of the thymus samples of the normal mice presented the standard Gaussian distribution.But there were few partial-peak/oligo-peak or low-peak.Different number of partial-peak/oligo-peak or low-peak at 72 hours of post-LPS injection was shown.Eight days after the model establishment,most of the families presented poly-peak.In addition,compared with normal group,different degrees of changes on the length of TCRβchain CDR3 region of thymus T cells were indicated at 72 hours and 8 days of post LPS injection.Conclusion The polymorphism and length of TCRβ chain CDR3 region in thymus T cells are significant changed in the condition of endotoxin-induced tolerance,which provides the preliminary experimental basis for further study on the development and function of thymus cells in endotoxin-induced tolerance.
endotoxin; thymus; TCRβ chain CDR3 region; mice
贵州省高层次创新型人才计划项目(NO:黔科合人才[2016]4031);遵义医学院优秀青年人才计划项目(NO: 15ZY-001)。
徐林,男,博士,教授,博士生导师,研究方向:分子免疫学,E-mail:xulinzhouya@163.com。
R392
A
1000-2715(2017)02-0139-04

