绿原酸对Aβ25-35诱导PC12细胞损伤的保护作用
林 茂,王 敏,刘 芳,罗小金,高仕琴,王春梅
(遵义医学院珠海校区 珠海市重点实验室暨中药基础及应用研究实验室,广东 珠海 519041)
基础医学研究
绿原酸对Aβ25-35诱导PC12细胞损伤的保护作用
林 茂,王 敏,刘 芳,罗小金,高仕琴,王春梅
(遵义医学院珠海校区 珠海市重点实验室暨中药基础及应用研究实验室,广东 珠海 519041)
目的 探讨绿原酸(CGA)对β淀粉样蛋白25-35(Aβ25-35)诱导的PC12细胞损伤的保护作用及其机制。方法 采用Aβ25-35诱导PC12细胞构建细胞损伤模型,并用3个不同浓度的CGA分组干预。CCK-8法检测细胞存活率;流式细胞术检测细胞凋亡率;比色法检测细胞丙二醛(MDA)含量、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活力;Western blot检测细胞核转录因子κB(NF-κB)和白细胞介素1β(IL-1β)表达;ELISA法检测细胞肿瘤坏死因子α(TNF-α)浓度。结果 与Control组比较,Model组细胞存活率下降、凋亡率升高,SOD和GSH-Px活力降低、MDA水平升高,NF-κB、IL-1β和TNF-α表达水平升高(P<0.05)。与Model组比较,CGA各组细胞存活率升高、凋亡率下降,SOD和GSH-Px活力升高、MDA水平降低,NF-κB、IL-1β和TNF-α蛋白表达水平下降(P<0.05)。结论 CGA对Aβ25-35致PC12细胞损伤具有保护作用。其机制可能与CGA提高细胞抗氧化能力,抑制NF-κB介导的炎症通路有关。
绿原酸;β淀粉样蛋白;PC12细胞;阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease,AD)是老年人常见的一种以渐进性认知功能减退为特征的中枢神经系统退行性疾病[1-3]。随着全球人口老龄化进程加剧,AD患者人数逐年上升,在严重影响老年人生活质量的同时,也给社会医疗带来了沉重负担[4]。β淀粉样蛋白(beta-amyloid protein,Aβ)异常沉积所形成的老年斑是AD主要的病理变化之一。Aβ可诱导产生炎症因子,引起氧化应激反应,造成神经细胞损伤[5-8]。因此,消除或减弱Aβ毒性是改善AD病程的关键。绿原酸(chlorogenic acid,CGA)作为杜仲、金银花中含量丰富的活性物质,是植物体有氧呼吸过程中产生的一种苯丙素类化合物,因具有良好的抗氧化、抗炎的药理作用而引起国内外学者广泛关注[9-10]。本实验通过Aβ25-35诱导PC12细胞构建细胞损伤模型[2,11],研究观察CGA对其保护作用,并分析可能机制,旨在为CGA用于临床防治AD提供药理学实验依据。
1 材料与方法
1.1 实验材料
1.1.1 供试细胞株 PC12细胞由遵义医学院珠海校区生物医药(学)研发中心中药基础及应用研究重点实验室提供。
1.1.2 药品与主要试剂 绿原酸购自成都曼思特生物科技公司(含量≥98%,批号:MUST-16031610);Aβ25-35和二甲基亚砜(dimethyl sulphoxide,DMSO)购自Sigma公司;细胞计数试剂盒(cell counting kit-8,CCK-8)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒购自碧云天生物技术研究所;细胞凋亡检测试剂盒购自南京凯基生物;丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购自南京建成生物工程研究所;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒和β-actin抗体购自武汉博士德生物工程有限公司;核转录因子κB(nuclear factor kappa β,NF-κB)和白细胞介素1β(interleukin-1β,IL-1β)抗体购自Cell Signaling Technology公司;其它试剂均为分析纯。
1.2 方法
1.2.1 细胞损伤模型的构建及分组处理 取对数生长期细胞,1×105个/mL细胞接种于96孔板,每孔100 μL。分为正常对照组(Control)、模型组(Model)组及3个不同浓度CGA组(CGA 25 μmol/L、CGA 50 μmol/L和CGA 100 μmol/L)。24 h后,无血清DMEM处理细胞,先用不同浓度CGA作用细胞2 h,除Control组外,其余各组加Aβ25-3520 μmol/L ,孵育24 h。
1.2.2 CCK-8法检测细胞存活率 药物干预结束后,每孔板细胞加入10 μL CCK-8试剂,37 ℃、5%的CO2孵育2 h,酶标仪于波长450 nm测吸光度值。存活率计算公式:细胞存活率(%)=(实验组A-空白组A)/(对照组A-空白组A)×100%。
1.2.3 流式细胞术检测细胞凋亡率 选用磷脂结合蛋白V-异硫氰酸荧光素(Annexin V- fluorescein isothiocyanate,Annexin V-FITC)/碘化丙啶(propidium iodide,PI)双染试剂盒检测细胞凋亡。每孔板细胞用不含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰酶消化,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤细胞两次,离心,弃上清。分别加入200 μL Annexin V-FITC结合液和10 μL PI染色液轻轻混匀,室温避光反应15 min,上流式细胞仪检测。
1.2.4 比色法检测细胞SOD、GSH-Px活力及MDA含量 收集各组细胞,冰上裂解,离心,将上清制成样品溶液。严格按照试剂盒说明书操作,测定MDA含量、SOD和GSH-Px活力。
1.2.5 Western blot检测细胞NF-κB和IL-1β的表达 冰上裂解细胞、提取蛋白。考马斯亮蓝法检测蛋白浓度。上样75 μg/泳道,SDS-PAGE凝胶电泳。260 mA电流下转膜70 min,5%脱脂奶粉封闭。分别加入NF-κB和IL-1β的一抗,4 ℃摇床上缓慢摇动,孵育过夜,加二抗。β-actin作为内参。曝光、显影、定影后Quantity-One软件分析,以相对光密度值(目的条带光密度值/β-actin光密度值)作为各蛋白表达量。
1.2.6 ELISA测定细胞内TNF-α的浓度 冰上裂解细胞、离心、吸取各组上清即得到样品。严格按照ELISA试剂盒说明书操作,酶标仪450 nm处检测各孔吸光度值,测定TNF-α浓度。
2 结果
2.1 CGA对细胞存活率的影响 如图1所示,与Control组比较,Model组细胞存活率下降(P<0.05);与Model组比较,CGA各组细胞存活率升高(P<0.05)。

与Control组相比,*P<0.05;与Model组相比,。图1 各组细胞存活率的变化
2.2 CGA对细胞凋亡率的影响 如图2所示,凋亡早期的细胞仅被Annexin V-FITC染色,PI染色呈阴性(见图2中Q3象限)。死亡和凋亡晚期的细胞可以同时被Annexin V-FITC和PI染色(见图2中Q2象限)。统计Q2和Q3象限的细胞百分比之和记为各组细胞凋亡率,结果如表1所示。与Control组比较,Model组细胞凋亡率升高(P<0.05)。与Model组比较,CGA各组细胞凋亡率下降(P<0.05,见表1)。

图2 流式细胞术细胞凋亡检测分析图

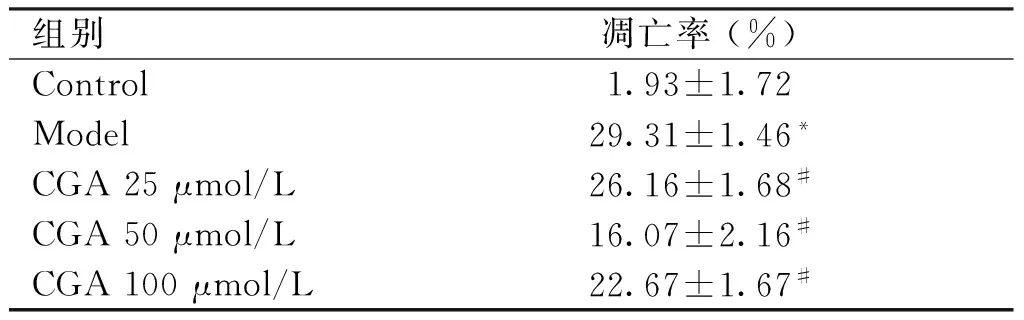
组别凋亡率(%)Control1.93±1.72Model29.31±1.46*CGA25μmol/L26.16±1.68#CGA50μmol/L16.07±2.16#CGA100μmol/L22.67±1.67#
与Control组相比,*P<0.05;与Model组相比,#P<0.05。
2.3 CGA对细胞SOD、GSH-Px活力及MDA含量的影响 如表2所示,与Control组比较,Model组细胞SOD、GSH-Px活力降低,MDA水平升高(P<0.05)。与Model组比较,CGA各组细胞SOD、GSH-Px活力升高,MDA含量减低(P<0.05)。

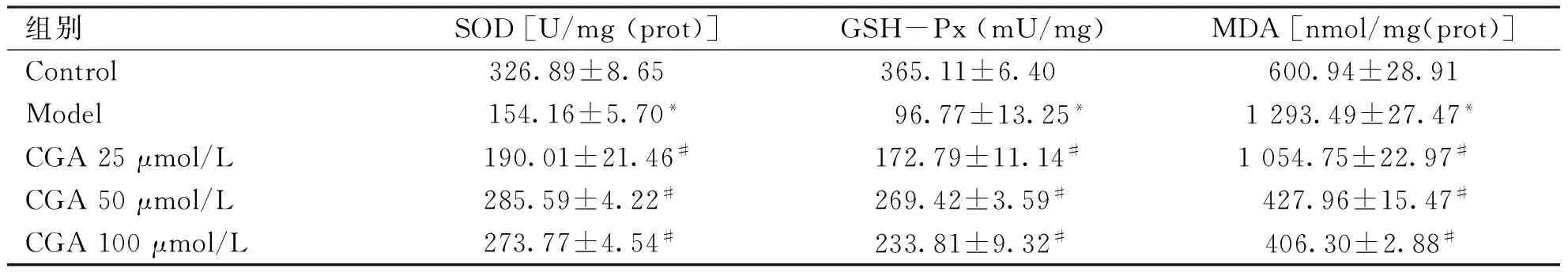
组别SOD[U/mg(prot)]GSH-Px(mU/mg)MDA[nmol/mg(prot)]Control326.89±8.65 365.11±6.40 600.94±28.91Model154.16±5.70* 96.77±13.25*1293.49±27.47*CGA25μmol/L190.01±21.46#172.79±11.14#1054.75±22.97# CGA50μmol/L285.59±4.22# 269.42±3.59#427.96±15.47#CGA100μmol/L273.77±4.54# 233.81±9.32#406.30±2.88#
与Control组相比,*P<0.05;与Model组相比,#P<0.05。
2.4 CGA对细胞IL-1β及NF-κB表达的影响 如图3所示,与Control组比较,Model组细胞NF-κB、IL-1β表达水平升高(P<0.05);与Model组比较,CGA各组细胞NF-κB、IL-1β表达水平下降(P<0.05)。
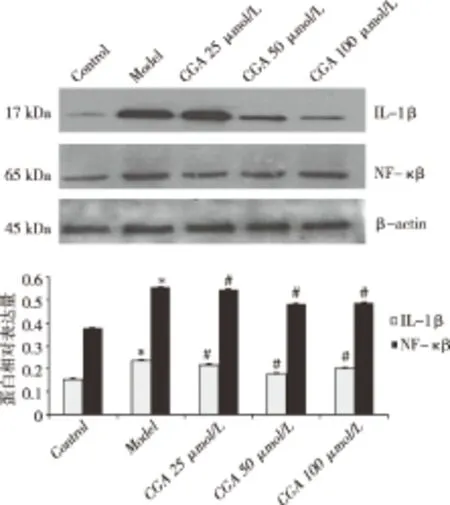
与Control组相比,*P<0.05;与Model组相比,。图3 各组细胞IL-1β、NF-κB的表达
2.5 CGA对细胞内TNF-α浓度的影响 如图4所示。与Control组比较,Model组细胞内TNF-α浓度升高(P<0.05);与Model组比较,CGA各组细胞内TNF-α浓度下降(P<0.05)。

与Control组相比,*P<0.05;与Model组相比,。图4 各组细胞内TNF-α浓度
3 讨论
Aβ是AD特征性病理老年斑的主要成份,也是AD多种病理变化的中心环节。生理情况下,Aβ的产生和降解保持动态平衡,并不影响神经系统的正常功能[7]。AD病程中Aβ异常增多,沉积的Aβ引起氧化应激,神经炎症,诱导tau蛋白磷酸化水平失衡,导致神经纤维缠结的形成,损伤神经元[5-8]。研究发现,Aβ25-35是Aβ产生毒性作用的必要结构。将Aβ25-35注入动物脑内或处理细胞可诱发细胞氧化损伤和炎症损伤,导致细胞凋亡,引起动物认知功能下降等表现[11-12]。PC12细胞是大鼠肾上腺嗜铬细胞瘤分化的细胞株,因其具有与神经元类似的生理特征,故常被应用于神经生理和药理研究。本实验选择Aβ25-35诱导的PC12细胞作为细胞损伤模型进行研究。结果显示,与Control组相比,Model组细胞存活率下降、凋亡率升高,SOD和GSH-Px活力降低、MDA水平升高,NF-κB、IL-1β和TNF-α表达水平升高。其中TNF-α和IL-1β作为两个重要的炎症因子,可以诱导NF-κB经典信号通路的激活,而NF-κB的激活又与TNF-α、IL-1β表达存在正反馈调节。在损伤细胞模型中它们三者的表达增高,说明了细胞炎症损伤的存在。此外,SOD、GSH-Px和MDA 3个指标的异常变化,揭示了氧化损伤的存在。以上结果说明Aβ25-3520 μmol/L 孵育24 h对PC12细胞造成了损伤,显示成功模拟出AD的部分病理生理变化。
相对于临床化学药物治疗AD的局限性,从天然药用植物中筛选活性成分已成为防治AD的重要途径[1-2]。CGA是杜仲、金银花等植物中含量丰富的一种酚型抗氧化剂,具有清除体内自由基、预防肿瘤和抗衰老等作用[9-10]。因其含有R-OH基,能消除超氧阴离子、羟自由基等自由基活性,可以保护细胞免受氧化损伤[10]。文献报道CGA可以通过抑制乙酰胆碱酯酶活性,改善强氧化剂诱导的大鼠脑组织氧化应激损伤[13]。CGA亦能通过调节Bcl-2表达,改善乙醇诱导的PC12细胞凋亡[14]。CGA还可以通过抑制p38分裂原激活蛋白激酶信号转导通路,保护神经细胞[15]。但针对AD特征病理Aβ和tau蛋白的研究尚少见,本实验结果显示,与Model组比较,CGA各组细胞存活率升高、凋亡率下降,细胞内SOD和GSH-Px活力升高、MDA水平降低;同时,NF-κB、IL-1β和TNF-α蛋白表达水平下降。提示CGA对Aβ25-35致PC12细胞损伤具有保护作用,其机制可能与CGA可以对抗Aβ毒性,提高细胞抗氧化能力,抑制NF-κB介导的炎症通路有关。
本实验设定了25、50和100 μmol/L 3个浓度CGA干预细胞损伤模型。CGA 25 μmol/L与50 μmol/L组间比较,可见随着CGA浓度升高细胞的存活率相应提高,而CGA 100 μmol/L较50 μmol/L组的存活率有所下降,但无统计学意义,提示这一现象是CGA浓度过高而出现的毒性作用,或是CGA 50 μmol/L已达到其最大效应浓度,尚有待进一步研究。
机体的生理环境与体外的细胞环境差别很大,影响因素更加复杂。CGA对AD模型动物是否也能发挥其抗炎抗氧化的多重神经保护作用有待深入研究。
[1] 倪南珍,王敏,林茂,等.白藜芦醇对阿尔茨海默病小鼠记忆能力及脑组织NOS和NO含量的影响[J].遵义医学院学报,2014,37(1):99-102.
[2] 张玮,胡娟,吴芹,等.金钗石斛生物总碱对β淀粉样蛋白25-35片段所致PC12细胞损伤的保护作用[J].遵义医学院学报,2015,38(4):346-349.
[3] Michael W,Christopher I,Michael A.A meta-annalysis of prospective studies on the role of physical activity and the prevention of Alzheimer’s disease in older adults[J].Bio Med Central,2015,15(1):1-9.
[4] Alzheimer's Association.2016 Alzheimer's disease facts and figures[J].Alzheimers Dement,2016,12(4):459-509.
[5] Obulesu M,Lakshmi M J.Apoptosis in Alzheimer's disease:an understanding of the physiology,pathology and therapeutic avenues[J].Neurochem Res,2014,39(12):2301-2312.
[6] Swomley A M,Förster S,Keeney J T,et al.Abeta,oxidative stress in Alzheimer disease:evidence based on proteomics studies[J].Biochim Biophys Acta,2014,1842(8):1248-1257.
[7] Thal D R,Walter J,Saido T C,et al.Neuropathology and biochemistry of Aβ and its aggregates in Alzheimer’s disease[J].Acta Neuropathol,2015,129(2):167-182.
[8] Sharma S,Verma S,Kapoor M,et al.Alzheimer's disease like pathology induced six weeks after aggregated amyloid-beta injection in rats:increased oxidative stress and impaired long-term memory with anxiety-like behavior[J].Neurol Res,2016,38(9):838-850.
[9] Bonarska-Kujawa D,Cyboran-Mikoajczyk S,Kleszczyńska H.Molecular mechanism of action of chlorogenic acid on erythrocyte and lipid membranes[J].Mol Membr Biol,2015,32(2):46-54.
[10] Liang N J,Kitts D D.Role of chlorogenic acids in controlling oxidative and inflammatory stress conditions[J].Nutrients,2015,8(1):16-35.
[11] Han J,Qu Q,Qiao J,et al.Vincamine alleviates amyloid-β 25-35 peptides-induced cytotoxicity in PC12 cells[J].Pharmacogn Mag,2017,13(49):123-128.
[12] Drummond E,Wisniewski T.Alzheimer's disease:experimental models and reality[J].Acta Neuropathol,2017,133(2):155-175.
[13] Oboh G,Agunloye O M,Akinyemi A J,et al.Comparative study on the inhibitory effect of caffeic and chlorogenic acids on key enzymes linked to Alzheimer's disease and some pro-oxidant induced oxidative stress in rats' brain-in vitro[J].Neurochem Res,2013,38(2):413-419.
[14] Fang S Q,Wang Y T,Wei J X,et al.Beneficial effects of chlorogenic acid on alcohol-induced damage in PC12 cells[J].Biomed Pharmacother,2016,79:254-262.
[15] 周静,赵宏,秦书俭,等.绿原酸对Aβ 25-35诱导的大脑皮层细胞损伤的保护作用机制[J].中国临床解剖学杂志,2014,32(3):316-320.
[收稿2017-02-14;修回2017-03-10]
(编辑:王静)
Protective effect of chlorogenic acid on β-amyloid protein 25-35 induced PC12 cell death
LinMao,WangMin,LiuFang,LuoXiaojin,GaoShiqin,WangChunmei
(Zhuhai Key Laboratory of Fundamental and Applied Research in Traditional Chinese Medicine,Zhuhai Campus of Zunyi Medical University,Zhuhai Guangdong 519041,China)
Objective To observe the protective effect of chlorogenic acid (CGA) on the death of rat pheochromocytoma (PC12) cells induced by β-amyloid protein 25-35 (Aβ25-35),and explore its possible mechanisms.Methods Aβ25-35was used to induce PC12 cell death.Cells were interfered with three different concentrations of CGA.CCK-8 kit was used to detect cell viability.Cell apoptosis rate was detected by flow cytometry.Photocolorimetric method was applied to detect the MDA content and GSH-Px and SOD activity.Western blot assay was used to detect the intracellular expression of nuclear factor kappa B (NF-κB) and interleukin-1β (IL-1β).The intracellular concentration of tumor necrosis factor-α (TNF-α) was measured by enzyme immunoassay assay (ELISA).Results Compared with the control group,PC12 cells viability of the model group were significantly reduced.The apoptosis rate of the model group was increased.The levels of intracellular SOD and GSH-Px were decreased and the MDA level was increased.The expressions of NF-κB,IL-1β and TNF-α were increased.Compared with the model group,the PC12 cells viability of CGA groups were significantly increased.The apoptosis rate of CGA groups were reduced.The levels of intracellular SOD and GSH-Px were increased and the MDA level was decreased.The expressions of NF-κB,IL-1β and TNF-α were declined.Conclusion CGA has a protective effect on Aβ25-35-induced PC12 cells death.The mechanisms may be related to the improvement of the antioxidant ability and the inhibition of NF-κB signaling pathway activation.
chlorogenic acid; β-amyloid protein; PC12 cells; Alzheimer’s disease
国家自然科学基金资助项目(NO:81560562);贵州省科技厅资助项目(NO:黔科合J字[2013]2314);贵州省教育厅资助项目(NO:黔教科[2009]0108);珠海市中药基础及应用研究重点实验室开放课题(NO:ZYKL-2016K6)。
王春梅,女,硕士,教授,硕士生导师,研究方向:神经退行性疾病发病机制及药物防治,E-mail:linmao3000@163.com。
R285.5;R741
A
1000-2715(2017)02-0161-05

