393例过敏性紫癜患者临床及肾脏损害危险因素分析
王今朝 陆洪光 蒋燕萍 石 年
·病例报告·
·论著·
393例过敏性紫癜患者临床及肾脏损害危险因素分析
王今朝1陆洪光2蒋燕萍2石 年1
目的: 明确过敏性紫癜(HSP)的临床特点及肾脏损害的危险因素。方法: 回顾性分析393例HSP住院患者的临床资料,对发病年龄、病程等与肾脏损害的关系进行单因素和多因素分析。结果: ①发病年龄主要在4~18岁,占75.32%,发病月份以1月和3月最多,上呼吸道感染是主要诱因(24.42%);②紫癜累及双下肢392例(99.74%),臀部及外阴165例(41.98%)、双上肢115例(29.26%);272例(69.21%)患者皮损在1个月内消失;③136例患者有关节症状(34.61%),193例(49.11%)有胃肠道症。212例(53.94%)出现肾脏损害,临床上多表现为血尿和蛋白尿;④年龄≥10岁、皮疹反复≥1个月及IgA升高与肾脏损害存在正相关(P<0.05)。结论: HSP有年龄、季节特点,发病诱因常见于上呼吸道感染,发病年龄≥10岁、紫癜反复≥1个月、IgA升高是肾脏损害的危险因素。
过敏性紫癜; 肾脏损害
过敏性紫癜(Henoch-Schonlein purpura,HSP)是一种主要以IgA抗体介导的系统性毛细血管和细小血管炎,其临床表现多样、预后存在较大的个体差异。肾脏损害的有无及程度关系到HSP的预后,如何早期预测肾脏受累倍受临床医师关注,因此探讨其发生的危险因素尤为重要。现将393例住院HSP患者的流行病学特点、临床特征及肾脏损害的危险因素分析如下。
1 材料与方法
1.1 对象 HSP病例均来自2009年1月至2013年12月贵阳医学院附属医院皮肤科、儿科、肾内科住院病例,共393例。所有HSP患者均符合文献[1]的诊断标准。HSPN(Henoch-Schonlein purpura nephritis,HSPN)的诊断及病理分级依据文献[2]的标准,同时排除其他系统性疾病,排除乙肝肾、狼疮肾等继发性肾病。
1.2 方法 收集包括流行病学、临床表现、实验室检查及随访等资料。采用SPSS 13.0统计分析软件进行统计分析,组间计数资料的比较和单因素分析采用χ2检验,以Logistic回归分析作为多因素分析,并采用优势比及95%可信区间估计相对危险度。P<0.05为差异有统计学意义。
2 结果
2.1 流行病学
2.1.1 发病年龄与季节分布 393例HSP患者,男225例,女168例,男女之比为1.34∶1;年龄1岁7个月~88岁,平均年龄(17.5±15.0)岁,以4~18岁为发病高峰年龄,占75.32%(图1)。四季均有发病,多集中在春季和秋冬季,以1月及3月最多见(图2),分别占12.98%和12.47%。
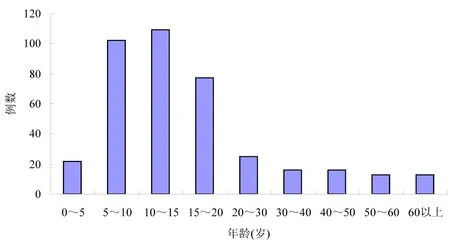
图1 HSP发病年龄趋势

图2 HSP 发病季节趋势
2.1.2 发病诱因 发病前有明确诱因者157例(39.95%)。其中由上呼吸道感染引起者96例(24.42%);由食用牛羊肉、鱼虾、方便面等食物过敏诱发者27例(6.87%);由服用药物诱发者24例(6.11%),分别为β内酰胺类抗生素、甲硝唑类、非甾体类抗炎药等;4例(1.02%)发病前有过劳史;3例(0.76%)发病前有剧烈运动史;接触室内装修、花粉过敏后发病3例(0.76%)。无明显诱因者236例(60.05%)。
2.2 临床特征
2.2.1 皮损表现 393例HSP患者均先后出现皮肤紫癜,大部分呈典型的紫癜样皮疹,累及部位以双下肢最多见,有392例(99.74%),其次依次为臀部及外阴165例(41.98%)、双上肢115例(29.26%)、躯干部66例(16.79%)、头面部24例(6.11%)。皮疹反复持续时间小于1个月272例(69.21%),1~3个月87例(22.14%),3个月以上34例(8.65%)。
2.2.2 关节症状 出现关节红肿或疼痛等症状136例(34.61%),常多个关节同时受累,特别是下肢关节最易累及,其中踝关节84例(21.37%)、膝关节71例(18.07%)、肘关节18例(4.58%)、腕关节16例(4.07%)、掌指关节6例(1.53%)、肩关节2例(0.51%)、跖趾关节1例(0.25%)。
2.2.3 胃肠道症状 193例(49.11%)HSP患者出现腹痛、恶心、呕吐、呕血、便血及黑便等轻重不一的胃肠道症状。其中以腹痛181例(46.06%)最为常见,恶心和(或)呕吐65例(16.54%)、便血和黑便58例(14.76%)、呕血2例(0.51%)、腹泻2例(0.51%)、发生不完全性肠梗阻2例(0.51%)。腹痛部位常为脐周、下腹、上腹部,少数累及全腹,性质一般为阵发性绞痛。
2.2.4 肾脏症状 出现尿检异常者212例(53.94%),临床表现为孤立性血尿57例(26.89%),孤立性蛋白尿26例(12.26%),血尿﹢蛋白尿129例(60.85%)。尿异常出现的时间:<1个月116例(54.72%),1~3个月76例(35.85%),>3个月20例(9.43%),最长的1例为紫癜、腹痛反复发作3年后出现尿液检测改变。肾穿刺活检34例(8.65%),其中肾脏组织病理改变II级26例(76.47%),III级4例(11.76%),IV级3例(8.82%),V级1例(2.94%),以肾小球系膜增殖为主。
2.2.5 其它症状 出现严重头痛2例(0.51%),经头颅CT检查证实分别为硬膜下水肿和颅内出血。心律失常3例(0.76%),并发急性睾丸炎2例(0.51%),并发胰腺炎1例(0.25%)。
2.3 实验室检查异常 393例HSP患者中WBC增高117例(29.77%),NEUT升高127例(32.32%),PLT增高181例(46.06%),MPV降低65例(16.54%),FIB升高96例(24.43%),D-二聚体升高304例(77.35%),血C3降低56例(14.25%),血IgA升高205例(52.16%),血沉(ESR)升高224例(57.00%),抗链球菌溶血素O(ASO)升高45例(11.45%),幽门螺杆菌(HP)阳性123例(31.30%),结核菌素试验(PPD)阳性58例(14.76%)。
2.4 治疗 本组患者均采消除病因,对症支持,抗感染,口服双嘧达莫,甲氰咪呱等药物综合治疗,对伴有严重关节痛、腹痛及消化道出血的患者加用糖皮质激素治疗,紫癜性肾炎酌情加用糖皮质激素、免疫抑制剂等治疗。
2.5 预后 371例(94.40%)经治疗治愈好转出院;22例(5.60%)未愈自动出院。有效随访病例367例(93.38%),失访病例26例(6.62%),随访6个月~5年不等。135例(34.35%)患者首次发病缓解后2周~2年内病情反复。大多数表现为皮疹反复出现,和(或)伴有腹痛、关节痛,有的患者在停药后、上呼吸道感染后、不当饮食后或剧烈运动后出现复发。肾脏损害患者随访尿检正常111例(52.36%),好转留有镜下血尿和(或)蛋白尿75例(35.38%),病变反复26例(12.26%)。
2.6 HSP患者肾脏受累危险因素分析 393例实验室资料完整的病例进行HSP肾脏损害危险因素分析,采用单因素分析危险因素与HSP肾脏损害的关系,结果提示年龄≥10岁、皮疹反复≥1个月、消化道出血、WBC>10×109/L、NEUT%>70%、IgA升高、C3降低、D-二聚体升高有统计学意义(P<0.05)(表1)。选择以上8项有统计学意义的危险因素同时进入Logistic回归模型,作为非条件的多因素分析。结果表明仅年龄≥10岁、皮疹反复≥1个月及IgA升高3项与肾脏损害存在正相关(β>0,OR>1),且有统计学意义(P<0.05)(表2),考虑为HSP容易发生肾脏损害的危险因素。
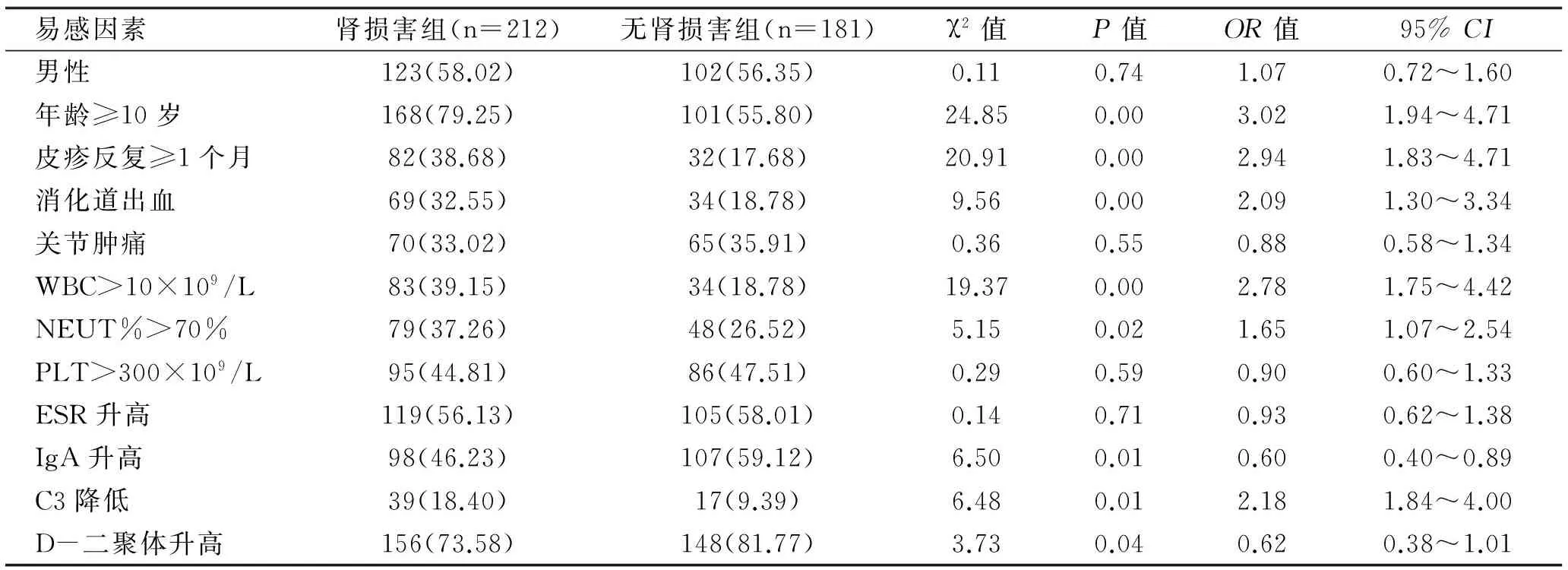
表1 HSP肾损害危险因素单因素分析 例(%)
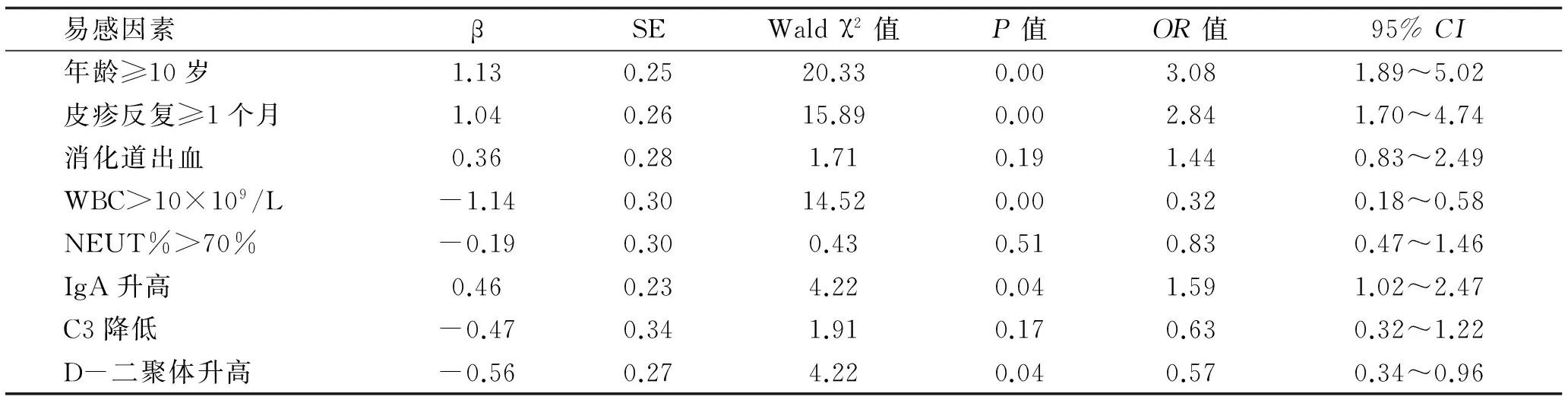
表2 HSP肾损害危险因素多因素Logistic回归分析
3 讨论
本研究对过敏性紫癜的流行病学特点、临床特征及肾损害的危险因素作了初步的探讨。本组资料显示,HSP常见于春季及秋冬季,好发于未成年人,且男性发病多于女性,男女比例为1.34∶1,与以往文献报道类似,但发病年龄略晚于文献报道[3],考虑可能与纳入的样本人群及样本量有关。四季均有发病,以1月及3月最多见,分析可能和上述月份天气冷,易患上呼吸道感染有关。
目前HSP的确切病因尚未明确,多数学者认为本病的发病诱因以感染为主,特别是上呼吸道感染,感染病原体包括病毒、细菌、支原体、衣原体等。本组资料显示,在有明确诱因的患者中,上呼吸道感染是HSP发病最常见的诱因,因此,预防上呼吸道感染是防止HSP发生和复发的一个重要环节[4]。
皮肤紫癜可遍及全身,以双下肢最多见(99.74%),可能与下肢远离心脏,回流压力大,静脉压力较高,血管通透性增高使红细胞更易漏出血管等因素有关。69.21%皮肤紫癜于1个月内消退,胃肠道及关节症状的发生率分别是49.11%和34.61%。本组资料中2例患者(0.51%)出现严重头痛,HSP其它少见系统症状易被忽视,中枢神经系统受累以头痛、精神改变及抽搐最常见,也有复视、共济失调、颅内出血、周围神经病变等[5]少见表现。
HSP发展多呈良性自限性过程[6],肾脏受累及其严重程度是决定本病远期预后的重要指标[7]。本组资料显示肾脏损害的发生率为53.94%,多表现为血尿和蛋白尿,其中90.57%的患者在起病3个月内出现尿检异常,最长紫癜、腹痛反复发作3年后出现尿异常改变,提示HSP患者至少要随访6个月,若无尿异常也应定期行尿常规检查。亦有文献报道肾损害的发生可先于尿检出现潜血、蛋白等表现,根据肾穿刺活检判断HSP肾损害对HSPN的早期诊断有重要意义[8]。本组资料显示肾脏病理改变以II级(76.47%)为主,与王旭等[9]对HSPN病理研究的分析结果类似。
HSPN是影响HSP预后的关键,因此探讨其相关因素至关重要。对HSP肾损害危险因素分析,本组资料显示关节、胃肠道等肾外症状与肾损害的出现无明显相关性。而年龄≥10岁、皮疹反复≥1个月及IgA升高可作为肾脏损害的预警信号,它们产生的危险性相对于无易感因素者分别高出3.08倍、2.84倍、1.59倍。而在血WBC、NEUT、PLT、ESR、C3、D-二聚体水平异常和性别因素与肾脏损害的关系,本研究未发现相关性。国外也有报道10岁以上HSP患者肾损害多见[10]。Yang等[11]认为,反复皮疹与肾脏损害有关,表明致病因素反复出现或持续存在容易导致免疫复合物介导的血管炎的发生,且可激活补体,引发肾小球和肾间质的炎症反应,从而损伤肾脏。Rigante等[12]通过单因素分析发现病初持续性皮疹(>1个月)与HSP肾脏损害有关。近年来大量的基础与临床研究发现,IgA在HSP发病机制中起着关键性作用。IgA有两个亚型,即IgA1和IgA2,IgA1分子的铰链区由含有6个N-乙酰半乳糖胺的O-糖基链构成,一般由β-1.3半乳糖基与其相连[13]。IgA1铰链区糖基化异常致半乳糖基脱落,使得IgA1的乙酰半乳糖胺残基暴露成为新抗原,由此引发自身免疫反应[14]。IgA1缺乏半乳糖基,不能很好地与肝脏细胞的去唾液酸糖蛋白受体结合,使之不能被肝脏有效代谢和清除,导致其在血液循环中的数量增加,最终导致含有IgA1的免疫复合物广泛沉积于皮肤、胃肠道,以及肾小球毛细血管等不同组织脏器[15,16]。IgA1免疫复合物沉积可激活补体系统的旁路途径损伤内皮细胞[16]。IgA1铰链区糖基化异常可能和肾脏损害有关,相关文献报道,HSP有肾脏损害组与无肾脏损害组IgA1比较,有肾脏损害组IgA1铰链区O-低聚糖中的半乳糖含量明显降低[17]。但是,IgA1糖基化异常的机制尚不清楚,可能与遗传因素有关[18]。
[1] Ozen S, Ruperto N, Dillon MJ, et al. EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides[J]. Ann Rheum Dis,2006,65(7):936-941.
[2] 中华医学会儿科学分会肾脏病学组.儿童常见肾脏疾病诊治循证指南(二): 紫癜性肾炎的诊治循证指南(试行)[J]. 中华儿科杂志,2009,47(12):911-913.
[3] Kawasaki Y, Suyama K, Yugeta E, et al. The incidence and severity of Henoch-Schönlein purpura nephritis over a 22-year period in Fukushima Prefecture, Japan[J]. Int urol and nephrol,2010,42(4):1023-1029.
[4] 张娜,钱悦,徐学超,等.过敏性紫癜168例住院患者临床分析[J]. 中国麻风皮肤病杂志,2013,29(4):293-294.
[5] Mutsukura K, Tsuboi Y, Fujiki F, et al. Acute motor sensory axonal neuropathy associated with Henoch-Schönlein purpura[J]. J Neurological Sci,2007,263(1):169-173.
[6] Reamy BV, Williams PM, Lindsay TJ. Henoch-Schönlein purpura[J]. Am Fam Physician,2009,80(7):697-704.
[7] Ece A, Kelekci S, Hekimoglu A, et al. Neutrophil activation, protein oxidation and ceruloplasmin levels in children with Henoch-Schönlein purpura[J]. Pediatr Nephrol,2007,22(8):1151-1157.
[8] Bogdanovic R. Henoch-Schönlein purpura nephritis in children: risk factors, prevention and treatment[J]. Acta paediatr,2009,98(12):1882-1889.
[9] 王旭,栾江威,杨杏鲜,等.儿童紫癜性肾炎的临床病理及预后[J]. 临床儿科杂志,2008,26(4):309-311.
[10] Tabel Y, Inanc FC, Dogan DG, et al. Clinical features of children with Henoch-Schönlein purpura: risk factors associated with renal involvement[J]. Iran J kidney Dis,2012,6(4):269-274.
[11] Yang YH, Chuang YH, Wang LC, et al. The immunobiology of Henoch-Schönlein purpura[J]. Autoimmun Rev,2008,7(3):179-184.
[12] Rigante D, Candelli M, Federico G, et al. Predictive factors of renal involvement or relapsing disease in children with Henoch-Schönlein purpura[J]. Rheumatol Int,2005,25(1):45-48.
[13] Renfrow MB, Mackay CL, Chalmers MJ, et al. Analysis of O-glycan heterogeneity in IgA1 myeloma proteins by Fourier transform ion cyclotron resonance mass spectrometry: implications for IgA nephropathy[J]. Ana Bioanal Chem,2007,389(5):1397-1407.
[14] Lau KK, Suzuki H, Novak J, et al. Pathogenesis of Henoch-Schönlein purpura nephritis[J]. Pediatr Nephrol,2010,25(1):19-26.
[15] Vogler C, Eliason SC, Wood EG. Glomerular membranopathy in children with IgA nephropathy and Henoch Schönlein purpura[J]. Pediatr Dev Pathol,1999,2(3):227-235.
[16] Allen AC, Willis FR, Beattie TJ, et al. Abnormal IgA glycosylation in Henoch-Schönlein purpura restricted to patients with clinical nephritis[J]. Nephrol Dial Transplant,1998,13(4):930-934.
[17] Lau KK, Wyatt RJ, Moldoveanu Z, et al. Serum levels of galactose-deficient IgA in children with IgA nephropathy and Henoch-Schönlein purpura[J]. Pediatr Nephrol,2007,22(12):2067-2072.
[18] Gharavi AG, Moldoveanu Z, Wyatt RJ, et al. Aberrant IgA1 glycosylation is inherited in familial and sporadic IgA nephropathy[J]. J Am Soc Nephrol,2008,19(5):1008-1014.
(收稿:2017-01-07 修回:2017-02-15)
Analysis of 393 patients with Henoch-Schonlein purpura and the risk factors of renal damage
WANGJinzhao1,LUHongguang2,JIANGYanping2,SHINian1.
1.DepartmentofDermatology,HuangshiCentralHospital,AffiliatedHospitalofHubeiPolytechnicUniversity,Huangshi435000,China; 2.DepartmentofDermatology,theAffiliatedHospitaltoGuizhouMedicalUniversity,Guiyang550004,China
SHINian,E-mail: 635653672@qq.com
Objective: To determine the clinical characteristics of 393 inpatients with Henoch-Schonlein purpura (HSP) and to analyze the risk factors of renal damage. Methods: The date of 393 patients with HSP was analyzed retrospectively and the relationship among the age at onset, the duration of course, the onset time and renal damage was analyzed by the univariate and multivariate analysis. Results: ① The age at onset ranged from 4 to 18 years old in 296 patients (75.32%). The onset time of HSP was in January and March in majority of the patients. Many patients (24.42%) had an upper respiratory tract infection before the onset of the disease. ② The lesions of purpura located on lower limbs in 392 patients (99.74%), followed by hip and vulva in 165 (41.98%), upper limbers in 115 (29.26%). The lesions in 272 (69.21%) patients disappeared within one month. ③ One hundred and thirty six patients (34.61%) presented with the joint symptoms, 193 (49.11%) with gastrointestinal symptoms, 212 (53.94%) with renal damage manifested with hematuria and proteinuria. ④ The univariate and multivariate analysis showed that renal damage was associated with the age at onset ≥10 years old, the duration of the purpura for more than one month and the high level of IgA (P<0.05). Conclusion: HSP has age and season predilection. The most important inducing factor was upper respiratory tract infection. The risk factors of renal damage included the age at onset ≥10 years old, the duration of the purpura for more than one month and high level of IgA.
Henoch-Schonlein purpura; renal damage
1鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)皮肤科,湖北黄石,435000
2贵州医科大学附属医院皮肤科,贵州贵阳,550004
石年,E-mail: 635653672@qq.com

