抗Galectin-3抗体在皮肤血管炎中的表达
张宇萍 唐增奇 王亮春
·论著·
抗Galectin-3抗体在皮肤血管炎中的表达
张宇萍 唐增奇 王亮春
目的: 检测系统性红斑狼疮、荨麻疹性血管炎(UV)、过敏性紫癜(HSP)和变应性皮肤血管炎(LCV)患者血清抗Galectin-3抗体的水平。方法: ELISA法检测15例伴发皮肤血管炎表现的SLE、13例UV、15例HSP和8例LCV患者血清及15例正常人血清(阴性对照)抗Galectin-3抗体水平。结果: SLE和UV患者血清中抗Galectin-3抗体吸光度值分别为:0.89±0.08、0.71±0.05,显著高于对照组的0.46±0.02(P<0.05);HSP和LCV患者中分别为0.60±0.05和0.60±0.04,与正常人相比无明显差异。结论: 有皮损的荨麻疹性血管炎及系统性红斑狼疮皮肤血管炎可能与血清中抗Galectin-3抗体升高有关。
荨麻疹性血管炎; 过敏性紫癜; 变应性皮肤血管炎; 抗Galectin-3抗体
皮肤血管炎是一组主要以血管壁肿胀、纤维素样变性以及血管周围炎症细胞浸润为组织病理特点的疾病,可以局限于皮肤,也可以同时伴发系统性损害。临床上较常见的类型有荨麻疹性血管炎(Urticarial Vasculitis,UV)、过敏性紫癜(Henoch-Schonlein Purpura,HSP)、变应性皮肤血管炎(Leukocytoclastic Vasculitis,LCV);最常见的伴发皮肤血管炎的系统性疾病是系统性红斑狼疮(Systemic Lupus Erythematosus,SLE)[1,2]。这几种皮肤血管炎,血管周围浸润细胞都以中性粒细胞为主,病理上统称为中性粒细胞碎裂性血管炎,目前认为其发病机制与免疫复合物介导的三型变态反应有关。半乳糖凝集素-3(Galectin-3)广泛存在人体各个组织器官中,作为功能性蛋白,其在肿瘤细胞的增殖分化、粘附迁移以及肿瘤转移中有重要作用。该蛋白在SLE患者肾脏中也有丰富表达[3]。我们曾研究发现,伴有皮肤血管炎表现的SLE患者血清中抗Galectin-3抗体水平明显高于健康人,抗体滴度与皮损严重程度相关,且随治疗好转而下降;从SLE患者血清中分离的抗Galectin-3抗体经皮内注射入小鼠体内,可以引起类似于SLE皮肤血管炎的组织病理表现,充分提示该抗体在SLE皮肤血管炎的发生机制中有重要作用[4]。但是,抗Galectin-3抗体是否也与其他常见皮肤血管炎的发生有关还不清楚,因此,本研究主要通过分离和收集伴有皮损的不同类型皮肤血管炎患者的血清,以 ELISA方法检测其中抗Galectin-3抗体的水平,并初步研究该抗体存在与皮肤血管炎发生之间的关系。
1 材料和方法
1.1 样本来源 伴发皮肤血管炎表现的SLE患者血清(阳性对照)15例,正常人血清(阴性对照)15例,有皮损的UV、HSP、LCV患者血清分别为13例、15例、8例。
1.2 主要试剂 Galectin-3蛋白购自Sino Biological公司;HRP标记山羊抗人IgG购自Sigma公司;BSA购自Roche公司;TMB购自湖州英创生物科技有限公司;2M 盐酸购自汕头市西陇化工厂有限公司;PBS购自博士德生物工程有限公司;吸光度检测采用MULTISKAN MK3 ELISA检测仪。
1.3 主要方法
1.3.1 收集血清 抽取患者及正常人晨起空腹静脉血4 mL,3000 r/min离心10 min,吸取上层血清,EP管分装,置于-80℃冰箱保存备用。
1.3.2 ELISA方法检测样本血清中的抗Galectin-3抗体水平[4]用PBS将Galectin-3蛋白浓度稀释至1 μg/mL,在每个聚苯乙烯板的反应孔中加入50 μL蛋白液,4℃条件下孵育过夜;PBST洗5遍,用2% BSA于37℃条件下温育1h;PBST洗5遍,每孔加入稀释比为1∶500的血清标本100 μL,37℃温育1 h;PBST洗5遍,加入浓度为1:3000的HRP-羊抗人IgG,室温孵育1 h;PBST洗5遍,底物TMB显色5 min,2M盐酸终止反应,在ELISA检测仪上于450 nm处测吸光度(OD值)并记录。
1.4 统计学方法 用Prism 5统计软件进行分析。数据采用均数±标准误表示,用Kruskal-Wallis检验进行单因素分析(one-way ANOVA),各组之间数据多重比较用Dunn's检验。P<0.05认为差异有统计学意义。
2 结果
2.1 SLE患者血清中抗Galectin-3抗体水平 如图1所示,SLE患者和正常人血清中抗Galectin-3抗体OD值分别为0.89±0.08和0.46±0.02。抗Galectin-3抗体在SLE患者血清中显著高于健康对照组,且具有统计学差异(P<0.05)。而我们前期实验检测抗Galectin-3抗体吸光度值在有皮损SLE患者和正常人分别为:0.75±0.39和0.40±0.32(P<0.05)。此次实验结果和前期结果一致[4],一方面进一步肯定了我们之前的发现,另一方面也保证了本次试验中实验技术的可靠性。
2.2 UV、HSP、LCV患者血清中抗Galectin-3抗体水平 如图1所示,UV、HSP、LCV患者血清中抗Galectin-3抗体均高于正常人,OD值分别为:0.71±0.05,0.60±0.05和0.60±0.04,但仅有UV患者血清中抗Galectin-3抗体水平较健康对照组是有统计学差异(P<0.05)。
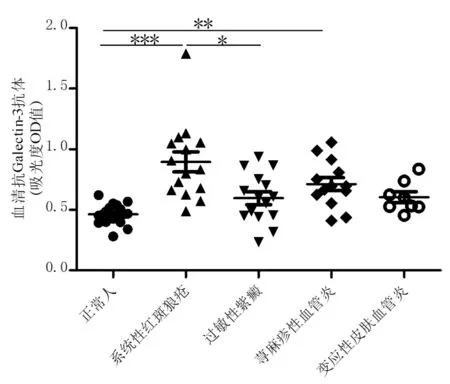
正常人(15例);SLE(15例);HSP(15例);UV(13例); LCV(8例); *P<0.05, **P<0.01, ***P<0.001
图1 有皮损的SLE、HSP、UV、LCV患者血清中抗Galectin-3抗体的水平
3 讨论
Galectin-3蛋白可表达在细胞核、胞浆或胞膜上,也可以被分泌至循环系统中,具有促进细胞生长、加速细胞周期、调控细胞凋亡以及调节转录等功能[5,6]。抗Galectin-3抗体在一些自身免疫性疾病和肿瘤发生过程中有重要作用。在之前的研究中我们发现,有皮肤血管炎表现的SLE患者血清中抗Galectin-3抗体明显高于正常人,且与皮损严重程度呈正相关,提示抗Galectin-3抗体在SLE皮损发生发展中可能起着重要的作用[4]。另外,一些肠道自身免疫性疾病如克罗恩病患者血清中抗Galectin-3抗体滴度也显著高于正常人,并且与疾病活动性相关[7]。还有,国外也有研究将抗Galectin-3抗体用于治疗多发性骨髓瘤及卵巢肿瘤,并取得了不错的成果,提示该抗体在肿瘤发生中也有重要作用[8]。
在本研究中,我们发现UV患者血清中抗Galectin-3抗体的滴度高于健康对照组,提示血清抗Galectin-3抗体升高不仅见于有皮肤血管炎表现的SLE患者,也可以出现在有皮损的UV患者。众所周知,SLE发病机制主要是免疫调节失常及外界等因素综合作用于遗传易感人群,从而产生大量自身抗体、免疫复合物及炎症细胞、炎症因子,导致皮肤、肾脏、肺脏等多脏器损害[9]。在前期研究中,我们还通过体内实验证实了经皮内注射抗Galectin-3抗体可导致实验小鼠出现皮肤血管炎的表现[4]。既往研究证实免疫复合物的形成和沉积是导致UV疾病发生发展的重要机制,免疫复合物沉积于血管壁,通过激活补体从而导致局部血管性水肿、缺血、坏死等血管炎性表现,但是参与该病理过程的致病性抗体和靶抗原尚不清楚[10,11]。因此,血清中抗Galectin-3抗体水平升高可能是引起UV患者皮损病变的原因之一,其血清水平升高与荨麻疹性血管炎的发生、发展以及转归之间的关系尚需进一步研究。与此同时,在我们的研究中,伴有皮肤血管炎表现的SLE患者血清中抗Galectin-3抗体滴度较正常人明显升高,但在UV患者中升高程度并不如前者。Her MY及Roy K等[12,13]的研究也发现,UV中的一部分患者,尤其是伴有低补体表达的患者,在随访过程中演变成为SLE,提示外周血中抗Galectin-3抗体明显升高的UV患者有演变成SLE的趋势,而HSP、LCV则基本不会演变成SLE,这为我们进一步追踪UV患者是否会演变至SLE,以及观察其诊断是否准确、治疗是否合适提供了一定的借鉴意义。
值得注意的是,UV、HSP、LCV作为皮肤科三种常见的皮肤血管炎,目前其病因尚不明确。大约有45%~55%的皮肤血管炎患者属于特发性发病,其他病因主要包括感染(15%~15%)、炎性疾病(15%~20%)、药物(10%~15%)、肿瘤(<5%)等[14]。而在皮肤病理表现上,这三种皮肤血管炎均可见毛细血管、微静脉等小血管周围有大量炎症细胞浸润。在临床工作中,皮肤血管炎诊断的重要依据是临床及病理表现。如这三种疾病临床表现不典型,而病理未见明显改变或机体状态不允许行皮肤病理活检,鉴别诊断就成为一个相当困难的问题。在本次研究中我们发现,只有伴有皮损表现的UV患者血清中抗Galectin-3抗体水平明显高于健康对照组,由此,血清抗Galectin-3抗体可能成为UV的相对特异的生物标志物,有助于UV的诊断。当然,本次试验的局限性在于,样本的例数相对较少,期望将来能有更多的患者参与大样本研究,以充分肯定上述结果。
综上所述,本研究发现了有皮损的UV患者血清中抗Galectin-3抗体滴度较正常人升高,可能在UV患者发病机制中发挥重要作用。
[1] Filosa A, Verdelli A, Bianchi B, et al. Cutaneous vasculitidis: histology and immunofluorescence[J]. G Ital Dermatol Venereol,2015,150(2):183-191.
[2] Barile-Fabris L, Hernandez-Cabrera MF, Barragan-Garfias JA. Vasculitis in systemic lupus erythematosus[J]. Curr Rheumatol Rep,2014,16(9):440.
[3] Larsen L, Chen HY, Saegusa J, et al. Galectin-3 and the skin[J]. J Dermatol Sci,2011,64(2):85-91.
[4] Shi ZR, Tan GZ, Meng Z, et al. Association of anti-acidic ribosomal protein P0 and anti-galectin 3 antibodies with the development of skin lesions in systemic lupus erythematosus[J]. Arthritis Rheumatol,2015,67(1):193-203.
[5] Newlaczyl AU, Yu LG. Galectin-3-a jack of all trades in cancer[J]. Cancer Lett,2011,313(2):123-128.
[6] Saccon F, Gatto M, Ghirardello A, et al. Role of galectin-3 in autoimmune and non-autoimmune nephropathies[J]. Autoimmun Rev,2017,16(1):34-47.
[7] Jensen-Jarolim E, Neumann C, Oberhuber G, et al. Anti-Galectin-3 IgG autoantibodies in patients with Crohn's disease characterized by means of phage display peptide libraries[J]. J Clin Immunol,2001,21(5):348-356.
[8] Mirandola L, Nguyen DD, Rahman RL, et al. Anti-galectin-3 therapy: a new chance for multiple myeloma and ovarian cancer?[J]. Int Rev Immunol,2014,33(5):417-427.
[9] Tsokos GC. Systemic lupus erythematosus[J]. N Engl J Med,2011,365(22):2110-2121.
[10] Venzor J, Lee WL, Huston DP. Urticarial vasculitis[J]. Clin Rev Allergy Immunol,2002,23(2):201-216.
[11] Mehregan DR, Hall MJ, Gibson LE. Urticarial vasculitis: a histopathologic and clinical review of 72 cases[J]. J Am Acad Dermatol,1992,26(3 Pt 2):441-448.
[12] Her MY, Song JY, Kim DY. Hypocomplementemic urticarial vasculitis in systemic lupus erythematosus[J]. J Korean Med Sci,2009,24(1):184-186.
[13] Roy K, Talukdar A, Kumar B, et al. Hypocomplementaemic urticarial vasculitis syndrome: a mimicker of systemic lupus erythematosus[J]. BMJ Case Rep,2013,2013.
[14] Fiorentino DF. Cutaneous vasculitis[J]. J Am Acad Dermatol,2003,48(3):311-340.
(收稿:2017-02-07)
Detection of serum anti-galectin-3 antibody in the patients with cutaneous vasculitis
ZHANGYuping,TANGZengqi,WANGLiangchun.
DepartmentofDermatology,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China
WANGLiangchun,E-mail:wliangch@mail.sysu.edu.cn
Objective: To detect the level of the serum anti-Galectin-3 antibody in the patients with systemic lupus erythematosus (SLE), urticarial vasculitis (UV), Henoch-Schönlein purpura (HSP) and leukocytoclastic vasculitis (LCV). Methods: The level of serum anti-Galectin-3 from 15 patients with SLE, 13 with UV, 15 with HSP, 8 with LCV and 15 healthy controls was detected by enzyme-linked immunosorbent assay (ELISA). Results: The values of optical density (OD) of anti-Galectin-3 antibody in the patients with SLE and UV were 0.89±0.08 and 0.71±0.05 respectively, which were significantly higher than those in the healthy controls (0.46±0.02) (P<0.05). There was no significant difference in the level of anti-Galectin-3 antibody among the patients with HSP (0.60±0.05), LVC (0.60±0.04) and healthy controls. Conclusion: Serum level of anti-Galectin-3 antibody was associated the cutaneous vasculitis in the patients with UV and SLE.
urticarial vasculitis; Henoch-Schönlein purpura; leukocytoclastic vasculitis; anti-Galectin-3 antibody
中山大学孙逸仙纪念医院皮肤科,广东广州,510120
王亮春, E-mail: wliangch@mail.sysu.edu.cn

