ZFP580对大鼠心肌缺血/再灌注后心室重塑的影响*
苗 婕, 孟凡鹏, 毛士云, 马玉梅, 孟祥艳△, 张 梅△
(1. 天津医科大学研究生院, 天津 300070; 2. 武警后勤学院附属医院心内科, 天津 300162;3. 武警后勤学院生理学与病理生理学教研室, 天津 300309)
ZFP580对大鼠心肌缺血/再灌注后心室重塑的影响*
苗 婕1, 孟凡鹏2, 毛士云3, 马玉梅3, 孟祥艳3△, 张 梅2△
(1. 天津医科大学研究生院, 天津 300070; 2. 武警后勤学院附属医院心内科, 天津 300162;3. 武警后勤学院生理学与病理生理学教研室, 天津 300309)
目的:探究锌指转录因子(ZFP580)与心肌缺血/再灌注损伤后心室重塑的关系。方法:72只SD大鼠随机分为假手术(sham)组(n=8)和心肌缺血/再灌注(I/R)组(n=64),其中I/R组分别在再灌注后的0.5 h、1 h、2 h、4 h、1 d,7 d,14 d,28 d 处死后取材,观察心肌组织中ZFP580的表达。培养大鼠H9C2心肌细胞,每组设3个复孔,分别在转化生长因子β1(TGF-β1)刺激0 h、8 h、16 h、24 h后观察心肌细胞肥大情况,并检测心肌细胞中β-MHC、心房利钠肽(ANP)以及ZFP580 mRNA的表达。利用慢病毒介导的基因转染获得高表达ZFP580的H9C2心肌细胞,转染72h后,检测心肌细胞中基质金属蛋白酶3(MMP-3)的表达。结果:成功建立心肌缺血/再灌注损伤模型,大鼠心肌I/R损伤后第14天,心肌组织大面积梗死,心肌细胞呈嗜酸性变。大鼠心肌组织中ZFP580及TGF-β1表达上调。TGF-β1(5 ng/ml)刺激H9C2心肌细胞后诱导心肌细胞肥大,心肌细胞肥大标志蛋白β-MHC、ANP表达上调,且心肌细胞中ZFP580mRNA表达上调(P<0.05)。高表达ZFP580的H9c2心肌细胞中MMP-3表达下调(P<0.05)。结论:锌指转录因子ZFP580可能参与了心肌缺血/再灌注后心室重塑的过程,其作用可能与参与TGF-β1诱导的心肌细胞肥大过程以及抑制心肌细胞产生MMP-3有关。
转录因子;锌指;缺血/再灌注损伤;转化生长因子;大鼠
心脏负荷增加、心肌缺血和缺血/再灌注(ischemia/reperfusion,I/R)损伤等急慢性疾病诱发的病理性心室重塑,在心血管疾病中有重要作用,日益受到人们的关注。心室重塑重要的病理生理变化是心肌肥厚,心肌肥厚发生的结构基础主要有心肌细胞的肥大以及心肌间质的纤维化。研究发现,转化生长因子β1(transforming growth factor-beta 1, TGF-β1)与心肌细胞肥大及心肌细胞外基质形成密切相关[1,2]。大鼠源性锌指蛋白ZFP580(zinc finger protein 580, ZFP580)是一种C2H2型锌指核转录因子[3,4]。检索基因表达数据库中有关ZFP580的信息显示,ZFP580受多条信号通路的调控,并通过调节靶基因的转录水平,参与细胞增殖、分化与凋亡[5]。前期实验研究证明ZFP580可能参与维持细胞的正常功能,对于细胞的存活、增殖等生理活动具有明显意义[6];在大鼠心肌I/R损伤过程中,ZFP580作为心肌细胞内源性抗凋亡因子发挥细胞保护作用[7]。本组前期通过酵母双杂交实验发现TGF-β1下游的调控因子Smad2为ZFP580的互作蛋白[8]。本次研究旨在探讨ZFP580是否参与了TGF-β1诱导的心肌I/R损伤后心室重塑的过程。
1 材料与方法
1.1 实验动物及分组
雄性SD大鼠72只,体质量(250~300)g,随机分为: (1)假手术(sham)组(n=8):大鼠行开胸手术后,冠状动脉下只穿线不结扎。(2)心肌缺血/再灌注(I/R)损伤组(n=64):10%水合氯醛(0.3 ml/100 g)腹腔麻醉大鼠,行气管插管进行机械通气,沿大鼠胸骨左缘纵行切开皮肤,钝性分离皮下及肌肉组织,自左侧第3肋间进入胸腔。钝性剥离大鼠心包,暴露心脏,在肺动脉圆锥和左心耳交界处用5-0号丝线结扎左冠状动脉前降支30 min后再通实现再灌注,分别在再灌注后0.5 h、1 h、2 h、4 h、1 d、7 d、14 d、28 d处死动物64只,留取标本。
1.2 实验材料
大鼠H9C2心肌细胞由中国科学院上海细胞研究所提供。TGF-β1含量ELISA检测试剂盒(R&D),HE染色试剂盒(索莱宝),免疫组化试剂盒(碧云天),ZFP580一抗(Abcam),β-actin一抗(Sigma),α-actin一抗(Sigma),Triton-X(Sigma),高糖DMEM(Gibco),其余为国产分析纯。
1.3 实验方法
1.3.1 HE染色及免疫组化法观察大鼠心肌组织形态的变化 大鼠放血处死后,自心肌结扎点以下将心脏横切,取3~5 mm厚度心肌组织用4%多聚甲醛固定、脱水、石蜡包埋、切片。常规苏木素-伊红(HE)染色后在光镜下观察形态学改变。大鼠心肌组织切片脱蜡至水,依次入3%过氧化氢中10 min,灭活内源性过氧化物酶;正常羊血清封闭20 min,添加ZFP580一抗,4℃孵育过夜;添加生物素标记二抗,37℃孵育30 min;SABC工作液孵育20 min,显微镜下观察ZFP580在心肌组织的表达、分布及亚细胞定位情况。以细胞内可见呈棕黄色颗粒的阳性反应产物作为ZFP580阳性细胞,每张切片在高倍显微镜下(×400)随机选择5个视野,计算每个视野阳性细胞率,取平均值作为该标本的ZFP580阳性细胞率。
1.3.2 ELISA测定大鼠心肌组织中TGF-β1含量 各组大鼠心肌I/R后0.5 h、1 h、2 h、4 h 后,留取左心室组织块剪碎,加入裂解液,电动匀浆,12 000 r/min离心10 min后,取上清,按照ELISA试剂盒说明检测血清中TGF-β1含量。
1.3.3 TGF-β1诱导H9C2心肌细胞肥大 按1×106cells/well将H9C2细胞接种于培养皿,细胞融合至80%时更换为含1% FBS的DMEM培养基,对细胞进行饥饿处理8 h,在培养基中加入溶于DMSO的TGF-β1(5 ng/ml),对照组加入相同剂量的DMSO,刺激0 h、8 h、16 h、24 h后分别收集细胞,每个时间段设3个复孔,重复2次。
1.3.4 qPCR法检测心肌组织中或H9C2细胞中ZFP580、β-MHC、心房利钠肽的表达 提取大鼠心肌梗死周边区组织中的总RNA或H9C2心肌细胞总RNA,逆转录合成cDNA。在反应体系中分别加入目的基因的上下游引物(表1)对应的SYBR Green荧光染料进行qPCR,计算Ct(Threshold Cycle)值。利用荧光曲线值和Ct值分别计算目的基因ZFP580、β-MHC、ANP和对照β-actin的比值。扩增程序为:变性95℃,15 s;退火50℃~65℃,32 s;延伸72℃,20 s;荧光检测76℃,3 s,共45个循环;溶解程序:55℃~65℃,10~20 s,95℃,10~20 s,一个循环。
Tab. 1 Primer sequences use for ZFP580, ANP and β-MHC cDNA(bp)
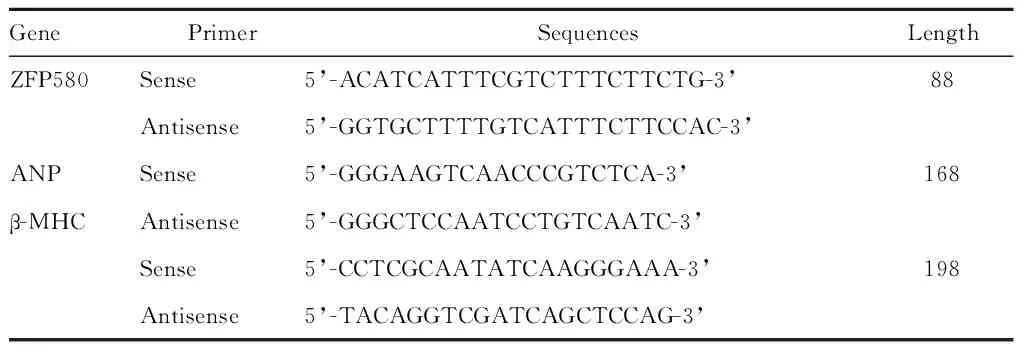
GenePrimerSequencesLengthZFP580Sense5’-ACATCATTTCGTCTTTCTTCTG-3’88Antisense5’-GGTGCTTTTGTCATTTCTTCCAC-3’ANPSense5’-GGGAAGTCAACCCGTCTCA-3’168β-MHCAntisense5’-GGGCTCCAATCCTGTCAATC-3’Sense5’-CCTCGCAATATCAAGGGAAA-3’198Antisense5’-TACAGGTCGATCAGCTCCAG-3’
ZFP580: Zinc finger protein 580; ANP: Atrial natriuretic peptide; β-MHC: Myosin heavy chain beta
1.3.5 Western blot检测H9C2细胞中ZFP580、MMP-3目的蛋白的表达 提取H9C2细胞总蛋白,BCA法测定蛋白浓度,每孔上样60 μg,10% SDS PAGE,转膜、封闭、加入目的蛋白一抗(1∶1 000 稀释)、4℃孵育过夜、辣根过氧化物酶标记的二抗孵育1 h、ECL化学发光法显色照相。用Image J分析软件对照片中蛋白条带进行灰度(integrated absorbance,IA)分析。IA值=平均吸光度值×面积,以目的蛋白ZFP580、MMP-3与β-actin的IA值比反映靶蛋白相对表达水平。
1.3.6 激光共聚焦荧光显微镜观察H9C2细胞肥大情况 以5 ng/ml TGF-β1刺激H9C2心肌细胞24 h后,多聚甲醛室温固定20 min,用含0.1%的TritonX-100的PBS室温孵育10 min,BSA室温封闭10 min,加入α-actin一抗4℃孵育过夜,第2日加入二抗避光室温孵育2 h,1 μg/ml DAPI染核10 min,甘油封片,激光共聚焦荧光显微镜进行观察,选取五个不同视野用IPP软件测量细胞面积并统计。
1.3.7 慢病毒介导的基因转染实验 重组表达ZFP580全长基因的慢病毒载体(Lenti-ZFP580)颗粒,并设置空载体(Lenti-NC)作为对照。在H9C2细胞融合至30%~40%时按照感染复数 (MOI值) 200进行转染,转染72 h后进行后续试验。
1.4 统计学方法
2 结果
2.1 大鼠心肌I/R损伤对ZFP580 mRNA表达的影响
qPCR检测结果显示大鼠心肌I/R损伤后,与sham组(0.28± 0.11)比较,心肌组织中ZFP580 mRNA的表达在I/R损伤后的2 h(1.82± 0.36)及第14天(1.51±0.28)显著升高(P<0.05,图1)。

Fig. 1 Expression of ZFP580 mRNA after myocardial ischemia/reperfusion injury (n=8) ZFP580: Zinc finger protein 580*P<0.05vssham group
2.2 大鼠心肌组织I/R损伤后的形态学改变
大鼠心肌I/R损伤后第14天,心肌组织经HE染色后在缺血心肌区组织中可见心肌细胞肿胀,心肌间质内炎性细胞渗出,大量心肌细胞呈嗜酸性变。经免疫组织化学染色后,于梗死周边区心肌组织中可见大量ZFP580表达阳性细胞,与sham组(11.07±1.58)%相比,梗死周边区ZFP580表达阳性细胞率明显增多(30.01±2.85)% (P<0.05,图2)。
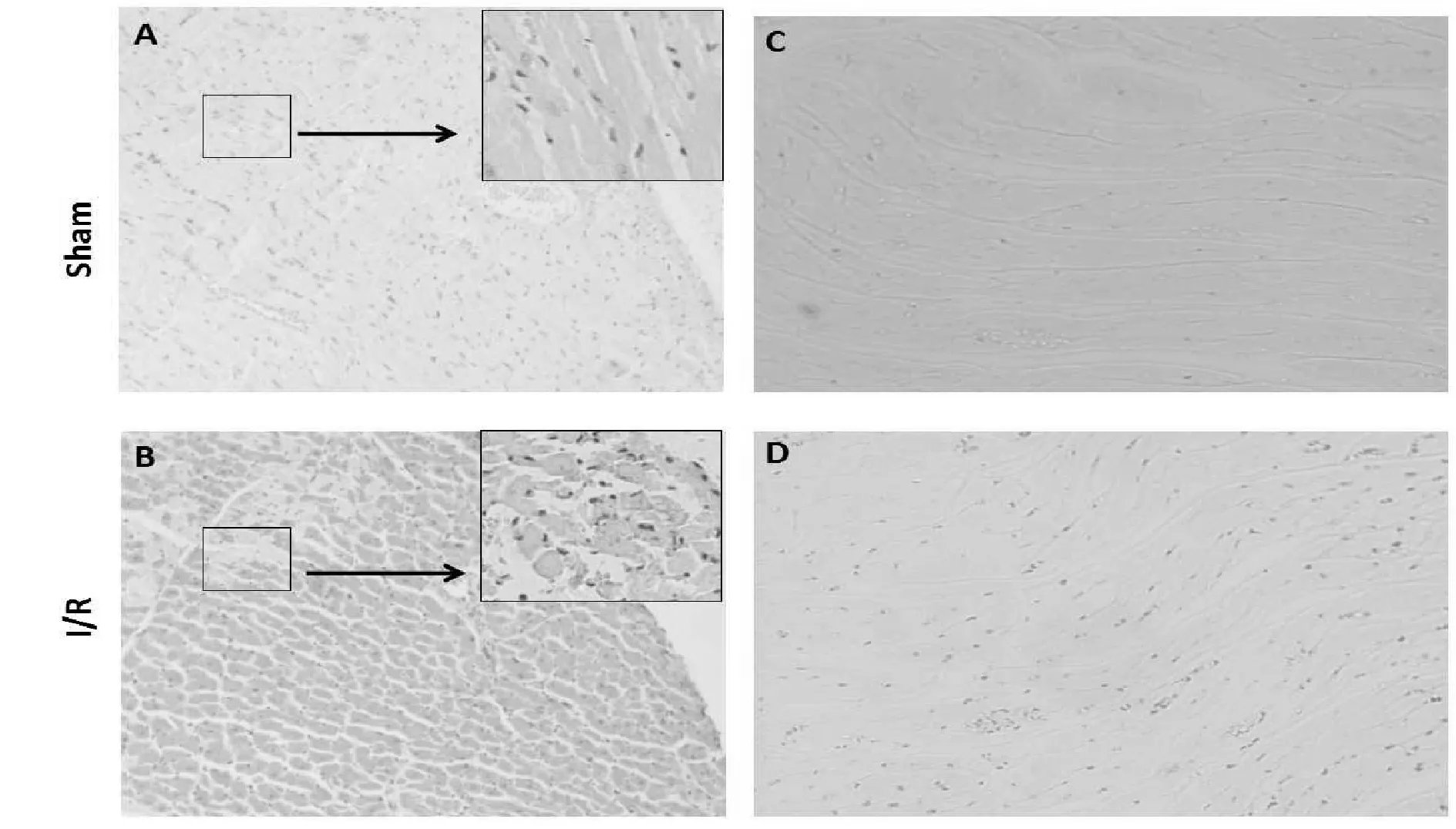
Fig. 2 Results of immunohisto-chemical staining and HE staining 14thd after myocardialIschemia/reperfusion injury in rats (×400,n=8) A: Sham group(HE); B: Myocardial I/R group(HE); C: Sham group(immunohistochemical); D: Myocardial infarction group(immunohistochemical)
2.3 大鼠心肌I/R损伤对TGF-β1表达的影响
大鼠心肌I/R损伤0.5 h、1 h、2 h、4 h后取左室心肌心尖部组织,剪碎匀浆离心后,取上清液检测。结果显示,与sham组(0.49±0.07)比较,大鼠心肌I/R损伤后的心肌组织匀浆中TGF-β1的含量明显升高,在2 h最为明显(1.10±0.30),差异有显著性(P<0.05,图3)。

Fig. 3 ELISA results of TGF-β1 in the tissue after myocardial ischemia/reperfusion injury in rats (n=8) TGF-β1: Transforming growth factor-beta 1*P<0.05vssham group
2.4 TGF-β1诱导H9C2心肌细胞中β-MHC、ANP、ZFP580表达的改变
分别以不同浓度TGF-β1(0~10 ng/ml)刺激H9C2心肌细胞24 h,qPCR结果显示, β-MHC及ZFP580在5 ng/ml TGF-β1刺激时表达升高,而ANP在TGF-β1浓度为2.5 ng/ml 至10 ng/ml时均可诱导其表达上调,不成剂量依赖性(表2)。取TGF-β1为5 ng/ml浓度进行后续实验。Western blot显示ZFP580在TGF-β1刺激8 h、16 h、24 h时间后,ZFP580表达上调,且随作用时间的延长而表达上调(图4)。
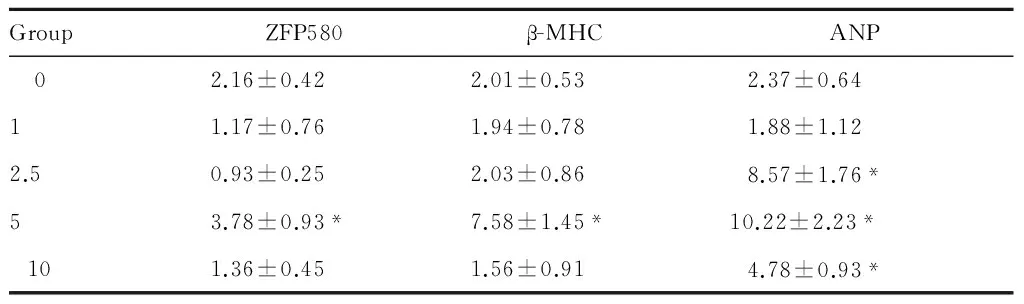
GroupZFP580β-MHCANP 02.16±0.422.01±0.532.37±0.6411.17±0.761.94±0.781.88±1.122.50.93±0.252.03±0.868.57±1.76*53.78±0.93*7.58±1.45*10.22±2.23*101.36±0.451.56±0.914.78±0.93*
ZFP580: Zinc finger protein 580; ANP: Atrial natriuretic peptide; β-MHC: Myosin heavy chain beta;TGF-β: Transforming growth factor-beta
*P<0.05vs0 content of TGF-β
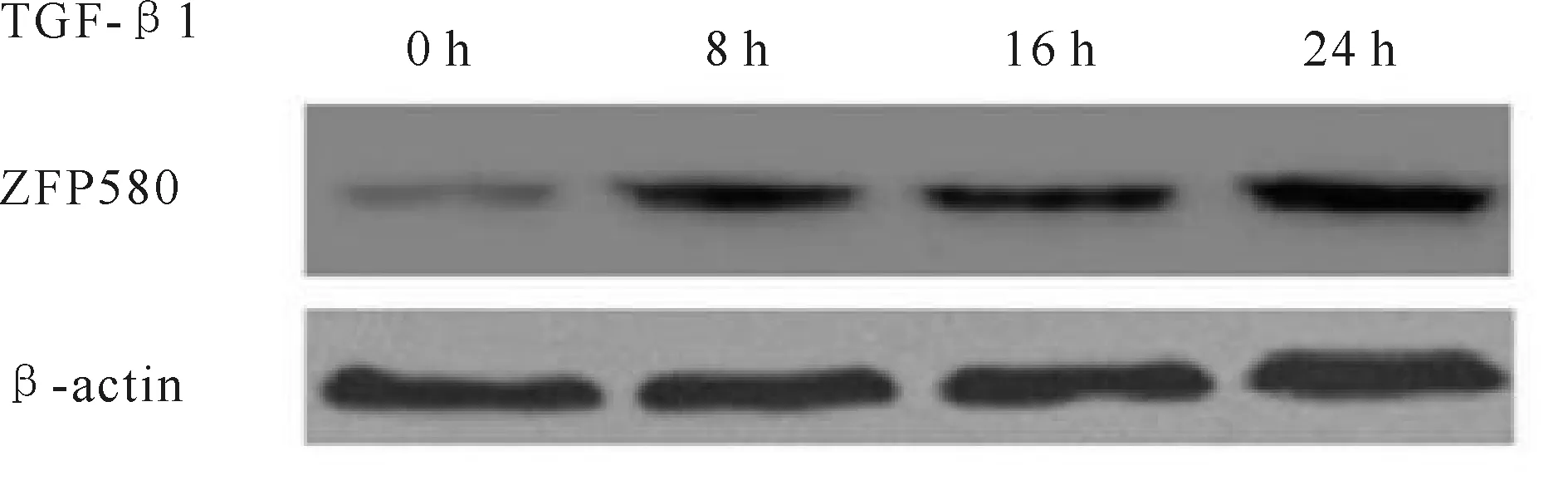
Fig. 4 Expression of ZFP580 protein after exposure to TGF-β1(n=8) ZFP580: Zinc finger protein 580; TGF-β: Transforming growth factor-beta
2.5 激光共聚焦显微镜观察TGF-β1诱导的心肌细胞形态学的改变
细胞经TGF-β1刺激24 h后,激光共聚焦显微镜下观察,可见连接a-actin的辣根过氧化酶所带绿色荧光显示为细胞骨架,蓝色荧光为DAPI所染的细胞核,选取五个不同视野用IPP软件测量细胞体积并统计,统计结果表明TGF-β1处理过后细胞骨架细胞面积(21315.59±1249.19)μm2明显大于control组(14663.09±1300.12)μm2,面积比为(1.45±0.22∶1)(图5)
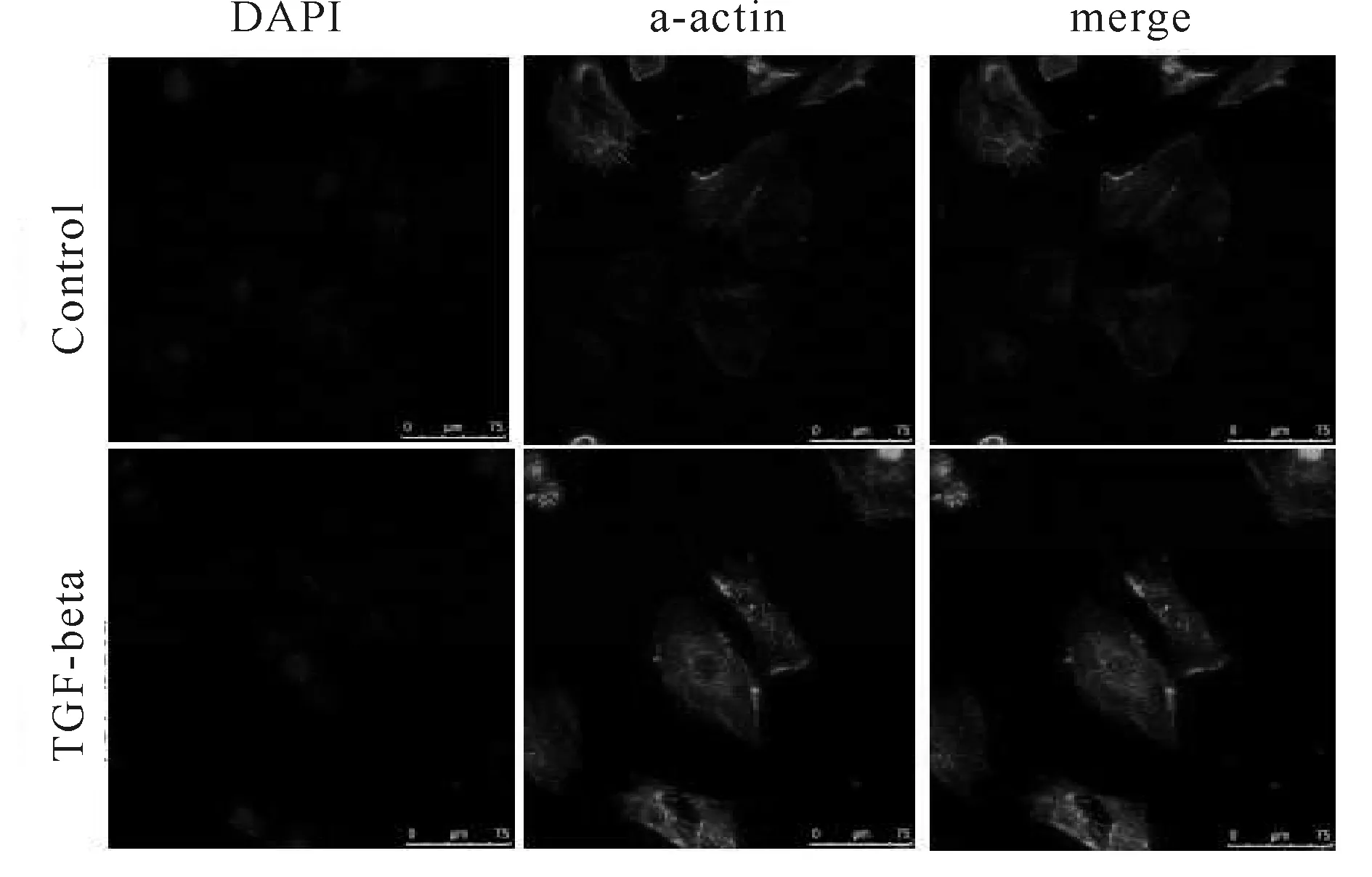
Fig. 5 Observation of H9C2 cardiomyocytes under Laser confocal microscope with TGF-β1 treatment
2.6 高表达ZFP580的H9C2细胞中MMP-3表达的改变
利用慢病毒转染实验获得了高表达ZFP580的H9C2心肌细胞。WB结果显示,转染72 h后,与空载体对照组(0.65 ±0.02)相比较,高表达ZFP580的H9C2细胞中MMP-3表达明显下调(0.37±0.03)(P<0.05,图6)。

Fig. 6 Expression of MMP-3 protein in H9C2 cells with and without ZFP580 transfection (three experiments were performed for each group and each experiment was repeated twice) Lenti-ZFP580: H9C2 cells transfected by Lentiviral-mediated ZFP580gene; Lenti-NC: Negetive control
3 讨论
心肌缺血/再灌注损伤后可通过启动一系列复杂的分子和细胞机制导致心肌的结构、功能和表型发生变化,从而导致心室的重构,其发生与内源性炎症细胞因子的释放密切相关[9]。TGF-β1 是促进心肌细胞增殖分化的主要生长因子,可通过刺激成纤维细胞的增生,促进胶原合成,升高基质金属蛋白酶的表达以及诱导心肌细胞的肥大等,在心肌I/R损伤后心室重构中起着重要作用。大量动物和临床实验结果提示,心肌梗死或压力超负荷所致心肌肥厚均同时伴随着左室心肌组织中的TGF-β1的表达上调[10-13];血清TGF-β1水平与慢性心力衰竭患者心室重构密切相关[14]。TGF-β1引起心肌细胞肥大及心室重塑的过程涉及多种复杂的细胞因子相互作用及细胞信号转导通路的级联反应,其中,TGF-β/Smads通路是与心肌肥大及纤维化过程相关的最重要和最特异的信号转导通路[15]。本研究发现,心肌I/R后心肌组织中TGF-β1蛋白水平上调,与文献报道一致,然而其与心室重塑间的联系及其具体机制值得探讨。
人ZNF580及其鼠源性同源基因ZFP580,是本室最先发现的与心血管发育或疾病密切相关的锌指转录因子。本组前期实验中利用酵母双杂交技术,筛选出与ZNF580相互作用的14种蛋白,经免疫共沉淀技术验证了ZNF580和Smad2之间存在相互作用,并经免疫荧光共定位实验证实在内皮细胞中ZNF580和Smad2存在共定位现象,定位主要集中在细胞核[16],提示人ZNF580或鼠 ZFP580可能通过参与Smads 信号途径发挥生物作用。本研究发现,心肌I/R后心肌组织中ZFP580 mRNA在1 d之内和7~14 d出现两个表达高峰,免疫组织化学染色结果显示ZFP580表达阳性细胞多存在于梗死周边心肌组织中,提示ZFP580可能参与了心肌细胞的自身修复及心室重塑的过程。在细胞实验中发现,TGF-β1刺激可引起心肌细胞肥大以及肥大标志蛋白β-MHC、ANP在转录水平的表达上调,同时H9C2心肌细胞中ZFP580表达水平上调。可见,ZFP580与TGF-β1诱导的心肌细胞肥大存在关联,结合本组之前有关ZNF580和Smad2之间存在相互作用的研究结果,我们推测ZFP580可被TGF-β1诱导,并作为TGF-β1/Smads通路的下游转录因子发挥作用,参与了TGF-β1诱导的心肌细胞肥大过程。
另外,细胞外基质的改建,尤其是心肌胶原的沉积与心肌细胞肥大的不同步发展是促使心肌肥厚由代偿向失代偿转变的主要原因之一[1-3]。基质金属蛋白酶MMPs是水解细胞外基质的蛋白裂解酶,主要由胶原酶和弹性蛋白酶构成。MMPs的表达和活性增强,可导致正常心肌胶原蛋白过度降解,并被缺乏连接结构的纤维间质取代,使心脏组织重构,最终导致心功能恶化[16]。本研究发现,转染Lenti-ZFP580后获得高表达ZFP580的心肌细胞中MMP-3表达下降,表明转录因子ZFP580能够通过下调MMP-3的表达,与细胞外基质形成存在一定的关联。
综上所述,ZFP580可能作为下游转录因子影响TGF-β1诱导的心肌细胞肥大,并通过抑制MMP-3的表达调控心肌细胞外基质形成,从而影响了心肌I/R损伤后心室重塑的过程。但其参与的具体机制还未完全阐明,值得进一步研究。
[1] Kim SI, Na HJ, Ding Y,etal. Autophagy promotes intra-cellular degradation of type I collagen induced by transfor-ming growth factor (TGF)-beta1[J].JBiolChem, 2012, 287(15): 11677-11688.
[2] Schultz Jel J, Witt SA, Glascock BJ,etal. TGF-β1 mediates the hypertrophic cardiomyocyte growth induced by angiotensin II[J].JClinInvest, 2002, 109(6): 787-796.
[3] 张文成, 陈保生, 曾武威, 等. 低密度脂蛋白诱导下调的新基因cDNA的克隆及组织表达[J]. 基础医学与临床, 2003, 23(3): 279-282.
[4] 张文成, 张 敏, 徐瑞成, 等. 锌指蛋白ZNF580定位在MGC803细胞核[J]. 基础医学与临床, 2006, 26(2): 199-200.
[5] 王 维, 林 雷, 郭 敏, 等. 基于基因表达数据库的鼠ZFP580基因功能分析[J]. 武警医学院学报, 2011, 20(2): 147-150.
[6] Sun HY, Wei SP, Xu RC,etal. Sphingosine-1-phosphate induces human endothelial VEGF and MMP-2 production via transcription factor ZNF580: Novel insights into angiogenesis [J].BiochemBiophysResCommun, 2010, 395(3): 361-366.
[7] 孟祥艳, 于海龙, 郭 敏, 等. 间歇低压低氧预处理对心肌缺血-再灌注损伤及ZFP580表达的影响[J]. 中国应用生理学杂志, 2014, 30(5): 396-400.
[8] 罗玉玉, 杨 蓉, 孔麟麟, 等. 酵母双杂交筛选与转录因子ZNF580相互作用的蛋白[J]. 中国病理生理杂志, 2012, 28(6): 1120-1123.
[9] 郑 欢, 罗 明. 炎性细胞因子与急性心肌梗死后心室重构的关系[J]. 心血管病学进展, 2007, 28(2): 208-211.
[10]刘 英, 廖玉华, 程 翔, 等. 急性心肌梗死后心脏TGF-β1的表达和心室重塑[J]. 中国病理生理杂志, 2005, 21(12): 2305-2309.
[11]Li G, Li RK, Mickle DA,etal. Elevated insulin-like growth factor-1 and transforming growth factor-beta 1 and their receptors in patients with idiopathic hypertrophic obstructive cardiomyopathy. A possible mechanism [J].Circulation, 1998, 98(19 Suppl): 1144-1149.
[12]Schluter KD, Zhou XJ, Piper HM. Induction of hypertrophic responsiveness to isoproterenol by TGF-beta in adult rat cardiomyocytes [J].AmJPhysiolCellPhysiol, 1995, 269(5): 1311-1316.
[13]Lindsey ML, Iyer RP, Jung M,etal. Matrix metalloproteinases as input and output signals for post-myocardial infarction remodeling[J].JMolCellCardiol, 2016, 91: 134-140.
[14]邬 涛, 吴清华, 吴 丹, 等. 慢性心力衰竭患者外周血NF-κB、血清TGF-β1与心室重构的相关性[J]. 重庆医学, 2016, 45(24): 3408-3411.
[15]Lcesk A, Abraham DJ. TGF-beta signaling and the fibrotic response [J].FASEBJ, 2004, 18(7): 816-827.
[16]Luo Y, Hu W, Xu R,etal. ZNF580, a novel C2H2 zinc-finger transcription factor, interacts with the TGF-beta signal molecule Smad2 [J].CellBiolInt, 2011, 35(11): 1153-1157.
Effects of ZFP580 on ventricular remodeling after myocardial ischemia/reperfusion in rats
MIAO Jie1, MENG Fan-peng2, MAO Shi-yun3, MA Yu-mei3, MENG Xiang-yan3△, ZHANG Mei2△
(1. Graduate School of Tianjin Medical University, Tianjin 300070; 2. Department of Cardiology, Affiliated Hospital of Logistics University of Chinese People’s Armed Police Force, Tianjin 300162; 3. Department of Physiology and Pathophysiology, Logistics University of Chinese People’s Armed Police Force, Tianjin 300309, China)
Objective: To investigate the relationship between zinc finger protein(ZFP580)and ventricular remodeling after myocardial ischemia/reperfusion(I/R) injury in rats. Methods: Seventy-two rats were divided into sham group and I/R groups which would be tested in series time of 0.5 h, 1 h, 2 h, 4 h, 1 d,7 d,14 d,28 d after reperfusion to observe the expression of ZFP580 in rat myocardium. The H9C2 cells were cultured and treated with transforming growth factor-beta1 (TGF-β1) to establish cardiac hypertrophy in vitro model in series time of 0 h, 8h, 16 h and 24 h. The cardiomyocyte hypertrophy morphology was measured. The mRNA levels of atrial natriuretic peptide(ANP), myosin heavey chain beta(β-MHC) and ZFP580 genes were quantified. The protein levels of MMP-3 and ZFP580 were quantified after H9C2 cells were transfected by lentiviral-mediated ZFP580 gene. Results: Myocardial I/R injury model was successfully established. Myocardial tissue in rats had large area infarction, and myocardial cells were eosinophilic changed. The increased level of ZFP580 protein was observed in the cardiomyocytes around infarction zone. The expression of TGF-β1 in myocardium was up-regulated after myocardial I/R injury. TGF-β1 (5 ng/ml) treatment could induce cardiomyocyte hypertrophy in H9C2 cells. TGF-β1 treatment increased the cell size and mRNA levels of ANP and β-MHC genes (P<0.05), which represent degree of cardiac hypertrophy. TGF-β1 treatment also increased the protein levels of ZFP580 in H9C2 cells (P<0.05). In the H9C2 cells transfected by lentiviral-mediated gene, the protein level of MMP3 was decreased (P<0.05). Conclusion: ZFP580 is probably related with ventricular remodeling after myocardial I/R injury by involving TGF-β1 induced cardiomyocyte hypertrophy and attenuating MMP-3 production.
transcription factor; Zinc-fingers; ischemia/reperfusion injury; transforming growth factor; rat
天津市心血管重塑与靶器官损伤重点实验室开放基金(TJC1409);武警后勤学院附属医院种子基金重点项目(FYZ201509);天津市科委重点项目(16JCZDJC31900)
2016-12-23
2017-03-06
R541.4
A
1000-6834(2017)03-262-05
10.12047/j.cjap.5544.2017.064
△【通讯作者】Tel: 022-84876723,022-60577620; E-mail: mengxy1975@sina.cn,chyouyou@126.com

