一次性力竭运动过程中大鼠“黑质-丘脑-皮层”通路神经元相干性及递质动态变化*
胡琰茹, 刘晓莉, 乔德才△
(1. 北京师范大学体育与运动学院, 北京 100875; 2. 中南大学体育教研部, 湖南 长沙 410083)
一次性力竭运动过程中大鼠“黑质-丘脑-皮层”通路神经元相干性及递质动态变化*
胡琰茹1, 2, 刘晓莉1, 乔德才1△
(1. 北京师范大学体育与运动学院, 北京 100875; 2. 中南大学体育教研部, 湖南 长沙 410083)
目的:通过观察一次性力竭运动过程中大鼠“黑质-丘脑-皮层”通路核团间神经元电活动的相干性及各核团神经递质谷氨酸(Glu)和γ-氨基丁酸(GABA)的浓度,探讨运动疲劳发生过程中大鼠“黑质-丘脑-皮层”通路神经元电活动的可能机制。方法:40只雄性Wistar大鼠,随机分为神经元电活动实时测定组、黑质网状部(SNr)神经元胞外神经递质实时测定组、丘脑腹外侧核(VL)神经元胞外神经递质实时测定组及皮层辅助运动区(SMA)神经元胞外神经递质实时测定组(n=10)。大鼠提供3级递增负荷跑台运动方案进行一次性力竭运动,通过自身对照,观察神经元电活动实时测定组大鼠SNr、VL及SMA神经元细胞在一次性力竭运动前、中、后神经元电活动的动态变化,同步、动态观察神经元胞外神经递质实时测定组大鼠一次性力竭运动前、中、后大鼠SNr、VL及SMA胞外Glu和GABA的浓度及其比值变化。结果:黑质网状部、丘脑腹外侧核局部场电与皮层脑电在力竭运动过程的不同阶段脑区之间神经元电活动,在0~30 Hz范围内均存在显著相干性。与安静状态相比较,自主运动期,大鼠黑质网状部神经元胞外Glu浓度、Glu/GABA比值均显著下降(P<0.05,P<0.01), GABA浓度则显著升高(P<0.05,P<0.01),而丘脑腹外侧核及皮层辅助运动区神经元胞外Glu浓度、Glu/GABA比值均显著升高(P<0.05,P<0.01), GABA浓度则显著下降(P<0.05,P<0.01);疲劳初期和力竭期,大鼠黑质网状部神经元胞外Glu浓度、Glu/GABA比值均显著升高(P<0.05,P<0.01),GABA浓度则显著下降(P<0.05,P<0.01),而丘脑腹外侧核及皮层辅助运动区神经元胞外Glu浓度、Glu/GABA比值均显著下降(P<0.05,P<0.01),GABA浓度则显著升高(P<0.05,P<0.01)。结论:大鼠在一次性力竭运动过程中“黑质-丘脑-皮层”通路各核团之间存在神经网络联系,该通路各核团神经递质Glu、GABA浓度的改变是导致其神经元电活动变化的因素之一。
力竭运动;大鼠;“黑质-丘脑-皮层”通路;相干性;神经递质
中枢神经系统通过锥体系和锥体外系神经纤维的下行传导来完成躯体运动的调控。基底神经节是锥体外系传导通路中的重要核团,接受来自大脑皮层的大量信息传入,然后再将处理整合后的信息反馈给皮层,在运动调控中起着非常重要的作用[1]。基底神经节的信息传导主要通过以下3条通路来完成:即直接通路(皮层-纹状体-黑质网状部/苍白球内侧部复合体-丘脑-皮层),间接通路(皮层-纹状体-苍白球外侧部-丘脑底核-黑质网状部/苍白球内侧部复合体-丘脑-皮层)及超直接通路(皮层-丘脑底核-黑质网状部/苍白球内侧部复合体-丘脑-皮层),这3条通路最后均通过黑质网状部,经由丘脑腹外侧核的中继后传递到达皮层辅助运动区,因此,“黑质-丘脑-皮层”通路被称为基底神经节信息的最后输出通路,该通路各核团神经元兴奋性的改变及核团之间的相互作用可以反映基底神经节对皮层兴奋性的调控作用[2]。本实验室前期研究发现,在一次性力竭运动过程中,大鼠“黑质-丘脑-皮层”通路各核团神经元兴奋性的变化呈现明显的阶段性特征,运动疲劳发生时,黑质网状部神经元兴奋性增强,对丘脑腹外侧核神经元的兴奋性产生抑制作用,经丘脑中继后对皮层神经元产生去兴奋作用,是导致运动疲劳发生的因素之一[3]。然而,有关力竭运动过程中“黑质-丘脑-皮层”通路各核团神经元兴奋性变化的机制目前尚未见文献报道。中枢神经系统是由众多神经元组成,神经元之间信息传递的结构基础是突触,突触间信息传递的物质基础是神经递质[4]。近年来,关于运动疲劳与脑内神经递质之间关系的研究已成为运动领域的热点问题[5-6]。已有资料显示,“黑质-丘脑-皮层”通路各核团之间的神经纤维投射主要是谷氨酸(glutamic acid,Glu)能和γ-氨基丁酸(gamma-aminobutyric acid,GABA)能,黑质网状部接收来自纹状体、苍白球外侧部的GABA能神经纤维投射
,以及来自丘脑底核的Glu能神经纤维投射,并发出GABA能神经纤维投射至丘脑腹外侧核,经丘脑腹外侧核中继后发出Glu能神经纤维投射至皮层辅助运动区[7]。为此,本实验采用多通道电生理记录技术和在体微透析(microdialysis,MD)-高压液相色谱(high pressure liquid chromatography techniques,HPLC)联用技术,对一次性力竭运动过程中大鼠“黑质-丘脑-皮层”通路各核团间神经元电活动的相干性及神经元胞外递质Glu和GABA浓度的变化规律进行同步、动态观察,探讨一次性力竭运动过程中大鼠“黑质-丘脑-皮层”通路各核团间的神经网络联系,并试图从神经递质的角度揭示各核团在运动疲劳发生过程中电活动变化的可能机制,为进一步阐明运动疲劳的中枢机制,开发研制具有延缓疲劳产生或加速疲劳消除作用的分子靶向药物,提高运动员的竞技水平均具有重要的理论价值和实际意义。
1 材料与方法
1.1 实验动物
实验采用雄性Wistar大鼠,购自北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2002-2003),8周鼠龄,体重(290±20)g,分笼饲养,自由饮水,定量进食(每只大鼠每天20 g),自然光照,动物房内温度(20±3)℃,相对湿度为(50±10)%。大鼠随机分为4组,每组10只,共40只,第1组进行神经元电活动的实时测定;第2组进行黑质网状部神经元胞外神经递质的实时测定;第3组进行丘脑腹外侧核神经元胞外神经递质的实时测定;第4组进行皮层辅助运动区神经元胞外神经递质的实时测定。
1.2 金属微电极及微透析探针导轨埋藏手术
大鼠适应性饲养后进行3 d的动物跑台训练,能够以20 m/min速度连续运动30 min的大鼠进入后续实验,否则予以淘汰。大鼠腹腔麻醉后,俯卧位固定于小动物脑立体定位仪上(SN-3N,日本成茂)。依照Paxinos& Watson 大鼠脑立体定位图谱[8]进行三维立体定位,在不同组别大鼠左侧黑质网状部(A: -5.0, L: 2.0, H: -7.5)、丘脑腹外侧核(A: -2.5, L: 2.0, H: -5)及皮层辅助运动区(A: 3.7, L: 1.4, H: -0.5)对应部位[9]分别埋藏金属微电极/微透析探针导轨,并利用小镙钉和牙科水泥固定,注射药物地塞米松注射液以缓解手术后遗症脑水肿。电生理研究组设置参考电极。术后恢复4~5 d,待手术引起的不良反应消失,行为恢复正常后,开始恢复性的渐增负荷跑台训练,并使其逐渐适应电生理测试系统或微透析液体收集系统导联状态下的跑台运动。
1.3 大鼠运动方案
采用本实验室根据Bedford 方法改建的递增负荷跑台运动方案[10,11],大鼠进行一次性力竭运动,运动负荷分为3 级:Ⅰ级负荷为10 m/min,15 min;Ⅱ级负荷为15 m/min,15 min;Ⅲ级负荷为20 m/min,运动至力竭。力竭判断标准:大鼠的跑姿由蹬地式变为伏地式,滞留在跑道后1/3处,且使用声波和光刺激均无法驱使其维持预定强度运动。
1.4 皮层脑电及局部场电信号的同步采集
金属微电极与多通道 JFET 前置放大器(headstage)连接后,通过导线与差分放大器 (Dagan EX4-400,USA)连接。预先植入的金属微电极记录黑质网状部和丘脑腹外侧核神经元的局部场电活动,另植入皮层辅助运动区的微电极记录皮层脑电活动。使用PowerLab 8通道生理记录仪(PowerLab 8/30, AD Instrument,Australia)进行局部场电与皮层脑电电信号的记录,并按照如下参数进行设置,记录模式:差分模式,电信号采集频率:512 Hz,数字陷波:50 Hz,主放大器硬件滤波:0.1~100 Hz,增益:200。连续同步动态记录大鼠安静状态、一次力竭运动过程和恢复90 min 皮层脑电和局部场电的电信号。完成电信号记录之后,大鼠断头取脑使用冷冻切片机连续冠状切片,并进行Nissl染色(图1),参照大鼠脑立体定位图谱确定金属电极尖端所在位置,未同时准确插入黑质网状部和丘脑腹外侧核的实验数据将不予采用。
1.5 微透析样品的收集
黑质网状部、丘脑腹外侧核及皮层辅助运动区神经元胞外神经递质的收集采用在体微透析技术完成,首先将微透析探针(长度:1 mm,Microbiotech/se AB 公司,瑞典)插入导轨,使用微量注射泵(CMA/100,瑞典)将人工脑脊液(ACSF)通入,注射泵的流速为2 μl/min。持续灌注平衡90 min后,先收集30 min大鼠安静状态下黑质网状部、丘脑腹外侧核、前辅助运动区神经元细胞外液的透析液(每15 min收集一个样本,一个样本为30 μl,由冷冻自动收集器完成),然后连续同步动态收集对大鼠一次性力竭运动过程和恢复90 min不同核团细胞外液的透析液,透析液置于-20℃的冰箱中保存待测。实验完成后,对探针位置进行组织学定位检查,记录位点在预定目标核团内的数据有效,否则数据将不予采用。
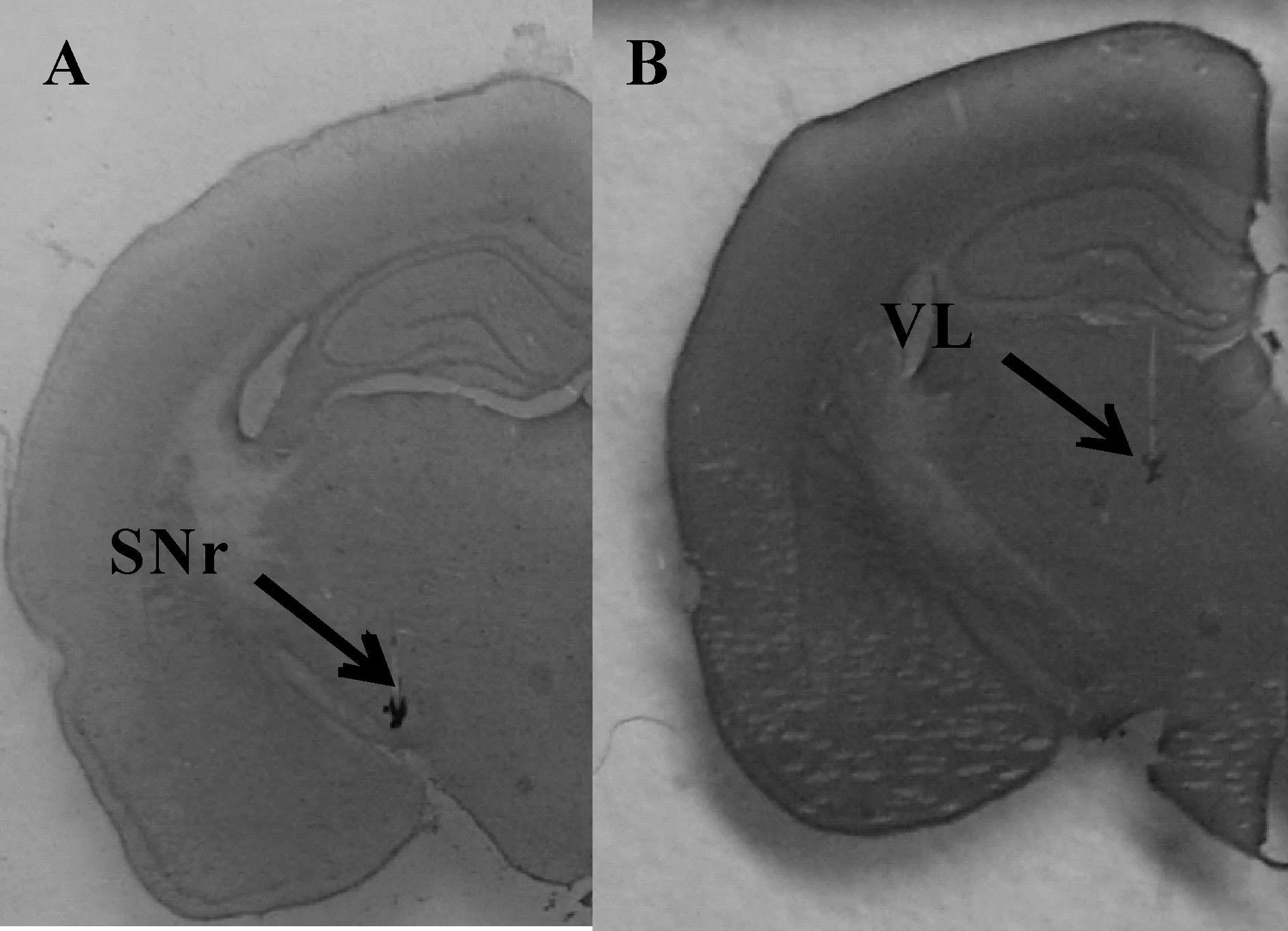
Fig. 1 Histological confirmation of electrodeplacement.The electrode was planted in the SNr (A) understereotaxic conditions (A: -5.0, L: 2.0, H: -7.5) and VL (B)understereotaxic conditions (A: -2.5, L: 2.0, H: -5)
1.6 Glu、GABA标准曲线的测定
标准品溶液分别是0.025 ng/μl、0.05 ng/μl、0.1 ng/μl、0.2 ng/μl、0.5 ng/μl等5个浓度梯度,根据样品峰出现的保留时间及主峰与临近通道峰高的比值对样品峰进行定性,测量主峰峰高进行定量。利用所得数据进行Glu和GABA标准曲线的绘制(图2)。
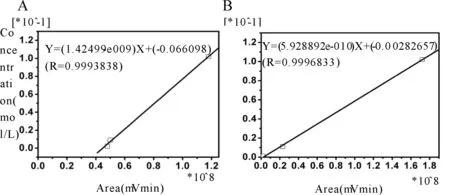
Fig. 2 The standard curve of standard Glu and GABA solutions
1.7 Glu、GABA含量的检测
Glu和GABA的浓度采用高效液相色谱进行测定,检测器为荧光检测,色谱条件:激发波长(Ex)=357 nm、发射波长(Em)=455 nm,柱温箱25℃,色谱柱为C18柱(4~6 mm×150.0 mm,5 μm,日本岛津)。洗脱方式为等度洗脱,流动相为A相甲醇:B相磷酸二氢钾缓冲液(pH 6.6)=40:60。配置衍生剂,配方为邻苯二甲醇(OPA)125 mg,经2.5 ml甲醇(色谱纯)溶解后,加入25 ml 0.4 mol/L的硼酸缓冲液(pH:9.5),混匀,再加入100 μl β-巯基乙醇。检测之前,在30 μl透析液样品中加入15 μl Na2CO3溶液和15 μl衍生剂,混匀45 s后,静置30 s反应进样,进样量为20 μl。
1.8 统计学处理
2 结果
2.1 大鼠力竭运动过程中皮层脑电与局部场电相干系数的动态变化
大鼠的个体差异造成力竭时间的不同,为了便于分析,依据大鼠运动能力的表现可将一次性力竭运动过程划分为5个阶段[12,13],分别是:安静状态(rest condition)、自主运动期(大鼠自主跑台运动,auto exercise period)、疲劳初期(给予大鼠声、光、电等外部刺激后继续维持预定强度运动,early fatigue period)、力竭期(给予大鼠外部刺激也无法维持预定强度的运动,直至停止运动,exhaustion condition)和恢复期(recovery period)。对力竭运动过程中不同阶段大鼠黑质网状部、丘脑腹外侧核局部场电及皮层脑电的频率进行相干性分析,发现力竭运动过程的不同阶段(安静、自主运动、疲劳初期、力竭、恢复期)“黑质-丘脑-皮层”通路不同脑区两两核团之间的神经元电活动在0~30 Hz范围内均存在显著相干性(相干系数>0.05,图3)。
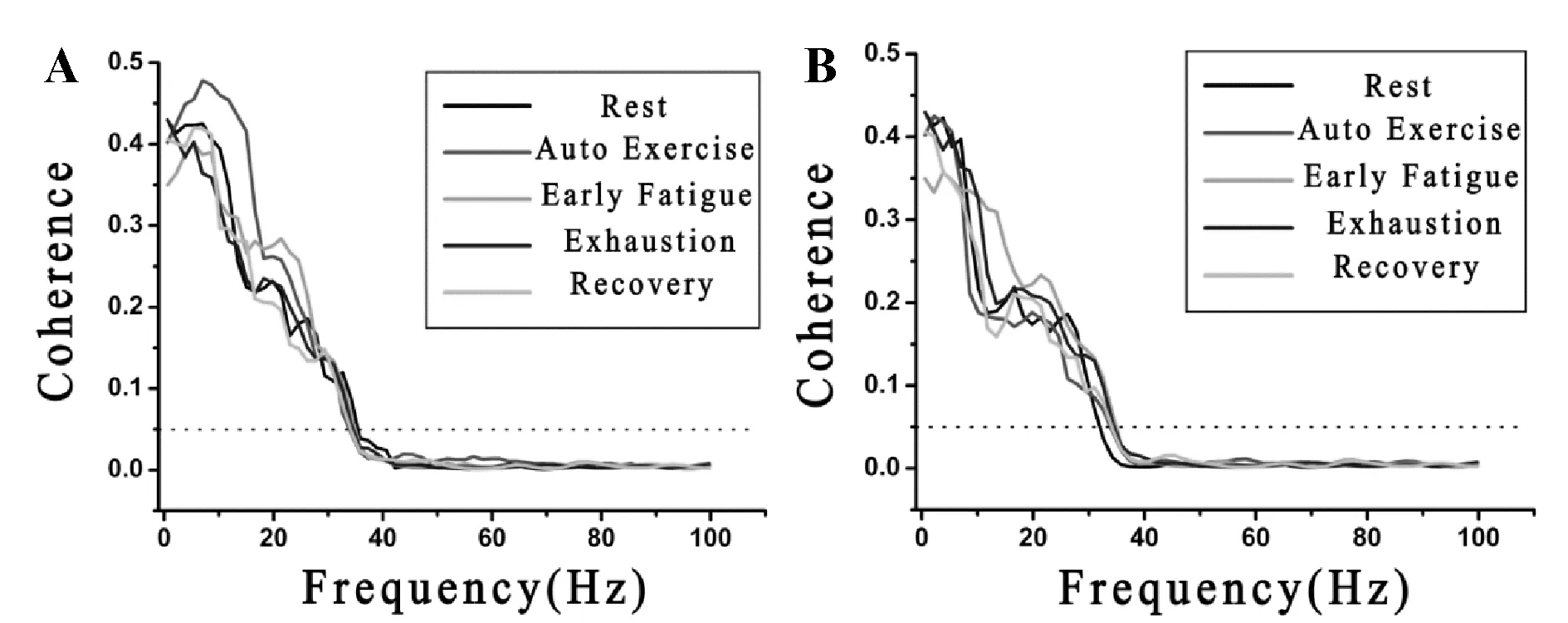
Fig. 3 Changes of coherence in different conditions during exhausting exercise A: Changes of coherence between neural activity in SNr and SMA; B: Changes of coherence between neural activity in VL and SMA. Dashed line indicates 95% confidence intervals
2.2 大鼠力竭运动过程中“黑质-丘脑-皮层”通路各核团神经递质Glu、GABA浓度的动态变化
微透析探针使用次数等因素会对回收率产生影响,为了有效的避免误差,本研究分别以每只大鼠在安静状态时透析液中神经递质Glu、GABA浓度为基础浓度,使用不同时间点透析液神经递质Glu、GABA浓度与基础浓度的比值来反映神经递质Glu、GABA的浓度。力竭运动过程中大鼠“黑质-丘脑-皮层”通路各核团胞外神经递质Glu、GABA浓度的变化见图4、5、6。从图中可以看出,Glu浓度与GABA浓度的变化呈相反趋势,在运动初期,大鼠处于自主运动期,黑质网状部胞外神经递质Glu浓度显著降低(P<0.05),GABA浓度显著升高(P<0.05),丘脑腹外侧核及皮层辅助运动区胞外神经递质Glu浓度显著上升(P<0.05),GABA浓度显著下降(P<0.05);大约运动到30 min时,黑质网状部Glu浓度降至最低点(P<0.05),GABA浓度升至最高点(P<0.05),丘脑腹外侧核及皮层辅助运动区Glu浓度升至最高点(P<0.05),GABA浓度降至最低点(P<0.05);随后黑质网状部Glu浓度开始出现上升趋势,GABA浓度开始出现下降趋势,而丘脑腹外侧核及皮层辅助运动区Glu浓度开始出现下降趋势,GABA浓度开始出现上升趋势;大约运动到45 min时黑质网状部Glu浓度升至较高点(P<0.05),GABA浓度降至较低点(P<0.05),而丘脑腹外侧核及皮层辅助运动区Glu浓度降至较低点(P<0.05),GABA浓度升至较高点(P<0.05);此时,给予大鼠一定强度的声波和光刺激后,黑质网状部Glu浓度出现下降的趋势,但仍高于安静水平,GABA浓度出现回升的趋势,但仍低于安静水平,而丘脑腹外侧核及皮层辅助运动区Glu浓度出现上升的趋势,但仍低于安静水平,GABA浓度出现下降的趋势,但仍高于安静水平;稳定一段时间后,黑质网状部Glu浓度又开始逐渐上升直至力竭达到最高点(P<0.05),GABA浓度则开始逐渐下降直至力竭降至最低点(P<0.05),而丘脑腹外侧核及皮层辅助运动区Glu浓度又开始逐渐下降直至力竭达到最低点(P<0.01),GABA浓度则开始逐渐上升直至力竭升至最高点(P<0.01);在恢复期,黑质网状部Glu浓度逐渐下降,GABA浓度逐渐上升,而丘脑腹外侧核及皮层辅助运动区神经递质的浓度变化趋势相反,Glu浓度逐渐上升,GABA浓度逐渐下降,并基本恢复到安静水平。
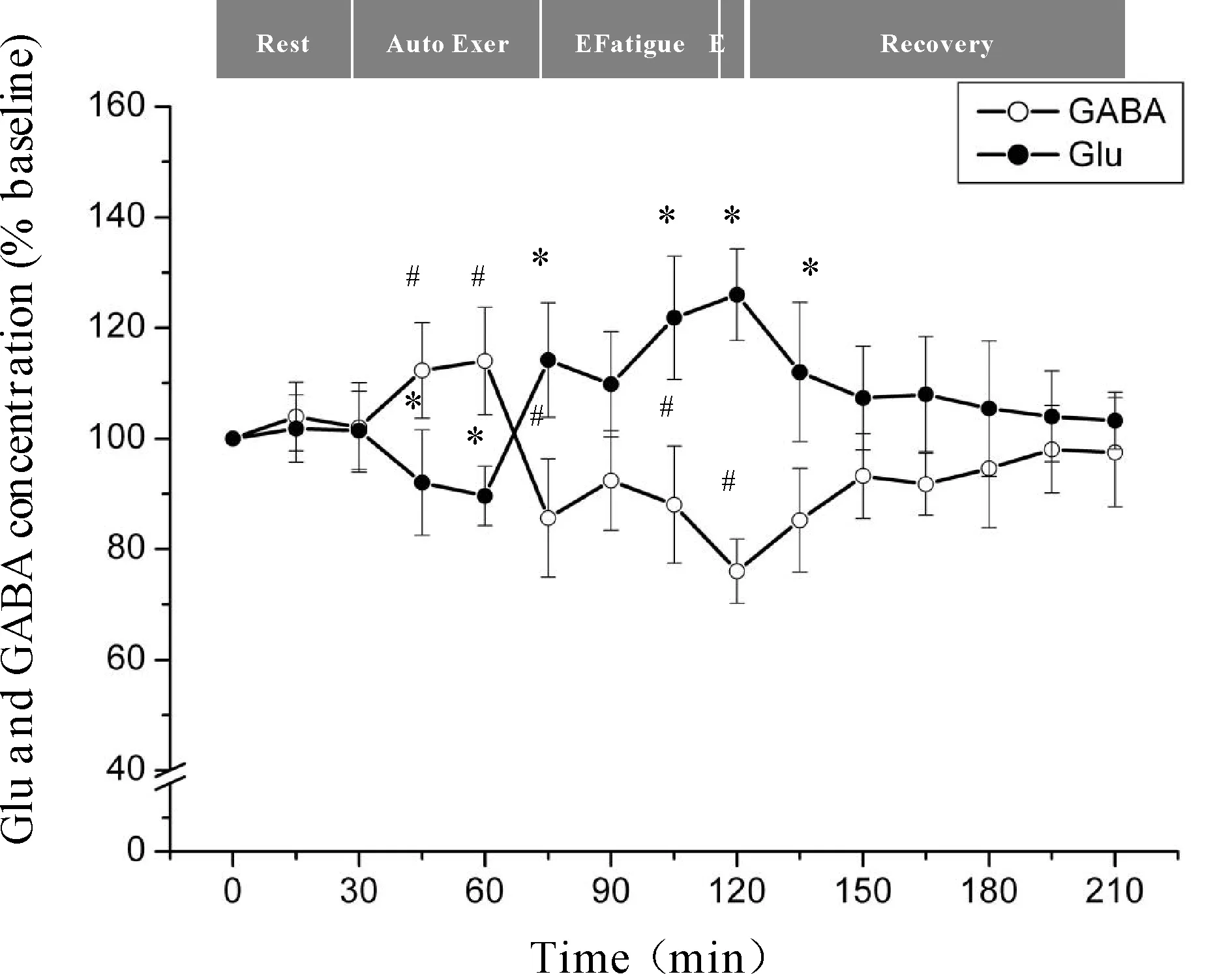
Fig. 4 Changes of extracellular Glu and GABA concentrations in rat SNr during exhausting exercise Rest: Rest condition; Auto Exer: Auto exercise period; E Fatigue: Early fatigue period; E: Exhaustion condition; Recovery: Recovery period*P<0.05vsGlu concentration in rest condition;#P<0.05vsGABA concentration in rest condition
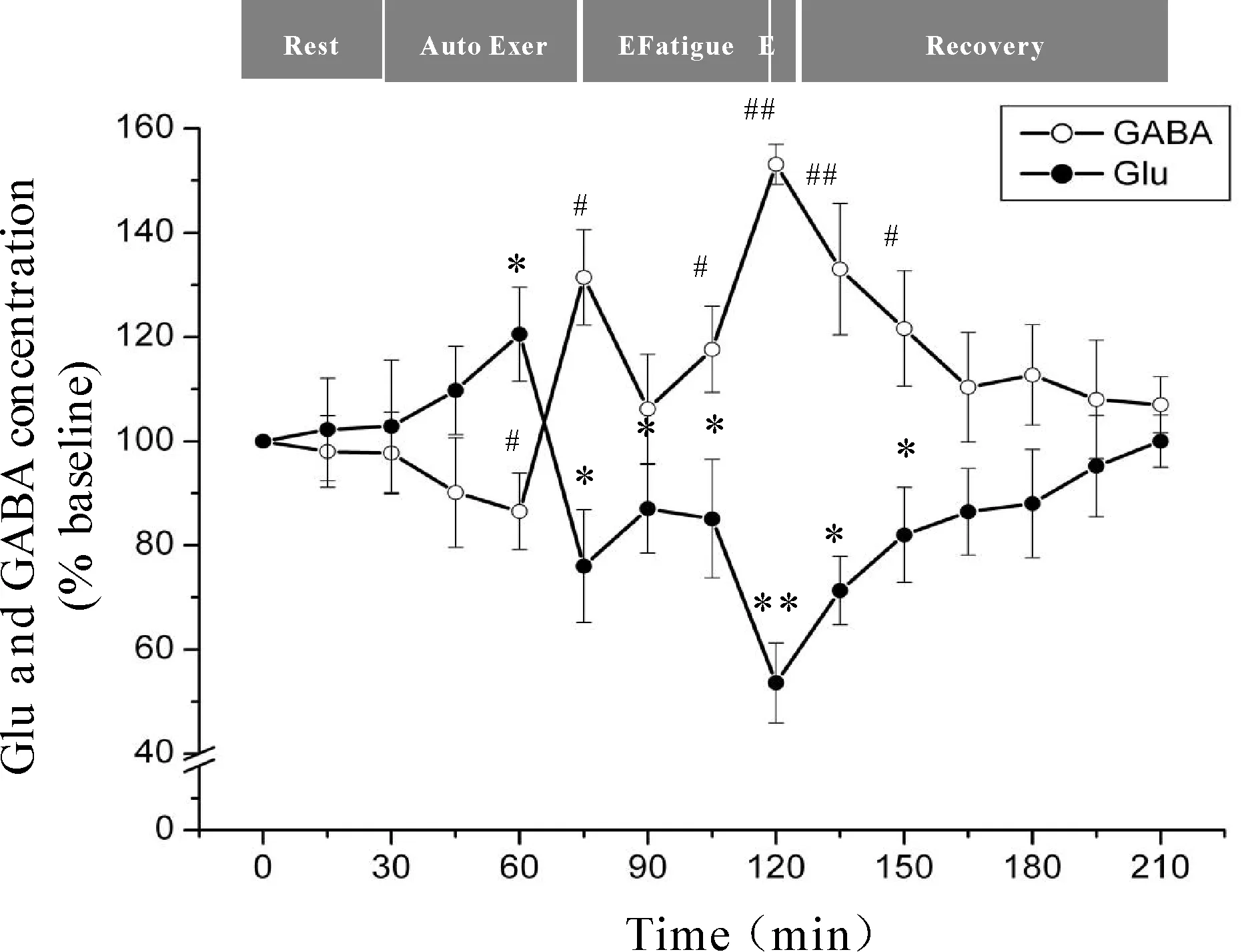
Fig. 5 Changes of extracellular Glu and GABA concentrations in rat VL during exhausting exercise*P<0.05vsGlu concentration in rest condition;#P<0.05vsGABA concentration in rest condition
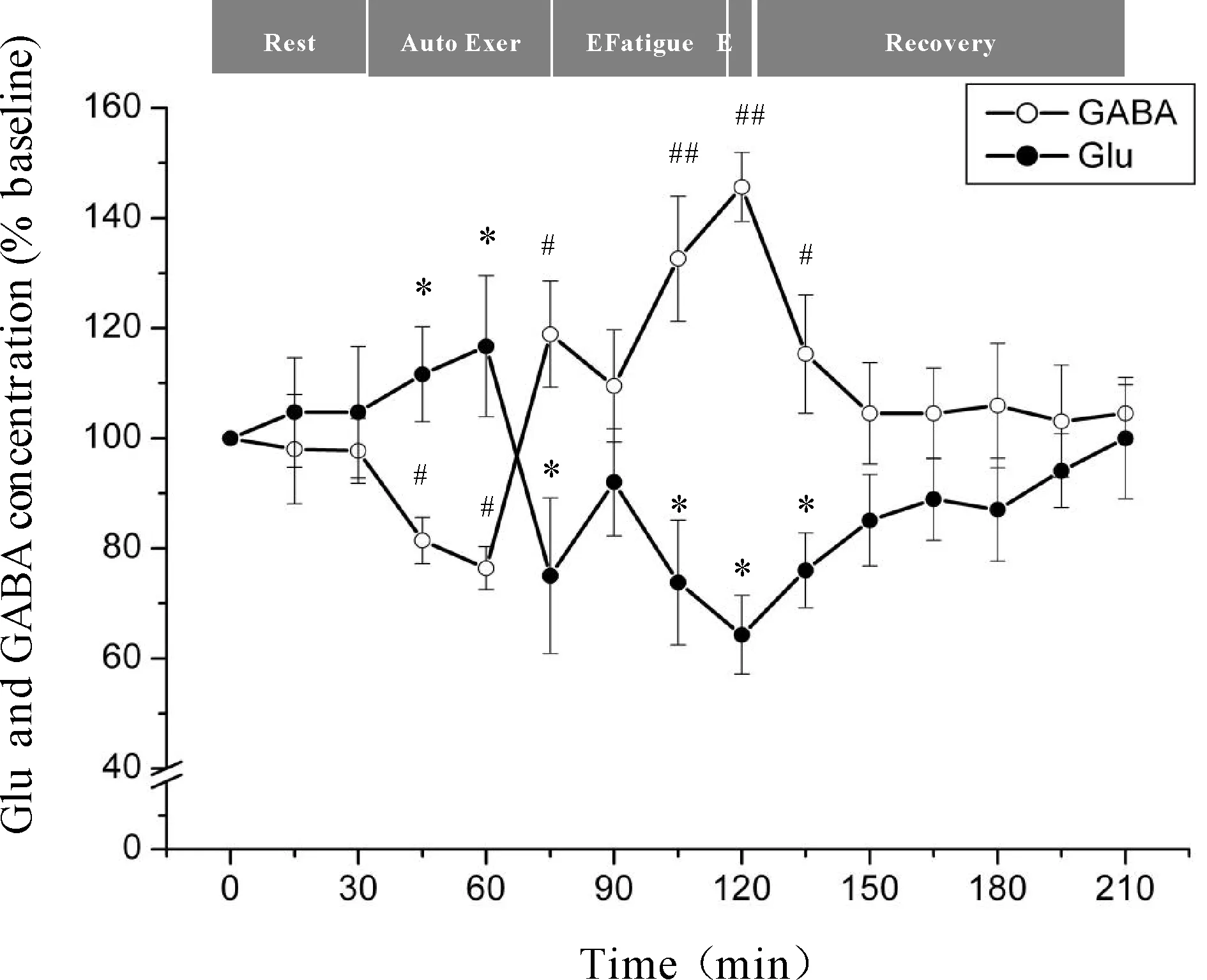
Fig. 6 Changes of extracellular Glu and GABA concentrations in rat SMA during exhausting exercise Rest: Rest condition; Auto Exer: Auto exercise period; E Fatigue: Early fatigue period; E: Exhaustion condition; Recovery: Recovery period*P<0.05vsGlu concentration in rest condition;#P<0.05vsGABA concentration in rest condition
一次性力竭运动过程中大鼠“黑质-丘脑-皮层”通路各核团胞外神经递质Glu/GABA比值的变化如图7、8、9所示,大鼠在自主运动期,黑质网状部Glu/GABA比值呈现下降趋势,而丘脑腹外侧核及皮层辅助运动区Glu/GABA比值的变化趋势相反,呈现上升趋势,大约运动到30 min时,黑质网状部Glu/GABA比值降至最低点(P<0.05),而丘脑腹外侧核及皮层辅助运动区升至最高点(P<0.05);随后黑质网状部Glu/GABA比值开始出现上升趋势,丘脑腹外侧核及皮层辅助运动区则开始出现下降趋势,运动到大约45 min时黑质网状部升至较高点(P<0.05),丘脑腹外侧核及皮层辅助运动区降至较低点(P<0.05);此时,给予大鼠一定强度的声波和光刺激后,大鼠能够维持预定强度运动,黑质网状部Glu/GABA比值有所下降,但仍高于安静水平,丘脑腹外侧核及皮层辅助运动区Glu/GABA比值有所回升,但仍低于安静水平;稳定一段时间后,黑质网状部Glu/GABA比值又开始逐渐上升直至力竭升至最高点(P<0.01),丘脑腹外侧核及皮层辅助运动区又开始逐渐下降直至力竭降至最低点(P<0.01);在恢复期,黑质网状部Glu/GABA比值逐渐下降,丘脑腹外侧核及皮层辅助运动区Glu/GABA比值逐渐上升,并基本恢复到安静水平。
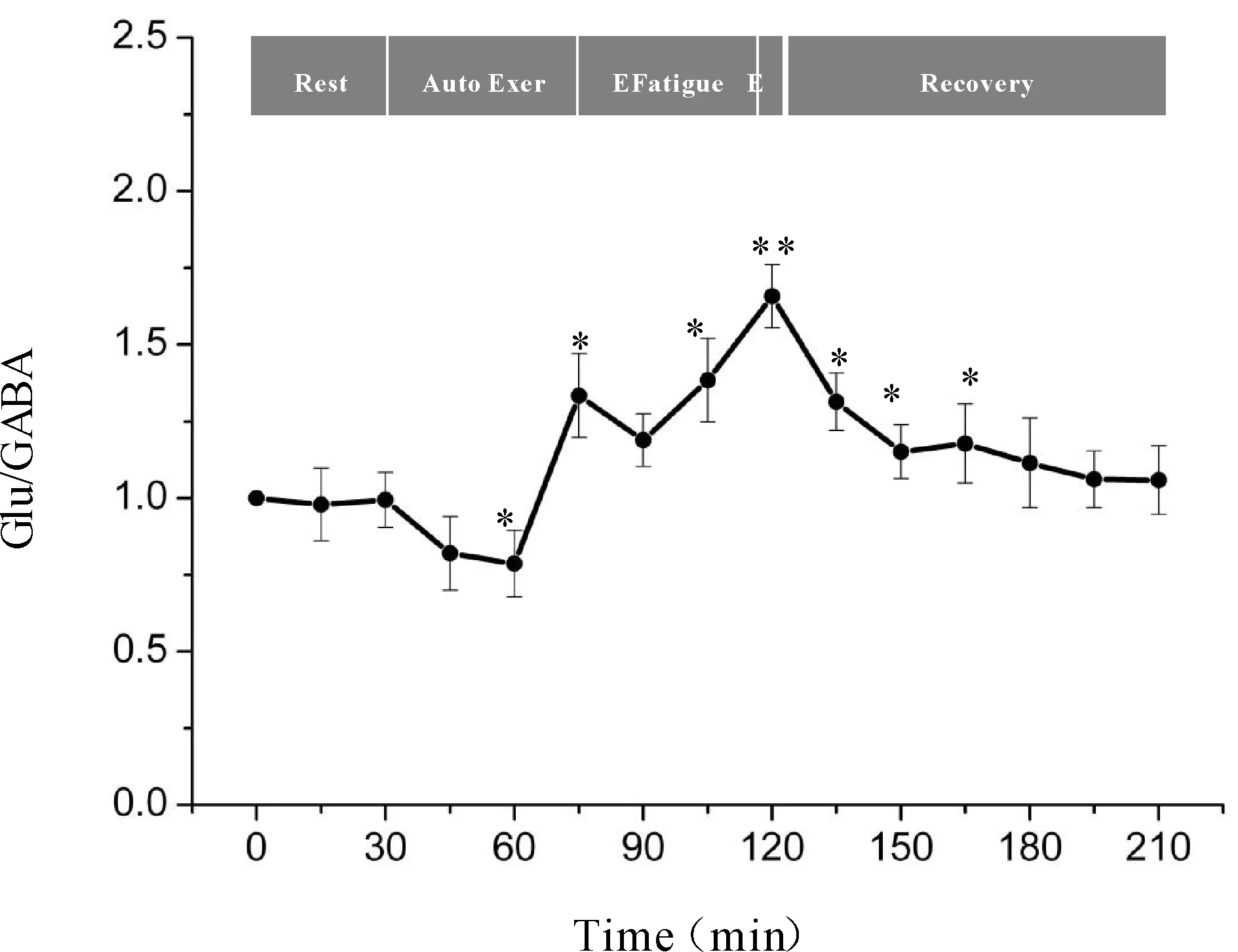
Fig. 7 Changes of Glu/GABA ratio in rat SNr during exhausting exercise Rest: Rest condition; Auto Exer: Auto exercise period; E Fatigue: Early fatigue period; E: Exhaustion condition; Recovery: Recovery period*P<0.05,**P<0.01vsrest condition
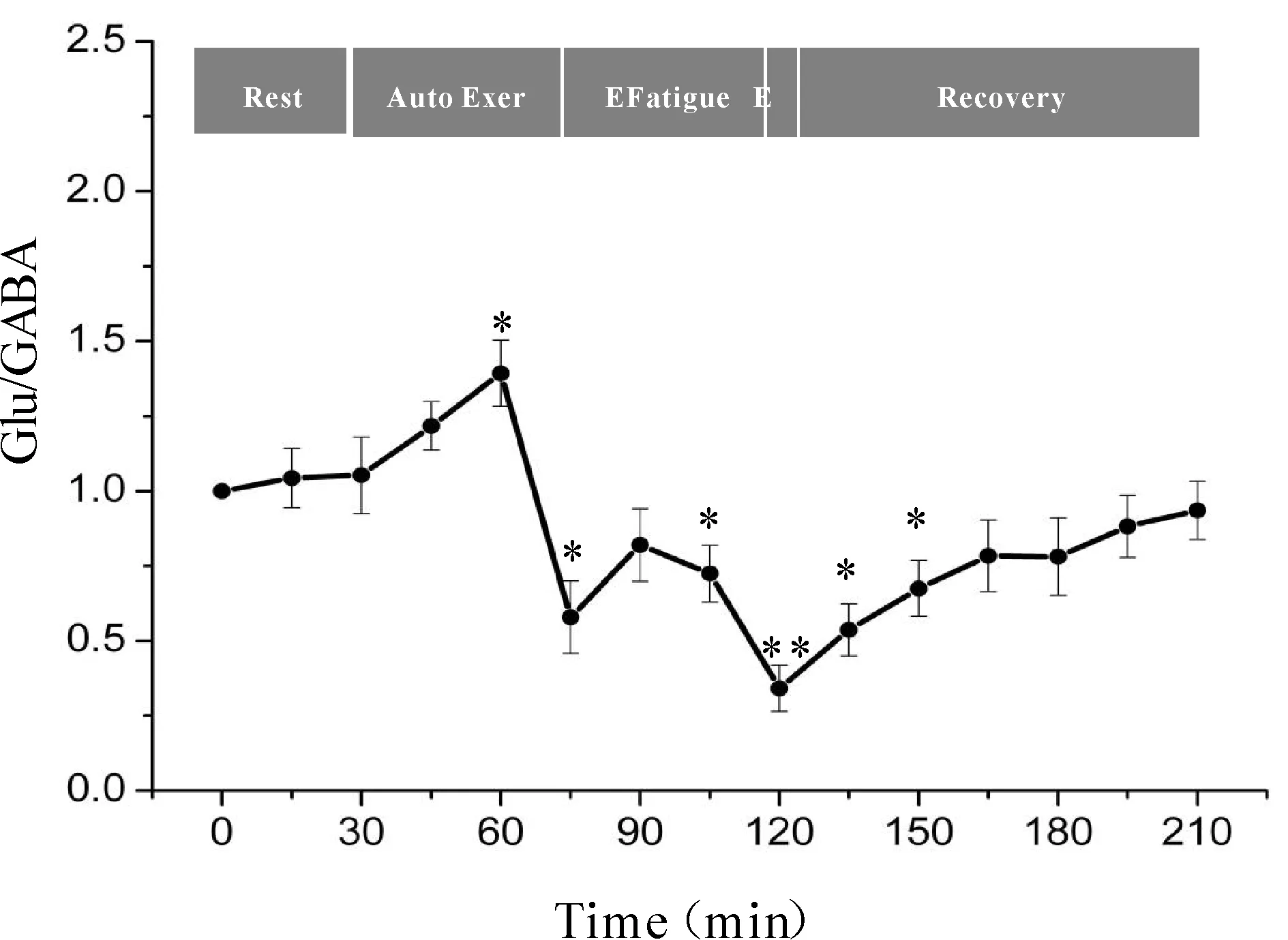
Fig. 8 Changes of Glu/GABA ratio in rat VL during exhausting exercise Rest: Rest condition; Auto Exer: Auto exercise period; E Fatigue: Early fatigue period; E: Exhaustion condition; Recovery: Recovery period*P<0.05,**P<0.01vsrest condition
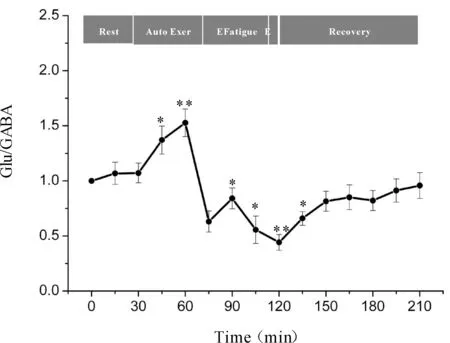
Fig. 9 Changes of Glu/GABA ratio in rat SMA during exhausting exercise Rest: Rest condition; Auto Exer: Auto exercise period; E Fatigue: Early fatigue period; E: Exhaustion condition; Recovery: Recovery period*P<0.05,**P<0.01vsrest condition
3 讨论
相干性是神经科学领域中广泛应用的一种计算方法,是指两个时间序列作为节律的函数之间的线性相关性[14],描述序列信号在频域内相似程度,是反应不同脑区神经元信息线性关系的有效指标之一[15]。相关研究表明,不同脑区之间存在相干性,神经元群相位的变化具有同步性,可以促进不同脑区之间的神经信息传递[16]。本研究结果显示,黑质网状部与皮层、丘脑腹外侧核与皮层之间的神经元电活动在0~30 Hz的频域内存在相干性,证实在一次性力竭运动过程中“黑质-丘脑-皮层”通路的各核团之间存在功能耦合、信息交换及神经通路的整合。
神经递质浓度的改变是引起神经元电活动改变的重要原因之一。Glu和GABA是脑内重要的氨基酸类神经递质,与其特异性受体结合实现神经信息的传递,对神经元电活动的变化发挥调控作用。Glu是哺乳类动物脑内含量最高的氨基酸类神经递质,可有效的提高神经元的兴奋性,增强神经元的电活动,发挥兴奋性调控作用;GABA是脑中最重要的抑制性神经递质,可有效防止神经元的过度兴奋,实现对中枢兴奋性的调控[7]。由于GABA由Glu经谷氨酸脱羧酶的作用下脱羧而成,因此,我们常使用Glu/GABA比值作为评定脑神经元兴奋或抑制的指标[17]。Glu作为兴奋性氨基酸类递质可以提高运动神经元的兴奋性,增强神经元电活动,其作用机制是储存在突触前神经末梢的Glu通过突触前电压门控通道与相应受体结合而提高神经元的兴奋性,其释放形式是Ca2+依赖型[18]。GABA作为抑制性氨基酸类神经递质可以抑制神经元电活动,其作用机制主要是通过影响Cl-通道,增加Cl-内流而降低神经元的兴奋性[7]。前期研究结果显示,在一次性力竭运动过程中,大鼠在疲劳发生时,黑质网状部神经元电活动显著增强,增强对丘脑腹外侧核的神经元兴奋性的抑制作用,进而对皮层辅助运动区神经元产生去兴奋作用[3],证实各核团之间存在空间联系;本实验电生理部分的实验结果显示,黑质网状部、丘脑腹外侧核与皮层之间的神经元电活动存在相干性,证实各核团之间存在时间联系。该联系可能通过神经递质浓度的变化来实现的,本实验研究结果发现,力竭运动过程中,在黑质网状部、丘脑腹外侧核及皮层神经元胞外Glu与GABA浓度变化呈相反趋势。而在不同核团间,丘脑腹外侧核及皮层胞外Glu与GABA浓度变化具有一致性,两者与黑质网状部胞外Glu与GABA浓度变化趋势相反。造成该现象的原因,可能是大鼠在力竭时,黑质网状部神经元胞外神经递质Glu浓度的上升和GABA浓度的下降,增强向丘脑腹外侧核的GABA能神经纤维投射,引起丘脑腹外侧核神经元胞外神经递质Glu浓度下降和GABA浓度上升,该核团神经元兴奋性下降,抑制向皮层辅助运动区的Glu能神经纤维投射,导致皮层辅助运动区神经元胞外神经递质Glu浓度下降和GABA浓度上升,抑制皮层辅助运动区神经元的兴奋性。如图10所示,与安静状态相比,大鼠在力竭状态时,黑质网状部/苍白球内侧部复合体神经元兴奋性增强,向丘脑腹外侧核的GABA能神经纤维投射增强,引起丘脑腹外侧核神经元兴奋性减弱,抑制丘脑-皮层通路的Glu能神经纤维投射,对皮层产生去兴奋作用。临床研究也发现类似现象,帕金森(parkinson disease,PD)动物黑质网状部[19]神经元胞外神经递质GABA浓度下降,该核团神经元电活动显著增强,引起丘脑腹外侧核和皮层胞外神经递质Glu、GABA浓度及其比值的改变,对丘脑及皮层产生去兴奋作用,引发肌张力障碍,出现运动能力下降和运动不能的症状[20]。高频刺激PD患者的丘脑底核可以显著提高黑质网状部GABA浓度,并且可以激活突触间隙的GABA受体,从而抑制黑质网状部的神经元兴奋性,有效改善PD运动不能的病理症状[21],从另一个角度证实“黑质-丘脑-皮层”通路各核团神经递质Glu、GABA浓度的改变是导致该通路神经元电活动发生变化的重要原因之一,也是运动疲劳发生的可能机制之一。
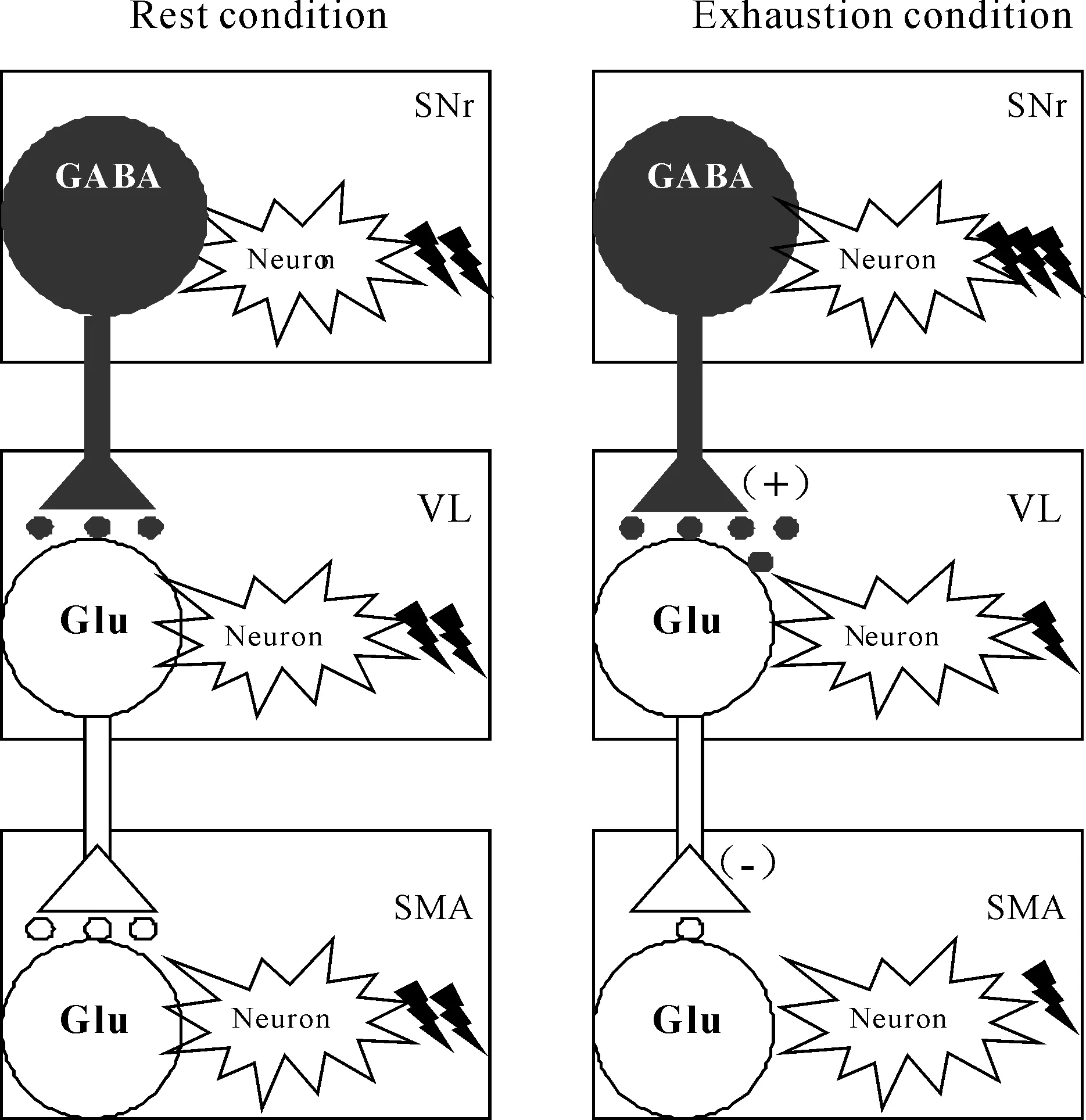

4 小结
一次性力竭运动过程中,大鼠“黑质网状部-丘脑-皮层”各核团之间存在神经网络联系;该通路各核团神经元胞外神经递质Glu浓度、GABA浓度以及Glu/GABA比值的改变均具有明显的阶段性特征,大鼠在力竭时,黑质网状部神经元胞外Glu浓度的上升和GABA浓度的下降,神经元兴奋性增强,向丘脑腹外侧核发放的GABA能神经纤维投射增强,导致丘脑腹外侧核GABA浓度上升和Glu浓度下降,神经元的兴奋性减弱,抑制丘脑-皮层通路的Glu能神经纤维投射,导致皮层辅助运动区Glu浓度下降和GABA浓度上升,从而对皮层辅助运动区神经元产生去兴奋作用。证实大鼠“黑质网状部-丘脑-皮层”各核团神经递质Glu、GABA浓度的改变是导致神经元兴奋性改变的原因之一,是导致运动疲劳发生的递质性因素之一。该研究对于进一步揭示基底神经节-丘脑-皮层环路在运动疲劳发生、发展中的中枢调控作用,开发、设计基于该环路的疲劳延缓及消除药物具有重要的理论价值和实际意义。
[1] Middleton FA, Strick PL. Basal ganglia and cerebellar loops: motor and cognitive circuits [J].BrainResBrainResRev, 2000, 31(2-3): 236-250.
[2] Nybo L, Secherb NH. Cerebral perturbations provoked by prolonged exercise [J].ProgNeurobiol, 2004, 72(4): 223-261.
[3] 胡琰茹, 刘晓莉, 乔德才. 大鼠在力竭运动过程中“黑质-丘脑-皮层”通路的调控作用研究[J]. 上海体育学院学报, 2013, 37(5): 57-62.
[4] Meeusen R, Watson P, Dvorak J. The brain and fatigue: new opportunities for nutritional interventions[J].JSportsSci, 2006, 24(7): 773-782.
[5] 王大磊, 刘晓莉, 乔德才. 大鼠力竭运动中丘脑底核和皮层神经元电活动的变化[J]. 中国应用生理学杂志, 2011, 27(4): 427-431.
[6] 杨东升, 刘晓莉, 乔德才. 力竭运动及恢复期大鼠纹状体5-HT、DA及其代谢物浓度的动态变化研究[J]. 中国应用生理学杂志, 2011, 27(4): 432-436.
[7] Mora F, Segovia G, Del Arco A. Glutamate-dopamine-GABA interactions in the aging basal ganglia[J].BrainResRev, 2008, 58(2): 340-353.
[8] Paxinos G, Watson C. The rat brain in stereotaxic coordinates[M]. 3rdEdition,SanDiego:Academic, 1997: 26-30,36-37,39-43.
[9] Taib NOB, Manto M. Effects of trains of high-frequency stimulation of the premotor/supplementary motor area on conditioned corticomotor responses in hemicerebellectomized rats [J].ExpNeurol, 2008, 212(1): 157-165.
[10]刘晓莉, 罗 勇, 乔德才. 大鼠一次性力竭跑台运动模型的建立及动态评价[J]. 中国实验动物学报, 2012, 20(3): 25-28.
[11]胡琰茹, 刘晓莉, 乔德才. 力竭运动大鼠苍白球内侧部神经递质浓度及相应受体表达变化研究[J]. 北京体育大学学报, 2015, 38(1): 57-62,79.
[12]Wang D, Liu X, Qiao D. Modulatory effect of subthalamic nucleus on the development of fatigue during exhausting exercise: aninvivoelectrophysiological and microdialysis study in rats[J].JSportsSciMed, 2012, 11(2): 286-293.
[13]Hu Y, Liu X, Qiao D. Increased extracellular dopamine and 5-hydroxytryptamine levels contribute to enhanced subthalamic nucleus neural activity during exhausting exercise[J].BiolSport, 2015, 32(3): 187-192.
[14]Colgin LL, Denninger T, Fyhn M,etal. Frequency of gamma oscillation routes flow of information in the hippocampus[J].Nature, 2009, 462(7271): 353-357.
[15]Del percio C, Iacoboni M, Lizio R,etal. Functional coupling of parietal alpha rhythms is enhanced in athletes before visuomotor performance: a coherence electroencephalographic study [J].Neuroscience, 2011, 175(4): 198-211.
[16]Fell J, Axmacher N. The role of phase synchronization in memory processes[J].NatRevNeurosci, 2011, 12(2): 105-118.
[17]Blomstrand E. A role for branched-chain amino acids in reducing central fatigue[J].JNutr, 2006, 136(2): 544-547.
[18]Sophie S, Marco L, Francesco M,etal. In vivo neurochemical effects of the NR2B selective NMDA receptor antagonist CR 3394 in 6-hydmxydopamine lesioned rats [J].EurJPharmacol, 2008, 584(2/3): 297-305.
[19]Galeffi F, Bianchi L, Bolam JP,etal. The effect of 6-hydroxydopamine lesions on the release of amino acids in the direct and indirect pathways of the basal ganglia: a dual microdialysis probe analysis[J].EurJNeurosci, 2003, 18: 856-868.
[20]José A, Obeso, María C. Rodríguez-Oroz, Manuel Rodríguez,etal. The Basal ganglia and disorders of movement: pathophysiological mechanisms[J].NewsPhysiolSci, 2002, 17(2): 51-55.
[21]Dostrovsky JO, Levy R, Wu JP,etal. Microstimulation-induced inhibition of neuronal firing in human globuspallidus[J].JNeurophysiol, 2000, 84(1): 570-604.
Dynamic changes of ‘substantianigra-ventralislateralis-cortex’pathway neural activity coherence and neurotransmitters in rat during exhausting exercise
HU Yan-ru1, 2, LIU Xiao-li1, QIAO De-cai1△
(1. College of Physical Education and Sports, Beijing Normal University, Beijing 100875;2. Department of Physical Education, Central South University, Changsha 410083, China)
Objective: To reveal the possible mechanism of changes of ‘substantianigra-ventralislateralis-cortex’ pathway neural activity during one bout of exhausting exercise through observing the neural activity coherence between different nucleus and the concentration of extracellular glutamate (Glu) and gamma-aminobutyric acid (GABA). Methods: Male Wistar rats were randomly divided into neural activity real-time observation group, substantianigra (SNr) extracellular neurotransmitters observation group, ventralislateralis (VL) extracellular neurotransmitters observation group and supplementary motor area (SMA) extracellular neurotransmitters observation group, 10 rats in each group. For rats of neural activity real-time observation group, by using LFPs and ECoG recording technique, and self-comparison, we simultaneously recorded the dynamic changes of neural activity of rat SNr, VL and SMA during one bout of exhausting exercise. The dynamic changes of extracellular Glu and GABA in rat SNr, VL and SMA were also observed through microdialysis combined high performance liquid chromatography (HPLC) technique and self-comparison method. Results: Based on the behavioral performance, the exhausting exercise process could be divided into 5 different stages, the rest condition, auto exercise period, early fatigue period, exhaustion condition and recovery period. The electrophysiological study results showed that, the coherence between neural activity in rat SNr, VL and SMA was significant between 0~30 Hz during all the procedure of exhausting exercise. Compared with the rest condition, the microdialysis study showed that the Glu concentrations and Glu/GABA ratio in SNr were decreased significantly during automatic exercise period (P<0.05,P<0.01), the GABA concentrations were increased significantly (P<0.05,P<0.01), while, in VL and cortex, the Glu concentrations and Glu/GABA ratio were increased significantly (P<0.05,P<0.01), the GABA concentrations were decreased significantly (P<0.05,P<0.01). Under early fatigue and exhaustion conditions, compared with the rest condition,the Glu concentrations and Glu/GABA ratio in SNr were increased significantly (P<0.05,P<0.01), the GABA concentrations were decreased significantly (P<0.05,P<0.01), while the Glu concentrations and Glu/GABA ratio in VL and cortex were decreased significantly (P<0.05,P<0.01), the GABA concentrations were increased significantly (P<0.05,P<0.01). Conclusion: The neural net work communication between ‘substantianigra-ventralislateralis-cortex’ pathway exists, changes of Glu and GABA in the nucelus of the pathway are one of the factors resulting in the changes of neural activity.
exhausting exercise; rat; ‘substantianigra-ventralislateralis-cortex’pathway; coherence; neurotransmitter
国家自然科学基金资助项目(31171138,31571221);湖南省体育科学学会重点资助项目(2015HN016)
2016-03-07
2016-12-12
G804.2
A
1000-6834(2017)03-204-08
10.12047/j.cjap.5435.2017.051
△【通讯作者】Tel: 010-58802227; E-mail: decaiq@bnu.edu.cn

