高糖对线粒体乙醛脱氢酶2在大鼠心肌成纤维细胞中表达的影响*
谷小雨, 方婷婷, 高 琴, 康品方, 李正红, 程向阳
(1. 蚌埠医学院第一附属医院麻醉科, 2. 心血管内科, 安徽蚌埠 233004; 3. 蚌埠医学院生理学教研室, 安徽蚌埠 233030)
高糖对线粒体乙醛脱氢酶2在大鼠心肌成纤维细胞中表达的影响*
谷小雨1, 3, 方婷婷3, 高 琴3, 康品方2, 李正红3, 程向阳1△
(1. 蚌埠医学院第一附属医院麻醉科, 2. 心血管内科, 安徽蚌埠 233004; 3. 蚌埠医学院生理学教研室, 安徽蚌埠 233030)
目的:观察心肌成纤维细胞是否存在线粒体乙醛脱氢酶2(ALDH2)的表达,探讨ALDH2在高糖诱导的心肌成纤维细胞引起纤维化发生中的作用。方法:原代培养心肌成纤维细胞,分为正常对照组(5.5 mmol/L)、正常+ALDH2激动剂Alda-1(20 μmol/L)组、高糖组(30 mmol/L)、高糖+Alda-1组。免疫荧光鉴定心肌成纤维细胞。各组细胞分别培养48 h后应用MTT法检测成纤维细胞增殖活力,RT-PCR和Western blot检测ALDH2 mRNA及蛋白的表达。结果:RT-PCR和Western blot结果显示心肌成纤维细胞ALDH2 mRNA和蛋白均有表达。与正常对照组相比,高糖组心肌成纤维细胞增殖能力提高(P<0.01),ALDH2蛋白表达下降(P<0.05);与高糖组相比,高糖+Alda-1组心肌成纤维细胞增殖能力降低(P<0.01), ALDH2的蛋白表达增加(P<0.05)。结论:心肌成纤维细胞存在ALDH2的表达,ALDH2激动剂Alda-1提高ALDH2的表达后可以抑制高糖引起的心肌成纤维细胞的增殖。
心肌成纤维细胞;乙醛脱氢酶2;高糖;Alda-1;大鼠
糖尿病是世界范围内常见的慢性疾病之一,其发病年龄日趋年轻化。糖尿病的重要并发症之一-糖尿病心肌病导致患者病死率明显高升, 主要病理改变为心脏的结构以及功能紊乱,心肌纤维化是其
重要表现之一。
对于心肌损伤和纤维化研究,以往多着重于心肌细胞的作用[1],近期报道表明,心肌纤维化的发生发展与心肌成纤维细胞密度增加密切相关[2]。除心肌细胞外,心肌成纤维细胞、血管内皮细胞以及血管平滑肌细胞是心脏的其他主要细胞来源[3],其中心肌成纤维细胞数量最多,约占整个心脏细胞总数的60%,具有较高的增殖能力[2, 4],也是细胞外基质产生的主要来源。因此,探讨心肌成纤维细胞在糖尿病心肌病中的作用及相关机制至关重要。
ALDH2是19个ALDH基因家族中的一员,它在乙醛和其他有毒醛类,如4-羟基壬烯醛的代谢以及硝酸盐向一氧化氮的生物转化中发挥重要的作用[5]。本实验室前期结果显示[6, 7]糖尿病大鼠早期已经发生心肌纤维化,表现为胶原沉积、心肌细胞排列紊乱以及心脏收缩和舒张功能紊乱等,心肌中羟脯氨酸含量随着纤维化程度增加而增高。以往的报道多集中于ALDH2在糖尿病或高糖诱导的心肌细胞损伤[1, 8]、心脏整体水平研究等,但ALDH2是否在心肌成纤维细胞上表达尚未见报道。
本研究首先观察心肌成纤维细胞上是否存在ALDH2的表达,进一步探讨高糖诱导的心肌成纤维细胞中ALDH2的变化情况,分析ALDH2在糖尿病心肌病中的作用。
1 材料与方法
1.1 实验动物及主要药品试剂
SD乳鼠1~3 d(蚌埠医学实验动物中心),合格证号:SCXK(沪)2013-0006。细胞裂解液,0.25%胰酶消化液(含0.05%EDTA)(碧云天公司),DMEM(Dulbecco modified Eagle medium)低糖培养基(Hyclone公司),胎牛血清(四季青公司),II型胶原酶以及MTT(Sigma公司),DNA酶I(Solarbio公司),mouse anti-Vimentin、FITC-羊抗小鼠IgG、小鼠抗大鼠GAPDH抗体和HRP标记的羊抗兔IgG(武汉博士德生物有限公司),兔抗大鼠ALDH2抗体(Abcam公司),引物合成(上海生工生物工程股份有限公司),TRIzol(Invitrogen公司),逆转录以及PCR试剂盒(Themo Fisher Scientific公司)。
1.2 实验方法
1.2.1 大鼠心肌成纤维细胞的培养和鉴定 超净工作台中取乳鼠心尖部组织,预冷的D-Hank’s液冲洗2~3遍,剪碎后加入混合酶(终浓度分别为0.07%的胰蛋白酶,0.08%的II型胶原酶,10 μg/ml的DNA酶混合物),37℃,5%CO2培养箱静置6~7 min,弃去浑浊上清。重复以上消化步骤约6~8次,直至心肌组织结构疏松。加入等体积预冷的含10%胎牛血清的完全培养基,轻柔吹打5~6次,静置,待大块组织沉淀后吸取浑浊上清液入另一离心管中,放入4℃冰箱以保持细胞活力。重复以上步骤直至心肌组织完全被吹散,收集上清1 000 r/min离心6 min得到细胞沉淀。完全培养基重悬细胞沉淀,37℃,5%CO2培养箱差速贴壁90 min,吸出培养瓶中含未贴壁心肌细胞的培养基,此时心肌成纤维细胞几乎均已贴壁。加入DMEM低糖完全培养基,37℃,5% CO2培养箱中培养。
将心肌成纤维细胞爬片用PBS液轻柔冲洗3遍,每遍1 min,4%的多聚甲醛37℃固定30 min,PBS液冲洗后加入0.5%Triton-100,37℃孵育30 min,PBS液冲洗后5% BSA 37℃封闭30 min,波形蛋白(Vimentin 1∶300)4℃孵育过夜,次日PBS液冲洗后加入FITC-羊抗兔IgG(1∶60)37℃避光孵育30 min,PBS液冲洗3遍,每遍5 min,DAPI染细胞核37℃避光孵育15 min,吸除DAPI染液,甲醇漂洗1遍,5 min;PBS液冲洗后在避光条件下滴加50%的甘油封片,荧光显微镜下拍照。镜下可见阳性细胞胞质区发绿色荧光,此为心肌成纤维细胞,计算有荧光标记的细胞的比例,重复5次,确定心肌成纤维细胞纯度。
1.2.2 实验分组 含体积分数为0.1的胎牛血清的DMEM低糖培养基培养心肌成纤维细胞,给予实验条件干预前予以无血清的培养基培养48 h,使其同步化。选取传代2~3代的细胞作为实验对象,分为4组:(1)正常对照组(normal control group,NG):心肌成纤维细胞在葡萄糖浓度为5.5 mmol/L的DMEM完全培养基中培养;(2)正常+ALDH2特异性激动剂Alda-1(NG+Alda-1):葡萄糖浓度为5.5 mmol/L的DMEM完全培养基,加入ALDH2特异性激动剂Alda-1使得其终浓度为20 μmol/L[9],培养48 h;(3)高糖组(high glucose,HG):葡萄糖浓度为30 mmol/L[8, 10]的DMEM完全培养基培养48 h;(4)高糖+Alda-1组(HG+Alda-1):葡萄糖浓度为30 mmol/L的DMEM完全培养基,加入Alda-1使得其终浓度为20 μmol/L,培养48 h;(5)为排除高糖渗透压对心肌成纤维细胞的影响,设置高渗组(hypertonic pressure,HOP):葡萄糖浓度为5.5 mmol/L的DMEM加24.5 mmol/L的甘露醇组成30 mmol/L的高渗完全培养基,培养48 h。我们选取(1)~(5)组进行MTT实验,(1)~(4)组进行Western blot实验。
1.2.3 RT-PCR以及Western blot检测心肌成纤维细胞ALDH2的mRNA以及蛋白表达 选取三个不同批次培养的正常心肌成纤维细胞样本,按照TRIzol说明书提取细胞总RNA,测量浓度和纯度。取3 μg为模板,按照逆转录试剂盒说明书方法逆转录为cDNA进行PCR[9],引物序列见(表1)。
选取三个不同批次培养的正常心肌成纤维细胞样本,收集细胞沉淀。加入细胞裂解液和PMSF(100∶1)提取细胞总蛋白,按照BCA试剂盒方法进行蛋白浓度的测定。取得的样品进行聚丙烯酰胺凝胶(SDS-PAGE)电泳(12%分离胶70 V,4%浓缩胶100 V)。电泳结束后,采用380 mA,90 min将目的蛋白转印至PVDF膜上,室温下5%的脱脂牛奶(脱脂奶粉+TBST)封闭2 h,ALDH2抗体(1∶3 500)4℃孵育过夜。加入HRP标记的羊抗兔IgG(1∶10 000)孵育1 h,洗膜后ECL显影液显影。
Tab. 1 Reverse transcription-PCR primers for ALDH2 and GAPDH
1.2.4 MTT检测各组细胞增殖能力 取传代2~3代心肌成纤维细胞,以1×105cells/ml种于96孔板培养,实验干预前予以无血清DMEM同步化48 h。设置高渗组(5.5 mmol/L DMEM+24.5 mmol/L甘露醇)排除高渗透压对细胞的影响。各组细胞按实验干预条件处理48 h之后每孔加入20 μl MTT溶液(5 mg/ml),继续37℃培养4 h后弃去培养液,每孔加入150 μl DMSO,置于摇床上缓慢振荡20~30 min,酶标仪测定490 nm吸光度值。
1.2.5 Western blot检测各组心肌成纤维细胞ALDH2蛋白表达 药物培养48 h后收集各组细胞沉淀,提取各组细胞总蛋白,按照前述方法检测各组心肌成纤维细胞ALDH2蛋白的表达,以GAPDH为内参对照。采用凝胶成像系统进行条带的灰度值测量,计算ALDH2/GAPDH比值,将该比值作为ALDH2蛋白表达量的半定量结果。
1.3 统计学方法
2 结果
2.1 心肌成纤维细胞的免疫荧光鉴定
Vimentin是一种存在于间质细胞中的中间纤维,是细胞支架的组成部分,维持了细胞完整性,Vimentin表达阳性用于鉴定心肌成纤维细胞[4]。免疫荧光染色显示心肌成纤维细胞Vimentin抗原免疫荧光呈阳性反应,为绿色,位于细胞浆内,DAPI染细胞核为蓝色。免疫荧光染色表明本实验培养的细胞为成纤维细胞,经计算纯度为96.8±2.6(图1)。
2.2 心肌成纤维细胞中ALDH2的表达
选取三个不同批次培养的心肌成纤维细胞样本,提取样本细胞的总蛋白或总RNA,测量浓度后计算上样量或模板量,进行Western blot以及RT-PCR。结果显示,ALDH2 mRNA和蛋白在心肌成纤维细胞上均有表达(图2、图3)。

Fig. 1 Immune fluorescence identification of cardiac fibroblasts (×100) A: DAPI; B: Vimentin; C: Merged
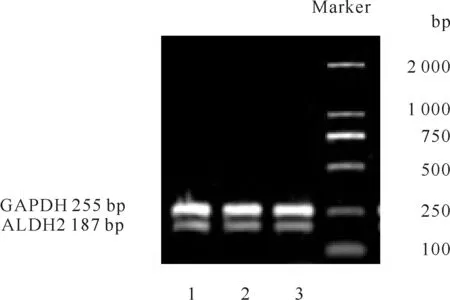
Fig. 2 mRNA expression of ALDH2 gene in cardiac fibroblasts

Fig. 3 Expression of ALDH2 in cardiac fibroblasts
2.3 各组心肌成纤维细胞的MTT检测结果
NG和HOP(高渗组,5.5 mmol/L DMEM+24.5 mmol/L甘露醇)组心肌成纤维细胞的增殖活力无显著差异,说明高渗环境对于心肌成纤维细胞增殖能力没有影响。与NG组相比,HG组细胞的增殖能力明显升高(P<0.01),HG+Alda-1组细胞增殖被抑制(P<0.01,表2)。
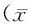

GroupODvalueNG0.206±0.016NG+Alda-10.222±0.056HG0.315±0.035**HG+Alda-10.222±0.025##HOP0.225±0.038
NG: Normal control; HG: High glucose; Alda-1: Agonist of ALDH2; HOP: HG+Alda-1
**P<0.01vsNC;##P<0.01vsHG
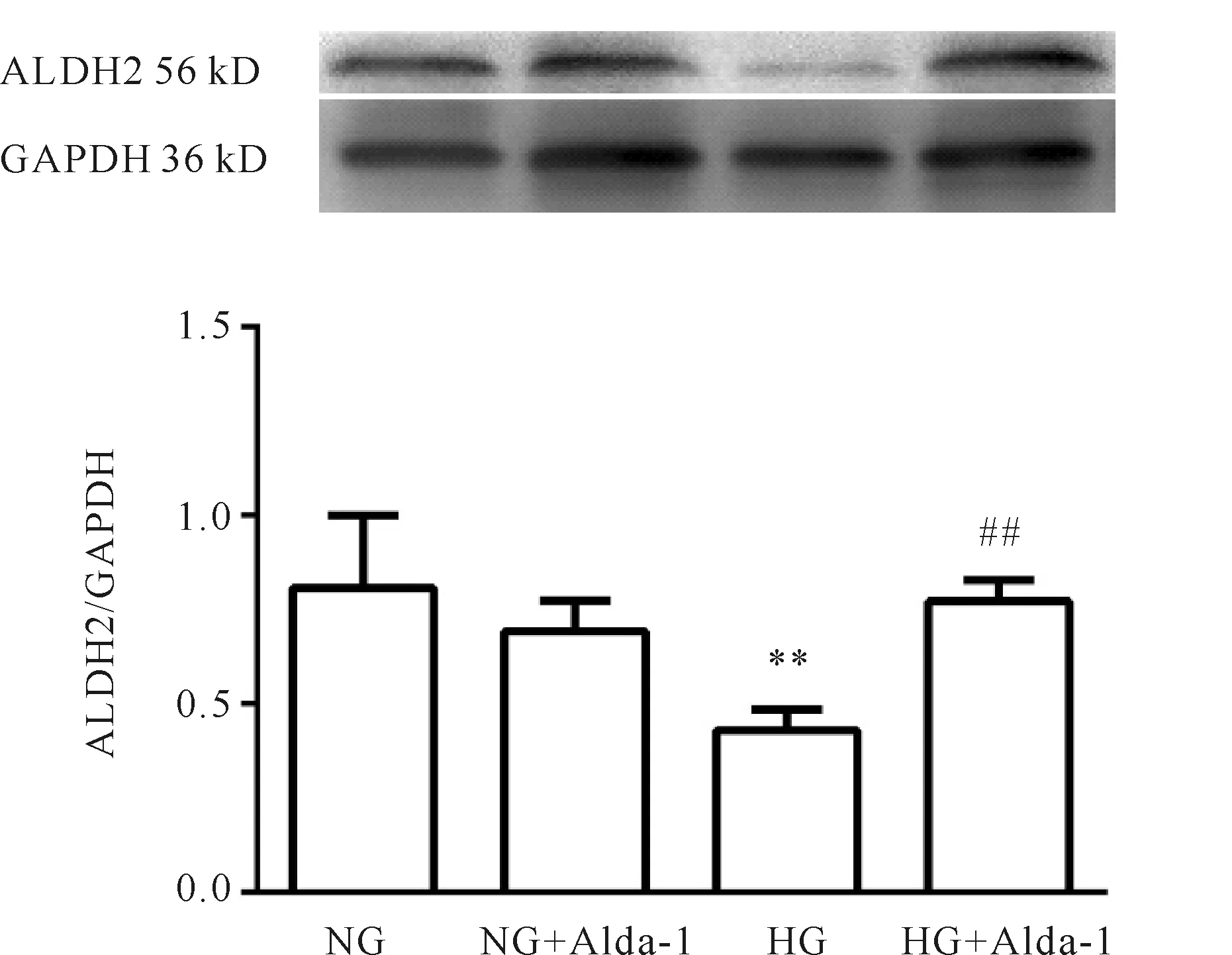
2.4 高糖干预后两组心肌成纤维细胞ALDH2蛋白的表达情况
由于MTT实验结果表明高渗环境对于成纤维细胞无明显影响,故在Western blot实验中我们并未继续讨论高渗组中ALDH2的变化。NG和NG+Alda-1组中ALDH2的表达无明显区别,与NG组相比,HG中ALDH2的表达明显降低(P<0.01),HG+Alda-1组ALDH2的表达升高(P<0.01,图4)。
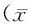
3 讨论
糖尿病心肌病是糖尿病严重的并发症之一,威胁着人类健康。高糖可以刺激心肌成纤维细胞增殖,增加细胞外基质的形成,胶原分泌增多,从而使得心脏显著增大,心脏的收缩和舒张功能减退[11]。本研究中观察到高糖刺激下,心肌成纤维细胞数目显著增加,增殖能力明显增强。
国内外研究显示,ALDH2广泛表达于心脏、肝脏、肾脏以及肺脏等重要器官中,并参与了上述脏器相关疾病的发生。激动ALDH2可减轻糖尿病大鼠心肌损伤程度[12, 13]。已有研究表明激动ALDH2可以抑制高糖诱导的心肌细胞AMPK激活、上调FOXO3a磷酸化,减少心肌细胞凋亡,发挥保护作用[8],并且可以通过提高细胞自噬改善高糖引起的心肌细胞损伤[1, 14],但关于心肌成纤维细胞是否表达ALDH2以及在糖尿病心肌病中的作用却鲜有报道。本实验中通过mRNA及蛋白水平检测观察到心肌成纤维细胞存在ALDH2的表达。
ALDH2对多种心血管相关损伤具有保护作用。提高ALDH2的表达可以改善糖尿病引起的微血管损伤[15],在大鼠糖尿病心肌病中发挥心肌保护作用,并且可以对抗大鼠心肌缺血/再灌注损伤,改善心脏功能[16]。低剂量乙醇为ALDH2非特异性激动剂,它的干预可以通过增高ALDH2表达、抑制JNK表达减轻糖尿病大鼠心肌纤维化的发生[17]。当心肌细胞发生缺氧以及高糖损伤时,ALDH2的表达降低,予以心肌细胞保护干预时ALDH2的表达有所提高[6, 18]。本实验中观察到,与正常组相比,高糖处理组心肌成纤维细胞增殖的同时,ALDH2蛋白表达降低,提示高糖可能通过降低心肌成纤维细胞ALDH 2的表达参与高糖引起的细胞损伤。给予ALDH 2特异性激动剂Alda-1干预后可以提高ALDH2的表达,抑制高糖引起的心肌成纤维细胞增殖,对抗高糖培养带来的细胞损伤。
综上所述,我们首次证实了心肌成纤维细胞上存在ALDH2的表达,并且发现,提高ALDH2的表达可以抑制高糖引起的心肌成纤维细胞的增殖从而产生心肌保护作用,对糖尿病心肌纤维化的临床治疗带来新的治疗方向和实验依据,其具体机制还有待进一步研究。
[1] 刘 敏, 张 乐, 马 颖, 等. 线粒体乙醛脱氢酶2通过提高细胞自噬改善高糖导致的心肌损伤[J]. 心脏杂志, 2015, 27(3): 249-254.
[2] Baudino TA, Carver W, Giles W,etal. Cardiac fibroblasts: friend or foe[J].AmJPhysiolHeartCircPhysiol, 2006, 293(3): 1015-1026.
[3] Sun Y, Weber KT. Animal models of cardiac fibrosis[J].MethodsMolMed, 2005, 117: 273-290.
[4] 辛 毅, 许秀芳, 黄益民, 等. 乳小鼠心肌成纤维细胞和心肌细胞的分离培养及荧光鉴定[J]. 新乡医学院学报, 2011, 28(5): 541-547.
[5] Budas GR, Disatnik MH, Mochly-Rosen D. Aldehyde Dehydrogenase 2 in Cardiac Protection: A New Therapeutic Target [J].TrendsCardiovascMed, 2009, 19(5): 158-164.
[6] 王晓梅, 叶红伟, 康品方, 等. 线粒体乙醛脱氢酶在大鼠糖尿病心肌病中的表达及意义[J]. 中国药理学通报, 2012, 28(3): 379-383.
[7] 张冠军, 张蔚屏, 王开成, 等. 厄贝沙坦对抗糖尿病大鼠心肌纤维化作用及机制[J]. 中国应用生理学杂志, 2016, 32(3): 221-224.
[8] 郭钰丽, 闫 浩, 张荣庆, 等. 线粒体乙醛脱氢酶2(ALDH2)通过 AMPK/FOXO3a 通路改善高糖导致的心肌细胞凋亡[J]. 现代生物医学进展, 2014, 14(11): 2024-2028.
[9] Miller SP, Younus H, Vanam R,etal. Alda-1 is an agonist and chemical chaperone for the common human aldehyde dehydrogenase 2 variant[J].NatStructMolBiol, 2010, 17(2): 159-164.
[10]Yu W, Zha W, Ke Z,etal. Curcumin protects neonatal rat cardiomyocytes against high glucose-induced apoptosis via PI3K/Akt signalling pathway[J].JDiabetesRes, 2016, 2016: 4158591.
[11]戴 斌, 崔 猛, 张 宏. 高糖状态下心肌成纤维细胞I、III型胶原表达变化的观察[J]. 重庆医学, 2013, 42(15): 1724-1726.
[12]Wang JL, Wang HG, Hao PP,etal. Inhibition of aldehyde dehydrogenase 2 by oxidative stress is associated with cardiac dysfunction in diabetic rats [J].MolMed, 2011, 17(3-4): 172-179.
[13]王洪巨, 康品方, 叶红伟, 等. 激动乙醛脱氢酶2对糖尿病大鼠心肌缺血/再灌注损伤的作用[J]. 中国应用生理学杂志, 2012, 28(2): 133-137.
[14]Guo YL, Yu WJ, Sun DD,etal. A novel protective mechanism formitochondrial aldehyde dehydrogenase 2 (ALDH2) in type I diabetes-induced cardiac dysfunction: Role of AMPK-regulated autophagy[J].BiochimBiophysActa, 2015, 1852(2): 319-331.
[15]Idewaki Y, Iwase M, Fujii H,etal. Association of genetically determined aldehyde dehydrogenase 2 activity with diabetic complications in relation to alcohol consumption in Japanese patients with type 2 diabetes mellitus: the fukuokadiabetes registry[J].PLoSOne, 2015, 10(11): e0143288.
[16]Ji W, Wei S, Hao P,etal. Aldehyde dehydrogenase 2 has cardioprotective effects on myocardial ischaemia/reperfusion injury via suppressing mitophagy[J].FrontPharmacol, 2016, 7: 101.
[17]于 影, 张冠军, 宗巧凤, 等. 低剂量乙醇干预减轻糖尿病大鼠心肌纤维化的机制探讨[J]. 中国临床药理学与治疗学, 2015, 20(4): 379-383.
[18]张应花, 孙爱军, 文小军, 等. 硝酸甘油对大鼠缺氧心肌细胞乙醛脱氢酶 2表达的影响[J]. 上海医学, 2010, 33(5): 417-420.
Effect of high concentration glucose on the expression of ALDH2 in cardiac fibroblasts of rats
GU Xiao-yu1, 3, FANG Ting-ting3, GAO Qin3, KANG Pin-fang2, LI Zheng-hong3, CHENG Xiang-yang1△
(1. Department of Anesthesiology, 2. Department of Cardiovascular Medicine, the First Affiliated Hospital of Bengbu Medical College, Bengbu 233004;3. Department of Physiology, Bengbu Medical College, Bengbu 233030, China)
Objective: To observe whether acetaldehyde dehydrogenase 2 (ALDH2) is expressed in cardiac fibroblasts and investigate the change of ALDH2 in cardiac fibroblasts when cultured with high concentration of glucose. Methods: Cultured cardiac fibroblasts were randomly divided into four groups: normal control group (5.5 mmol/L glucose), Alda-1 (the agonist of ALDH2, 20 μmol/L) group, high glucose group (30 mmol/L glucose) and high glucose + Alda-1 group. Cardiac fibroblasts were identified by immunofluore-scence technique. Cell proliferation was detected by MTT method after treated with drugs for 48 hours. mRNA and protein expressions of ALDH2 were determined by RT-PCR and Western blot, aimed to ensure whether ALDH2 was expressed in cardiac fibroblasts. The changes of ALDH2 protein expression in cardiac fibroblasts were tested by Western blot. Results: RT-PCR and Western blot results revealed that ALDH2 was expressed in cardiac fibroblasts. Compared with normal control group, cardiac fibroblasts proliferation was increased (P<0.05), while the protein expression of ALDH2 was reduced (P<0.05) in high glucose group. When treated with Alda-1, the proliferation of cardiac fibroblasts was decreased (P<0.01), while the protein expression of ALDH2 was increased (P<0.05) in high glucose group. Conclusion: ALDH2 was expressed in cardiac fibroblasts. Alda-1, the agonist of ALDH2 enhanced the expression of ALDH2 and inhibited the proliferation of cardiac fibroblasts when cultured with high concentration of glucose.
cardiac fibroblasts; acetaldehyde dehydrogenase 2; high concentration of glucose; Alda-1; rat
国家自然科学基金资助项目(81550036);安徽省自然科学基金资助项目(1508085MH169,1508085MH170);蚌埠医学院研究生科研创新计划项目(Byycx1548)
2016-09-13
2017-01-25
R363.2
A
1000-6834(2017)03-267-05
10.12047/j.cjap.5514.2017.065
△【通讯作者】Tel: 0552-3086198; E-mail: cxybbmc@163.com

