硫化氢对1型糖尿病大鼠膈肌NO含量和iNOS活性的影响*
杨 锐, 贾 强, 马善峰, 刘小粉, 高 琴, 王 蕾
(蚌埠医学院 生理学教研室, 安徽蚌埠 233030)
硫化氢对1型糖尿病大鼠膈肌NO含量和iNOS活性的影响*
杨 锐, 贾 强△, 马善峰, 刘小粉, 高 琴, 王 蕾
(蚌埠医学院 生理学教研室, 安徽蚌埠 233030)
目的:观察硫化氢(H2S)对1型糖尿病大鼠膈肌一氧化氮(NO)含量和诱导型一氧化氮合酶(iNOS)活性的影响。方法:将32只雄性SD大鼠随机分为4组:正常组(NC组)、糖尿病组(DM组)、糖尿病治疗组(DM+NaHS组)和NaHS对照组(NaHS组)(n=8)。采用一次性腹腔注射链脲佐菌素55 mg/kg制备1型糖尿病大鼠模型,造模成功后第4周起,DM+NaHS组和NaHS组大鼠腹腔注射NaHS溶液14 μmol/kg干预治疗。连续注射5周后,测大鼠空腹血糖值(FBG)和膈肌重量/体重量比(DW/BW);HE染色观察膈肌显微结构变化;利用NOS分型测试盒测膈肌组织iNOS活性;硝酸还原法测定膈肌组织NO含量;利用RT-PCR和Western blot分别检测膈肌组织iNOS mRNA和蛋白表达。结果:与NC组比较,DM组大鼠FBG显著升高,膈肌显微结构损伤明显,DW/BW下降,膈肌组织iNOS活性和NO含量显著增加,iNOS mRNA和蛋白表达明显增高,NaHS组各项指标差异无统计学意义。与DM组比较,DM+NaHS组膈肌显微结构明显改善,DW/BW增高,膈肌组织iNOS活性和NO含量明显下降,iNOS mRNA和蛋白表达显著降低。结论:外源性补充H2S可能通过下调膈肌组织iNOS活性和蛋白表达,降低NO含量,进而保护糖尿病大鼠膈肌的功能。
糖尿病;硫化氢;大鼠;膈肌;一氧化氮;诱导型一氧化氮合酶
糖尿病是由胰岛素分泌及(或)作用缺陷引起
的一种全身慢性内分泌代谢性疾病,临床上主要以1型(胰岛素依赖型)和2型(非胰岛素依赖型)最为多见,持续高血糖为其重要特征。糖尿病的根本危害在于机体长期持续高血糖而引起的多种并发症,常常累及全身各重要器官如心、肾、脑等。骨骼肌也是糖尿病损害的重要部位。膈肌是体内重要的呼吸肌,对于维持机体的呼吸功能具有重要作用。研究发现1型糖尿病会损伤膈肌的收缩功能[1]。
一氧化氮(nitric oxide, NO)、一氧化碳(carbon monoxide, CO)和硫化氢(hydrogen sulfide, H2S)是机体内的3种气体信号分子,在多个组织器官中发挥重要的调节作用[2]。NO是第1个被认定的气体信号分子,其前体是L-精氨酸,在一氧化氮合酶(nitric oxide synthase, NOS)的催化下生成。作为内皮依赖性的舒张因子,生理浓度的NO可以促进骨骼肌肌浆网中Ca2+的释放和葡萄糖的代谢,但当NO生成过量后会损伤肌肉的收缩功能[3]。
H2S是机体内的另一种气体信号分子,参与机体内许多生理功能的调控[4]。前期研究发现,外源性H2S可以减轻1型糖尿病大鼠膈肌损伤,增强膈肌的收缩功能,抑制膈肌细胞凋亡[5, 6]。NO和H2S同作为机体内的气体信号分子,其相互作用是目前研究的热点。因此,本研究通过制备1型糖尿病大鼠模型,研究外源性H2S对膈肌组织NO含量、iNOS活性和蛋白表达的影响,探讨H2S对糖尿病大鼠膈肌损伤的保护机制及与NO间的相互关系,为糖尿病引起合并症的防治提供理论依据。
1 材料与方法
1.1 材料
链脲佐菌素和硫氢化钠(sodium hydrosulfide,NaHS)为美国Sigma公司产品;NOS分型测试盒和NO测定试剂盒购自南京建成生物工程研究所;兔抗大鼠iNOS抗体购自英国Abcam公司;兔抗大鼠β-actin抗体购自中国Proteintech公司;山羊抗兔抗体购自中国biosharp公司;RNAiso Plus试剂购自大连TaKaRa公司;RT-PCR反转录试剂盒和PCR试剂盒购自立陶宛Fermentas公司;iNOS和β-actin引物由上海生工生物工程股份有限公司合成。所用iNOS引物:上游5’- ATC CCG AAA CGC TAC ACT T -3’,下游5’-TCT GGC GAA GAA CAA TCC -3’,扩增产物长度为314 bp;β-actin引物:上游5’- GAT GGT GGG TAT GGG TCA GAA GG -3’,下游5’- GCT CAT TGC CGA TAG TGA TGA CC -3’,扩增产物长度为632 bp。
1.2 动物分组及方法
1.2.1 动物分组及模型的建立 雄性SD大鼠32只(蚌埠医学院实验动物中心提供),体重160~200 g,适应性饲养1周后随机分为4组:正常对照 (normal control, NC)组,糖尿病(diabetes mellitus, DM)组,糖尿病治疗(DM treatment, DM+NaHS)组和NaHS对照(NaHS control, NaHS)组(n=8)。糖尿病组大鼠空腹12 h后,一次性腹腔注射链脲佐菌素 55 mg/kg (溶于0.1 mmol/L柠檬酸-柠檬酸钠缓冲液中,pH 4.4),72 h后尾静脉采血测空腹血糖值,取血糖值≥16.7 mmol/L为1型糖尿病模型。造模成功后第4周起,DM+NaHS组和NaHS组开始腹腔注射NaHS溶液14 μmol/(kg·d)[7],NC组和DM组腹腔注射相应体积的生理盐水,共持续注射5周。
1.2.2 大鼠空腹血糖和膈肌质量/体质量比值测定 第8周末,记录大鼠体重,尾静脉采血测空腹血糖值(fasting blood gulcose,FBG)。用断头器断头后开胸取膈肌,放入4℃生理盐水中清洗,用滤纸吸干表面水分后称重,计算膈肌质量/大鼠体质量比值(diaphragm weight/body weight, DW/BW)。
1.2.3 HE染色观察膈肌显微结构变化 取膈肌组织,置于10%中性甲醛溶液中固定,包埋、切片后,行HE染色,光学显微镜下观察膈肌显微结构。
1.2.4 测定膈肌组织iNOS活性和NO含量 按照试剂盒说明书操作,测定膈肌组织iNOS活性;硝酸还原法测定膈肌组织NO含量。
1.2.5 RT-PCR检测iNOS mRNA表达 取膈肌组织100 mg,提取总RNA,根据反转录试剂盒要求反转录合成cDNA,行PCR扩增。取PCR产物行1.2%琼脂糖凝胶电泳。在凝胶处理系统中拍摄,用凝胶电泳图像分析软件计算iNOS与β-actin条带光密度面积积分比值表示mRNA相对表达量。
1.2.6 Western印迹检测iNOS蛋白表达 取膈肌组织100 mg,加细胞裂解液匀浆,离心后取上清,BCA法测定蛋白质浓度。各组取35 μg上样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离。蛋白转至聚偏二氟乙烯膜,在含5%脱脂奶粉的洗涤缓冲液中室温封闭2 h后,再分别加入1∶1 000稀释的iNOS和β-actin一抗抗体,4℃孵育过夜。次日洗膜,加入1∶1 000稀释的辣根过氧化物酶标记的山羊抗兔抗体,室温孵育1 h。增强化学发光显色,曝光成像。凝胶成像系统测定条带的灰度值,计算iNOS/β-actin蛋白表达的相对量。
1.3 统计学处理
2 结果
2.1 大鼠FBG和DW/BW测定
与NC组比较,DM组和DM+NaHS组大鼠FBG显著升高(P<0.01),大鼠体重、膈肌重量和DW/BW均明显降低(P<0.05,P<0.01),NaHS组各项指标无显著性差异。外源性补充H2S干预后, DM+NaHS组大鼠FBG较DM组无显著性差异,体重、膈肌重量和DW/BW均明显增高(P<0.05,表1)。
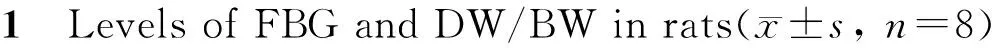
Tab.
NC: Normal control; DM: Diabetic mellitus; DM+NaHS: DM treatment; NaHS: NaHS control; FBG: Fasting blood glucose; DW/BW: Diaphragm weight/ body weight
*P<0.05,**P<0.01vsNC group;#P<0.05vsDM group
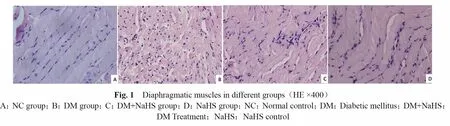
2.2 膈肌显微结构变化
HE染色后观察:NC组大鼠膈肌纤维排列整齐,细胞核清晰、着色正常,膈肌间隙正常;DM组膈肌纤维排列紊乱,细胞肿胀明显,膈肌间隙增宽,有炎细胞浸润,胞浆分布不均匀;DM+NaHS组膈肌损害较DM组明显改善,大部分膈肌细胞排列整齐,结构完整,仅部分细胞有水肿,少数有膈肌溶解、断裂或间隙加宽,炎细胞浸润减少;NaHS组膈肌组织较NC组无异常改变(图1,见彩图页Ⅲ)。
2.3 膈肌组织iNOS活性和NO含量的测定
与NC组比较,DM组和DM+NaHS组大鼠膈肌组织iNOS活性和NO含量均显著增高(P<0.01),NaHS组iNOS活性和NO含量差异无统计学意义;与DM组比较,DM+NaHS组iNOS活性和NO含量均明显降低(P<0.05,表2)。
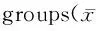

GroupiNOS(U/mg)NO(μmol/g)NC0.14±0.061.22±0.39DM0.50±0.11**3.06±0.64**DM+NaHS0.39±0.09**#2.45±0.52**#NaHS0.15±0.071.35±0.43
NC: Normal control; DM: Diabetic mellitus; DM+NaHS: DM treatment; NaHS: NaHS control; iNOS: Inducible nitric oxide synthase; NO: Nitric oxide
**P<0.01vsNC group;#P<0.05vsDM group
2.4 膈肌组织iNOS mRNA和蛋白表达测定
与NC组比较,DM组和DM+NaHS组大鼠膈肌组织iNOS mRNA和蛋白表达均显著增高(P<0.01),NaHS组差异无统计学意义;与DM组比较,DM+NaHS组大鼠膈肌组织iNOS mRNA和蛋白表达均明显降低(P<0.05,图2,表3)。
3 讨论
糖尿病是由于胰岛素分泌绝对或相对不足,出现以持续高血糖为主要特征的代谢紊乱综合症。膈肌是重要的吸气肌,膈肌的收缩和舒张影响机体的呼吸功能。研究[8, 9]报道,糖尿病会降低大鼠膈肌的收缩功能,损伤膈肌的显微和超微结构。笔者通过复制1型糖尿病大鼠膈肌损伤的动物模型,证实在病程持续8周时,糖尿病大鼠膈肌的显微结构明显受损,肌肉萎缩,膈肌的收缩能力减弱。
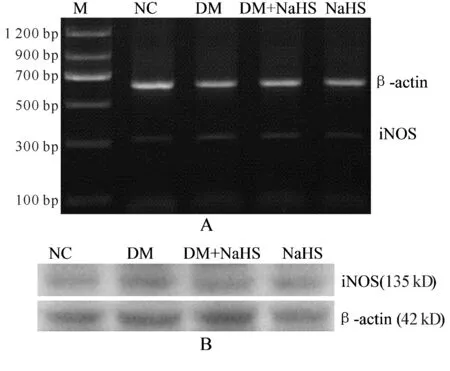
Fig. 2 Representative RT-PCR (A) and Western blot (B) results in diaphragmatic tissues
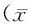

GroupiNOS/β-actinmRNAiNOS/β-actinproteinNC0.14±0.050.15±0.05DM0.32±0.07**0.39±0.08**DM+NaHS0.25±0.06**#0.31±0.07**#NaHS0.15±0.060.16±0.05
NC: Normal control; DM: Diabetic mellitus; DM+NaHS: DM Treatment; NaHS: NaHS control; iNOS: Inducible nitric oxide synthase
**P<0.01vsNC group;#P<0.05vsDM group
NO、CO和H2S是机体内的3种气体信号分子,发挥着广泛的生理调节作用。体内的NO主要是由L-精氨酸在NOS催化下生成的。NOS有3种类型: 内皮型NOS(endothelial NOS, eNOS)主要存在于内皮细胞;神经型NOS(neuronal NOS, nNOS)主要存在于神经元;诱导型(inducible NOS, iNOS)主要存在于单核-巨噬细胞系统。eNOS与nNOS合称为结构型NOS(constitutive NOS, cNOS),在机体内稳定表达,对钙调蛋白和胞内Ca2+浓度有依赖性;而iNOS的生物活性不依赖于钙调蛋白和Ca2+浓度,iNOS在细胞应激时被诱导活化, 生成大量NO[10]。正常生理状态下,NO的生成量很少,生理浓度的NO参与维持血管的正常张力,调节血管紧张度;抑制血小板聚集,防止血栓形成;抑制平滑肌细胞的增殖,维持血管的正常结构和功能,对机体起到保护作用。而在持续高血糖的病程中,NO生成量增多[11]。过量的NO可与超氧阴离子结合形成过氧化亚硝酸盐阴离子(ONOOˉ),ONOOˉ具有毒性作用,可致细胞变性、凋亡;此外,过量的NO还会触发组织的脂质过氧化反应,耗尽硫醇类物质如谷胱甘肽,产生过多的自由基从而损伤生物大分子,最终导致细胞损伤或死亡[12]。徐敏等[13]研究发现,1型糖尿病大鼠病程5周时,膈肌组织中NO含量和NOS活性显著增高,氧化应激损伤明显加重。本实验结果也提示在1型糖尿病病程中,膈肌的损伤可能与iNOS活性和表达上调致NO生成过量相关。
H2S是机体内继NO和CO之后的第3种气体信号分子,参与机体内许多组织器官的生理功能调控[14]。笔者前期研究发现,外源性H2S通过减轻糖尿病大鼠膈肌的氧化应激损伤,抑制细胞凋亡,继而改善糖尿病大鼠膈肌的收缩功能。本实验结果也进一步证实外源性H2S对1型糖尿病大鼠膈肌损伤确实具有一定的保护作用。
H2S和NO同作为体内的气体信号分子,两者的相互关系是近年来研究的热点[15]。韩颖等[16]研究发现在热性惊厥大鼠模型中,外源性H2S可以抑制机体内NO/NOS体系,减少NO产生,继而保护热性惊厥大鼠的脑损伤。通常在病理状态下(如高糖、细胞应激、缺血再灌注等),NO的生成增多,主要是由于iNOS的活性和表达明显增强。因此,很多研究者也在关注外源性H2S对iNOS的影响。Li等[17]研究发现在脂多糖诱导的RAW 264.7巨噬细胞中,外源性H2S能够抑制iNOS的蛋白表达,发挥了较好的抗炎效果。Hua等[18]研究发现外源性H2S可以通过下调心肌组织iNOS mRNA和蛋白表达,减轻CVB3诱导的小鼠心肌损伤。本实验结果显示:在1型糖尿病大鼠膈肌损伤的模型中,给予外源性H2S干预后,DM+NaHS组大鼠膈肌组织iNOS活性和NO含量均显著降低,iNOS mRNA和蛋白表达明显下调,提示外源性H2S对糖尿病大鼠膈肌的保护作用可能与下调iNOS活性和表达,继而抑制NO的过量生成相关。
综上所述,外源性H2S可能是通过调节糖尿病大鼠膈肌组织iNOS活性、mRNA和蛋白表达,降低膈肌组织NO含量,减轻膈肌组织的结构损伤,进而起到改善1型糖尿病大鼠呼吸功能的作用。
[1] van Lunteren E, Moyer M. Gene expression profiling in the type 1 diabetes rat diaphragm[J].PLoSOne, 2009, 4(11): e7832.
[2] Wang R. Gasotransmitters: growing pains and joys[J].TrendsBiochemSci, 2014, 39(5): 227-232.
[3] Vassilakopoulos T, Govindaraju K, Parthenis D,etal. Nitric oxide production in the ventilatory muscles in response to acute resistive loading [J].AmJPhysiolLungCellMolPhysiol, 2007, 292(4): L1013-1022.
[4] Polhemus DJ, Lefer DJ. Emergence of hydrogen sulfide as an endogenous gaseous signaling molecule in cardiovascular disease[J].CircRes, 2014, 114(4): 730-737.
[5] 贾 强, 马善峰, 刘小粉, 等. 硫化氢对1型糖尿病大鼠膈肌收缩功能的影响[J].中南大学学报(医学版), 2016, 41(5): 496-501.
[6] 杨 锐, 贾 强, 郭晓磊, 等. 硫化氢对1型糖尿病大鼠膈肌损伤的保护作用及抗凋亡机制[J]. 中南大学学报(医学版), 2015, 40(11): 1173-1178.
[7] 贾 强, 杨 锐, 马善峰, 等. 硫化氢对糖尿病大鼠心肌损伤保护作用及其抗凋亡机制[J]. 安徽医科大学学报, 2014, 49(2): 172-176.
[8] 沈兴平, 舒昌达, 何 军. 糖尿病大鼠膈肌功能和形态学变化[J]. 中国病理生理杂志, 2002, 18(8): 970-973.
[9] 李旭升, 傅永强, 周 标, 等. 银杏叶提取物对2型糖尿病大鼠膈肌收缩能力的影响[J]. 中国应用生理学杂志, 2010, 26(2): 249-251.
[10]Rochette L, Lorin J, Zeller M,etal. Nitric oxide synthase inhibition and oxidative stress in cardiovascular diseases: Possible therapeutic targets[J].PharmacolTher, 2013, 140(3): 239-257.
[11]Maree A, Peer G, Iaina A,etal. Nitric oxide in streptozotocin-induced diabetes mellitus in rats[J].ClinSci, 1996, 90(5): 379-384.
[12]Pacher P, Beckman JS, Liaudet L. Nitric oxide and peroxynitrite in health and disease[J].PhysiolRev, 2007, 87(1): 315-424.
[13]徐 敏, 王 芳, 李旭升, 等. 香菇多糖对糖尿病大鼠膈肌线粒体的保护作用[J]. 中国应用生理学杂志, 2006, 22(2): 240-242.
[14]Beltowski J. Hydrogen sulfide in pharmacology and medicine--An update[J].PharmacolRep, 2015, 67(3): 647-658.
[15]Nagpure BV, Bian JS. Interaction of Hydrogen Sulfide with Nitric Oxide in the Cardiovascular System[J].OxidMedCellLongev, 2016, 2016: 6904327.
[16]韩 颖, 秦 炯, 常杏芝, 等. 反复热性惊厥过程中气体信号分子硫化氢对一氧化氮/一氧化氮合酶体系的影响[J]. 中国病理生理杂志, 2007, 23(4): 785-788.
[17]Li L, Salto-Tellez M, Tan CH,etal. GYY4137, a novel hydrogen sulfide-releasing molecule, protects against endotoxic shock in the rat[J].FreeRadicBiolMed, 2009, 47(1): 103-113.
[18]Hua W, Chen Q, Gong F,etal. Cardioprotection of H2S by downregulating iNOS and upregulating HO-1 expression in mice with CVB3-induced myocarditis[J].LifeSci, 2013, 93(24): 949-954.
Effects of hydrogen sulfide on NO content and iNOS activity in diaphragm from type 1 diabetic rats
YANG Rui, JIA Qiang△, MA Shan-feng, LIU Xiao-fen, GAO Qin, WANG Lei
(Department of Physiology, Bengbu Medical College, Bengbu 233030, China)
Objective: To investigate the effects of hydrogen sulfide (H2S) on nitric oxide (NO) content and inducible nitric oxide synthase (iNOS) activity in diaphragm from type 1 diabetic rats. Methods: Thirty-two male SD rats were randomly divided into four groups: normal control group (NC), diabetes mellitus group (DM), DM treatment group (DM+NaHS) and NaHS control group (NaHS) (n=8). Rats were treated with streptozotocin 55 mg/kg by intraperitoneal injection to establish type 1 diabetic rat model. The fourth week after the modeling, the rats in the DM+NaHS and NaHS groups were treated with 14 μmol/kg NaHS solution by intraperitoneally injected. After treatment for 5 weeks, fasting blood glucose (FBG) and diaphragm weight (DW)/body weight (BW) were measured. The pathological changes of draphragmatic tissues were observed by HE staining. The activity of iNOS was analyzed by spectrophotometric method, while the content of NO was measured by nitric acid reductase method. The iNOS expressions at mRNA and protein levels in diaphragmatic tissues were detected by RT-PCR and Western blot respectively. Results: Compared with the NC group, there was no significant difference in the various indexes in the NaHS group. While FBG was increased significantly, DW/BW was decreased obviously in the DM group. HE staining revealed obvious changes in diaphragmatic tissues. The activity of iNOS and the content of NO were increased. The levels of iNOS mRNA and protein were increased significantly. Compared with the DM group, DW/BW and pathological damages were improved in the DM+NaHS group. The activity of iNOS and NO content were decreased significantly. The levels of iNOS mRNA and protein were decreased obviously. Conclusion: Exogenous H2S can suppress iNOS activity and expression to decrease the content of NO, which improving the capacity of diaphragm in type 1 diabetic rats.
diabetes mellitus; hydrogen sulfide; rat; diaphragm; nitric oxide; inducible nitric oxide synthase
国家自然科学基金(81000074);安徽省高校自然科学研究项目(KJ2015B006by,KJ2017A216,KJ2017A210);蚌埠医学院科研项目(BYKY1312,BYKY1414ZD,BYKY1621ZD)
2016-10-08
2017-02-13
R587.1
A
1000-6834(2017)03-248-05
10.12047/j.cjap.5497.2017.061
△【通讯作者】Tel: 0552-3175269; E-mail: jiaq12@sina.com

