缺氧肺动脉平滑肌细胞中PKCα/c-fos、Bax/Bcl-2表达变化及其对增殖和凋亡的影响*
曹艳红, 潘建勋, 梁月琴, 师锐赞△
(1. 大同市第五人民医院, 山西 大同 037000; 2. 山西医科大学, 太原 030001)
缺氧肺动脉平滑肌细胞中PKCα/c-fos、Bax/Bcl-2表达变化及其对增殖和凋亡的影响*
曹艳红1, 潘建勋1, 梁月琴2, 师锐赞2△
(1. 大同市第五人民医院, 山西 大同 037000; 2. 山西医科大学, 太原 030001)
目的:研究缺氧大鼠肺动脉平滑肌细胞(PASMCs)PKCα/c-fos、Bax/Bcl-2表达的变化及对其增殖和凋亡的影响。方法:将原代培养的大鼠PASMCs分为常氧组(5%CO2、21%O2、74%N2)和低氧组(5%CO2,2% O2,93%N2) 24 h,48 h。通过氮蓝四唑盐(MTT)比色法测定PASMCs的增殖水平,以流式细胞仪Annexin V-FITC/PI染色法检测细胞凋亡率,并通过用RT-PCR和Western blot法检测PKCα/c-fos、Bax/Bcl-2基因和蛋白表达的变化。实验至少重复3次,每组设置至少3个复孔。结果:低氧24 h和48 h组PASMCs增殖明显,与常氧组相比差异具有统计学意义(P<0.01),而细胞凋亡率无显著变化。相对于常氧组,低氧24 h和48 h组PASMCs PKCα、c-fos表达增强,Bax表达变化不明显,而Bcl-2表达增加。结论:低氧培养的PASMCs增殖明显,凋亡无明显变化。同时PKCα、c-fos表达增强,而抗凋亡基因Bcl-2表达增加。
PKCα/c-fos;Bax/ Bcl-2;增殖;凋亡;低氧
低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是肺心病发病过程中的中心环节,目前研究认为,肺血管结构重建(pulmonary vascular structural remodeling,PVSR)是其最主要的形态学基础,而肺动脉平滑肌细胞(pulmonary artery smooth muscle cells, PASMCs)的增殖和凋亡失衡是PVSR
的重要机制之一。因此,以PASMCs增殖和凋亡为切入点,探讨HPH的发病机制和治疗策略具有重要意义。
据文献报道,PKCα/AP-1通路参与了小牛主动脉的SMCs增殖[1]。另外,抗细胞凋亡基因Bcl-2和凋亡促进基因Bax的比例上调是诱发PASMCs增殖的重要因素[2]。本实验通过原代培养大鼠PASMCs,观察低氧条件下PASMCs增殖和凋亡的变化,同时观察低氧条件下PKCα、c-fos和凋亡相关基因(Bax、Bcl-2)表达的改变。
1 材料与方法
1.1 主要试剂和材料
胶原酶Ⅰ型(Sigma公司),DMEM培养基和胎牛血清(Hyclone公司),胰酶(Gibco公司),自动常压缺氧孵箱(德国贺氏公司),TRIzol、MMLV 逆转录酶、OIigo(dT)15,RNA 酶抑制剂(Invitrogen公司),兔抗大鼠PKCα、c-fos一抗、辣根过氧化酶(HRP)标记物羊抗兔/鼠IgG(sentacruz Biotechnology公司)、小鼠抗大鼠Bcl-2、Bax一抗(Cell Signaling Technology公司),MTT细胞增殖、BCA蛋白浓度测定试剂盒 (碧云天公司),Annexin V/PI凋亡试剂盒(BD公司)。
1.2 大鼠PASMCs培养、纯化与分组
健康雄性Wistar大鼠,体重180~220 g,由山西医科大学实验动物中心[许可证号:医动字第070101]提供。大鼠PASMCs的培养和鉴定采用胶原酶Ⅰ消化法[3]。称量大鼠体重,腹腔注射乌拉坦麻醉后断颈法处死,无菌条件下分离肺动脉,去除血管内膜和外膜,将中膜组织以酶消化法行原代培养,培养于含有20%胎牛血清的DMEM 培养液中,3~4 d更换一次培养液,细胞生长融合铺满瓶壁约80%后,0.25%胰蛋白酶消化传代,接种于新培养瓶扩大培养,首次传代时, 采用差别消化法将PASM Cs与上皮细胞分离。传代培养后改用含有10%胎牛血清的 DMEM 培养液。兔抗大鼠α-SM-actin单克隆抗体免疫荧光鉴定。倒置相差显微镜下观察,PASMCs呈典型的“峰-谷”长势,α-SM-actin染色细胞阳性率98%以上;实验用第 4~8代细胞。将PASMCs随机分成以下组:常氧组(normoxia group, N)、低氧组(hypoxia group, H)。低氧培养采用37℃、2%O2、93% N2和5% CO2,时间点设为24 h,48 h。常氧对照组条件为37℃、21% O2、74% N2和5% CO2。
1.3 MTT法测定PASMCs增殖
以2×103cells/well接种PASMCs于96孔板,各组设6个平行复孔,在边缘区域设立对照 (只加培养液,不加细胞 ),在37℃、5%CO2条件下培养24 h。生长成层后换无血清 DMEM 培养基同步化24 h。将培养板移入不同条件培养环境中继续培养,培养板中每孔终体积200 μl。特定时间点检测时,每孔加入MTT溶液(5 mg/ml) 20 μl,37℃继续孵育4 h,每孔加入150 μl DMSO,将培养板平放在平板振荡器上摇振10 min,使结晶物完全溶解。在酶标仪上选择490 nm波长测定各孔吸光度值[D(490)]。
1.4 Annexin V-FITC/PI染色法检测PASMCs凋亡率
参照Annexin V /PI双染凋亡试剂盒操作说明书操作。0.25%胰酶消化制成单细胞悬液,用100 μlBinding buffer将待测细胞的密度调整为5×105~1×106个细胞悬液,加入5 μl Annexin V-FITC标记液和5 μl PI,轻轻混匀。避光室温染色15 min,400 μl Binding buffer重悬细胞,流式细胞仪(FACS calibur,BD)测定各组细胞发生凋亡的百分数。
1.5 RT-PCR法检测基因表达
Trizol提取各组单克隆细胞总RNA,1%甲醛变性琼脂糖凝胶电泳鉴定,获得的总RNA用20 μl DEPC水溶解。紫外吸收法测定总RNA在吸光度260 nm和280 nm处吸收值,计算其浓度和纯度。取总RNA 2 μg,按Invitrogen公司MMLV First Strand cDNA Synthesis Kit说明书合成cDNA,进行PCR反应。引物序列、退火温度及产物bp数见表1。以β-actin mRNA表达水平作为内部标定基因对照。PCR产物在1.5%~1.8%的琼脂糖凝胶上电泳,条带经紫外显色灰度扫描。实验重复3次。
Tab. 1 Primer sequences of PKCα, c-fos, Bax, Bcl-2 and β-actin

Tar-getgenePrimersequence(5'➝3')Productsize(bp)Tm(℃)PKCαP1:CCAAACGGGCTTTCAGAT42360P2:TTCACTCGGT-CAAGGTTGTTc-fosP1:GTCTCCAGTGC-CAACTTCAT28954P2:CAGCCATCTTATTC-CTTTCCBcl-2P1:CTGGTGGACAA-CATCGCTCTG22854P2:GGTCTGCTGACCT-CACTTGTGBaxP1:GCGAATTGGAGAT-GAACTGG36655P2:GTGAGCGAGGCGGT-GAGGACβ-ac-tinP1:CTACAATGAGCT-GCGTGTGGC27055P2:CAGGTCCAGACG-CAGGATGGC
1.6 Western blot检测蛋白表达
提取细胞总蛋白,通聚丙烯酰胺凝胶电泳后,电转移至硝酸纤维素滤膜(NC膜)上,脱脂奶粉封闭后,一抗4℃杂交过夜,并与HRP标记的二抗杂交,置摇床室温孵育1 h。洗膜后暗室加入ECL溶液,进一步显影、定影。以β-actin蛋白表达水平作为内部标定蛋白对照,以消除蛋白上样量不同带来的误差。实验重复3次。
1.7 统计学处理
2 结果
2.1 低氧PASMCs增殖的改变
MTT结果表明,PASMCs细胞经常氧、低氧处理24 h和48 h后,低氧组在490 nm处吸光度值均高于常氧组(图1)。24 h和48 h常氧组和低氧组在490 nm处吸光度值分别为0.74±0.01和0.81±0.02、0.77±0.01和0.84±0.01。结果表明:低氧明显促进PASMCs的增殖 (P<0.01),且低氧处理48 h后PASMCs的增殖明显高于24 h (P<0.01)。

Fig. 1 The proliferation of rat PASMCs in hypoxia**P<0.01vsnormal group;##P<0.01vshypoxic group 24 h
2.2 低氧对PASMCs凋亡的影响
FITC-Annexin V/PI染色检测结果显示,常氧组PASMCs的凋亡率为6.68%±0.97%, 低氧24 h和48 h培养的PASMCs的凋亡细胞数和常氧组凋亡率分别为7.54%±0.72%和6.58%±1.13 %,各组凋亡率均在10%以内(图2),各组之间的凋亡率差异无统计学意义(P>0.05),提示低氧条件下PASMCs的凋亡率相比常氧无明显增加。

Fig. 2 Apoptosis of rat PASMCs in hypoxia A: Normal group; B: Hypoxic group 24 h; C: Hypoxic group 48 h
2.3 低氧PASMCs PKCα、c-fos表达的改变
PASMCs细胞经低氧处理特定的时间后,PKCα、c-fos mRNA(图3A)和蛋白表达(图3B)在24 h即有升高,48 h达高峰。如图3C和图3D所示,与β示actin比较,PKCα mRNA在常氧组、低氧24 h 和48 h的灰度值分别为: 0.19±0.01,0.54±0.04,0.71±0.03; c-fos mRNA在各组的灰度值分别为:0.20±0.01, 0.71±0.04, 0.93±0.07;PKCα蛋白在各组的灰度值分别为: 0.61±0.04,1.75±0.07,2.37±0.04; C-FOS蛋白在各组的灰度值分别为:0.69±0.02, 1.72±0.03, 2.54±0.15。这些结果证实PASMCs PKCα、c-fos在低氧条件下的表达呈时间依赖增强。

Fig. 3 Effects of hypoxia on the expressions of PKCα and c-fosin PASMCs A, B: The mRNA and protein expression of PKCα and c-fos in different groups; C, D: Relative mRNA and protein expression of PKCα, c-fos to β-actin; N: Normoxia group; H: Hypoxia group; H24: Hypoxia group 24 h; H48: Hypoxia for 48 h**P<0.01vsnormal group;#P<0.05,##P<0.01vshypoxic group 24 h
2.4 低氧PASMCs Bax、Bcl-2表达的改变
PASMCs细胞经低氧处理24 h和48 h后,Bax mRNA和蛋白表达未出现明显变化,而Bcl-2 mRNA(图4A)和蛋白表达增强(图4B)。如图4C和图4D所示,与β-actin比较,bax mRNA在常氧组、低氧24 h 和48 h的灰度值分别为: 0.16±0.008,0.15±0.001,0.15±0.003; Bcl-2 mRNA在各组的灰度值分别为:0.15±0.01, 0.48±0.03, 0.85±0.07;Bax蛋白在各组的灰度值分别为: 0.53±0.05,0.55±0.06,0.52±0.04; Bcl-2蛋白在各组的灰度值分别为:1.73±0.07, 2.56±0.28, 3.65±0.23。这些结果证实Bcl-2在低氧条件下的表达呈时间依赖增强。
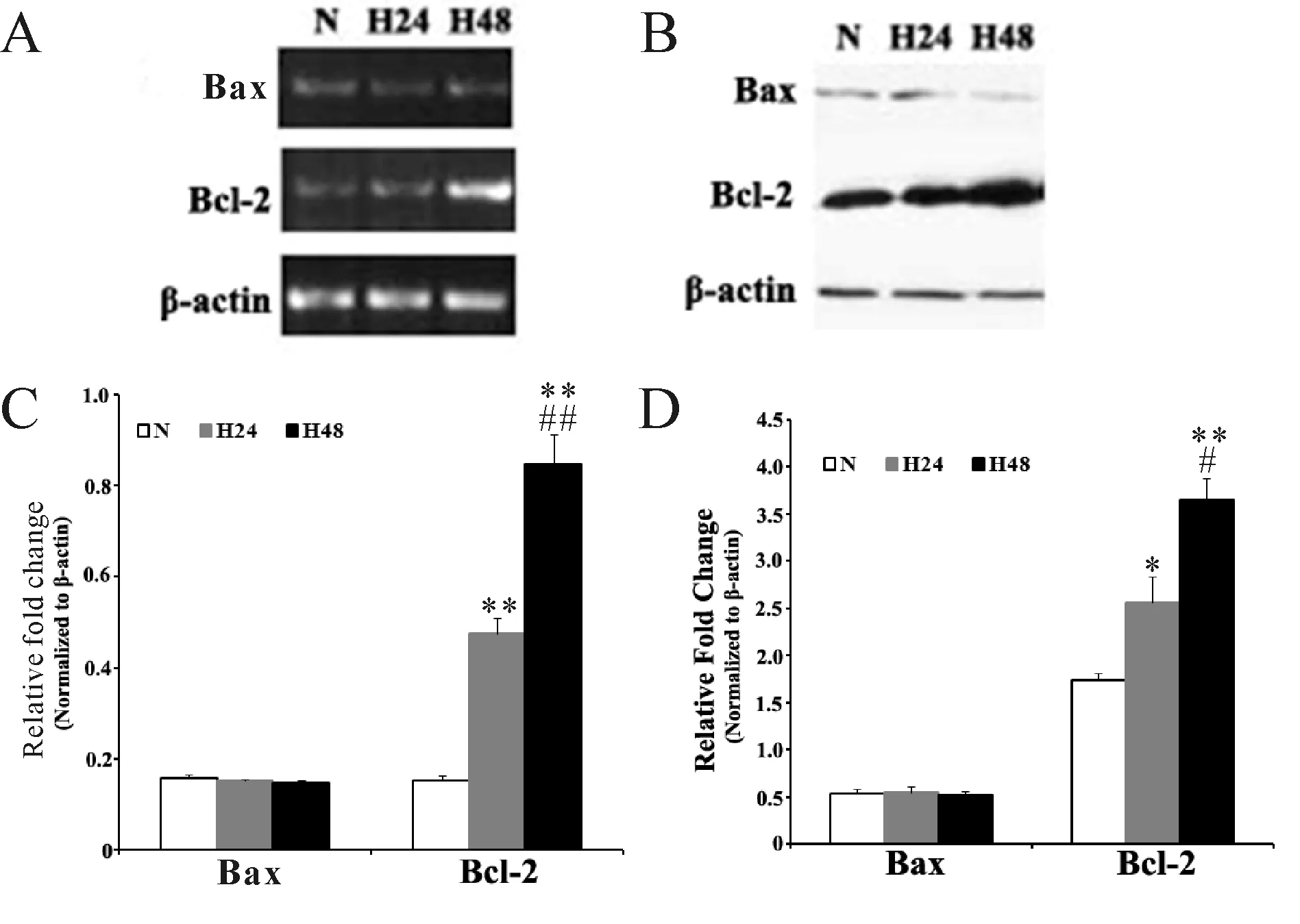
Fig. 4 Effects of hypoxia on the expressions of Bax and Bcl-2 in PASMCs A, B: The mRNA and protein expression of Bax, Bcl-2 in different groups; C, D: Relative mRNA and protein expression of Bax, Bcl-2 to β-actin; N: Normoxia group; H: Hypoxia group; H24: Hypoxia group 24 h; H48: Hypoxia for 48 h*P<0.05,**P<0.01vsnormal group;#P<0.05,##P<0.01vshypoxic group 24 h
3 讨论
近年来,随着分子生物学和基因组学的发展,针对PASMCs增殖和凋亡失衡的分子靶向治疗已成为HPH生物治疗的最新发展方向[4]。尽管近十年来HPH的药物治疗取得了较大进展,但目前尚缺乏特异性治疗措施。因此,研究PASMCs增殖和凋亡失衡的分子基础,是探讨HPH、慢性肺源性心脏病及其他血管疾病发生机制的一个重要方向。本研究以低氧条件下PASMCs作为细胞模型,观察低氧对PKCα、AP-1、Bcl-2、Bax基因表达的影响,为探讨HPH的发病机制和治疗策略奠定实验基础。
多个因子及信号通路参与HPH中PASMCs增殖和凋亡失衡。PKC属于丝/苏氨酸蛋白激酶家族,PKC亚型的表达和活性异常在调节细胞的增殖、生长、分化、凋亡、运动、肿瘤的形成和转移等过程均起着重要作用[5,6],研究证实活化的PKC促进血管平滑肌的增生,在HPH发生发展中起重要作用。本课题结果表明,低氧培养24 h和48 h PASMCs的PKCα基因和蛋白表达呈时间依赖性增强,提示PKCα的激活促进低氧条件下PASMCs增殖。有关PKCα促PASMCs的分子机制,有研究表明,香烟烟雾提取物促进PASMCs增殖,其机制与PKCα激活并促进cyclin D1表达有关[7],另有研究表明,PKC活化后可刺激原癌基因c-fos、sis等表达,而后者被激活后结合至cyclin D1启动子区,诱导cyclin D1等的转录,发挥其促增殖作用[8]。因此本课题进一步检测低氧条件下的c-fos表达变化。结果表明,低氧培养PASMCs 24 h和48 h后c-fos基因和蛋白表达呈时间依赖性地增强。以上结果提示低氧条件下的PASMCs PKCα/c-fos表达异常,但对于cyclin D1是否是其下游靶点仍需进一步的实验验证。
PASMCs异常增殖同时是否伴有凋亡水平的改变,尚有很多争论。Yu等的实验研究发现,低氧刺激大鼠PASMCs增殖,同时抑制细胞凋亡,导致肺血管重塑[9]。Luo等报道,低氧过程中,HIF-1α通过增强glycolysis活性,降低培养液的pH值,促进A549细胞凋亡增加[10]。本研究结果表明,低氧24 h和48 h对PASMCs的凋亡率影响不明显。进一步对凋亡相关基因的检测结果表明,相对于常氧组,低氧培养PASMCs24 h和48 h后Bax表达变化不明显,而抗凋亡基因Bcl-2 mRNA和蛋白表达呈时间依赖性增多。Bcl-2和Bax的比例上调是诱发PASMCs增殖的重要因素。综合以上结果表明,低氧条件下PASMCs的增殖和凋亡失衡,而PKCα/c-fos及Bcl-2表达的改变可能是其原因之一。
结合本研究的实验结果可以发现,低氧条件下增殖凋亡相关基因的改变可能是造成PASMCs增殖和凋亡的失衡、PVSR的主要原因。因此,以特定的增殖凋亡相关基因为靶点,抑制PASMCs的异常增殖,诱导其凋亡,无疑是改善PVSR、治疗HPH的有效方法。
[1] Gai XY, Tang F, Ma J,etal. Antiproliferative effect of echinacoside on rat pulmonary artery smooth muscle cells under hypoxia [J].JPharmacolSci, 2014, 126(2): 155-163.
[2] Zhou CH, Xiang M, He SY,etal. Protein kinase C pathway is involved in the inhibition by crocetin of vascular smooth muscle cells proliferation [J].PhytotherRes, 2010, 24(11): 1680-1686.
[3] 钱国清, 王良兴, 陈 婵, 等. 大鼠细小肺动脉平滑肌细胞原代培养和鉴定方法的研究[J]. 中国应用生理学杂志, 2010, 26(1): 125-128.
[4] Dong L, Li Y, Hu H,etal. Potential therapeutic targets for hypoxia-induced pulmonary artery hypertension [J].JTranslMed, 2014, 12: 39.
[5] 马治云. 急性力竭运动对大鼠心肌PKCα、δ和ε表达的影响[J]. 中国应用生理学杂志, 2016, 32(4): 333-335.
[6] 刘洁瑾, 荣良群, 魏秀娥, 等. 蛋白激酶C在细胞凋亡中的研究进展[J]. 徐州医学院学报, 2016, 36 (4): 272-276.
[7] Zeng DX, Xu YJ, Liu XS,etal. Cigarette smoke extract induced rat pulmonary artery smooth muscle cells proliferationviaPKCα-mediated cyclin D1 expression [J].JCellBiochem, 2011, 112(8): 2082-2088.
[8] Soh JW, Weinstein IB. Roles of specific isoforms of protein kinase C in the transcriptional control of cyclin D1 and related genes [J].JBiolChem, 2003, 278(36): 34709-34716.
[9] Yu X, Li T, Liu X,etal. Modulation of pulmonary vascular remodeling in hypoxia: role of 15-LOX-2/15-HETE-MAPKs pathway [J].CellPhysiolBiochem, 2015, 35(6): 2079-2097.
[10]Luo F, Liu X, Yan N,etal. Hypoxia-inducible transcription factor-1α promotes hypoxia-induced A549 apoptosisviaa mechanism that involves the glycolysis pathway [J].BMCCancer, 2006, 6: 26.
Effects of PKCα/c-fos, Bax/Bcl-2 expression on the proliferation and apoptosis of rat pulmonary arterial smooth muscle cells in hypoxia
CAO Yan-hong1, PAN Jian-xun1, LIANG Yue-qin2, SHI Rui-zan2△
(1. Datong the Fifth People's Hospital, Datong 037000; 2. Shanxi Medical University, Taiyuan 030001, China)
Objective: To explore the effects of PKCα/c-fos, Bax/Bcl-2 on the proliferation and apoptosis of rat pulmonary arterial smooth musclecells(PASMCs) in hypoxia. Methods: The PASMCs of rats had been isolated and cultured, and then were cultured under normoxia(5%CO2、21%O2、74%N2)and hypoxia(5%CO2,2% O2,93%N2)condition for 24 h and 48 h, respectively.The proliferation of PASMCs was tested by methylthiazolyltetrazolium (MTT). The changes of PASMCs apoptosis were detected by Annexin V-FITC/PI staining combined flow cytometry. RT-PCR and Western blot analysis were performed to detect the gene and protein levels of PKCα/c-fos, Bax/Bcl-2, respectively. All experiments were repeated three times with at least triplicate samples. Results: The proliferation of PASMCs in hypoxia group were stronger than that of normoxia group after 24 h and 48 h (P<0.01), while the apoptosis rate did not change significantly.Meanwhile, the higher levels of PKCα, c-fos, Bcl-2 mRNA and proteins after hypoxia for 24 h and 48 h were detected by RT-PCR and Western blot analysis, while the expression levels of Bax had no significant difference under normoxic and hypoxic conditions. Conclusion: Elevated proliferation and expression of PKCα, c-fos, Bcl-2 was observed in rat PASMCs in hypoxia, and while the apoptosis rate had no significant change.
PKCα/c-fos; Bax/Bcl-2; proliferation; apoptosis; hypoxia
山西省青年科技研究基金资助项目(2014021038-3);山西医科大学校科技创新基金资助项目(01201308);山西医科大学博士启动基金资助项目(B032001207)
2016-03-28
2016-12-07
R563. 9
A
1000-6834(2017)03-218-05
10.12047/j.cjap.5442.2017.054
△【通讯作者】Tel: 0351-4135079; E-mail: shiruizan@163.com

