松果菊苷对人肝癌细胞HepG2生长和缝隙连接细胞通讯的影响※
杨晓寰
(汕头大学医学院第一附属医院中医科,广东 汕头 515041)
松果菊苷对人肝癌细胞HepG2生长和缝隙连接细胞通讯的影响※
杨晓寰
(汕头大学医学院第一附属医院中医科,广东 汕头 515041)
目的 观察松果菊苷(ECH)对人肝癌细胞HepG2生长和缝隙连接细胞通讯(GJIC)的影响。方法 Alamar Blue法绘制HepG2细胞生长曲线,并检测ECH的细胞毒作用;划痕标记染料示踪技术(SL/DT)法观察空白对照组、API阳性对照组、AGA阴性对照组和ECH组对GJIC的影响;异硫氰酸荧光素(FITC)间接免疫荧光法观察ECH对缝隙连接蛋白Cx43表达的影响。结果 HepG2细胞在20 000个/mL的细胞密度Alamar Blue还原率与时间有线性关系。ECH(5、10、20、40和80 μM)处理HepG2细胞24 h,细胞存活率分别为(92.69±3.35)%、(88.33±2.12)%、(80.97±2.50)%、(76.95±1.40)%和(69.09±1.11)%(P<0.01)。抑制率最高(80 μM浓度下)为30.91%。IC50为467.8 μM(368.3 μg/mL)。SL/DT显示阳性对照芹黄素和ECH处理24 h后,荧光染料在划痕外4列细胞出现了明显荧光(++++),说明细胞出现染料传输的现象。间接免疫荧光法对Cx43表达进行计分,空白对照组细胞得分为(1.40±0.55)分,ECH组得分为(1.60±0.55)分。结果表明ECH组的Cx43表达增强不明显。结论 ECH对HepG2细胞有细胞毒作用,同时可增强GJIC功能,但Cx43表达不明显,为ECH抗肿瘤机制提供依据。
肝肿瘤,实验性;病理学;皂苷类;基因表达;细胞间通讯
恶性肿瘤是现今全世界最主要的发病和致死原因,每年癌症新发病例约1 400万,死亡约800万,2015年因癌症死亡人数占全球死亡数的1/6,造成男性死亡的5种最常见癌症依次为肺癌、肝癌、胃癌、结直肠癌及前列腺癌,造成女性死亡的5种最常见癌症依次为乳腺癌、肺癌、结直肠癌、宫颈癌及胃癌,我国新发癌症病例和死亡人数均居世界首位[1]。如何有效防治恶性肿瘤仍然是当前研究的热点。缝隙连接(gap junction,GJ)是相邻细胞间作用的直接通道。缝隙连接细胞通讯(gap junctional intercellular communication,GJIC)是指直径<1.5 nm、分子量<1 kDa的小分子物质或水溶性的细胞代谢物能通过缝隙连接通道进行物质和能量交换,从而调节细胞的增殖、分化和凋亡等生命活动。肿瘤形成的一个重要原因在于相邻的肿瘤细胞间及肿瘤细胞与相邻正常细胞间出现的缝隙连接功能的异常或缺失[2]。中医药具有毒副作用少的优点,肉苁蓉具有补益机体阳气,提高肿瘤患者机体免疫力的作用[3]。本研究观察了肉苁蓉的主要活性成分松果菊苷(ECH)对HepG2细胞的增殖抑制作用和对肿瘤细胞缝隙连接功能的影响,结果如下。
1 材料与方法
1.1 药物与试剂 ECH为中国药品生物制品检定所的对照品,18-α甘草酸(AGA)和芹黄素(API)为Sigma公司产品,以上纯度均>98%(高效液相色谱法)。Alamar Blue为AbD公司产品,细胞培养液RPMI-1640和0.25%含乙二胺四乙酸(EDTA)胰酶的消化液为GIBCO公司产品,新生牛血清为杭州四季青公司产品。ECH经二甲基亚砜(DMSO)助溶后用磷酸盐缓冲液(PBS)配成2 mM,调pH为7.2,0.22 μm过滤除菌,分装保存,于1个月内使用。以上药物在培养体系中溶剂浓度不超过1%。HepG2购自中山大学实验动物中心细胞库。
1.2 细胞培养 HepG2 37 ℃、5%CO2及饱和湿度条件下用含10%新生牛血清的RPMI-1640培养液于培养箱内培养。
1.3 细胞生长曲线的绘制 收获对数生长期的细胞,分别按每孔2 500、5 000、10 000、20 000、25 000和50 000个/mL的细胞浓度接种入96孔板培养,每个浓度设5个复孔。每孔加入20 μL Alamar Blue,用酶标仪分别测定570、630 nm波长的吸收值,计算Alamar Blue还原率。以还原率为纵坐标,细胞培养时间为横坐标,绘制细胞生长曲线。
1.4 细胞毒实验(Alamar Blue法) 收获对数生长期的细胞,按照每孔4 000个细胞接种入96孔板培养24 h后分别加ECH 0、5、10、20、40和80 μM培养。每孔加入20 μL Alamar Blue,24、48和72 h时用酶标仪分别测定570、630 nm波长的吸收值,计算每个浓度及时间段存活率。以存活率为纵坐标,药物浓度为横坐标,计算药物IC50值。
1.5 划痕标记染料示踪技术(scrape-loading dye transfer assay,SL/DT)检测ECH对HepG2细胞GJ功能的影响 细胞按0.8×106个/孔接种到六孔板中,分为空白对照组、API阳性对照组、AGA阴性对照组和ECH组,药物孵育36 h后用PBS冲洗3遍并吸净。l mL 0.1%罗氏黄染液加入培养皿后用薄手术刀片划痕5道,5 min后吸净染液并用PBS冲洗3遍吸净,置于荧光显微镜下观察,通过观察染色的邻近细胞距离进行半定量检测。若荧光仅在划痕旁1列细胞则为(-);荧光扩散到划痕旁2列细胞即为(+);荧光扩散到划痕旁3列细胞即为(++);荧光扩散到划痕旁4列细胞即为(+++);荧光扩散到超过划痕旁4列细胞即为(++++)。
1.6 异硫氰酸荧光素(FITC)间接免疫荧光法检测ECH对HepG2细胞Cx43的表达 细胞培养于24孔板中,80 μM的ECH作用24 h后固定和染色。具体如下:PBS冲洗3次,4%甲醛室温固定30 min,PBS冲洗10次,50 g/L血清白蛋白(BSA)封闭30 min,吸去多余水分,滴加兔抗鼠Cx43 Ⅰ级抗体覆盖抗原标本,过夜后,PBS冲洗10次,暗室中滴加1∶100稀释的FITC-兔抗山羊IgG Ⅱ级抗体,湿盒内2 h后吸去多余水分。用荧光显微镜在蓝色激发光下观察,200倍视野下每个样本随机抽取5~7个进行盲法摄像和盲法评分,根据荧光是否表达及亮度分为(-)~(++++),(+)记1分,(++)记2分,以此类推。
1.7 统计学方法 用SPSS 14.0软件进行分析,多组间的比较用One-Way ANOVA和LSD法。
2 结 果
2.1 HepG2细胞生长曲线 算出HepG2细胞在不同细胞浓度和时间段的Alamar Blue还原率并做图。结果发现HepG2在20 000个/mL的密度培养24~72 h间还原率与时间有线性关系,得出此体系最优化的培养密度和时间是20 000个/mL的密度培养3 d。见表1、图1。
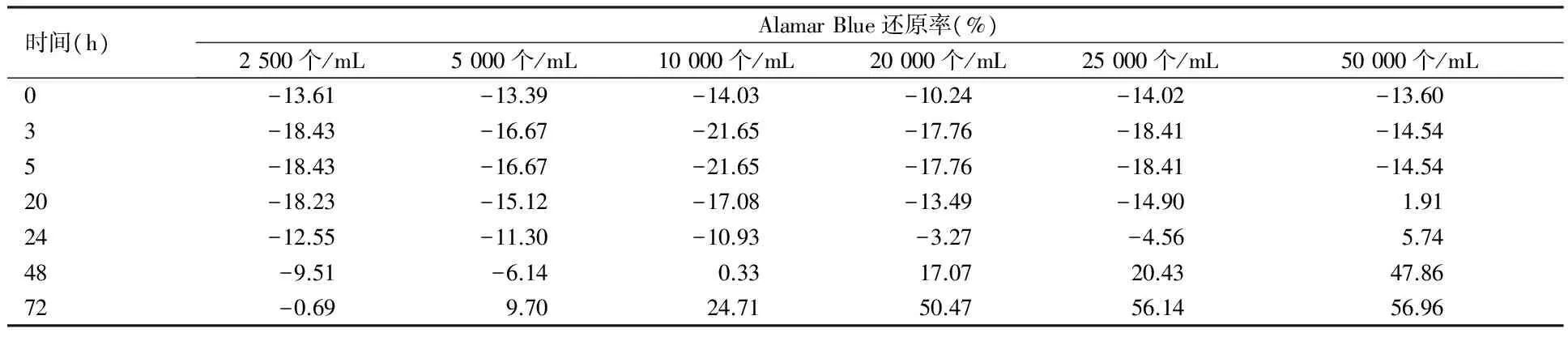
表1 HepG2不同时间和密度的还原率 mean,n=5

图1 HepG2生长曲线图
2.2 ECH对HepG2细胞毒作用 采用Alamar Blue法检测ECH对HepG2的细胞毒作用。结果显示,ECH作用24 h开始镜下可见40 μM和80 μM组的细胞明显减少,尤其在80 μM组仅见散在贴壁细胞,存活率为(69.09±1.11)%(P<0.01)。80 μM下ECH对细胞抑制率最高,为30.91%。IC50为467.8 μM(368.3 μg/mL)。见表2、图2、图3。
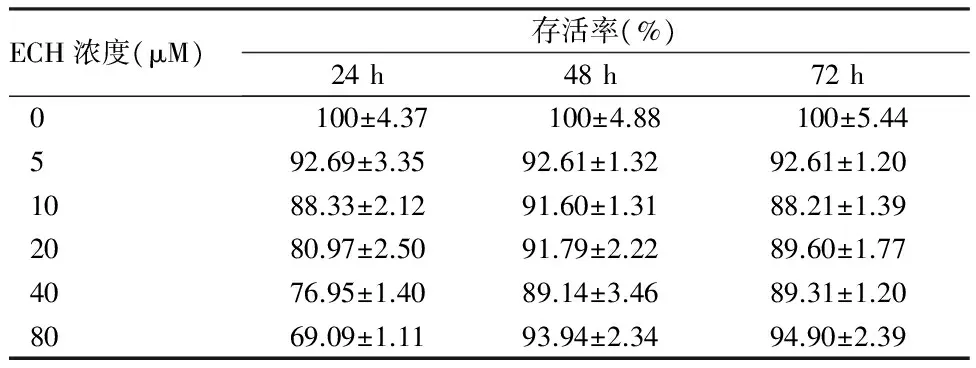
表2 ECH对HepG2的作用mean±SD,n=5


图2 ECH对HepG2细胞毒作用镜下观察(24 h)
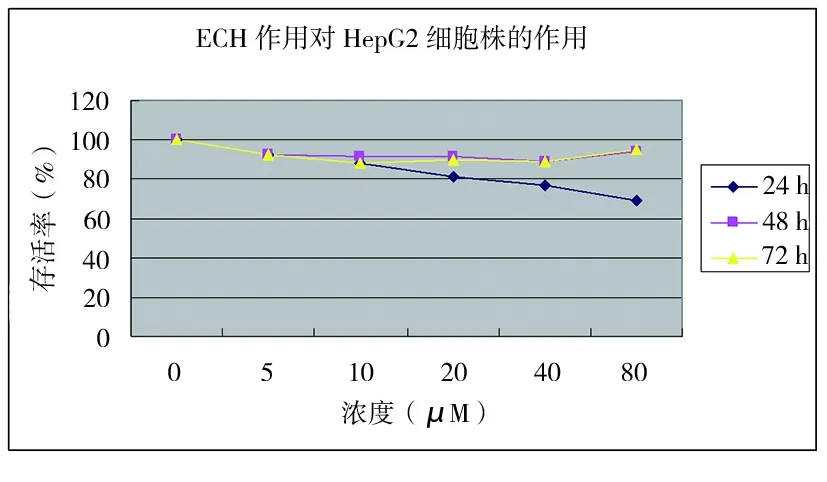
图3 ECH对HepG2的细胞毒作用曲线图
2.3 SL/DT检测ECH对GJIC的影响 划痕后罗氏黄负载5 min,倒置荧光显微镜下观察。结果显示,AGA阴性对照组未见荧光(-),空白对照组荧光出现在划痕旁1~2列细胞中且亮度低,说明GJIC功能差;而API阳性对照和ECH处理24 h后,荧光均扩散到划痕以外的3~4列细胞,荧光强度为强阳性(++++),说明细胞GJIC明显增强。见表3、图4。

图4 各药物处理后HepG2细胞间荧光染料传输功能变化(×100)

组 别荧光强度空白对照组±AGA阴性对照组-API阳性对照组++++ECH组++++
2.4 FITC法检测Cx43表达情况 镜下观察发现空白组的荧光强度一般,Cx43的表达评分为(1.40±0.55),ECH组细胞中荧光主要集中在细胞质和细胞膜上,Cx43的表达评分为(1.60±0.55)。结果表明ECH组的Cx43表达增强不明显。见表4、图5。

图5 ECH对HepG2细胞Cx43表达的影响

组 别++++++++++平均分值对照组32001.40±0.55ECH80μM23001.60±0.55
3 讨 论
缝隙连接是细胞间直接进行信息交换的重要通道,GJIC的异常与肿瘤的发生、发展关系密切。相邻细胞膜上的连接子(connexon)对接形成跨膜通道,每个连接子由6个连接蛋白(connexin,Cx)组成。现代研究发现在乳腺癌、肺癌等多种癌变组织和细胞株中均可检测到Cx表达的异常。恢复肿瘤细胞的GJIC功能成为目前研究肿瘤防治的热点。
中医学认为,癌瘤的病机是本虚标实,机体正气内虚为本,痰浊、气滞、血瘀等病理产物为标,虚实夹杂,凝聚而为肿块。因此,肿瘤的治疗注重补益药的应用。临床上常用补益中药提高患者抵抗力,但是否具有直接抗肿瘤作用及其机制尚未明确。据报道,一些补阳中药的提取物如冬虫夏草[4]、巴戟天[5]等,具有体外抗肿瘤作用。补阳中药的活性物质也有报道对肿瘤细胞有直接细胞毒作用,如补骨脂素[6]、虫草素[7]、灵芝多糖[8]和淫羊藿苷[9]等。
肉苁蓉始载于《神农本草经》,性温,味甘、咸,归肾、肠经,具有补肾壮阳、润肠通便的作用。临床上常用于治疗阳气虚衰所致的腰膝痠软、阳萎早泄、宫寒不孕以及肠燥便秘等症。现代研究表明,肉苁蓉具有补肾壮阳、改善记忆力、利尿通便、抗疲劳和抗辐射等作用[3]。
ECH是肉苁蓉的主要活性成分,是一种多酚物质。目前报道ECH的药理作用主要是神经保护[10-12]、抗衰老[13-14]、清除自由基[15]、保护血管内皮细胞[16-17]、促进造血功能[18]和促进成骨[19-20]等。也有报道ECH诱导胰腺癌等肿瘤细胞凋亡[21-22],但对肿瘤细胞GJIC的影响研究较少。
Alamar Blue还原法是一种定量检测细胞活力的新方法,具有敏感、操作简便、快速及并能连续监测的优点。其主要原理是Alamar Blue能被生长良好的细胞摄入,细胞内的还原环境将其变为红色,而生长抑制的细胞维持的氧化环境则使其保持原有的蓝色。检测2个颜色波长吸光度则可计算出Alamar Blue的还原率,从而定量细胞的活力。由于Alamar Blue对活细胞没有毒性,因此可用于连续测定不同时间段各密度细胞的吸光值,根据其还原率绘制生长曲线。本实验发现ECH作用24 h开始镜下40 μM和80 μM组的细胞明显减少,尤其在80 μM组仅见散在贴壁细胞,80 μM下ECH对细胞抑制率为30.91%。IC50为467.8 μM(368.3 μg/mL)。说明ECH对HepG2有体外细胞毒作用,提示ECH具有体外直接抗肿瘤作用。
SL/DT的原理在于通过划痕法使单层培养的细胞膜上出现短暂的裂痕(这种裂痕既不影响细胞的存活,亦不影响其分化能力),荧光染料罗氏黄可通过裂痕进入细胞,在荧光显微镜下观察罗氏黄染液所发出的黄色荧光向邻近细胞间的传递而用于表示间隙连接细胞间通讯功能。API为GJ增效剂,AGA为GJ的长效抑制剂。SL/DT结果显示,空白对照组细胞的荧光染料主要出现在划痕旁1~2列细胞中而且亮度低(±),细胞间染料传输功能差;经阳性对照API和ECH处理24 h后,荧光染料不仅出现在划痕的附近细胞内,而且在划痕以外的3~4列细胞内也出现了明显荧光(++++)。说明出现了细胞间染料传输的现象,说明细胞的间隙连接通讯功能获得增强。HepG2细胞分别经阴性对照AGA处理24 h后,荧光染料出现在划痕旁1列细胞且亮度比对照组低(-)。说明无细胞间染料传输的现象,细胞的间隙连接通讯功能得到抑制。
镜下观察,各组均有Cx43的表达的阳性细胞,但其中空白对照组的荧光强度一般,各用药组细胞中荧光主要集中在细胞核外的胞浆或胞膜上。本实验在盲法摄取图象后,采用盲法评分,根据荧光表达的亮度分为(+)、(++)、(+++)、(++++)4个等级,具体标准由观察者掌握,其中(+)记1分,(++)记2分,如此类推。分析结果发现,空白对照组细胞得分为(1.40±0.55),ECH组得分为(1.60±0.55)。结果表明ECH的Cx43表达增强不明显,其中的Cx43部分错误定位在细胞质上。其明显的GJIC功能可能是通过其他Cx的表达形成的缝隙连接通道实现的,关于ECH体外直接抗肿瘤是否通过凋亡实现及其增强GJIC的机制均有待进一步实验证明。
[1] McGuire S. World Cancer Report 2014. Geneva,Switzerland: World Health Organization, International Agency for Research on Cancer, WHO Press, 2015[J].Adv Nutr,2016,7(2):418-419.
[2] Cronier L, Crespin S, Strale PO, et al.Gap junctions and cancer: new functions for an old story[J].Antioxid Redox Signal,2009,11(2):323-338.
[3] 胡佳琦,冯佳媛.肉苁蓉的化学成分和药理作用[J].中医临床研究,2012,4(15):26-28.
[4] 陈家念,张璇,蔡豪斌,等.冬虫夏草菌丝体水提醇沉物体外抗肿瘤活性研究[J].药物评价研究,2014,37(2):108-112.
[5] 张学新,肖柳英,潘竞锵.巴戟天对小鼠肿瘤细胞增殖及Bax、Bcl-2蛋白表达的影响[J].中药材,2011,34(4):598-601.
[6] 谭敏,孙静,赵虹,等.补骨脂素对乳腺癌MCF-7和MDA-MB-231细胞体外作用的比较研究[J].广州中医药大学学报,2009,26(4):359-362,427.
[7] 蔡伟,叶青,唐亮,等.虫草素对结肠癌细胞体外增殖、迁移能力的影响及其诱导细胞凋亡的作用[J].中华临床医师杂志:电子版,2011,5(14):4048-4054.
[8] Liang ZE,Yi YJ,Guo YT,et al. Inhibition of migration and induction of apoptosis in LoVo human colon cancer cells by polysaccharides from Ganoderma lucidum[J].Mol Med Rep,2015,12(5):7629-7636.
[9] Fan C, Yang Y, Liu Y, et al. Icariin displays anticancer activity against human esophageal cancer cells via regulating endoplasmic reticulum stress-mediated apoptotic signaling[J].Sci Rep,2016,6:21145.
[10] Zhao Q, Yang X, Cai D, et al. Echinacoside Protects Against MPP(+)-Induced Neuronal Apoptosis via ROS/ATF3/CHOP Pathway Regulation[J]. Neurosci Bull,2016,32(4):349-362.
[11] 马婧怡,张万鑫,陈虹,等.松果菊苷对血管性痴呆大鼠氧化应激损伤的保护作用[J].中国药理学通报,2014,30(5):638-642.
[12] Zhang J, Zhang Z, Xiang J, et al.Neuroprotective Effects of Echinacoside on Regulating the Stress-Active p38MAPK and NF-κB p52 Signals in the Mice Model of Parkinson's Disease[J].Neurochem Res,2017,42(4):975-985.
[13] 李媛,宋媛媛,张洪泉.松果菊苷对衰老小鼠免疫功能和线粒体DNA相对含量的影响[J].中国药理学通报,2010,26(6):810-813.
[14] Xie H, Zhu H, Cheng C, et al. Echinacoside retards cellular senescence of human fibroblastic cells MRC-5[J].Pharmazie,2009,64(11):752-754.
[15] 刘春丽,陈虹,姜勇,等.松果菊苷对血管性痴呆大鼠行为学、氧自由基以及胆碱能神经递质代谢速率的影响[J].中国药理学通报,2013,29(7):1035-1036.
[16] 王毓杰,康云雪.松果菊苷和麦角甾苷对血管内皮细胞EA.hy926的增殖抑制和凋亡诱导作用[J].中成药,2016,38(10):2244-2248.
[17] 李欢,宋安齐,薛嘉虹,等.松果菊苷对血管内皮细胞损伤的保护作用[J].西安交通大学学报:医学版,2013,34(3):387-392.
[18] Wang S, Zheng G, Tian S,et al. Echinacoside improves hematopoietic function in 5-FU-induced myelosuppression mice[J].Life Sci,2015,123:86-92.
[19] 田原,邸阳,包翠芬,等.松果菊苷含药血清诱导骨髓间充质干细胞成骨分化及BMP2表达的研究[J].中药药理与临床,2015,31(4):60-64.
[20] Yang X, Li F,Yang Y,et al. Efficacy and safety of echinacoside in a rat osteopenia model[J].Evid Based Complement Alternat Med,2013:926-928.
[21] Wang W, Luo J, Liang Y,et al. Echinacoside suppresses pancreatic adenocarcinoma cell growth by inducing apoptosis via the mitogen-activated protein kinase pathway[J].Mol Med Rep,2016,13(3):2613-2618.
[22] Dong L, Wang H, Niu J,et al. Echinacoside induces apoptotic cancer cell death by inhibiting the nucleotide pool sanitizing enzyme MTH1[J].Onco Targets Ther,2015,8:3649-3664.
(本文编辑:董军杰)
Effects of echinacoside on growth and gap junctional intercellular communication in HepG2 of human hepatoma carcinoma cell
YANGXiaohuan.
DepartmentoftraditionalChinesemedicine,theFirstHospitalAffiliatedtoMedicalCollegeofShantouUniversity,Guangdong,Shantou515041
Objective To observe the effects of echinacoside (ECH) on growth and gap junctional intercellular communication (GJIC) in HepG2 of human hepatoma carcinoma cell. Methods The cytotoxicity of ECH was detected through draw the growth curve of HepG2 cells by Alamar Blue method. The effects of blank group, API positive control group, AGA negative control group and ECH group on GJIC were observed by scrape-loading dye transfer assay(SL/DT). The effect of EHC on expression of Cx43 protein was observed by flourescein isothiocyanate(FITC)indirect immunofluorescence assay. Results There was a liner correlation in alamar blue reduction rate and time of HepG2 cells under 20 000/mL cell density. The HepG2 cells were conducted by EHC (5,10,20,40 and 80 μM)for 24 h ,and the survival rates of cells were (92.69 ± 3.35)%, (88.33 ± 2.12)%, (80.97 ± 2.50)%, (76.95±1.40)% and (69.09±1.11)%(P<0.01). The highest inhibition rate (under 80 μM concentration) was 30.91%. IC50 was 467.8 μM (368.3 μg/mL). The apigenin and ECH were conducted after treatment 24 h, the SL/DT showed positive control, and fluorescent dyes showed obvious fluorescence (++++) in the scratches outside four cells, which indicated the cells appear the phenomenon of dye transfer. The expression of Cx43 was scored by indirect immunofluorescence assay. The score of blank control group was (1.40 ± 0.55) and the score of ECH group was (1.60 ± 0.55). Conclusion ECH had cytotoxic effect on HepG2 cells, and can enhance GJIC function, but the expression of Cx43 was not obvious, which provide the basis for the anti-tumor mechanism of ECH.
Liver tumor; Experimental; Pathology; Saponins class; Gene expression; Intercellular communication
※ 项目来源:汕头大学(医学院)创新强校工程人才培育项目
杨晓寰(1979—),女,副主任中医师,博士。从事中医内科临床及基础研究。
10.3969/j.issn.1002-2619.2017.04.024
R-332;R282.710.5;R735.7;R329.25
A
1002-2619(2017)04-0579-06
2017-01-17)

