不同胁迫温度条件下坛紫菜中脂肪酸和挥发性物质分析
宋 悦,卓 馨,陈娟娟,骆其君,杨 锐,陈海敏,严小军
(宁波大学海洋学院,浙江 宁波 315211)
不同胁迫温度条件下坛紫菜中脂肪酸和挥发性物质分析
宋 悦,卓 馨,陈娟娟*,骆其君,杨 锐,陈海敏,严小军
(宁波大学海洋学院,浙江 宁波 315211)
摘 要:为了解高温胁迫条件下坛紫菜脂肪酸变化规律,采用气相色谱-质谱联用技术对不同胁迫温度条件下的坛紫菜脂肪酸和挥发性物质进 行分析。结果显示,以20 ℃为对照温度,分别在25、28 ℃和35 ℃三个温度胁迫后,坛紫菜中共鉴定出13 种总脂肪酸、14 种游离脂肪酸和32 种挥发性物质。当胁迫温度升高至28 ℃时,饱和脂肪酸和挥发性物质含量随胁迫温度升高而增加,而不饱和脂肪酸和游离脂肪酸含量则随胁迫温度升高而降低;当胁迫温度升高至35 ℃时,总脂肪酸、总游离不饱和脂肪酸和挥发性物质含量均随胁迫温度升高而降低。了解高温胁迫条件下总脂肪酸、游离脂肪酸和挥发性物质之间的转化,有助于了解坛紫菜抗高温胁迫机理和坛紫菜的健康栽培。
关键词:坛紫菜;高温胁迫;脂肪酸;挥发性物质;气相色谱-质谱法
坛紫菜(Pyropia haitanensis)是我国重要的经济海藻,其年产量约占紫菜年总产量的75%[1-2],由于生长在环境复杂的潮间带,其生长常受到一些因素的影响,如温度、光照、营养盐和水流等,其中温度是最主要的影响因素[3-4]。近几年,在浙闽海区,每年10~11月会出现高温回暖天气,俗称“小阳春”,此时养殖坛紫菜经常会出现大量烂菜现象,造成巨大损失[5],因此亟需筛选具有耐高温品系,了解坛紫菜抗高温胁迫机制,是指导紫菜栽培生产及减灾防病的当务之急。细胞膜系统,作为藻类对高温胁迫的最初敏感器,在胁迫环境中不断地调整脂质代谢以维持细胞膜的流动性、完整性和功能性,从而得以存活与生长[6-9]。高温胁迫条件下,细胞膜受到损伤,活性氧的大量释放打破脂肪酸与膜脂之间的平衡,脂肪酸链被不同程度的氧化,不饱和度、双键位置及长度的变化都在不同程度地影响着细胞膜的功能和生物体的抗热性[10-13]。低温条件下的有机体倾向于产生更多的不饱和脂肪酸[14-15],受到高温胁迫后的有机体膜脂饱和脂肪酸含量增多,有助于增加细胞膜脂的变相温度,通过提高细胞膜系统的稳定性来提高耐热能力[16]。
某些挥发性物质被称为挥发性氧化脂质,当藻类受到胁迫时,脂酶促进游离不饱和脂肪酸的释放,进一步在脂氧合酶的作用下转化得到,可以在藻类与环境、藻类与藻类之间进行信号传递,在保护藻类防御各种胁迫中有重要作用[17-19]。因此,研究高温胁迫条件下坛紫菜的脂肪酸和挥发性物质的变化,对于了解坛紫菜的抗高温胁迫机理,以及坛紫菜的健康养殖具有重要意义。
1 材料与方法
1.1 材料与试剂
脂肪酸C19:0、正己烷、乙腈、五氟苄基溴(PFBBr)、N,N-二异丙基乙胺、丁羟甲苯(均为色谱纯) 美国Sigma-Aldrich公司;甲醇、香草醛、碳酸钾、乙酸乙酯、乙酰氯(均为分析纯) 国药集团化学试剂有限公司;甲酰氯(100 mL甲醇中加入10 mL乙酰氯)现配现用。
1.2 仪器与设备
QP 2010气相色谱-质谱分析仪(配有AOC-20自动进样器) 日本Shimadzu公司;SPB-50色谱柱(30 m×0.25 mm,0.25 μm)、Vocol色谱柱(60 m×0.32 mm,0.18 μm)、固相微萃取系统和75 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/ carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取头 美国Supelco公司;FreeZone冷冻干燥机 美国Labconco公司。
1.3 方法
1.3.1 样品前处理
2015年11月2日在宁波象山采集的浙东1号坛紫菜保存于-20 ℃冰箱。挑选健康坛紫菜,坛紫菜长度大约在15~20 mm之间,紫菜宽度在3~4 mm之间。于0.7% KI海水中消毒10 min后清洗2~3 次,灭菌海水中复苏24 h,培养温度为(19±1) ℃,光强为2 500~3 000 lx,光暗比为1∶1(12 h/12 h)。复苏完成后取出分置于水温为20、25、28、35 ℃的培养箱内热激1 h,热激完成的坛紫菜取出后加液氮于-80 ℃冰箱保存,冷冻干燥后液氮研磨成粉。
1.3.2 总脂肪酸分析
1.3.2.1 总脂肪酸提取
准确称取干藻粉50 mg置于4 mL样品瓶内,加入1 mL正己烷、1.5 mL甲酰氯和15 μg内标物C19:0。振荡1 min,70 ℃水浴提取2 h,冷却30 min至室温,加2.5 mL 6% K2CO3溶液和1 mL正己烷。振荡30 s,3 500 r/min离心5 min,上清液蒸干。按照上述前处理操作步骤,平行3 次,获得3 个平行重复,且分别用1 mL正己烷复溶、离心和过膜,上机待测。每个平行样品采用气相色谱-质谱分析方法重复进样两针。
1.3.2.2 总脂肪酸气相色谱-质谱分析
气相色谱条件:进样口温度250 ℃;载气为99.999%高纯氦气;柱流速0.81 cm3/min;柱前压73.0 kPa;升温程序:柱起始温度150 ℃,保持3.5 min,以20 ℃/min升至200 ℃,保持5 min,再以5 ℃/min升至280 ℃,保持20 min;分流进样,分流比为50∶1。
质谱条件:电子电离源;离子源温度200 ℃;接口温度250 ℃;选取全程离子碎片扫描模式;质量扫描范围m/z 50~650;溶剂延迟时间3 min。
1.3.3 游离脂肪酸分析
1.3.3.1 游离脂肪酸提取
准确称取干藻粉200 mg于50 mL离心管中,加入6 mL乙酸乙酯(50 mg/L丁羟甲苯),振荡2 min,超声5 min,于4 ℃摇1 h,10 000 r/min离心15 min,上清液转至另一50 mL离心管中。固体残渣加入4 mL乙酸乙酯,振荡2 min,超声5 min,10 000 r/min离心15 min,合并上清液于50 mL离心管中,加5 mL冰水,10 000 r/min离心15 min。取乙酸乙酯相于4 mL样品瓶中,旋转蒸干。
4 mL样品瓶中加15 μL PFBBr、30 μL N-乙基二异丙胺、150 μL乙腈和20 μg C19:0,35 ℃水浴30 min,N2吹干。用0.5 mL正己烷复溶、离心和过膜,平行分析3 次。
1.3.3.2 游离脂肪酸气相色谱-质谱分析
气相色谱条件:进样口温度250 ℃;载气为99.999%高纯氦气;柱流速0.62 cm3/min;柱前压51.6 kPa;升温程序:柱起始温度150 ℃,保持3.5 min,以20 ℃/min升至200 ℃,保持5 min,再以5 ℃/min升至280 ℃,保持18 min;不分流进样。
质谱条件:负化学离子源;离子源温度200 ℃;接口温度250 ℃;选取全扫描模式;质量扫描范围m/z 50~750;溶剂延迟时间3 min。
1.3.4 挥发性物质分析
1.3.4.1 分析样品预处理
称取样品0.3 g(鲜质量),液氮研磨成粉,加入15 mL顶空瓶中,再加入2 mL缓冲溶液A(50 mmol/LTris与20 mmol/L NaCl,加盐酸调pH值至8.0)和内标香草醛0.6 mg,萃取头气相色谱进样口老化30 min,40 ℃条件下顶空瓶中萃取50 min,室温条件下萃取20 min,取出萃取头立即插入210 ℃进样口,脱吸附5 min,平行测定3 次。
1.3.4.2 挥发性物质气相色谱-质谱分析
气相色谱条件:进样口温度210 ℃;载气为99.999%高纯氦气;柱流速1.99 cm3/min;柱前压128.3 kPa;升温程序:柱起始温度35 ℃,保持3 min,以3 ℃/min升至40 ℃,保持1 min,再以5 ℃/min升至210 ℃,保持25 min;不分流进样。
质谱条件:电子电离源;离子源温度200 ℃;接口温度300 ℃;选取全扫描模式;质量扫描范围m/z 40~1 000;溶剂延迟时间3 min。
2 结果与分析
2.1 脂肪酸和挥发性物质的定性定量方法建立
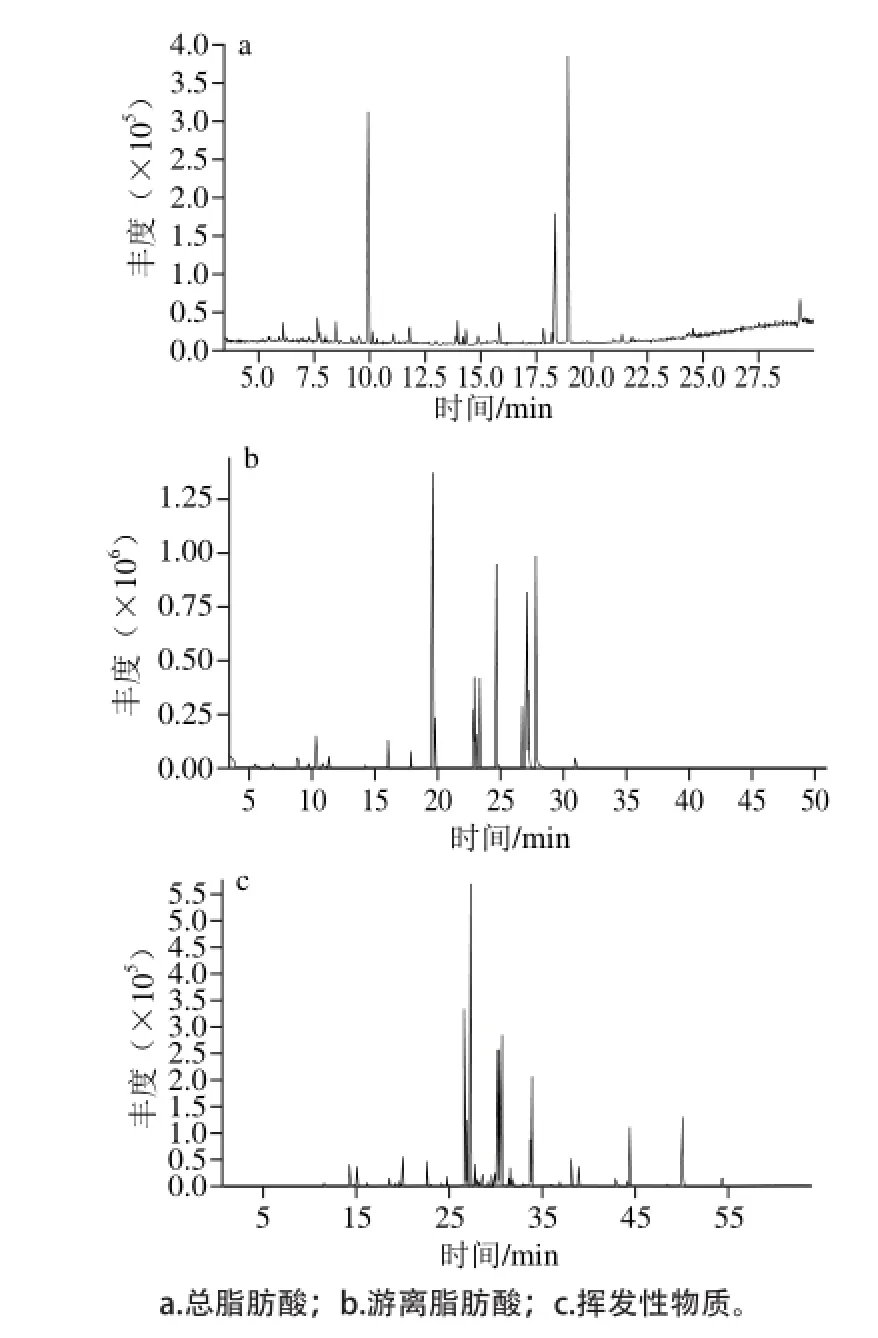
图 1 坛紫菜中各组分的总离子流图Fig. 1 Total ion current chromatograms of FAs and VOCs from P. haitanensis
以C19:0脂肪酸作为内标物,结合各个总脂肪酸的保留时间,并将其与C19:0脂肪酸的保留时间进行比较分析,得到的相对保留时间即为定性依据之一。此外,从图1中获得各个保留时间条件下色谱峰的质谱图,并从各组分分子离子峰,确定各组分的分子质量,再根据各组分的离子碎片质量谱图,通过NIST库中的脂肪酸标准谱图比较分析作为另一个定性依据。游离脂肪酸通过PFBBr衍生化法进行分析,是将游离脂肪酸与PFBBr进行酯化反应生成脂肪酸五氟苯甲酯[FA-PFBME],五氟苯甲酯失去五氟苯甲基得到[M-PFB]-离子,它们为游离脂肪酸在负化学离子源质谱图中丰度最高的离子,用于推测分子质量进行定性分析。由于总脂肪酸和游离脂肪酸的种类较多,因此采用的是相对定量分析方法,即通过加入C19:0脂肪酸标准物质作为定量内标,根据不同的C19:0峰面积绘制一条标准曲线,并利用该标准曲线和各组分的峰面积,由此计算出各组分在样品中的含量。
挥发性物质的定性分析与脂肪酸类似,而其相对定量则依据内标香草醛来分析挥发性物质在样品中的含量。
2.2 不同温度胁迫条件下坛紫菜总脂肪酸含量变化
28 ℃为自然界坛紫菜能承受的最高温度,而选择35 ℃是为了短期内,使坛紫菜代谢物可瞬间改变,以便更好地了解热激应答的代谢过程。选取20 ℃作为对照温度,25、28 ℃和35 ℃三个温度作为胁迫温度,在高温胁迫条件下,坛紫菜膜脂与脂肪酸之间的平衡被打破,脂肪酸的种类和含量发生有目的的改变,来参与胁迫防御。如图2所示,对不同温度胁迫条件下的坛紫菜进行总脂肪酸分析,共检测到13 种脂肪酸,包括C14:0、C16:0、C16:1 n-7、C16:1 n-9、C18:0、C18:1 n-9、C18:1 n-11、C18:2、C20:1、C20:2、C20:4、C20:5和C22:1。其中,C16:0、C20:4和C20:5含量较高,在每克坛紫菜中分别为11.95、7.88 μmol和14.27 μmol,占了脂肪酸总含量的80.33%~83.95%。
不同温度胁迫条件下,每种脂肪酸的变化不尽相同,因此对其进行分类分析。如图2n、o所示,当胁迫温度升至28 ℃时,饱和脂肪酸含量逐渐升高,当升至35 ℃时又出现明显下降,而不饱和脂肪酸含量则随着胁迫温度的升高不断下降。坛紫菜在高温胁迫条件下会通过增加饱和脂肪酸的含量,增加细胞膜脂的变相温度,提高细胞膜系统的稳定性来提高耐热能力,所以当胁迫温度升至28 ℃时,饱和脂肪酸含量升高。同时,坛紫菜在高温胁迫条件下释放大量活性氧,氧化膜脂并产生大量短链挥发性物质[10,20]。因此膜脂的不饱和脂肪酸链被大量存在的活性氧氧化,生成具有防御作用的氧化脂质,导致不饱和脂肪酸含量下降。但当刺激条件达到35 ℃胁迫1 h时,超出坛紫菜所能承受的最高温度,细胞膜系统受到严重损伤,光合作用产生的能量不足以支撑自身的生长,脂肪酸被氧化代谢,而未得到及时补充,因此饱和脂肪酸和不饱和脂肪酸含量均出现明显下降。
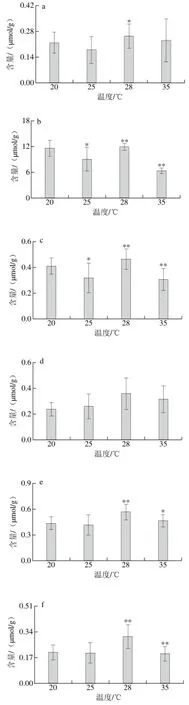


图 2 坛紫菜在不同胁迫温度条件下的总脂肪酸含量变化Fig. 2 Changes in total fatty acids of P. haitanensis under heat stress at different temperatures for 1 h

2.3 不同温度胁迫条件下坛紫菜游离脂肪酸含量变化

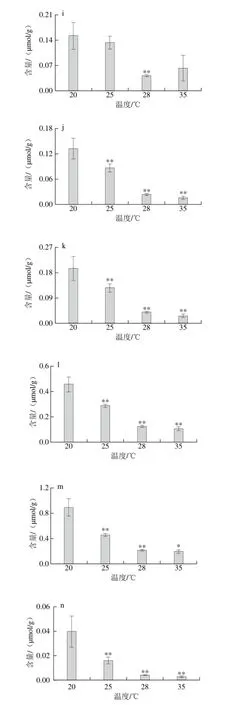

图 3 坛紫菜在不同温度条件下高温胁迫1 h游离脂肪酸含量变化Fig. 3 Changes in free fatty acids of P. haitanensis after heat shock at different temperatures for 1 h
不同温度胁迫条件下坛紫菜总脂肪酸分析发现,膜脂可能释放脂肪酸参与胁迫防御,因此对应条件的游离脂肪酸分析必不可少。如图3所示,对不同温度胁迫条件下坛紫菜游离脂肪酸进行分析,共检测到14 种游离脂肪酸,分别为C13:0、C14:0、C15:0、C16:0、C16:1、C18:0、C18:1(含2 种异构体)、C18:2、C20:1、C20:3、C20:4、C20:5和C22:1。其中C16:0、C20:4和C20:5含量较高,在每克坛紫菜中分别为0.45、0.46 μmol和0.89 μmol,占游离脂肪酸总含量的58.50%~70.20%。
不同温度胁迫条件下每种游离脂肪酸的变化不尽相同,因此对其进行分类分析。当胁迫温度升至25 ℃时,游离饱和脂肪酸的总含量几乎无变化,而当温度继续升高时其含量出现下降。对总脂肪酸的分析中,饱和脂肪酸的总含量随着胁迫温度的升高呈增加趋势,因此可能是游离饱和脂肪酸用于合成膜脂提高坛紫菜的耐热能力,因而含量出现下降。C16:1、C18:1、C18:2、C20:1、C20:3、C20:4、C20:5、C22:1和游离不饱和脂肪酸总量均随着胁迫温度的升高呈现降低趋势。当植物受到生物或非生物类胁迫时,防御性基因被激活表达相应的酶或蛋白,多不饱和脂肪酸在酶或者化学氧化作用下生成氢过氧化物,再被降解成氧化脂质参与胁迫防御[21-22]。因此,不饱和脂肪酸含量的降低可能是由于被氧化代谢成氧化脂质,因此本实验对挥发性物质的变化情况进行进一步分析。
2.4 不同温度胁迫条件下坛紫菜挥发性物质含量变化
挥发性物质是海藻的高效防御机制,其含量的变化是植物与环境复杂相互作用的结果,在防御胁迫中至关重要[23-24]。如表1所示,共鉴定出32 种挥发性物质,包括16 种醛、4 种酮、4 种醇、3 种酯、3 种烷烃和2 种烯烃。其中,C8醇、醛、酮为主要成分,如1-辛烯-3-酮、(E)-2-辛烯醛、3-乙烯环己醇、1-辛烯-3-醇、(E)-2-辛烯醇、1,5-辛二烯-3-醇、1,5-辛二烯-3-酮和辛醛,占总量的比例最高达74%。C8挥发性物质主要来源于C20多不饱和脂肪酸[25-26],如1-辛基-3-醇来源于C20:4,1,5-辛二烯-3-醇和1,3,5-辛三烯来源于C20:5[27]。

表 1 坛紫菜在不同温度条件下高温胁迫1 h挥发性物质含量变化Table 1 Changes in VOCs of P. haitanensis after heat shock at different temperatures for 1 h
在胁迫过程中,C8挥发性物质具有引起氧化损伤、抑制生长和激活防御基因等作用[28-29]。如图4所示,当胁迫温度升至28 ℃时,所有C8挥发性物质含量都随着热激温度的升高而增加,但当胁迫温度升高至35 ℃时,所有的挥发性物质含量均下降,有些甚至低于对照组含量。当胁迫温度升至28 ℃时,C8挥发性物质含量逐渐升高,而游离脂肪酸C20:3、C20:4和C20:5含量逐渐降低,说明随着热激温度升高,坛紫菜感受更强的热激胁迫,产生更多的保护性物质参与抗胁迫过程,来减轻藻体自身损害。但当高温胁迫温度升至35 ℃时,C8挥发性物质和游离脂肪酸C20:3、C20:4和C20:5含量均降低。在胁迫条件下,挥发性物质可以在羟自由基的作用下转化为其他物质。同时,藻体可以利用挥发性物质来获得碳源,并避免这种高代价防御带来的损害[30]。而总脂肪酸的分析也发现当高温胁迫温度达到35 ℃时,饱和脂肪酸和不饱和脂肪酸含量均下降,说明藻体受到严重损害,需要大量物质来维持生长。因此,在35 ℃条件下,饱和脂肪酸、游离脂肪酸C20:3、C20:4、C20:5和C8挥发性物质含量的下降可能是由于过度的热激防御使藻体遭受较大的损害而不得不重新利用挥发性物质来维持自身的生存与生长,也可能是由于35 ℃条件下热激1 h时,藻体已经处于适应阶段,但1 h之前的胁迫阶段损失过大,于是藻体重新利用挥发性物质来维持自身的生长。
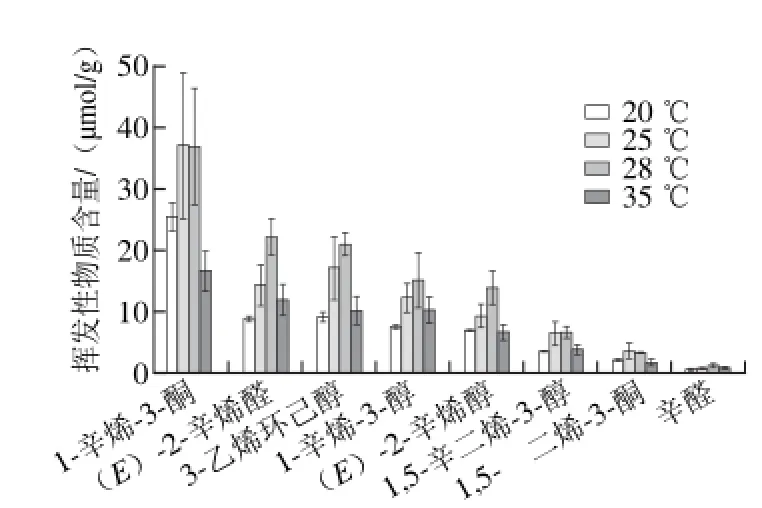
图 4 不同温度胁迫条件下挥发性物质含量变化Fig. 4 Changes in VOCs of P. haitanensis after heat shock at different temperatures for 1 h
3 结 论
本实验通过实验室模拟高温胁迫模式下,气相色谱-质谱对20、25、28 ℃和35 ℃刺激条件下坛紫菜中脂肪酸和挥发性物质进行定性定量研究,共鉴定出13 种总脂肪酸,14 种游离脂肪酸以及32 种挥发性物质(16 种醛、4 种酮、4 种醇、3 种酯、3 种烷烃和2 种烯烃)。结果显示,当胁迫温度升高至28 ℃时,饱和脂肪酸和挥发性物质含量随胁迫温度升高呈增加趋势,而不饱和脂肪酸和游离脂肪酸含量则随胁迫温度升高而降低;当胁迫温度升高至35 ℃时,总脂肪酸、总游离不饱和脂肪酸和挥发性物质含量均随胁迫温度升高而降低。由此说明高温胁迫条件下坛紫菜中的总脂肪酸、游离脂肪酸和挥发性物质通过含量的改变进行互相调节,来对抗高温逆境引起的损伤,使藻体在逆境环境中得以生存和生长。此研究有助于进一步了解坛紫菜抗高温胁迫机理、减轻高温引起的藻类栽培损失。
参考文献:
[1] 吴宏肖, 严兴洪, 宋武林, 等. 坛紫菜与Pyropia radi种间杂家重组优良品系的选育与特性分析[J]. 水产学报, 2014, 38(8): 1079-1088. DOI:10.3724/SP.J.1231.2014.49295.
[2] BLOUIN N A, BRODIE J A, GROSSMAN A C, et al. Porphyra: a marine crop shaped by stress[J]. Trends in Plant Science, 2011, 16(1): 29-37. DOI:10.1016/j.tplants.2010.10.004.
[3] YE Y, ZHANG L, YANG R, et al. Metabolic phenotypes associated with high-temperature tolerance of Porphyra haitanensis strains[J]. Journal of Agricultural and Food Chemistry, 2013, 61(35): 8356-8363. DOI:10.1021/jf402749a.
[4] DAVISON I R, PEARSON G A. Stress tolerance in intertidal seaweeds[J]. Journal of Phycology, 1996, 32(2): 197-211. DOI:10.1111/j.0022-3646.1996.00197.x.
[5] 张元, 谢潮添, 陈昌生, 等. 高温胁迫下坛紫菜叶状体的生理响应[J].水产学报, 2011, 35(3): 379-386. DOI:10.3724/SP.J1231.2011.17181.
[6] AYYASH M, ALGAHMI A, GILLESPIE J, et al. Characterization of a lysophospholipid acyltransferase involved in membrane remodeling in Candida albicans[J]. Biochimica et Biophysica Acta, 2014, 1841: 505-513. DOI:10.1016/j.bbalip.2013.12.015.
[7] BOROWITZKA M A, MOHEIMANI N R. Algae for biofuels and energy[M]. Dordrecht: Springer, 2013: 17-36. DOI:10.1007/978-94-007-5479-9_2.
[8] THOMPSON G A. Lipids and membrane function in green algae[J]. Biochimica et Biophysica Acta, 1996, 1302: 17-45. DOI:10.1016/0005-2760(96)00045-8.
[9] HU Q, SOMMERFELD M, JARVIS E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances[J]. The Plant Journal, 2008, 54(4): 621-639. DOI:10.1111/ j.1365-313X.2008.03492.x.
[10] YANG R, LIU W, ZHANG X L, et al. Sequences of Mn-sod gene from Pyropia haitanensis (Bangiales, Rhodophyta) and its expression under heat shock[J]. Botanica Marina, 2013, 56(3): 249-259. DOI:10.1515/ bot-2012-0178.
[11] VIDOUDEZ C, POHNERT G. Comparative metabolomics of the diatom Skeletonema marinoi in different growth phases[J]. Metabolomics, 2011, 8(4): 1-16. DOI:10.1007/s11306-011-0356-6.
[12] STILLWELL W, WASSALL S R. Docosahexaenoic acid: membrane properties of a unique fatty acid[J]. Chemistry and Physics of Lipids, 2003, 126(1): 1-27. DOI:10.1016/S0009-3084(03)00101-4.
[13] XIA L, SONG S, HU C. High temperature enhances lipid accumulation in nitrogen-deprived Scenedesmus obtusus XJ-15[J]. Journal of Applied Phycology, 2016, 28(2): 831-837. DOI:10.1007/s10811-015-0636-z.
[14] KARABUDAK T, BOR M, ☒ZDEMIR F, et al. Glycine betaine protects tomato (Solanum lycopersicum) plants at low temperature by inducing fatty acid desaturase 7 and lipoxygenase gene expression[J]. Molecular Biology Reports, 2014, 41(3): 1401-1410. DOI:10.1007/ s11033-013-2984-6.
[15] VAYDA M E, YUAN M L. The heat shock response of an antarctic alga is evident at 5 ℃[J]. Plant Molecular Biology, 1994, 24(1): 229-233. DOI:10.1007/BF00040590.
[16] SCHRODA M, VALLON O, WOLLMAN F A, et al. A chloroplast-targeted heat shock protein 70 (HSP70) contributes to the photoprotection and repair of photosystem Ⅱ during and after photoinhibition[J]. Plant Cell, 1999, 11(6): 1165-1178. DOI:10.2307/3870807.
[17] NIINEMETS Ü, MONSON R K. Biology, controls and models of tree volatile organic compound emissions[M]. Netherlands: Springer, 2013: 153-159. DOI:10.1007/978-94-007-6606-8.
[18] HOLOPAINEN J K. Multiple functions of inducible plant volatiles[J]. Trends in Plant Science, 2004, 9(11): 529-533. DOI:10.1016/ j.tplants.2004.09.006.
[19] LAOTHAWORNKITKUL J, TAYLOR J E, PAUL N D, et al. Biogenic volatile organic compounds in the Earth system[J]. New Phytologist, 2009, 183(1): 27-51. DOI:10.1111/j.1469-8137.2009.02859.x.
[20] WANG X J, CHEN H M, CHEN J J, et al. Response of Pyropia haitanensis to agaro-oligosaccharides evidenced mainly by the activation of the eicosanoid pathway[J]. Journal of Applied Phycology, 2013, 25(6): 1895-1902. DOI:10.1007/s10811-013-0009-4.
[21] BL☒E E. Phytooxylipins and plant defense reactions[J]. Progress in Lipid Research, 1998, 37(37): 33-72. DOI:10.1016/S0163-7827(98)00004-6.
[22] SAVCHENKO T, PEARSE I S, IGNATIA L, et al. Insect herbivores selectively suppress the HPL branch of the oxylipin pathway in host plants[J]. Plant Journal, 2013, 73(4): 653-662. DOI:10.1111/tpj.12064. [23] MITTLER R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410. DOI:10.1016/S1360-1385(02)02312-9.
[24] VIDOUDEZ C, POHNERT G. Comparative metabolomics of the diatom Skeletonema marinoi in different growth phases[J]. Metabolomics, 2012, 8(4): 654-669. DOI:10.1007/s11306-011-0356-6. [25] GERWICK W H. Structure and biosynthesis of marine algal oxylipins[J]. Biochimica et Biophysica Acta, 1994, 1211(3): 243-255. DOI:10.1016/0005-2760(94)90147-3.
[26] POHNERT G, BOLAND W. ChemInform abstract: the oxylipin chemistry of attraction and defense in brown algae and diatoms[J]. Natural Product Reports, 2002, 33(18): 108-122. DOI:10.1002/ chin.200218292.
[27] CROISIER E, REMPT M, POHNERT G. Survey of volatile oxylipins and their biosynthetic precursors in bryophytes[J]. Phytochemistry, 2010, 71(6): 574-580.
[28] RICHARD S, MARA N, BERTEA C M, et al. Truffle volatiles inhibit growth and induce an oxidative burst in Arabidopsis thaliana[J]. New Phytologist, 2007, 175(3): 417-424. DOI:10.1111/j.1469-8137.2007.02141.x.
[29] BENDERA M, EKESI S, NDUNGU M, et al. A major host plant volatile, 1-octen-3-ol, contributes to mating in the legume pod borer, Maruca vitrata (Fabricius) (Lepidoptera: Crambidae)[J]. Science of Nature, 2015, 102(9/10): 1-10. DOI:10.1007/s00114-015-1297-0. [30] OIKAWA P Y, LERDAU M T. Catabolism of volatile organic compounds influences plant survival[J]. Trends in Plant Science, 2013, 18(12): 695-703. DOI:10.1016/j.tplants.2013.08.011.
Analysis of Fatty Acids and Volatile Organic Compounds of Pyropia haitanensis under Heat Shock at Different Temperatures
SONG Yue, ZHUO Xin, CHEN Juanjuan*, LUO Qijun, YANG Rui, CHEN Haimin, YAN Xiaojun
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
To understand the changes in the fatty acid pro le of Pyropia haitanensis under heat shock stre ss, the fatty acids (FAs) and volatile organic compounds (VOCs) of P. haitanensis under heat shock stress at different temperatures were analyzed by gas chromatography-mass spectrometry (GC-MS). The results showed that after subjecting P. haitanensis to heat shock at 20 (control), 25, 28 and 35 ℃, a total of 13 total fatty acids (TFAs), 14 free fatty acids (FFAs) and 32 VOCs were identi ed. The contents of saturated fatty acids (SFAs) and VOCs were increased with increasing heat shock temperature up to 28 ℃, whereas the contents of unsaturated fatty acids (UFAs) and FFAs were decreased. As the heat shock temperature further rose to 35 ℃, the contents of TFAs, FFAs and VOCs were decreased. This study may be helpful to understand the mechanism of heat resistance of P. haitanensis and its cultivation.
Pyropia haitanensis; heat shock; fatty acid; volatile organic compounds; gas chromatography-mass spectrometry
10.7506/spkx1002-6630-201710032
TS252.53
A
1002-6630(2017)10-0191-08
宋悦, 卓馨, 陈娟娟, 等. 不同胁迫温度条件下坛紫菜中脂肪酸和挥发性物质分析[J]. 食品科学, 2017, 38(10): 191-198.
DOI:10.7506/spkx1002-6630-201710032. http://www.spkx.net.cn
SONG Yue, ZHUO Xin, CHEN Juanjuan, et al. Analysis of fatty acids and volatile organic compounds of Pyropia haitanensis under he at shock at different temperatures[J]. Food Science, 2017, 38(10): 191-198. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201710032.http://www.spkx.net.cn
2016-07-30
浙江省自然科学基金项目(LY17D060002);2015年度国家星火计划项目(2015GA701027);
浙江省科技厅公益项目(2016C37090);宁波大学王宽诚幸福基金资助项目
宋悦(1993—),女,硕士研究生,研究方向为分析化学。E-mail:306574925@qq.com
*通信作者:陈娟娟(1981—),女,副教授,博士,研究方向为分析化学。E-mail:chenjuanjuan@nbu.edu.cn

