甘薯酒发酵工艺优化及香气成分分析
陈 燕,李小惠,张惟广
甘薯酒发酵工艺优化及香气成分分析
陈 燕,李小惠,张惟广*
(西南大学食品科学学院,重庆 400715)
以甘薯为原料,经去皮、打浆、液化、麦芽糖化后制得甘薯浆,并以甘薯浆为原料酿酒。在单因素优化基础上,选取发酵温度、酵母添加量和发酵初始pH值为影响因素,以酒精体积分数和总酯含量为响应值,应用Box-Behnken试验设计建立数学模型并进行响应面分析。并用气相色谱-质谱联用技术对甘薯酒中的香气成分进行检测分析。结果表明:甘薯酒的最佳发酵工艺条件 为黄酒专用高活性干酵母添加量0.15%、发酵初始糖含量2 4%、发酵温度21.5 ℃、发酵初始pH4.0。在此条件下,甘薯酒的酒精体积分数为14.25%,总酯含量为372.41 mg/L;甘薯酒中共检测出54 种香气物质,以醇类和酯类为主;酒体呈均匀的金黄色,具有甘薯的薯香味和麦芽的麦香味。
甘薯酒;工艺优化;酒精体积分数;总酯含量;香气成分
甘薯营养丰富,除富含淀粉、可溶性多糖、维生素和氨基酸外,粗纤维及钙、铁、磷等矿物质成分也很丰富[1],具有预防心血管疾病、抗癌、维持视力、抗菌、抗氧化、提高免疫力等作用[2-3]。丰富的营养和药用价值使甘薯受到越来越多人的青睐。但目前甘薯加工仍以传统淀粉、粉丝等为主,占甘薯加工制品的70%~80%[4],还有些用作饲料,利用价值不高。国外甘薯食品的开发已经很多,如日本用甘薯加工出不用掺加任何果汁的饮料,不但有良好的口感、鲜美的色泽,其营养价值还很高,此外,日本烧酒的主要原料也是甘薯,有着醇甜柔和、自然协调、余味爽净的特点,还具有促进血液循环、溶血栓等功效。国内对甘薯的研究也日益增多,李佑稷等[5]用甘薯制得营养保健、风味独特的甘薯饮料,全亮等[6]用苹果和甘薯酿造出兼具苹果清香和甘薯香的果粮醋,黄建蓉等[7]以紫薯和麦芽为原料制备出麦芽香味、薯味浓郁的复合饮料,韩晓鹏等[8]用紫甘薯制得感官色泽酷似红葡萄酒的紫甘薯红酒等。因此,将甘薯作为酿酒原料可以使其得到更好地利用并增加附加值,具有 广阔的市场前景。麦芽富含淀粉酶和蛋白酶等多种酶类,同时含有麦芽糖、麦芽三糖、葡萄糖、蔗糖、果糖、糊精等多种糖类物质,以及含氨基酸、多肽、蛋白质等多种含氮物质[9],是很好的植物类糖化剂。有研究表明,麦芽作为糖化剂比工业糖化酶制剂更能“纯净”发酵液的组分,使得酒的品质更好[10]。
本实验采用酶解后的甘薯浆为原料发酵,采用Box-Behnken试验优化得到制备甘薯酒的最优酿造条件,在此条件下得到兼具薯香和麦芽清香的营养丰富、风味独特的甘薯酒,并对甘薯酒中的香气成分进行检测。实验旨在为实现甘薯资源的开发利用及甘薯酒新产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
选用市售新鲜、无病虫害的甘薯;麦芽 永顺麦芽公司;选用颗粒饱满,无虫害无霉变的麦芽,在高速粉碎机中粉碎后过60 目筛,备用。
α-淀粉酶(酶活力>3 700 U/g) 北京奥博星生物技术有限公司;黄酒专用酒高活性干酵母、耐高温酿酒高活性干酵母、果酒SY酵母、果酒RW酵母 安琪酵母股份有限公司;酵母D254、2323、K1 烟台帝伯士有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
QP2010型气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪 日本岛津公司;固相微萃取(solid phase microextraction,SPME)装置(手动进样器和50/30 μm DVB/CAR/PDMS萃取头) 美国Supelco公司;722-P可见分光光度计 上海现科仪器有限公司;FW-177粉碎机 天津市泰斯特仪器有限公司;SL602N型电子天平 上海民桥精密科学仪器有限公司;PHS-3E酸度计 上海仪电科学仪器股份有限公司;HH-W420数显三用恒温水箱 江苏省金坛市荣华仪器制造有限公司;LHS-150SC恒温恒湿培养箱 上海齐欣科学仪器有限公司;PSX-280A型手提高压灭菌锅 上海申安医疗器械厂;PAL-1手持糖度仪 广州市爱宕科学仪器有限公司;R2070飞利浦搅拌机 飞利浦电子香港有限公司。
1.3 方法
1.3.1 甘薯酒生产的基本工艺流程[11]

操作要点:将洗净后的甘薯去皮后切片,蒸熟糊化30 min后冷却,再与水按1∶2(m/V)比例打浆[12],接着向甘薯浆中添加一定比例的α-淀粉酶进行液化,液化结束后灭酶;麦芽打粉后过60 目筛,再与水按1∶4(m/V)比例混合,于45 ℃水浴中糊化40 min[7];将液化后的甘薯浆和糊化后的麦芽按设定比例混合均匀后进行糖化,糖化结束后灭酶;向糖化结束后的甘薯浆中(可溶性固形物含量(soluble solids content,SSC)为12.0%)添加已活化的酵母并在适宜条件下发酵;7 d主发酵完成后过滤、经巴氏灭菌得到甘薯酒成品。
1.3.2 理化指标的测定
酒精体积分数测定:酒精计法[13];总酸含量测定:酸碱中和滴定法,以酒石酸计;还原糖含量测定:3,5-二硝基水杨酸法[14],以葡萄糖计;SSC测定:手持糖度仪;总酯含量测定:指示剂法[15];干浸出物含量测定:参照GB/T 15038—2006《干浸出物测定方法》;细菌总数测定:参照GB/T 4789.2—2008《食品卫生微生物学检验 菌落总数测定》;大肠菌群测定:参照GB/T 4789.3—2008《食品卫生微生物学检验 大肠菌群计数》。
1.3.3 干酵母的活化[16]
将一定量的干酵母,加入含葡萄糖5 g/100 mL的无菌糖水中,38 ℃搅拌活化约30 min,直至糖水中出现大量小气泡为止。
1.3.4 感官评价[17]

表 1 甘薯酒感官评价标准Table 1 Criteria for sensory evaluation of sweet potato wine
参考葡萄酒干酒的感官要求和评分标准,制定出适合甘薯酒的感官评分标准。采用观察品尝的方法,挑选10 位受过相关培训的感官评定人员参加品尝实验,并参照评分标准进行综合打分,取平均分为最终感官评分值。甘薯酒评分标准见表1。
1.3.5 甘薯酒发酵条件的单因素试验设计
1.3.5.1 发酵方式的确定
选用带渣发酵和清汁发酵2 种发酵方式。调整糖化后的甘薯浆糖含量为22%,pH值为4.5,添加0.1%的黄酒专用高活性干酵母,22 ℃条件下发酵7 d。主发酵结束后过滤,测定并比较发酵液的酒精体积分数、总酸含量、还原糖含量、SSC和总酯含量并结合感 官评分,确定最佳发酵方式。
1.3.5.2 酵母菌品种的确定
调整糖化后的甘薯浆糖含量为22%,pH值为4.5,分别添加0.1%的黄酒专用高活性干酵母、耐高温高活性干酵母、果酒SY、果酒RW、K1、2323、D254,22 ℃条件下发酵7 d。主发酵结束后过滤,测定并比较发酵液的酒精体积分数、总酸含量、还原糖含量、SSC和总酯含量并结合感官评分,确定最适酿酒酵母。
1.3.5.3 初始糖含量的确定
调整糖化后甘薯浆的糖含量分别为20%、22%、24%、26%、28%,pH值为4.5,添加0.1%的黄酒专用高活性干酵母,22 ℃条件下发酵7 d。主发酵结束后过滤,测定并比较发酵液的酒精体积分数、还原糖含量、SSC和总酯含量并结合感官评分,确定最适初始糖含量。
1.3.5.4 发酵初始pH值的确定
调整糖化后的甘薯浆糖含量为22%,分别调节pH值为3.0、3.5、4.0、4.5、5.0、5.5,添加 0.1%的黄酒专用高活性干酵母,22 ℃条件下发酵7 d。主发酵结束后过滤,测定并比较发酵液的酒精体积分数、还原糖含量、SSC和总酯含量并结合感官评分,确定最适发酵初始pH值。
1.3.5.5 酵母菌添加量的确定
调整糖化后的甘薯浆的糖含量为22%,pH值为4.5,分别添加0.05%、0.10%、0.15%、0.20%、0.25%的黄酒专用高活性干酵母,22 ℃条件下发酵7 d。主发酵结束后过滤,测定并比较发酵液的酒精体积分数、还原糖含量、SSC和总酯含量并结合感官评分,确定最适酵母菌添加量。
1.3.5.6 发酵温度的确定
调整糖化后甘薯浆的糖含量为22%,pH值为4.5,添加0.1%的黄酒专用高活性干酵母,分别在16、19、22、25、28、31 ℃条件下发酵7 d,主发酵结束后过滤,测定并比较发酵液的酒精体积分数、还原糖含量、SSC和总酯含量并结合感官评分,确定最适发酵温度。
1.3.6 甘薯酒发酵工艺优化
在单因素试验基础上,采用Design-Expert V8.0.6软件,根据Box-Behnken试验设计原理[18],选择发酵温度、酵母添加量、发酵初始pH值这3 个影响甘薯酒发酵的主要因素为响应变量,以酒精体积分数和总酯含量为响应值进行响应面优化,进行三因素三水平试验,因素水平设计见表2。
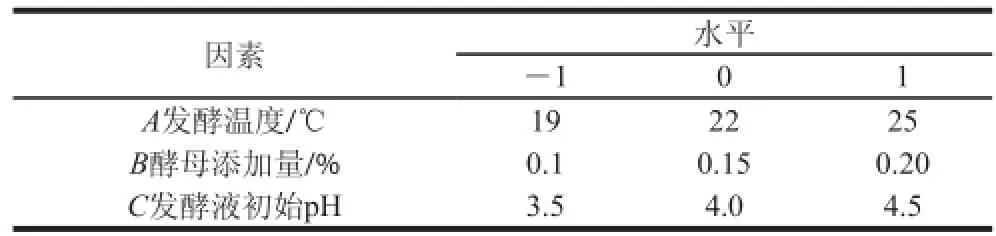
表 2 响应面试验因素水平设计Table 2 Factors and levels used in Box-Behnken design
1.3.7 甘薯酒香气成分测定
采用顶空-SPME法对甘薯酒中的香气成分物质进行检测。取8 mL甘薯酒样于20 mL样品瓶中,加入2 g NaCl后用聚四氟乙烯隔垫密封,45 ℃水浴中平衡10 min后将萃取针插入样品瓶顶空部分吸附40 min,插入到GC进样口热解吸5 min,进行GC-MS分析[19]。
GC条件:DB-5MS石英毛细管柱(30 m×0.25 mm,0.25 μm);进样口温度230 ℃;程序升温:35 ℃保持4 min,以5 ℃/min升至55 ℃,保持2 min,再以8 ℃/min升至120 ℃,再以10 ℃/min升至230 ℃,保持4 min;载气为氦气,流速1 mL/min,压力47.7 kPa;分流比5∶1,溶剂延迟3 min[20]。
MS条件:电子电离源;离子源温度230 ℃;电子能量70 eV;接口温度220 ℃;采集模式:全扫描;四极杆温度150 ℃;质量扫描范围m/z 40~450;检索谱库为NIST质谱数据库,扫描速率769 u/s。
1.3.7.1 香气成分的定性分析[21]
由GC-MS分析所得的质谱图经计算机自带的NIST 08谱库检索,并结合保留指数(retention index,RI)进行定性,按公式(1)计算RI:

式中:tx、tn和tn+1分别为被分析组分、碳原子数处于n和n+1的正构烷烃(tn<tx<tn+1)流出峰的保留时间/min[22]。1.3.7.2 香气成分的定性定量分析
采用内标法(2-辛醇)进行半定量分析,确定甘薯酒中各香气成分的含量。内标2-辛醇在萃取体系中质量浓度为1.225 mg/L,校正因子为1,通过比较待测组分与内标物峰面积的比值,按公式(2)计算出待测香气成分的含量。

式中:f为各香气成分对内标物的校正因子。
1.4 数据处理
实验的每组处理均重复3 次,结果以±s表示。采用Excel 2010对单因素试验的数据进行处理,SPSS 17.0进行数据统计分析,方差分析法进行显著性分析。Design-Expert V8.0.6软件进行响应面试验设计及结果分析。
2 结果与分析
2.1 单因素处理对甘薯酒基本成分的影响2.1.1 发酵方式对甘薯酒基本成分的影响由表3可知,2 种发酵方式酿制甘薯酒的总酸差异不大,这与其相同的发酵条件有很大关系,带渣发酵的酒精体积分数较高于清汁发酵,且还原糖含量和SSC更低,说明带渣发酵更彻底。此外,带渣发酵总酯含量和感官评分更高,这是因为带渣发酵能更多的保留甘薯和麦芽中的风味成分,口感更加饱满醇厚[23]。同时带渣发酵的操作相比清汁发酵更简单,更适合工业中规模化生产。故采用带渣发酵的方式进行甘薯酒发酵。

表 3 发酵方式对甘薯酒品质的影响Table 3 Quality attribute of sweet potato wines fermented by different methods
2.1.2 酵母菌品种对甘薯酒基本成分的影响

表 4 酵母品种对甘薯酒品质的影响Table 4 Effect of different yeast inoculums on the quality of sweet potato wine
酵母对酒的品质有很大的影响,不同酵母的发酵速率不同,且还原糖的利用程度也不一样,从而发酵得到酒的风味品质有很大的差异[24]。由表4可知,7 种酵母菌在相同条件下进行发酵,酵母2323产酒精能力最弱,酒精体积分数仅为12.1%,总酯含量也较低,感官评分得出风味最差,其他6 种酵母的产酒能力相当,但总酯和总酸含量有较大差异,其中黄酒干酵母的酒精体积分数较高、总酯含量最高、还原糖含量和SSC较低,发酵最彻底,感官评分得出其品质最好。故选择黄酒干酵母作为甘薯酒酒精发酵的酵母。
2.1.3 发酵初始糖 含量对甘薯酒基本成分的影响
由表5可知,随着初始糖含量的增加,酒精体积分数也随着上升。当初始糖含量较低时,酵母可利用的可发酵性糖含量较少,发酵提前终止使得酒精体积分数较低,不利于风味物质的积累;当糖含 量过高时,高糖含量会对酵母菌产生基质抑制作用,从而导致启酵速率变慢[25];糖含量高于28%时,由于发酵液渗透压大,酵母的基质抑制作用变强,不利于酵母的正常生长和代谢,糖转化为酒精不完全,且高糖度发酵得到酒精体积分数较高的酒,高酒精体积分数对酵母会产生产物反馈抑制作用,导致还原糖高,口感变差[26]。故选择24%为最适发酵初始糖含量。
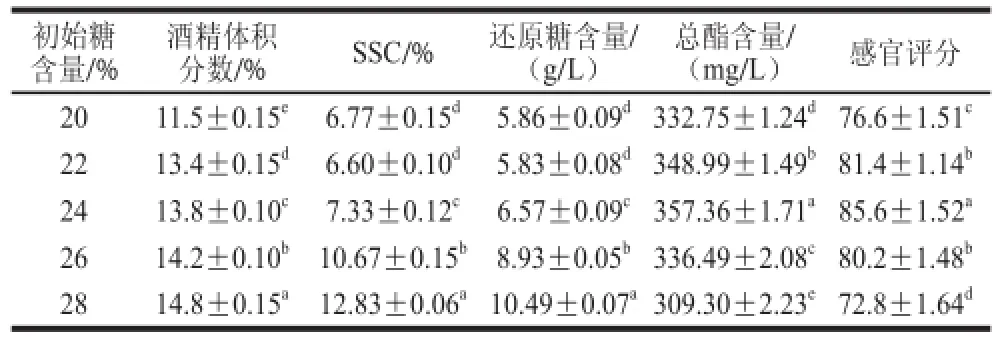
表 5 初始糖含量对甘薯酒品质的影响Table 5 Effect of initial sugar concentration on the quality of sweet potato wine
2.1.4 发酵初始pH值对甘薯酒基本成分的影响
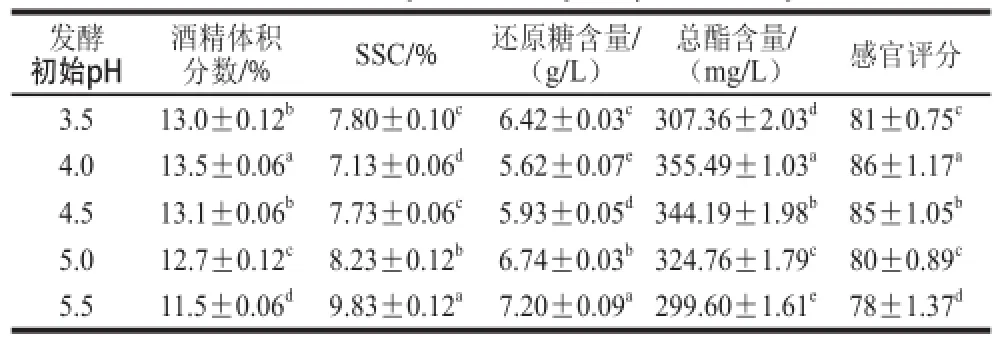
表 6 发酵初始pH值对甘薯酒品质的影响Table 6 Effect of initial pH on the quality of sweet potato wine
由表6可知,随着发酵初始pH值的增加,甘薯酒的酒精体积分数和总酯含量呈现先增后减的趋势,SSC和还原糖含量为先减后增的趋势,且当发酵液初始pH值为4.0时甘薯酒的酒精体积分数和总酯含量均最高。当发酵初始pH值较低时,在抑制杂菌生长的同时酵母菌的生长代谢也受到影响;而当发酵初始pH值太高时,酒体容易感染杂菌且酵母菌的生长也会受到抑制,糖的转化受到抑制从而酒精产量降低,风味物质积累 减少,品质下降[27]。故确定pH 4.0为最适发酵初始pH值。
2.1.5 酵母添加量对甘薯酒基本成分的影响
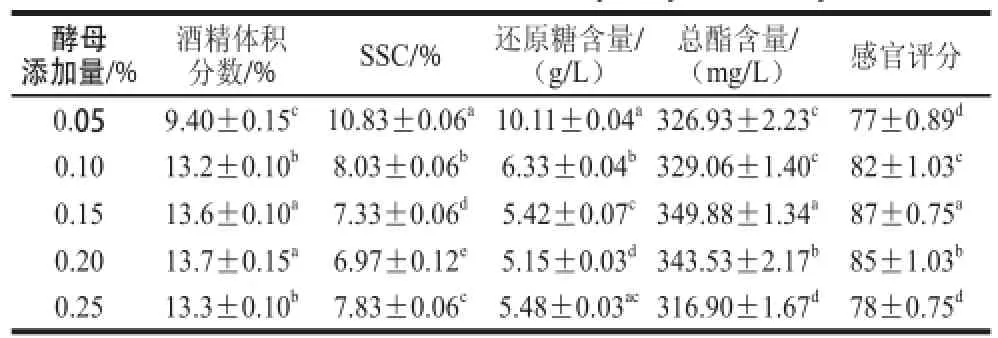
表 7 酵母添加量对甘薯酒品质的影响Table 7 Effect of inoculum size on the quality of sweet potato wine
由表7可知,当酵母添加量低于0.2%时,甘薯酒的酒精体积分数随酵母菌添加量的增加而增大,超过0.2%时酒精体积分数不增反减。酵母添加量过低时,发酵缓慢、易感染杂菌,原料利用不完全使得酒精含量低,SSC、还原糖量较高;而酵母添加量过大时,酵母菌短时间内大量繁殖消耗发酵液中的糖,从而减少了用于酒精生产的底物,酒精含量降低[28];此外,有害代谢产物的产生会使得菌体的生长环境恶化,细胞解体,细胞成分溶解到酒中,酒的品质下降[29]。故确定最适酵母添加量为0.15%。
2.1.6 发酵温度对甘薯酒基本成分的影响

表 8 发酵温度对甘薯酒品质的影响Table 8 Effect of fermentation temperature on the quality of sweet potato wine
由表8可知,当发酵温度低于25 ℃时,总酯含量和酒精体积分数随着温度的升高而增加,营养物质利用较完全;发酵温度高于25 ℃时,总酯含量和酒精含量随着温度的升高而降低。温度较低时,发酵前期酵母菌代谢缓慢,无法充分利用甘薯浆中的糖分进行酒精发酵,酒精体积分数较低,发酵时间长;而发酵温度过高时,酵母菌快速繁殖,不易控制,衰老快,挥发性香气较多,同时杂菌污染的可能性增加,不利于酒精的产生且酒的品质也会下降[30]。故确定较佳发酵温度为22 ℃。
2.2 甘薯酒发酵工艺参数的响应面试验优化
2.2.1 工艺模型建立及其显著性检验
结合单因素试验结果,利用Design-Expert V8.0.6软件,根据Box-Behnken试验设计原理进行三因素三水平试验,以酒精体积分数和总酯含量为响应值,通过响应面法进行优化,得到甘薯酒最佳工艺条件,如表9所示。
通过Design-Expert V8.0.6软件对表9的试验结果进行多元回归拟合后,确立了以酒精体积分数和总酯含量为目标函数的二次多项回归方程,结果见表10。2 个数学拟合模型Y1和Y2的P值均小于0.000 1,表明二次项方程模型极显著;失拟项在0.05水平上均不显著(P=0.218 5>0.05和P=0.132 4>0.05),表明试验结果和数学模型拟合良好,可用这2 个模型推测试验结果;模型的相关系数R2分别为0.994 6和0.995 2,表明方程拟合程度较好。

表 9 响应面试验设计方案及结果Table 9 Results of Box-Behnken design

表 10 甘薯酒酒精体积分数及总酯含量回归模型拟合结果Table 10 Significance test of the fitted regression models

表 11 以酒精体积分数和总酯含量为响应面结果的方差分析Table 11 Analysis of variance of the contents of alcohol and total ester with various fermentation parameters
为了检验方程的有效性,对上述回归模型进行方差分析,如表11所示。各发酵因素间存在交互作用的影响而不是简单的线性关系。其中,酒精体积分数模型的一次项A极显著,而B、C不显著;交互项AB显著,AC极显著,BC不显著;二次项A2、B2、C2均极显著。总酯模型的一次项A极显著,B、C均不显著;交互项AB极显著,AC显著,BC不显著;二次项A2、B2、C2均极显著。F值的大小代表了各因素对酒精体积分数影响的强弱,F值越大,说明影响作用越强[31]。因此,由F值的大小可以判断,各因素对酒精体积分数和总酯的影响大小顺序均为发酵温度>发酵初始pH值>酵母添加量。
2.2.2 各因素交互作用的响应面图

图 1 两因素交互对酒精体积分数及总酯含量影响的响应面图Fig. 1 Response surface plots showing the effects of various factors on the contents of alcohol and total ester
图1 中较直观地反映了任何2 个因素的交互影响,以及各因素对2 个响应值的影响。响应面坡度大表明因素对响应值影响大,等高线密集呈椭圆形表示两因素之间的交互作用比较显著,而坡度平缓、等高线呈圆形则与之相反。由图1可以看出,在交互作用对甘薯酒的酒精体积分数和总酯含量的影响中,发酵温度和酵母添加量以及发酵温度和发酵初始pH值的交互作用较为显著。
2.2.3 验证实验结果
经软件分析得到以酒精体积分数为响应值的最优发酵工艺参数为发酵温度21.44 ℃、酵母添加量0.15%、发酵初始pH 3.99,以总酯含量为响应值的最优发酵工艺参数为发酵温度21.09 ℃、酵母添加量0.15%、发酵初始pH 3.99。考虑到实际操作的可行性和两组温度间差异不大,将最优工艺条件修正为发酵温度21.5 ℃、酵母添加量0.15%、发酵初始pH值为4.0。在此工艺条件下进行3 次平行验证实验,取得平均值。实际得到甘薯酒酒精体积分数为14.25%,与预测值14.28%相差0.03%,总酯含量为372.41 mg/L,与预测值372.53 mg/L相差0.12 mg/L,表明实际值与预测值均相差不大。以上结果说明该模型能较好反映甘薯酒发酵条件与酒精体积分数和总酯含量的关系,因此采用响应面法优化甘薯酒发酵工艺的结果可靠。
2.3 甘薯酒的成分分析
2.3.1 甘薯酒香气成分分析

表 12 甘薯酒中20 种主要香气物质Table 12 Twenty main aroma components of sweet potato wine
采用CG-MS对甘薯酒的香气成分进行检测并分析,共检测出54 种香气物质,按照峰面积归一化法定量,主要的香气成分见表12。除烷烃外相对含量在0.1%以上的20 种香气成分,这些物质的相对含量之和占总香气物质的88.13%。
由表1 2可知,甘薯酒样品中主要的香气物质是醇酯类物质,醇类和酯类物质含量分别为(22.78±0.91) mg/L和(8.33±1.09) mg/L。其中醇类物质中以异戊醇、2-甲基丁醇和苯乙醇为主。酯类物质中以辛酸乙酯、癸酸乙酯、乙酸苯乙酯和月桂酸乙酯为主。异戊醇具有苹果白兰地香气和辛辣味,苯乙醇具有玫瑰香、紫罗兰香、茉莉花香、果香等多种风味[32],芳樟醇有着强烈的铃兰香气。辛酸乙酯具有水果、白兰地酒香味、蘑菇、椰子、奶油、脂肪味[33],癸酸乙酯具有果香和白兰地酒香,两者结合使得本格烧酒具有很强的白兰地酒味。此外,乙酸异戊酯具有水果香味,月桂酸乙酯具有花香、果香和肥皂香气;乙酸苯乙酯具有蜜甜香、玫瑰和茉莉花香。这些醇类和酯类物质赋予甘薯酒独特的香气特征。
2.3.2 甘薯酒理化成分分析

表 13 甘薯酒的主要理化成分分析Table 13 Analysis of main components of sweet potato wine
对优化工艺条件制得的甘薯酒进行理化成分检测,见表13。SO2含量为16.44 mg/L符合国家标准,细菌总数小于21 CFU/mL,大肠杆菌未检出,其他致病菌未检出。
2.4 感官指标分析
色泽:金黄色,透明清亮,光泽度好;口味:清爽,醇厚丰满,柔和怡人;香气:甘薯薯香浓厚,麦芽清香,香气协调且无异味;典型性:酒性协调,酒体完整,典型性突出。
3 结 论
通过单因素试验和Box-Behnken设计试验,采用响应面分析法优化甘薯酒的发酵工艺条件,确定的优化工艺条件参数为:带渣发酵方式、发酵温度21.5 ℃、黄酒专用高活性干酵母添加量0.15%、发酵初始pH 4.0。在此条件下发酵得到的甘薯酒酒精体积分数为14.25%,总酯含量可达372.41 mg/L。在本实验范围内建立的二次线性回归模型准确有效,可用来预测设定条件范围内及其周围的甘薯酒发酵工艺参数,对实验的拟合性较好,有一定的实用价值。成品甘薯酒中共检测出54 种香气成分,醇类以异戊醇、2-甲基丁醇和苯乙醇为主,酯类中辛酸乙酯、癸酸乙酯、乙酸苯乙酯等居多,多种香气成分的存在,赋予了甘薯酒独特的香气。发酵所得的甘薯酒,酒体呈金黄色,澄清透明,香气浓郁,具有薯 香和麦香的混合香气,口感绵延柔和,风味独特,是一种营养丰富的保健酒。
[1] 王关林, 黄红光, 吴海东, 等. 甘薯抗氧化物的分离提取及其生物活性研究[J]. 营养学报, 2005, 27(6): 479-482. DOI:10.13325/j.cnki. acta.nutr.sin.2005.06.013.
[2] 朱旭霞, 刘莉莎, 何素兰, 等. 保健甘薯的功能及产品开发研究[J]. 中国食物与营养, 2014, 20(11): 34-36. DOI:10.3969/j.issn.1006-9577.2014.11.008.
[3] HUANG D J, CHEN H J, HOU W C, et al. Sweet potato (Ipomoea batatas[L.]Lam Tainong 57) storage root mucilage with antioxidant activities in vitro[J]. Food Chemistry, 2006, 98(4): 774-781. DOI:10.1016/j.foodchem.2005.07.018.
[4] 杜连启. 甘薯综合加工技术[M]. 北京: 中国轻工业出版社, 2014: 6.
[5] 李佑稷, 杨谷良, 顾仁勇. 甘薯饮料的工艺研究[J]. 食品工业科技, 2002, 23(10): 59-61. DOI:10.3969/j.issn.100 6-9577.2014.11.008.
[6] 全亮, 刘芳, 胡彪, 等. 苹果甘薯复合果粮醋发酵工艺研究[J]. 中国酿造, 2010, 29(4): 170-172. DOI:10.3969/ j.issn.0254-5071.2010.04.055.
[7] 黄建蓉, 王志江, 徐金瑞, 等. 紫薯麦芽复合饮料加工工艺的研究[ J]. 食品工业科技, 2012, 33(14): 247-249. DOI:10.13386/j.issn1002-0306.2012.14.0 72.
[8] 韩晓鹏, 牟德华, 赵英莲, 等. 紫甘薯红酒酿造工艺优化及成分分析[J]. 食品科学, 2015, 36(17): 201-206. DOI:10.7506/ spkxl002-6630-201517038.
[9] 管敦仪. 啤酒工业手册[M]. 北京: 中国轻工业出版社, 2007.
[10] 王克菲. 伏特加酒与白酒风格 的比较[D]. 大连: 大连工业大学, 2008.
[11] 杨雅利, 阚建全, 沈海亮, 等. 紫甘薯酒发酵工艺条件的优化[J].食品科学, 2012, 33(3): 157-162.
[12] 张晓莲, 赵东, 袁杰彬, 等. 紫薯酒发酵条件优化及品质特征研究[J].酿酒科技, 2015(11): 76-80; 84. DOI:10.13746/j.Njkj.2015177.
[13] 郭新光, 马佩选, 王晓红, 等. 葡萄酒、果酒通用分析方法: GB/T 15038—2006[S]. 北京: 中国标准出版社, 2006.
[14] 韩德权, 章佳佳. DNS法在普鲁兰多糖发酵液中糖测定的研究[J].食品工业科技, 2008, 29(2): 285-286; 290. DOI:10.13386/ j.issn1002-0306.2008.02.017.
[15] 郭新光, 康永璞, 卢中明, 等. 白酒分析方法: GB/T 10345—2007[S].北京: 中国标准出版社, 2007.
[16] TRACEY E, DIMITRA L, KEVIN H, et al. Stable isotope dilution analysis of wine fermentation products by HS-SP ME-GC-MS[J]. Analytical and Bioanalytical Chemistry, 2005, 381(22): 937-947. DOI:10.1007/s00216-004-2992-4.
[17] 苏凤贤, 曹旭峰, 汪峰, 等. 人参果酒酿造中酿酒酵母的选择[J].食品与发酵工业, 2010, 36(4): 130-135. DOI:10.13995/ j.cnki.11-1802/ts.2010.04.019.
[18] KHAJEH M. Optimization ofmicrowave-assisted extraction procedure for zinc and copper determination in food samples by Box-B ehnken design[J]. Journal of Food Composition and Analysis, 2009, 22(4): 343-346. DOI:10.1016/j.jfca. 2008.11.017.
[19] 张明霞, 赵旭娜, 杨天佑, 等. 顶空固相微萃取分析白酒香气物质的条件优化[J]. 食品科学, 20 11, 32(12): 49-53.
[20] 李纪涛, 蒋一鸣, 束俊霞, 等. 不同酿酒酵母发酵的紫薯糯米酒香气成分分析[J]. 食品科学, 2014, 35(16): 202-207. DOI:10.7506/ spkx1002-6630-20 1416039.
[21] FAN W L, QIAN M C. Characterization of aroma compounds ofChinese Wuliangye and Jiann anchun liquors by aroma extract dilu tion analysis[J]. Journal of Agricultural and Food Chemistry, 2006, 54(2): 2695-2704. DOI:10.1021/jf052635t.
[22] ZHAO Y, XU Y, LI J, et al. Profile of volatile compounds in 11 brandi es by headspace solid-phase microextraction followed by gas chromatography-mass spectrometry[J]. Journal of Food Science, 2009,74(2): 90-99. DOI:10.1111/j.1750-3841.2008.01029.x.
[23] 杨旭, 陈亮, 辛秀兰, 等. 果汁发酵和带渣发酵蓝靛果酒香气成分分析[J]. 食品科学, 2014, 35(12): 115-119. DOI:10.7506/splk1002-6630-201412022.
[24] SATORA P, TUSZY T. Influence of indigenous yeasts on the fermentation and volatile profile of plum brandies[J]. Food Microbiology, 2010, 27(3): 418-424. DOI:10.1016/j.Fm.2009.12.005.
[25] 钟政昌, 王婷, 高根升, 等. 自然温度下光核桃果酒主发酵工艺优化[J].食品科学, 2012, 33(13): 197-201.
[26] 何伟, 张富县, 艾乃吐拉, 等. 杏皮渣白兰地酒精发酵最佳工艺条件的研究[J]. 酿酒科技, 2011(11): 23-24. DOI:10.13746/j.njkj.2011.11.019.
[27] 袁辉, 白云凤, 陈青青. 衢州柑桔果酒生产工艺的研究[J]. 中国酿造, 2010, 29(1): 158-161. DOI:10.3969/j.issn.0254-5071.2010.01.056.
[28] 李加兴, 陈双平, 梁先长, 等. 猕猴桃干型果酒发酵工艺优化[J].食品科学, 2010, 31(22): 504-507.
[29] 杨启贤, 胡曰德. 南水梨白兰地的研制[J]. 酿酒科技, 2010(1): 63-64; 69. DOI:10.13746/j.njkj.2010.01.016.
[30] 文连奎, 张微, 王立芳, 等. 人参发酵酒加工工艺优化[J]. 食品科学, 2010, 31(22): 508-511.
[31] 顾英, 韩凤丽, 王洪洋. 响应面法优化红薯叶类黄酮提取工艺的研究[J]. 食品工业科技, 2012, 33(3): 286-289; 333. DOI:10.13386/ j.issn1002-0306.2012.03.022.
[32] GILBERT J M, YOUNG H, BALL R D, e t al. Volatile flavor compounds affecting consumer acceptability of kiwi fruit flavor[J]. Journal of Sensory Studies, 1996, 11(3): 247-259. DO I:10.1111/j.1745-459X.1996.tb00044.
[33] 林翔云. 香精香料辞典[M]. 北京: 化学工业出版社, 2006.
Optimization of Fermentation of Sweet Potato Wine and Analysis of Aroma Components
CHEN Yan, LI Xiaohui, ZHANG Weiguang*
(College of Food Science, Southwest University, Chongqing 400715, China)
Sweet potato puree was obtained from sweet potato by peeling, pulping and liquefaction, and sacchari ed after addition of gelatinized malt for wine production. By one-factor-at-a-time method, fermentation temperature, inoculum size of yeast and initial pH were chosen as the major factors for further optimization by mathematical modeling usi ng Box-Behnken design and response surface analysis. The contents of alcohol and total esters were selected as response variables. The optimal fermentation conditions were determined as follows: initial sugar content, 24%; inoculum size of active dry yeast, 0.15%; and initial pH, 4.0. Under these optimal conditions, the contents of alcohol and total esters were 14.25% and 372.41 mg/L, respectively. Fifty-four aroma compounds were identi ed from sweet potato wine, mainly including alcohols and esters. The wine had a uniform golden color and itsavor was identical to that of both sweet potato and wheat malt.
sweet potato wine; process optimization; alcohol content; total esters; aroma components
10.7506/spkx1002-6630-201710026
TS261.4
A
1002-6630(2017)10-0155-07
陈燕, 李小惠, 张惟广. 甘薯酒发酵工艺优化及香气成分分析[J]. 食品科学, 2017, 38(10): 155-161. DOI:10.7506/ spkx1002-6630-201710026. http://www.spkx.net.cn
CH EN Yan, LI Xiaohui, ZHANG Weiguang. Optimization of fermentation of sweet potato wi ne and analysis of aroma c omponents[J]. Food Science, 2017, 38(10): 155-161. (in Chinese with English abstract)
10.7506/spkx1002-6630-201710026.http://www.spkx.net.cn
2016-08-18
陈燕(1990—),女,硕士研究生,研究方向为食品发酵工程。E-mail:chenyan0908@126.com*
张惟广(1963—),男,副教授,硕士,研究方向为食品发酵工程。E-mail:470184967@qq.com

