洋河大曲中螺甾醇健康功能因子研究
米 娇,陈 翔,吴林蔚,杨 勇,杨 涛,甘广东,庄名扬,周新虎,李国友
(1.中国科学院成都生物研究所,四川成都610041; 2.江苏洋河酒厂股份有限公司,江苏宿迁223800)
洋河大曲中螺甾醇健康功能因子研究
米 娇1,陈 翔2,吴林蔚1,杨 勇2,杨 涛1,甘广东2,庄名扬1,周新虎2,李国友1
(1.中国科学院成都生物研究所,四川成都610041; 2.江苏洋河酒厂股份有限公司,江苏宿迁223800)
白酒是我国最重要的传统发酵食品之一,在世界范围内享有很高的声誉。曲药被称为酒之骨,决定了白酒的风格和品质,对白酒酿造起着举足轻重的作用。目前,主要采用顶空-固相微萃取与气质联用的方法研究大曲中低沸点香味物质,对大曲中高沸点难挥发成分研究鲜有报道。本研究以洋河酒厂提供的大曲为材料,利用95%vol乙醇进行提取,结合正相硅胶、反相硅胶、Sephadex LH-20等多种色谱技术,从大曲中分离得到6个螺甾醇类化合物,应用核磁共振、质谱等波谱技术分别将其鉴定为sarsasapogenin(1)、7α-hydroxysarsasapogenin(2)、yamogenin(3)、diosgenin(4)、neotigogenin(5)和tigogenin(6)。本研究首次从洋河大曲中发现了具有广泛生理活性的螺甾醇类小分子,为揭示中国白酒的健康功能因子奠定了基础。
大曲; 化学成分; 活性成分; 色谱技术; 螺甾醇
白酒是我国特有的酒种,它与白兰地、威士忌、朗姆酒、伏特加和金酒齐名,被誉为世界著名的六大蒸馏酒之一[1],在世界范围内享有很高的声誉。白酒的酿造是以高粱、小麦等粮谷为主要原料,以曲药为糖化发酵剂,经蒸煮、糖化、发酵、蒸馏等步骤制作而成。“曲乃酒之骨”,曲为白酒发酵提供微生物、酶、香味物质和香味前体物质,决定了白酒的风格和品质[2],对白酒酿造起着非常重要的作用。现在通常采用自然制曲的方式生产大曲,因此,大曲中富集了来自原料、水、空气、场地中复杂的微生物菌系。微生物在大曲中的生长繁殖过程中,将原料中的淀粉、脂肪、蛋白质代谢转化为醇类、醛类、酸类、酮类、酯类等种类十分复杂的化学成分。大曲化学成分十分丰富,对白酒酿造、白酒香和味有重要贡献。目前,研究者们主要用顶空-固相微萃取结合气质联用的方法研究大曲中的挥发性化学成分,但这些方法最大的局限是它们很难检测大曲中沸点较高的化合物。然而,高沸点化合物在白酒酿造过程同样扮演着十分重要的角色,其对白酒呈香呈味有重要贡献。为了系统全面地认识大曲化学成分,充分阐明大曲对白酒质量的影响,本实验采用现代色谱技术和波谱手段对大曲的化学成分进行了研究。
1 材料与方法
1.1 材料、试剂及仪器
大曲样:洋河大曲酒厂提供的入库贮存1个月的优质大曲。
耗材及试剂:薄层层析(TLC)硅胶和柱层析硅胶(200~300目,300~400目)均为青岛海洋化工厂产品;反相硅胶为苏州纳微生物科技有限公司产品;葡聚糖凝胶Sephadex LH-20为GE Healthcare Bio-Sciences AB产品;甲醇、三氯甲烷、乙酸乙酯、石油醚、丙酮等均为工业级,重蒸后使用。254 nm和365 nm紫外、10%硫酸乙醇溶液加热显色及碘蒸气显色。
仪器设备:Bruker Avance 400核磁共振仪(TMS为内标);Bruker Daltonics BioTOF-Q质谱仪;HP 6890/5973 GC-MS为美国安捷伦公司产品。
1.2 螺甾醇的提取和分离
取洋河大曲曲块(18.0 kg)粉碎,用4倍量95%vol乙醇室温浸提2次,每次24 h,提取液过滤,减压浓缩得浸膏158.5 g。将浸膏与硅胶均匀拌和,以硅胶柱层析的方法分离纯化,以氯仿-甲醇体系(20∶1、10∶1、5∶1、1∶1、0∶1)为洗脱剂进行正相硅胶柱梯度洗脱,经TLC检测合并得到15个部分(A—O)。A部分45.0 g,为油状物,用GC-MS进行分析。B部分共20.1 g,其中油状物用GC-MS分析。C部分(15.4 g)经正相硅胶柱层析,石油醚-乙酸乙酯体系(30∶1、20∶1、10∶1、3∶1、1∶1)梯度洗脱,TLC检测后合并为6段(C1—C6)。C1段结晶得化合物1(1286.4 mg)。C2段经Sephadex LH-20柱层析,氯仿-甲醇(1∶1)为洗脱剂,分为C21、C22、C23,其中将C22经正相硅胶柱层析,石油醚-乙酸乙酯体系(10∶1、8∶1、6∶1、4∶1、1∶1)梯度洗脱,第6部分结晶得化合物3、4、5、6混合物(112.1 mg),第9部分经过Sephadex LH-20柱层析,氯仿-甲醇(1∶1)为洗脱剂,结晶得到化合物2(67.0 mg)。
1.3 波谱数据测试
取样品20~30 mg装于核磁管中,加入0.5 mL的氘代氯仿,以400 MHz的核磁进行数据采集得到1H NMR和13C NMR数据。
2 结果与分析
化合物1:C27H44O3;白色无定型粉末(甲醇);1H-NMR(400 MHz,CDCl3):δ 0.77(3H,s,H-18),0.99(3H,s,H-19),1.00(3H,d,J=7.8 Hz,H-21),1.09 (3H,d,J=7.0 Hz,H-27),3.31(1H,d,J=10.8 Hz,H-26a),3.96(1H,d,J=10.8 Hz,H-26b),4.12(1H,brs,H-3),4.41(1H,q,J=7.2 Hz,H-16);13C-NMR(100 MHz,CDCl3):δ 29.9(C-1),27.8(C-2),67.1(C-3),33.5(C-4),36.5(C-5),26.5(C-6),26.6(C-7),35.3 (C-8),40.3(C-9),35.3(C-10),20.9(C-11),39.9(C-12),40.6(C-13),56.4(C-14),31.7(C-15),81.0(C-16),62.1(C-17),16.5(C-18),23.9(C-19),42.1(C-20),14.3(C-21),109.8(C-22),27.1(C-23),25.8(C-24),26.0(C-25),65.1(C-26),16.1(C-27)。通过波谱数据分析,并与文献数据对照[3],将该化合物鉴定为sarsasapogenin。
化合物2:C27H44O4;白色无定型粉末(甲醇);ESI-MS:m/z 455.3[M+Na]+;1H-NMR(400 MHz,CDCl3):δ 0.77(3H,s,H-18),1.02(3H,s,H-19),1.01 (3H,d,J=6.0 Hz,H-21),1.09(3H,d,J=7.0 Hz,H-27),3.31(1H,d,J=10.9 Hz,H-26a),3.96(1H,dd,J= 2.5,J=10.96 Hz,H-26e),3.70(1H,td,J=2.9,J=11.9 Hz,H-7),4.03(1H,brs,H-3),4.38(1H,q,J=7.3 Hz,H-16);13C-NMR(100 MHz,CDCl3):δ 29.7(C-1),26.4(C-2),67.7(C-3),32.3(C-4),35.5(C-5),38.4(C-6),69.9(C-7),35.3(C-8),41.3(C-9),36.9 (C-10),21.1(C-11),40.2(C-12),40.6(C-13),56.3(C-14),31.7(C-15),80.9(C-16),62.1(C-17),16.5 (C-18),23.7(C-19),42.1(C-20),14.3(C-21),109.8 (C-22),26.0(C-23),25.8(C-24),27.1(C-25),65.1 (C-26),16.1(C-27)。通过波谱数据分析,并与文献数据对照[4],将该化合物鉴定为7α-hydroxysarsasapogenin。
化合物3:C27H42O3;白色无定型粉末(甲醇);13C-NMR(100 MHz,CDCl3):δ 37.2(C-1),26.0(C-2),71.7(C-3),40.2(C-4),140.8(C-5),121.4(C-6),32.1(C-7),31.5(C-8),50.1(C-9),36.7(C-10),20.9 (C-11),42.3(C-12),39.8(C-13),56.5(C-14),31.8 (C-15),80.9(C-16),61.9(C-17),42.1(C-18),19.4 (C-19),14.4(C-20),16.3(C-21),109.8(C-22),31.6 (C-23),25.8(C-24),27.1(C-25),65.1(C-26),16.1 (C-27)。通过波谱数据分析,并与文献数据对照[5],将该化合物鉴定为yamogenin。
化合物4:C27H42O3;白色无定型粉末(甲醇);13C-NMR(100 MHz,CDCl3):δ 37.2(C-1),31.6(C-2),71.7(C-3),42.3(C-4),140.8(C-5),121.4(C-6),32.1(C-7),31.4(C-8),50.1(C-9),36.7(C-10), 20.9(C-11),39.8(C-12),40.2(C-13),56.5(C-14), 31.8(C-15),80.9(C-16),62.0(C-17),16.3(C-18), 19.4(C-19),41.6(C-20),14.5(C-21),109.3(C-22),31.3(C-23),28.8(C-24),30.3(C-25),66.8(C-26),17.1(C-27)。通过波谱数据分析,并与文献数据对照[5],将该化合物鉴定为diosgenin。
化合物5:C27H44O3;白色无定型粉末(甲醇);13C-NMR(100 MHz,CDCl3):δ 37.0(C-1),32.3(C-2),71.3(C-3),38.2(C-4),44.8(C-5),28.6(C-6),32.3(C-7),35.1(C-8),54.4(C-9),35.6(C-10),21.1 (C-11),40.1(C-12),40.6(C-13),56.3(C-14),31.8 (C-15),81.0(C-16),62.2(C-17),16.5(C-18),12.4 (C-19),42.1(C-20),14.3(C-21),109.7(C-22),26.0 (C-23),25.8(C-24),27.1(C-25),65.1(C-26),16.1 (C-27)。通过波谱数据分析,并与文献数据对照[5],将该化合物鉴定为neotigogenin。
化合物6:C27H44O3;白色无定型粉末(甲醇);13C-NMR(100 MHz,CDCl3):δ 37.0(C-1),31.4(C-2),71.3(C-3),38.2(C-4),44.8(C-5),28.6(C-6),32.3(C-7),35.1(C-8),54.4(C-9),35.6(C-10),21.1 (C-11),40.1(C-12),40.6(C-13),56.3(C-14),31.8 (C-15),80.8(C-16),62.2(C-17),16.5(C-18),12.4(C-19),41.6(C-20),14.5(C-21),109.3(C-22),31.4 (C-23),28.8(C-24),30.3(C-25),66.8(C-26),7.1 (C-27)。通过波谱数据分析,并与文献数据对照[5],将该化合物鉴定为tigogenin。
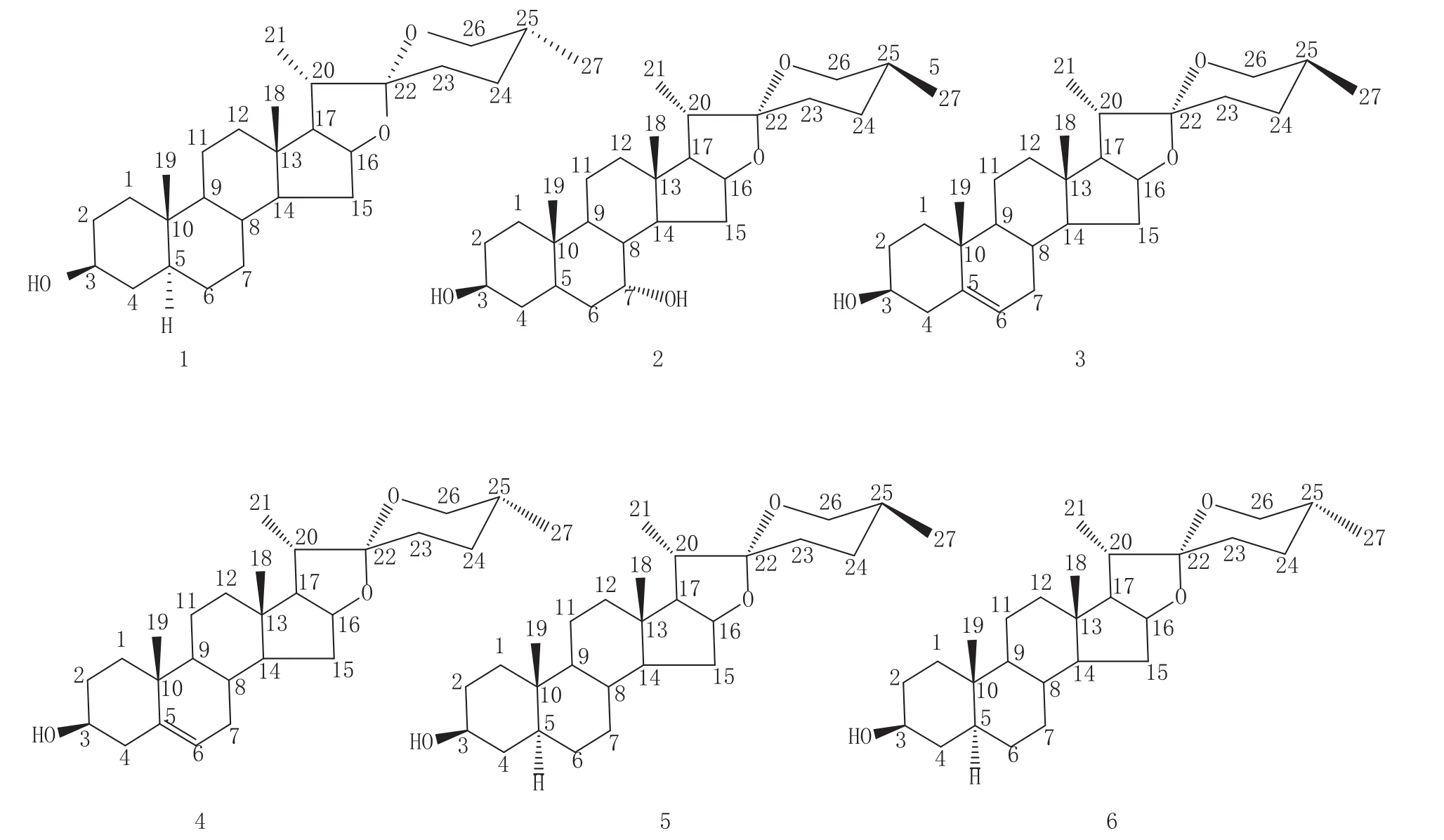
图1 洋河大曲分离的化合物1—6的结构
3 讨论
本实验从大曲中分离鉴定了6个小分子化学成分,经过核磁共振鉴定,确定为sarsasapogenin(1)、7α-hydroxysarsasapogenin(2)、yamogenin(3)、diosgenin(4)、neotigogenin(5)和tigogenin(6)。这6个化合物为螺甾醇类化合物,之前对我国酿酒大曲的研究中尚无此类成分的报道,因此本研究成果属于首次报道。此类型化合物具有十分广泛的生理活性,如:sarsasapogenin(菝葜皂苷元)具有改善老年性痴呆、抗氧化、降血糖、抗骨质疏松等作用;yamogenin(亚莫皂甙元)具有抗真菌的作用;diosgenin(薯蓣皂苷元)具有抗肿瘤、抗心血管疾病、抗炎、抗皮肤病与改善皮肤老化等作用[7];tigogenin(剑麻皂素)具有降血糖、抗炎、镇痛、增强免疫等作用[8-9]。我国白酒酿造中特殊的蒸馏方式,其蒸馏过程物理化学机理复杂,一些高沸点、大极性的成分容易被带入白酒中。本研究中发现的健康功能因子可能以微量成分存在于白酒中,因此,本研究结果不仅丰富了我们对大曲中化学成分的认识,更让我们意识到大曲和白酒中存在许多未知的健康功能因子还有待深入研究和认识。同时,螺甾醇类健康因子的发现,为中国白酒中健康功能因子的发现奠定了基础,有利于促进我国白酒产品的健康发展。
[1] 朱宝镛,章克昌.中国酒经[M].上海:文化出版社,2002.
[2] 沈怡方,李大和.低度白酒生产技术[M].北京:中国轻工业出版社,1998.
[3] 于德泉,分析化学手册(第七册)核共振波谱分册[M].3版.北京:化学工业出版社,2005.
[4]RAHMAN A,CHOUDHARY M I,ASIF F,et al. Microbial transformation of sarsasaprgenin by Fusarium lini[J].Phytochemistry,1998,49(8):2341-2342.
[5]TORI K,SEO S,TERUI Y,et al.Carbon-13 NMR spectra of 5β-steroidal sapogenins.Reassignment of the F-ring carbon signals of(25S)-spirostans[J].Tetrahedron l etters,1981,22(25):2405-2408.
[6] 岳蕾,陈玲,寇俊萍,等.薯蓣皂苷元药理活性及其机制研究进展[J].中国临床药理学与治疗学,2010,15(2):233-237.
[7] 李燕婧,周桂芬,韦善新,等.剑麻皂素药理作用的实验研究[J].时珍国医国药,2006,17(10):1958-1959.
[8] 赖克道,李燕婧,李茂.剑麻皂素降血糖作用的研究[J].广西科学院学报,2010,26(1):56-58.
Spirostanols with Health Functions in Yanghe Daqu
MI Jiao1,CHEN Xiang2,WU Linwei1,YANG Yong2,YANG Tao1,GAN Guangdong2, ZHUANG Mingyang1,ZHOU Xinhu2and LI Guoyou1
(1.Chengdu Institute of Biology,Chinese Academy of Sciences,Chengdu,Sichuan 601161;
2.Yanghe Distillery Co.Ltd.,Suqian,Jiangsu 223800,China)
Daqu is closely related to the quality and styles of Baijiu.It plays an important role in liquor-making.At present,the flavoring compounds with low boiling point in Daqu are studied by HS-SPME-GC-MS.However,there are few reports on the flavoring compounds with high boiling point in Daqu.In this study,Daqu from Yanghe Distillery was used as the research object.6 spirostanols were isolated from Daqu through 95%vol ethanol extraction and multiple chromatographic technology including silica gel,reverse phase silica gel and Sephadex LH-20.On the basis of spectroscopic analysis,they were identified as sarsasapogenin(1),7α-hydroxysarsasapogenin(2),yamogenin(3),diosgenin(4),neotigogenin(5),and tigogenin(6).These spirastanols with diverse biological activities were reported in Yanghe Daqu for the first time,which laid the foundation for discovering healthy constituents in Chinese Baijiu in the future.
Daqu;chemical constituents;bioactive components;chromatography;spirostanols
TS262.3;TS261.1;TS21.7
A
1001-9286(2017)05-0031-04
10.13746/j.njkj.2017064
2017-03-21
李国友(1977-),男,羌族,理学博士,中国科学院成都生物研究所,主要从事天然产物研究工作。
优先数字出版时间:2017-03-30;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170330.1541.003.html。

