猪繁殖与呼吸综合征病毒N蛋白原核表达及多克隆抗体的制备
刘 欢,姜一峰,张文超,杨 莘,周艳君,黄勤锋,童光志
(中国农业科学院上海兽医研究所,上海 200241)
·简报·
猪繁殖与呼吸综合征病毒N蛋白原核表达及多克隆抗体的制备
刘 欢,姜一峰,张文超,杨 莘,周艳君,黄勤锋,童光志
(中国农业科学院上海兽医研究所,上海 200241)
本研究将猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)HuN4株的N基因克隆至原核表达载体pCold-Ⅰ中,经IPTG诱导,在大肠杆菌中表达了重组His-N蛋白,蛋白分子量为14 kDa,能被PRRSV阳性血清特异性识别。经超声裂解和SDS-PAGE检测后,重组蛋白主要以可溶性形式表达。随后利用磁珠纯化重组蛋白,采用背部皮下多点注射免疫BALB/c小鼠,经四次免疫后获得多克隆抗体。Western blot和间接免疫荧光检测结果表明,制备的多克隆抗体具有良好的免疫反应活性,能够与真核表达或病毒的N蛋白发生特异性反应。
猪繁殖与呼吸综合征病毒;N蛋白;原核表达;多克隆抗体
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)是一种有囊膜包被的、单股正链RNA病毒,成熟的病毒粒子呈圆形或者椭圆形,直径50~72 nm,其二十面体对称的核衣壳直径为20~30 nm[1]。PRRSV基因组全长为14.9~15.5 kb,由核衣壳蛋白(nucleocapsid protein,N)通过共价或者非共价结合形成的双层中空结构包裹[2]。PRRSV基因组具有Poly(A)尾,包含有ORF1a、ORF1b、ORF2、ORF2b、ORF3~ORF5、ORF5a和ORF1a~TF等11个开放性阅读框(open reading frame,ORF)[3-6]。ORF1a和ORF1b负责翻译合成病毒的非结构蛋白(nonstructural protein,nsp),而OR2~ORF7合成病毒的结构蛋白(structural protein)。
N蛋白由ORF7编码,含有123(美洲型)或者128个氨基酸(欧洲型),是被感染细胞中含量最高的病毒蛋白[1]。虽然N蛋白具有最高的免疫原性,但是宿主产生的N蛋白抗体却没有中和保护作用[7]。在感染PRRSV后,猪体内产生的主要免疫反应是针对N蛋白的,感染后1周就能够检测到N蛋白的抗体[8]。N蛋白高度的保守性使得检测PRRSV N蛋白抗体成为诊断病毒感染非常普遍的方法。
N蛋白晶体结构解析结果发现,N蛋白通过四个β折叠和两侧的α螺旋构成紧密连接的二聚体[9]。N蛋白可以分为N端的RNA结合部位和C端二聚体化结构域。N蛋白的N端含有许多Lys、Gln 和Asn等氨基酸,该区域可能参与了蛋白与RNA的结合过程[10]。N蛋白的C端组成了蛋白的外壳部分,有报道指出C端的11个氨基酸对于核衣壳的形成具有重要作用[11]。通过检测一系列N蛋白单克隆抗体对于缺失突变N蛋白的免疫反应能力,发现PRRSV 北美毒株具有5个重要的抗原表位,分别位于aa30~aa52,aa37~aa52,aa69~aa112和aa112~aa123。另外的一些单克隆抗体发现了位于蛋白中部(aa52~69aa)美洲型和欧洲型毒株的通用构象表位[12,13]。
虽然目前已有商品化的N蛋白单克隆抗体,但是大多数并不能用于Western blot检测,这给进一步研究病毒复制和N蛋白水平的检测造成了困难。本研究通过构建PRRSV N基因的重组表达质粒pCold-N,在大肠杆菌中表达后,对目的蛋白进行诱导表达和纯化,并成功制备了多克隆抗体,为PRRSV N蛋白的免疫学检测提供重要的实验基础。
1 材料和方法
1.1 质粒、菌种及试剂 pCold-Ⅰ原核表达载体,Ecoli/BL21(DE3)和DH5α宿主菌为本实验室保存;限制性内切酶、T4 DNA连接酶购自NEB公司;Premix rTaq DNA聚合酶购自TaKaRa公司;IPTG购自索莱宝公司;BCA蛋白浓度测定试剂盒(增强型)购自碧云天公司;弗氏完全佐剂和不完全佐剂、蛋白酶抑制剂SIGMAFASTTMProtease Inhibitor Cocktail Tablets均购自Sigma-Aldrich公司;His标签蛋白纯化的Nickel磁珠购于Biotool公司;AlexaFlour 488标记的山羊抗鼠IgG购自Invitrogen公司;SPF级8周龄雌性BALB/c小鼠购自上海斯莱克实验动物中心。本研究的小鼠实验在得到上海兽医研究所动物福利委员会的认可后按照要求进行操作。
1.2 引物设计 结合pCold-Ⅰ酶切图谱和HuN4株(GenBank 登录号:EF635006)N基因序列,设计一对包含有EcoRⅠ和HindⅢ酶切位点(下划线碱基)的引物:PKE-N-F:5'-CCCGAATTCATGCCA AATAACAACGGCAAGCAG-3';PKE-N-R:GCC AAGCTTTCATGCTGAGGGTGATGCTGTGGC-3'。预计扩增片段长为390 bp,引物由上海捷瑞公司合成。
1.3 HuN4 N基因的PCR扩增 以HuN4感染性克隆质粒pHuN4为模板PCR扩增N基因,反应体系如下:2×Premix LA Taq 25 μ L、上下游引物(10 μ mol/ L)各1 μ L、pHuN4模板2 μ L(约20 ng)、ddH2O 21μ L。反应条件:94℃预变性5 min后,在94℃变性40 s,55℃退火30 s和72℃延伸30 s条件下进行32个循环扩增后,最后72℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测目的片段大小正确后,胶回收目的条带。
1.4 重组原核表达载体的构建 使用EcoRⅠ和HindⅢ对胶回收产物和pCold-Ⅰ空载体进行双酶切,酶切条件为37℃水浴3 h。酶切完成后,直接使用胶回收试剂盒回收酶切后的PCR片段和pCold-Ⅰ载体,使用T4 DNA连接酶将酶切后的N基因片段连接至pCold-Ⅰ载体(16℃连接过夜)。将连接后的重组质粒转化E.coli/DH5α感受态细胞,挑取阳性克隆接种于含氨 的液体培养基中,37℃、220 r/min振荡培养12 h,提取质粒DNA,经EcoRⅠ和HindⅢ双酶切鉴定正确后,将阳性质粒送上海生工生物公司测序。
1.5 His-N重组蛋白原核表达 将重组表达载体pCold-N转化E.coli/BL21感受态细胞,经37℃、200 r/min恒温摇床增菌培养。待菌液OD值为0.6时,加入IPTG诱导表达,作用浓度为1.0 mmol/L;100 r/min,16℃条件下低温诱导12 h,同时设置未诱导对照。诱导完成后,取少量诱导表达后的菌液50 μ L,加入等量的2×上样缓冲液,充分混匀后沸水浴10 min。处理好的样品经SDS-PAGE和考马斯亮蓝染色后,检测重组蛋白的表达。
1.6 蛋白纯化 取1 mL的BL21菌液加入到200 mL的LB培养基内,37℃、200 r/min继续培养至菌液OD值为0.6时开始诱导蛋白的表达, IPTG终浓度为1 mmol/L。16℃、100 r/min低温诱导表达12 h。诱导至指定时间后,将菌液分装至50 mL离心管,3000 ×g离心10 min。离心后弃掉上清,加入40 mL PBS重悬洗涤菌液2次,随后加入30 mL 含有蛋白酶抑制剂的结合缓冲液重悬菌液,置于冰上超声破碎至菌液澄清。4℃、4000 ×g低温离心裂解后菌液,将离心后上清转移至新的50 mL离心管,沉淀用30 mLPBS重悬后备用。取100 μ L裂解后上清和PBS重悬的裂解沉淀物进行SDS-PAGE凝胶电泳和考马斯亮蓝染色,分析重组蛋白的表达形式。
按照说明书使用Nickel磁珠进行蛋白纯化。收取各次洗脱液,经SDS-PAGE和考马斯亮蓝染色后观察蛋白纯化效果。按照BCA试剂盒说明书测定蛋白浓度后,-80℃保存各次蛋白洗脱液。
1.7 多克隆抗体制备 纯化后的His-N蛋白经SDSPAGE凝胶电泳后,转印至NC膜并使用脱脂乳封闭,用PRRSV阳性血清作为一抗孵育NC膜,检测原核表达的His-N是否具有反应原性。随后将纯化和测定浓度后的蛋白作为免疫原免疫8周龄BALB/c小鼠。第一次免疫采用弗氏完全佐剂和蛋白样品按1:1混合,使用银汞调和器进行乳化,蛋白免疫量为100 μ g/只,总体积为100 μ L/只。第2~4次免疫采用弗氏不完全佐剂进行乳化,乳化比例为1:1。免疫方式为背部皮下多点注射,每隔2周进行免疫1次。在第3次免疫后,眼眶采血,检测抗体的特异性。第4次免疫后,眼珠采血后处死小鼠。8000×g离心收集血清,编号后置于-80℃保存备用。
1.8 Western blot检测 为了检测多克隆抗体的反应效果,以真核表达N-HA和PRRSV感染的MARC-145细胞蛋白样品作为抗原进行SDS-PAGE凝胶电泳,将目的蛋白转印至NC膜。按照1:500的比例稀释多克隆抗体,室温孵育NC膜2 h,随后使用HRP标记的抗鼠IgG抗体室温孵育1 h。孵育完成后,使用ECL自发光试剂盒显影;经X光片曝光后,观察抗体反应特异性。
1.9 间接免疫荧光检测(indirect immunofluorescence assay,IFA) 将HuN4按照0.01MOI感染MARC-145细胞,在感染后48 h用4%多聚甲醛固定细胞,4℃封闭过夜。用新制备的N蛋白多克隆抗体按照1:200稀释后作为一抗在室温条件下孵育2 h。PBS洗涤孵育后的细胞2次,加入AlexaFluor 488标记的山羊抗鼠IgG作为二抗(1:800稀释),室温孵育1 h。经DAPI染核后在荧光显微镜下观察实验结果,同时设置未感染细胞作为阴性对照。
2 结果与讨论
2.1 原核表达载体构建 PCR扩增获得含有EcoRⅠ和HindⅢ酶切位点的PRRSV N蛋白编码序列,目的片段长390 bp。胶回收PCR产物,并连接至pCold-I载体。经酶切鉴定和序列测定分析,成功构建了含有N基因的原核表达载体pCold-N。
2.2 重组蛋白表达鉴定 将pCold-N转化E.coli/BL21感受态细胞,经IPTG低温诱导表达12 h后,目的蛋白获得成功表达,重组表达的His-N蛋白分子量为14 kDa左右(图1A)。Western blot检测结果发现,原核表达的His-N重组蛋白能够特异性的被PRRSV阳性血清识别,说明其具有良好反应原性(图1B)。
2.3 重组蛋白的纯化 将pCold-N转化E.coli/BL21感受态细胞,经过6 h的增菌后转移至200 mL的LB培养液中,大量诱导目的蛋白的表达。诱导表达菌液经离心、超声破碎后,SDS-PAGE结果发现重组表达的His-N主要以可溶性形式表达(图2A)。超声破碎后收集上清,利用Nickel磁珠进行纯化,纯化后的蛋白出现了2条大小相近的条带,可能是由蛋白降解引起(图2B)。
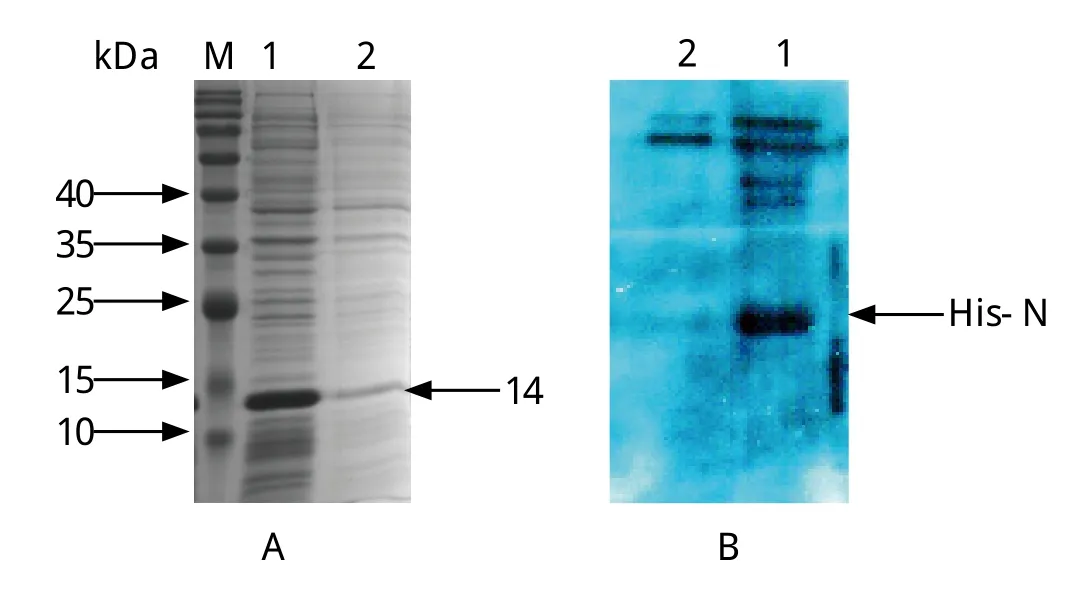
图1 PRRSV N蛋白原核表达(A)及反应原性检测(B)Fig. 1 Prokaryotic expression of PRRSV N protein (A) and identification of its reactogenicity by Western blot (B)M: 蛋白质分子量标准; 1: 诱导的重组菌; 2: 阴性对照M: Protein molecular weight marker; 1: E.coli/BL21 induced with IPTG; 2: Negative control
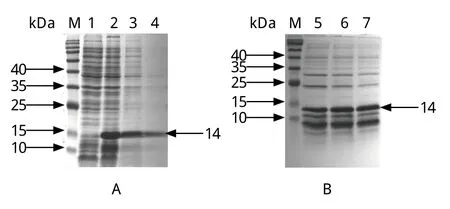
图2 His-N蛋白表达形式分析(A)及纯化(B)Fig.2 Identification of the solubility (A) and purification of the recombinant His-N (B)M: 蛋白质分子量标准; 1: 诱导的空质粒菌体; 2: 诱导的重组菌; 3: 上清; 4: 沉淀; 5~7: 洗脱的His-N蛋白M: Protein Marker; 1:Empty vector with IPTG induction; 2: pCold-N with IPTG induction; 3: Supernatant; 4: Precipitate; 5-7: Eluted His-N proteins
2.4 Western blot检测 蛋白纯化后,经BCA蛋白浓度测定试剂盒测定各次洗脱后的蛋白浓度,免疫8周龄BALB/c小鼠。四次免疫后,摘眼球采血并收集血清。为了检测制备的多克隆抗体的特异性,使用真核表达N-HA蛋白及PRRSV 感染细胞蛋白样品,进行在SDS-PAGE、蛋白转印NC膜和封闭,孵育小鼠血清,稀释比例为1:500。结果发现,多抗能够特异性识别真核表达的N-HA和PRRSV N蛋白(图3)。通过检测一系列N蛋白单克隆抗体(SDOW17、V O17、EP147、SR30、NS99、MR40、J P25、CF163、1D2、2G7、7C10、5H2)对截短表达N蛋白的免疫反应能力,发现PRRSV 北美毒株具有5个重要的抗原表位[12, 13]。目前运用比较广泛的商品化N蛋白单克隆抗体为SDOW17株,但是该单克隆抗体只能用于IFA检测[13]。多克隆抗体由于能够识别单个抗原的多个抗原表位,因此在Western blot检测时能够在目的蛋白的多个表位结合抗体分子,从而放大低丰度的靶蛋白信号。此外,多克隆抗体制备时间短,并且能够识别与免疫原同源性高的目的蛋白,因而成为检测变性蛋白质和免疫沉淀实验的首选抗体类型。
2.5 IFA检测 为进一步检测多克隆抗体,用PRRSV HuN4株感染(0.5 MOI)MARC-145 细胞48 h后,经4%多聚甲醛固定和5% BSA室温封闭1 h。按照1:300的比例稀释多克隆抗体并室温孵育细胞1 h。IFA结果表明,新制备的N蛋白多克隆抗体能够特异性识别病毒的N蛋白,并且具有良好的反应效果(图4)。当截短N蛋白C端11个氨基酸之后,大多数的构象型单克隆抗体均无法识别截短后的N蛋白,这说明C端11个氨基酸对于病毒的空间构象具有重要意义[13]。同理,多克隆抗体由于含有不同种类的抗体,既能够识别靶蛋白的构象性表位,也能够识别线性化表位,从而可以提供更有力的检测证据。

图4 PRRSV N蛋白多克隆抗体的间接免疫荧光检测Fig.4 Analysis the polyclonal antibody against PRRSV N protein with IFAA: 接种PRRSV的MARC-145细胞; B: 未接种PRRSV的MARC-145细胞A: MARC-145 lells infected with PRRSV; B: Normal MARC-145 lells
[1] Dea S, Gagnon C A, Mardassi H, et al. Current knowledge on the structural proteins of porcine reproductive and respiratory syndrome (PRRS) virus: comparison of the North American and European isolates[J]. Arch Virol, 2000, 145(4): 659-688.
[2] Spilman M S, Welbon C, Nelson E, et al. Cryo-electron tomography of porcine reproductive and respiratory syndrome virus: organization of the nucleocapsid[J]. J Gen Virol, 2009, 90(Pt 3): 527-535.
[3] Meulenberg J J, Hulst M M, de Meijer E J, et al. Lelystad virus, the causative agent of porcine epidemic abortion and respiratory syndrome (PEARS), is related to LDV and EAV[J]. Virology, 1993, 192(1): 62-72.
[4] Fang Y, T reffers E E, L i Y, et al. Efficient -2 frameshifting by mammalian ribosomes to synthesize an additional arterivirus protein[J]. Proc Natl Acad Sci USA, 2012, 109(43): E2920-2928.
[5] Johnson C R, Griggs T F, Gnanandarajah J, et al. Novel structural protein in porcine reproductive and respiratory syndrome virus encoded by an alternative ORF5 present in all arteriviruses[J]. J Gen Virol, 2011, 92(Pt 5): 1107-1116.
[6] Wu W H, Fang Y, Farwell R, et al. A 10-kDa structural protein of porcine reproductive and respiratory syndrome virus encoded by ORF2b[J]. Virology, 2001, 287(1): 183-191.
[7] Murtaugh M P, X iao Z, Zuckermann F. Immunological responses of swine to porcine reproductive and respiratory syndrome virus infection[J]. Viral Immunol, 2002, 15(4): 533-547.
[8] Loemba H D, Mounir S, Mardassi H, et al. Kinetics of humoral immune response to the major structural proteins of the porcine reproductive and respiratory syndrome virus[J]. Arch Virol, 1996, 141(3-4): 751-761.
[9] Doan D N, Dokland T. Structure of the nucleocapsid protein of porcine reproductive and respiratory syndrome virus[J]. Structure, 2003, 11(11):1445-1451.
[10] Y oo D, Wootton S K, Li G, et al. Colocalization and interaction of the porcine arterivirus nucleocapsid protein with the small nucleolar RNA-associated protein fibrillarin[J]. J Virol, 2003, 77(22): 12173-12183.
[11] Wootton S, K oljesar G, Y ang L, et al. A ntigenic importance of the carboxy-terminal beta-strand of the porcine reproductive and respiratory syndrome virus nucleocapsid protein[J]. Clin Diagn Lab Immunol, 2001, 8(3): 598-603.
[12] Rodriguez M J, Sarraseca J, Garcia J, et al. Epitope mapping of the nucleocapsid protein of European and North American isolates of porcine reproductive and respiratory syndrome virus[J]. J Gen Virol, 1997, 78 ( Pt 9): 2269-2278.
[13] Wootton S K, Nelson E A, Y oo D. Antigenic structure of the nucleocapsid protein of porcine reproductive and respiratory syndrome virus[J]. Clin Diagn Lab Immunol, 1998, 5(6): 773-779.
PROKARYOTIC EXPRESSION AND PREPARATION OF POLYCLONAL ANTIBODIES OF N PROTEIN OF PORCINE REPRODUCTIVE AND RESPIRATORY SYNDROME VIRUS
LIU Huan, JIANG Yi-feng, ZHANG Wen-chao, YANG Shen, ZHOU Yan-jun, HUANG Qin-feng, TONG Guang-zhi
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
In this study, the N gene of highly pathogenic Porcine reproductive and respiratory syndrome virus(PRRSV) strain HuN4 was cloned into prokaryotic expression vector pCold-Ⅰ and the recombinated protein was expressed after IPTG induction. The expressed N protein was 14 kDa in size and could be specificly recognized by PRRSV positive serum. Using ultrasonication and SDS-PAGE anlysis, the recombinant portein mainly expressed in a soluble form. The expressed His-N was purified by nickel magnetic beads and immunized to 8-week BALB/c mice. After 4 times immunization, the prepared anti-N polyclonal antibodies(pAb) was analyzed by Western blot and indirect immunofluorescence assay. The results showed that the prepared pAb showed good immunoreactivities to viral or eukaryotic expressed N protein.
PRRSV; N protein; prokaryotic expression; polyclonal antibody
S852.659.6
B
1674-6422(2017)02-0082-05
2017-04-23
国家科技支撑项目(2015BAD12B01-1);国家自然科学基金项目(31502072,31302098,31300140)
刘欢,男,博士研究生,预防兽医学专业
童光志,E-mail:gztong@shvri.ac.cn

