新型鸭细小病毒NS1基因的原核表达及生物信息学分析
张经伟,李 琦,陈宗艳,宫晓华,李国新,温建新,朱 杰,李传峰,刘光清
(1.中国农业科学院上海兽医研究所,上海 200241;2.青岛农业大学动物科技学院,青岛 266109)
·研究论文·
新型鸭细小病毒NS1基因的原核表达及生物信息学分析
张经伟1,2,李 琦1,陈宗艳1,宫晓华1,李国新1,温建新2,朱 杰1,李传峰1,刘光清1
(1.中国农业科学院上海兽医研究所,上海 200241;2.青岛农业大学动物科技学院,青岛 266109)
为研究新型鸭细小病毒(Novel duck parvovirus,NDPV)NS1蛋白的生物学功能,根据NDPV DS15株NS1基因(GenBank登录号:KU947420)设计1对特异性引物,对NS1全基因进行PCR扩增,将PCR扩增产物克隆入pGEX-4T-1载体,构建重组质粒pGEX-4T-NS1,并进行测序鉴定。经鉴定正确后重组质粒转化到BL21感受态细胞,SDS-PAGE和Western blot进行表达鉴定。将测序获得NS1基因编码蛋白进行生物信息学分析。结果显示,本研究构建的重组质粒可在原核细胞中成功表达97 kDa的NS1融合蛋白。进一步生物信息学分析结果显示,NS1蛋白为酸性、可溶性蛋白,由627个氨基酸组成,分子质量约为72 kDa。该蛋白主要位于胞浆,不含信号肽序列,无跨膜区,含有丝/苏氨酸激酶底物模序和1个潜在磷酸化位点(s546),抗原表位主要集中在多肽的C端。NS1基因的同源性及系统发生树分析表明,NDPV与鹅细小病毒(Goose parvovirus,GPV)处于同一进化分支,遗传进化关系最近。本研究结果为揭示NDPV NS1在病毒的复制、增殖以及致病机制中的作用奠定了基础。
新型鸭细小病毒;克隆;原核表达;生物信息学
鸭短喙-侏儒综合征, 又称鸭短喙长舌综合征,是一种以生长迟缓、鸭喙变短、舌头外露下垂、跛行、瘫痪、拉稀以及翅、腿易折断为主要临床特征的鸭病毒传染性疾病[1-4]。经过初步鉴定其病原为一种与鹅细小病毒(Goose parvovirus,GPV)密切相关的新型鸭细小病毒(Novel duck parvovirus,NDPV)[4,5]。该病主要发生于10~25日龄肉鸭,发病鸭常因采食和饮水困难而消瘦,甚至死亡,发病率20%~30%,甚至高达50%,给养鸭业造成了巨大的经济损失。
根据文献可知,NDPV与GPV以及番鸭细小病毒(Muscovy duck parvovirus,MDPV)同属于水禽细小病毒。水禽细小病毒基因组包括两个开放阅读框(open read frame,ORF),左侧ORF编码非结构蛋白NS1和NS2,它们具有相同的终止密码子;右侧ORF编码结构蛋白VP1、VP2和VP3,其中VP1包含了VP2和VP3,它们使用同一终止密码子[6]。NS1蛋白不仅参与DNA的复制和转录调节以及对宿主细胞具有毒性作用,还与病毒DNA和蛋白质的有效合成以及病毒的增殖密切相关[7]。前期研究发现,NDPV 与GPV和MDPV在宿主嗜性、临床表型及病理变化等方面存在显著差异[4],那么NS1蛋白在调节不同水禽细小病毒致病力和毒力上具有何种作用及其作用机理还有待于进一步阐明。本研究以NDPV DS15 株NS1基因为研究对象,克隆和表达NS1基因并对其进行生物信息学分析,以期为下一步NS1蛋白生物学功能、病毒的检测方法及致病机制等研究奠定基础。
1 材料与方法
1.1 病毒、载体、感受态细胞 NDPV DS15毒株由中国农业科学院上海兽医研究所鉴定和保存;载体pGEX-4T-1购自北京康为世纪生物科技有限公司;Trans5α和BL21感受态细胞购自北京全式金生物技术有限公司。
1.2 主要试剂 高保真PCR酶Premix Taq购自TaKaRa公司;质粒提取试剂盒AxyPrep plasmid miniprep Kit 250-prep和胶回收试剂盒AxyPrep plasmid miniprep Kit 250-prep购自康宁生命科学(吴江)有限公司;Trans2K Plus DNA Marker购自北京全式金生物技术有限公司;DNA 10× Loading Buffer购自普瑞麦迪(北京)实验室技术有限公司;4S Red Plus核酸染料购自生工生物工程上海(股份)有限公司;琼脂糖(Biowest Agarose)购自南京生兴生物技术有限公司;组织DNA提取试剂盒购自美国Omega 生物技术公司;ECL化学发光检测试剂盒购自赛默飞世尔科技公司。
1.3 引物设计与合成 根据NDPV DS15株NS1基因序列(GenBank登录号:KU947420),利用Primer primier5.0软件设计1对扩增NS1基因的特异性引物,并在上、下游引物5'端分别引入BamHⅠ和XhoⅠ酶切位点(下划线)和相应的保护性碱基。预扩增目的片段长度约为1884 bp。上游引物:5'-CGCGGA TCCATGGCACTTTCTAGGCCTCTTCAG-3',下游引物:5'-CCGCTCGAGTTGTTCATTTTCAGCATC ATCAAGC-3'。引物由上海华津生物工程有限公司合成。
1.4 病毒DNA的提取 分离本实验保存的NDPV DS15株鸭胚尿囊毒F5代,按TaKaRa DNA 提取试剂盒操作说明提取DNA,-20℃保存备用。
1.5 NDPV NS1基因克隆 以上述提取的DNA为模板,进行PCR扩增。PCR反应体系为50μ L:25μ L Ex Taq DNA酶,22μ L ddH2O,上、下游引物各1μ L,DNA 1μ L。PCR反应条件:95℃预变性5 min;95℃变性30 s,63℃退火30 s,72℃延伸2 min,共35个循环;最后72℃延伸10 min。反应结束后取10μ L PCR产物用1%琼脂糖凝胶电泳观察结果。将剩余PCR扩增产物全部进行凝胶电泳,切胶回收后按照pGEX-4T-1载体的说明进行连接。连接体系如下:5μ L回收片段、3μ L pGEX-4T-1载体、1μ L 10× T4 DNA ligase,总体积为10μ L。混匀后16℃连接过夜,然后转化至Trans5α感受态细胞。挑取单克隆后扩大培养,分别经PCR和双酶切鉴定正确后送上海华津生物科技有限公司测序,测序正确后命名为pGEX-4T-NS1。
1.6 重组GST-NS1蛋白的原核表达及Western blot分析 将鉴定正确的重组质粒pGEX-4T-NS1和pGEX-4T-1空载体分别转化表达感受态BL21,挑取单克隆,37℃、220 r/min过夜培养,按照1:100比例转接5 mL新鲜LB培养基培养3~3.5 h;加入终浓度为1.0 mmol/L的IPTG,诱导8 h后收集1 mL菌液的菌体,10 800×g离心1 min,弃上清,加40 μ L ddH2O 及10μ L聚丙烯酰胺凝胶电泳上样缓冲液经煮样10 min处理后,10 800×g离心2 min,SDS-PAGE检测分析。常规SDS-PAGE后,将凝胶中的蛋白转印至硝酸纤维素膜上,5%脱脂牛奶4℃封闭过夜;然后以鼠抗GST单克隆抗体1:1000)为一抗,辣根过氧化物酶(HRP)标记羊抗鼠IgG(1∶2000)为二抗进行Western blot检测;最后用ECL化学发光检测试剂盒来显色检测。
1.7 NS1编码的蛋白的生物信息学分析 把所测序列获得的NS1基因完整的阅读框录入DNAStar的Editseq工作区,选择Translate DNA功能翻译NS1的氨基酸序列,应用EXPASY服务器(http://web.expasy.org/ tools)的Protparam、ProtScale及SOPMA分析工具对蛋白的基本理化性质、疏水性及二级结构进行分析;利用在线软件SingalP4.1(http://www.cbs.dtu. dk/services/signalP/)对其氨基酸序列的信号肽进行分析;采用TMHMM2.0(http://www.cbs.dtu.dk/ services/)软件对NS1蛋白的跨膜区进行预测;利用Scansite(http://scansite.mit.edu/),采用默认参数,选择高严谨度搜索,对NS1蛋白质底物结合模序及潜在磷酸化位点进行预测;采用PSORTⅡ(http:// posrt.hgc.jp/)在线软件对NS1蛋白的亚细胞定位进行分析;利用DNAStar软件的protean工作区,对NS1蛋白的抗原位点进行预测。
1.8 氨基酸同源性分析及系统进化树构建 利用MEGA6.0软件,采用Clustal W方法对NDPV DS15株NS1基因编码蛋白与其他细小病毒NS1蛋白氨基酸同源性进行比对分析并绘制系统进化树,所用的毒株信息见表1。
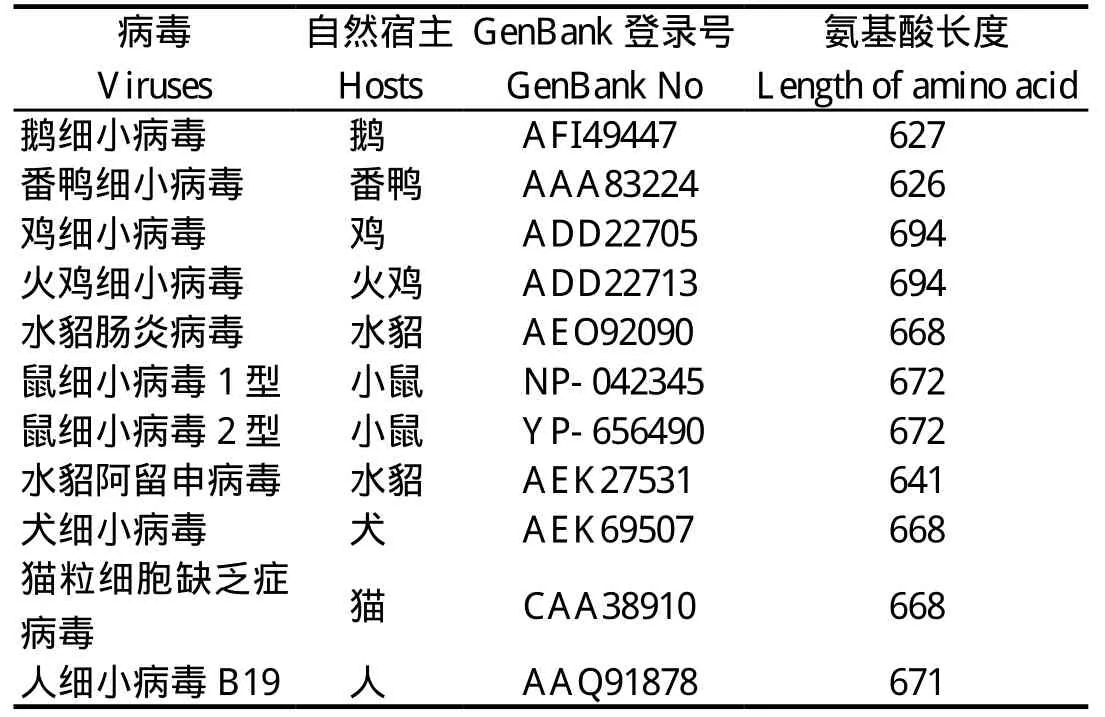
表1 细小病毒参考株NS1基因编码蛋白相关信息Table 1 NS1 gene encoding protein of parvovirus reference strains
2 结果
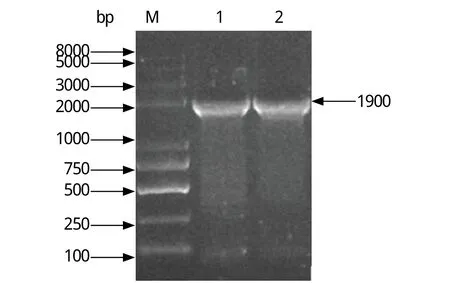
图1 新型鸭细小病毒NS1基因扩增产物Fig.1 PCR-amplified products of NDPV NS1 geneM: DNA分子量标准; 1、2: NS1基因扩增产物M: DNA Marker (Trans2K Plus); 1, 2: PCR products of NS1 gene
2.1 NS1基因克隆 以NDPV DS15株基因组DNA为模板,经PCR扩增获得1条长度约为1.9 kb的特异性条带(图1)。将回收纯化后的PCR产物与pGEX-4T-1载体连接,经双酶切鉴定后获得重组质粒pGEX-4T-NS1。测序结果显示,获得NS1基因序列与参考毒株DS15株同源性达到100%。2.2 重组蛋白GST-NS1的原核表达及Western blot分析 已诱导以及未诱导的pGEX-4T-NS1和空载体pGEX-4T-1进行SDS-PAGE电泳后,将凝胶中的蛋白转印至硝酸纤维素膜,5%脱脂牛奶4℃封闭过夜;然后以鼠抗GST单克隆抗体(1:1000)为一抗,辣根过氧化物酶(HRP)标记羊抗鼠IgG (1∶2000)为二抗进行Western blot检测。结果显示,在大肠杆菌中进行诱导表达GST-NS1蛋白,结果显示在98 kDa处出现1条明显的条带,空质粒对照组则在26 kDa处出现1条特异性条带(图2)。
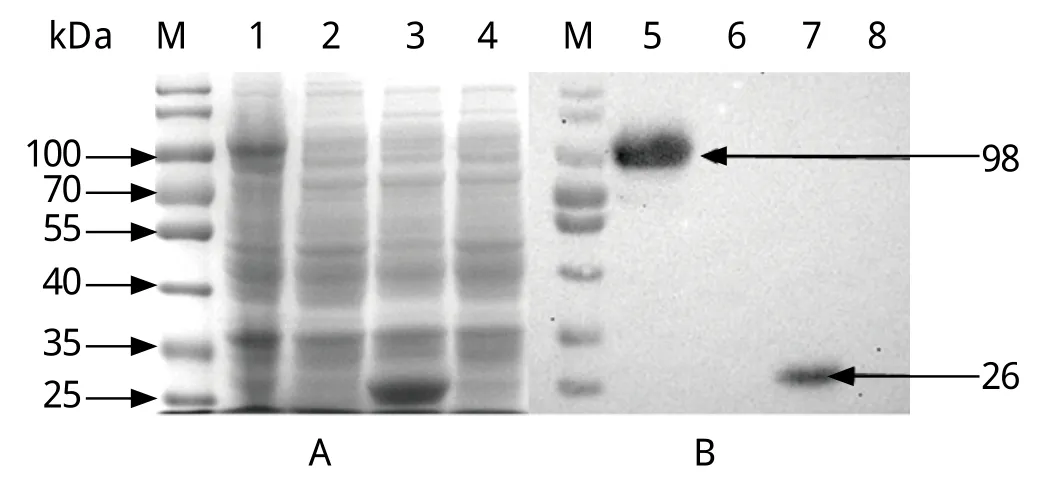
图2 重组蛋白GST-NS1的表达(A)及Western blot分析(B)Fig.2 Expression (A) and Western blot analysis (B) of recombinant GST-NS1 proteinM: 蛋白质分子量标准;1,5: 1 mmol/L IPTG诱导的BL21/ pGEX-4T-NS1;2, 6:未经IPTG诱导的BL21/pGEX-4T-NS1;3,7: 1 mmol/L IPTG诱导的BL21/pGEX-4T-1;4,8:未经IPTG诱导的BL21/pGEX-4T-1M: Protein molecular weight standards; 1,5: BL21/pGEX-4T-NS1 induced by 1 mmol/L IPTG; 2,6: BL21/pGEX-4T-NS1 without IPTG induction; 3,7: BL21/pGEX-4T-1 induced by 1 mmol/L IPTG; 4,8: BL21/pGEX-4T-1 without IPTG induction
2.3 NS1蛋白的生物信息学分析 采用Protparam和Protscale软件对NS1蛋白的一级结构进行分析,NS1蛋白由627个氨基酸组成,预测蛋白质分子质量为71 976.9 Da,等电点PI为5.27,为酸性蛋白。蛋白不稳定系数(instability index)为46.41,属不稳定蛋白。蛋白脂肪指数(aliphatic index)为80.26,蛋白疏水系数(Grand average of hydropathicity GRAVY)为-0.419。采用SOPMA软件对蛋白质的二级结构α-螺旋、β-折叠等进行预测分析,结果显示NS1蛋白中251个氨基酸组成α-螺旋,占40.03%;112个氨基酸构成延伸链;占17.86%;48个氨基酸构成β-转角,占7.66%;216个氨基酸构成无规则卷曲,占34.45%。采用DNAStar软件对其序列进行分析显示,NS1蛋白α-螺旋、β-转角2者含量差距较大,α-螺旋含量更为丰富(图3)。
2.4 NS1蛋白信号肽和跨膜区分析结果 通过在线SignalP4.1 Server工具用Neural networks方法进行信号肽分析,结果显示该蛋白不含信号肽序列。采用在线TMHMM2.0软件对NS1蛋白的跨膜区进行预测,结果显示NS1蛋白不含跨膜区。
2.5 NS1蛋白底物结合模序及潜在磷酸化位点 利用在线Scansite工具,采用默认参数,选择高严谨度搜索,对NS1蛋白底物结合模序进行预测,结果见图4。由图4可知,此蛋白含有丝/苏氨酸激酶底物模序(模序序列为:IPVTPQNSPEPKRSK)和s546 1个潜在磷酸化位点。NS1蛋白包括的结构域为Rep-N (14~196 aa)、Parvo-NS1(220~481 aa)。
2.6 NS1蛋白亚细胞定位预测 采用PsortⅡ在线软件对NS1蛋白的亚细胞定位进行分析,结果显示细胞核、细胞质、囊泡分泌系统、液胞、过氧化物酶及线粒体分别占17.4%、65.2%、4.3%、4.3%、4.3% 和4.3%。
2.7 NS1蛋白的主要抗原位点预测 应用DNAStar软件预测NDPV非结构蛋白NS1的亲水结构、抗原指数、表面可能性及可能的抗原表位结果如下所示。预测结果显示,NDPV NS1蛋白主要的抗原表位区为N端的75~85、142~155、165~170、187~194、240~267、325~331、485~524和542~558 aa(图5)。
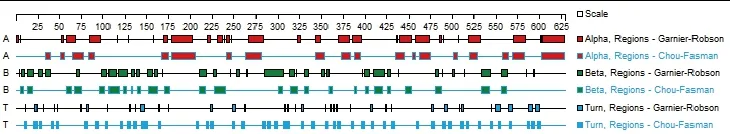
图3 DNA Star软件预测的 NS1蛋白的二级结构Fig.3 Secondary structure of NS1 protein predicted by DNAStar software
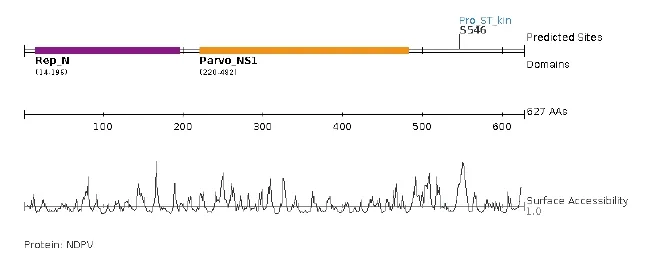
图4 NS1蛋白 Scansite软件分析结果Fig.4 Analysis results of NS1 protein using Scansite software
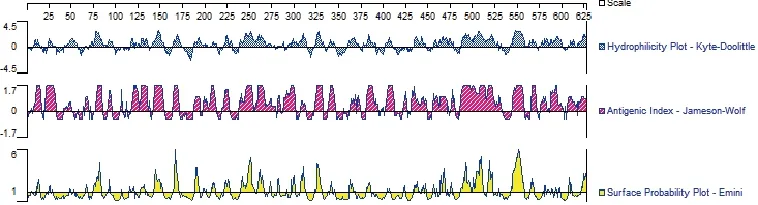
图5 NDPV NS1蛋白的主要抗原位点的预测Fig。5 Prediction of the major antigenic site of NDPV NS1 protein
2.8 NS1氨基酸同源性及系统进化树分析 根据NDPV DS15株NS1基因编码蛋白与其他细小病毒NS1蛋白氨基酸同源性分析结果表明,本研究中的DS15毒株NS1蛋白氨基酸序列与NS1的同源性最高为96.7%,与MDPV的同源性次之为89.5%;与水貂阿留申病毒(Aleutian disease virus,ADV)NS1的同源性最低为19.6%。基于不同细小病毒NS1蛋白氨基酸序列系统进化树可知,NDPV DS15株与GPV亲缘关系最近,与MDPV关系稍远,而与犬细小病毒(Canine parvovirus,CPV)、鼠细小病毒(Mouse parvovirus,MPV)、猫粒细胞缺乏症病毒(Feline panleukopenia virus,FPLV)、水貂肠炎病毒(Mink enteritis virus,MEV)、ADV、人细小病毒B19 (Human parvovirus B19)等细小病毒关系较远(图6)。
3 讨论
在不同细小病毒编码的非结构蛋白中,NS1蛋白在病毒DNA的复制[9-11]、诱导细胞病理变化以及基因转录调控[12]等多种生理生化过程发挥着十分重要的作用。Nü esch等[13]研究显示NS1蛋白含有DNA绑定位点、ATP绑定位点、转录激活位点、解旋酶域等,具有与位点特异性的核酸内切酶、解旋酶、三磷酸腺苷酶(ATP)和DNA序列结合活性。Christensen等[15]发现在小鼠细小病毒(Minute virus of mice,MVM)的复制过程中,复制蛋白A与NS1蛋白相互作用激活NS1蛋白的解旋酶活性。NS1蛋白的这种多功能性主要与磷酸化以及同其他蛋白相互作用有关,同时也影响着病毒的复制与细胞凋亡[13-15]。因此,有必要对NDPV NS1蛋白进行生物学信息预测和分析,利用成熟的表达系统获得该蛋白,为下一步研究NDPV NS1蛋白的生物学功能奠定理论和物质基础。
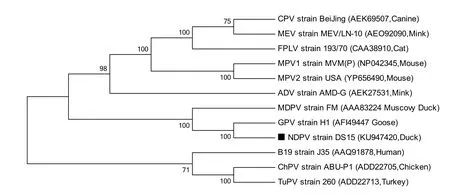
图6 基于不同细小病毒NS1蛋白氨基酸序列的系统进化树Fig.6 Phylogenetic tree based on amino acid sequences of NS1 protein from different parvoviruses
本研究利用生物学软件对NDPV NS1蛋白的结构以及其生物学信息进行了预测和分析。通过对不同宿主间NS1的氨基酸同源性构建的系统进化树进行分析,结果显示,NDPV与GPV处于同一个较小的分支,说明他们具有较近的亲缘关系,与李传峰等[4]的研究结果一致。NDPV NS1基因在同一种属内为高度保守的基因,但不同物种之间的差异性比较大,证明其适用于细小病毒种属分类地位的确定。本研究对NDPV NS1蛋白中的B细胞抗原表位进行了预测,分析结果显示NDPV NS1蛋白的主要抗原表位区在蛋白的C端,特别是240~267、485~513、542~558 aa成为抗原表位的可能性较大。Madsen等[8]研究显示,非结构蛋白NS1与结构蛋白VP1一样具有抗原性,表明其具有良好的抗原性,在病毒复制时,能持续刺激机体产生抗体,这对于NDPV抗体检测方法的建立具有重要的意义。本研究中NS1蛋白亚细胞定位主要在胞质中,这似乎与NS1参与病毒的复制作用相矛盾。然而相关研究也表明,NS1在敏感细胞系和非敏感细胞系中的主要定位区域存在明显差异[16, 17],也有文献报道NS1是一种核质穿梭蛋白[18]。因此,NDPV NS1蛋白亚细胞定位还需要进一步验证。信号肽预测结果显示,NDPV NS1蛋白无信号肽序列,表明该蛋白可以高效表达。跨膜区预测结果显示NS1蛋白无跨膜区,推测该蛋白可较高量及可溶性的表达,这为获得可溶性的NS1蛋白进行相关研究奠定了理论基础。采用Scansite分析软件,用默认参数,选择高严谨度搜索,对NDPV NS1蛋白质序列模序进行在线预测,发现NDPV NS1蛋白含1个潜在磷酸化修饰位点。NDPV NS1蛋白磷酸化位点的存在可能与细胞内信号传导和蛋白定位等过程关系密切,因为细小病毒NS1与细胞因子相互作用的结果往往是NS1的磷酸化或糖基化,NS1蛋白磷酸位点的存在提示该蛋白在信号传导过程中具有潜在的功能[19, 20]。
原核表达系统与真核表达系统相比具有很大优势:遗传背景清晰,表达量高,生产周期短及成本较低。研究选用pGEX-4T-1载体作为原核表达载体,它具有Amp抗性、多克隆位点、tac启动子及GST标签序列等特点,对于目的蛋白分离纯化以及顺利翻译具有积极作用[21]。重组质粒pGEX-4T-NS1作为抗原制备相应多克隆抗体或单克隆抗体时主要具有以下几方面的优势:抗原制备方法简单,易纯化、且用量少;可以通过基因工程的手段,根据需要设计抗原、获得所需要的外源基因片段;DNA质粒可以通过基因工程菌体外培养和提纯的方法获得,且易于保存运输[22]。本研究利用pGEX-4T-1载体构建了NS1的原核表达质粒,并在BL21细胞高效表达了重组NS1蛋白,为深入研究NS1蛋白的生物学功能奠定了良好的物质基础。
参考文献
[1] 陈浩, 刁有祥, 窦砚国, 等.“鸭短喙长舌综合征”初步研究[J]. 山东农业大学学报(自然科学版), 2015, 46(4): 640.
[2] 陈浩, 唐熠, 刁有祥, 等. 樱桃谷肉鸭短喙长舌综合征病原的分离鉴定[J]. 中国兽医学报, 2015, 35(10): 1600-1604.
[3] 黄瑜, 万春和, 傅秋玲, 等. 新型番鸭细小病毒的发现及其感染的临床表现[J]. 福建农业学报, 2015, 23(5): 442-445.
[4] 李传峰, 李琦, 陈宗艳, 等. 鸭短喙-侏儒综合征病原的初步鉴定[J]. 中国动物传染病学报, 2015, 23(6): 1-6.
[5] Chen H, Dou Y, Tang Y, et al. Isolation and genomic characterization of a duck-origin GPV-related Parvovirus from cherry valley ducklings in China [J]. PLos One, 2015, 10(10): e0140284.
[6] Wang S, Cheng X X, Chen S Y, et al. Phylogenetic analysis of VP1 gene sequences of waterfowl parvoviruses from the Mainland of China revealed genetic diversity and recombination [J]. Gene, 2016, 578(1): 124-131.
[7] 张云,耿宏伟,郭东春,等.鹅和番鸭细小病毒全基因克隆与序列分析[J]. 中国预防兽医报, 2008, 15(6) : 415-419. [8] Madsen E S, Madsen K G, Nielsen J, et al. Detection of antibodies against porcine parvovirus nonstructural protein NS1maydistinguish between vaccinated and infected pigs[J]. Vet Microbiol, 1997, 54(1): 1-16.
[9] Christensen J, Cotmore S F, Tattersall P. Minute virus of mice transcriptional activator protein NS1 binds directly to the transactivation region of the viral P38 promoter in a strictly ATP-dependent manner[J]. J Virol, 1995, 69(9): 5422-5430.
[10] Jindal H K, Y ong C B, Wilson G M, et al. Mutations in the NTP-binding motif of minute virus of mice (MVM) NS-1 protein un-couple ATPase and DNA helicase functions[J]. J Biol Chem, 1994, 269(5): 3283-3289.
[11] Lachmann S, Rommeleare J, Nü esch J P. Novel PKC is required to activate replicative functions of the major nonstructural proteinNS1 of minute virus of mice[J]. J Virol, 2003, 77(14): 8048-8060.
[12] Y ang B, Zhang J M, Cai D W, et al. Biochemical characterization of Periplaneta fuliginosa densovirus non-structural protein NS1[J]. Biochem Biophys Res Commun, 2006, 342(4): 1188-1196.
[13] Nü esch J P F, Rommelaere J. A viral adaptor protein modulating casein kinase Ⅱ activity induces cytopathic effects in permissive cells [J]. Proc Natl Acad Sci USA, 2007, 104(30): 12482-12487.
[14] Daeffler L H, Rlein R, Rommelaere J, et al. Modulation of minute virus of mice cytotoxic activities through sitedirected mutagenesis within the NS coding region[J]. J Virol, 2003, 77(23): 12466-12478.
[15] Christensen J, Tattersall P. Parvovirus initiator protein NS1 and RPA coordinate replication fork progression in a reconstituted DNA replication system [J]. J Virol, 2002, 76(13): 6518-6531.
[16] Wan Z, Zhi N, Wong S, et al. Human parvovirus B19 causes cell cycle arrest of human erythroid progenitors via deregulation of the E2F family of transcription factors [J]. J Clin Invest, 2010, 120(10): 3530-3544.
[17] Kivovich V, Gilbert L, V uento M. et al. The putative metal coordination motif in the endonuclease domain of human Parvovirus B19 NS1 is critical for NS1 induced S phase arrest and DNA damage [J]. Int J Biol Sci, 2012, 8 (1): 79-92.
[18] Ihalainen T O, Niskanen E A, Jylhävä J, et al. Dynamics and interactions of parvoviral NS1 protein in the nucleus[J]. Cell Microbiol, 2007, 9(8): 1946-1959.
[19] Briggs L J, Johnstone R W, Elliot R M, et al. Novel properties of the protein kinase CK 2-site-regulated nuclear-localization sequence of the interferon-induced nuclear factor IFI 16[J]. Biochem J, 2001, 353(Pt1): 69-77.
[20] Colombo S, Longhi R, Alcaro S, et al. N-myristoylation determines dual targeting of mammalian NA DH-cytochrome b(5) reduction to ER and mitochondrial outer membranes by a mechanism of kinetic partitioning[J]. J Cell Biol, 2005, 168(5): 735-745.
[21] 罗雯, 徐志凯, 阎岩, 等. 汉滩病毒M、S基因部分片段在大肠杆菌中的融合表达[J] .细胞与分子免疫学杂志, 2001, 17(2): 115-117.
[22] 赵占中, 刘群, 汪明. 犬新孢子虫NcSRS2基因真核表达质粒的构建[J]. 畜牧兽医学报, 2005, 36(8): 819-822.
PROKARYOTIC EXPRESSION AND BIOINFORMATICS ANALYSIS OF NS1 GENE OF NOVEL DUCK PAROVIRUS
ZHANG Jing-wei1,2, LI Qi1, CHEN Zong-yan1, GONG Xiao-hua1, LI Guo-xin1, WEN Jian-xin2, ZHU Jie1, LI Chuan-feng1, LIU Guang-qing1
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. College of Animal Science and Technology, Qingdao Agricultural University, Qingdao 266109, China)
In order to investigate the biological function of NS1 protein of Nocel duck parvovirus (NDPV), one pair of primers were designed according to the NS1 gene sequence of NDPV DS15 strain (GenBank No. KU947420). The PCR products from the NDPV NS1 gene were cloned into the prokaryotic expression vector pGEX-4T-1, resulting in the recombinant plasmid pGEX-4T-NS1. After sequencing analysis, bioinformatics software and net servers were performed to predict and analyze the structures and biochemical properties of NS1 protein. The recombinant plasmid was transformed into BL21 competent cells and then induced with IPTG. Expression of the NS1 protein was examined in SDS-PAGE and Western blot. The results showed that the recombinant protein NS1 with molecular weight of 97 kDa was expressed successfully in the prokaryotes. Bioinformatic analysis showed that the NS1 protein, a soluble and acidic protein, was mainly expressed in the cytoplasm and composed of 627 amino acids with a molecular weight of about 72 kDa. It containedone serine/threonine kinase substrate motif and one s546 potential phosphorylation site but had neither signal peptide nor transmembrane region. The main epitope mainly located at the C terminal end of NS1 polypeptide. Phylogenetic tree and homological analysis of NS1 gene showed that NDPV and goose Parvovirus (GPV) were grouped in the same evolutionary branch, which indicated that they had the closest genetic evolutionary relationship. The results of the present study have laid a foundation for revealing the role of the NS1 protein in the replication, proliferation and pathogenesis of NDPV.
Novel duck parvovirus; cloning; prokaryotic expression; bioinformatics
S852.659.2
A
1674-6422(2017)02-0049-07
2016-05-18
国家自然科学青年基金 (31502068); 上海市科委科技创新医药与农业领域项目(13391901602)
张经伟,男,硕士研究生,预防兽医学专业
刘光清,E-mail:liugq@shvri.ac.cn;李传峰,E-mail:lichuanfeng@shvri.ac.cn
——一道江苏高考题的奥秘解读和拓展

