虾桃拉病毒、黄头病毒和白斑病毒液相芯片快速检测方法的建立
王 政,蒋 静,张磊萍,王 艳
(1.上海市浦东新区农产品安全检测中心,上海 201202;2.上海出入境检验检疫局,上海 200135)
·简报·
虾桃拉病毒、黄头病毒和白斑病毒液相芯片快速检测方法的建立
王 政1,蒋 静2,张磊萍2,王 艳2
(1.上海市浦东新区农产品安全检测中心,上海 201202;2.上海出入境检验检疫局,上海 200135)
本研究通过设计、合成并修饰基因特异性引物和寡核苷酸探针并标记生物素,利用该探针与荧光编码微球偶联后与虾黄头病毒(Yellow head virus,YHV)、虾桃拉综合征病毒(Taura syndrome virus,TSV)和白斑综合征病毒(White spot syndrome virus,WSSV)的PCR产物杂交反应,用液相芯片检测仪(Luminex200)检测荧光信号,初步建立了虾黄头病毒、桃拉病毒和白斑病毒的快速同步检测方法。结果显示,建立的该方法具有较好的特异性,偶联特异性探针的微球只与相应的病毒基因的PCR产物反应,而不与其他虾病病毒基因反应,YHV、TSV和WSSV检测灵敏度高分别为401.5、251.5和75.2 copies。
虾桃拉病毒;虾黄头病毒;白斑病毒;液相芯片
白斑综合征病毒(White spot syndrome virus,WSSV)、Taura综合征病毒(Taura syndrome virus,TSV)和黄头病毒(Y ellow head virus, Y HV)是广泛流行并严重威胁虾养殖的三种主要病原体,引起的虾白斑综合征、Taura综合征和黄头病均属世界动物卫生组织(international office ofepizootic disease, OIE)规定的必需上报的疫病[1,2]。WSSV为一种无包涵体病毒,地理分布广,流行范围大,传染性强,对发病虾致死时间短,目前尚无有效的治疗药物,还不能有效地控制疫情[3,4]。TSV最早的暴发流行在南北美洲,1992年夏季厄瓜多尔Taura河附近的虾养殖场首次发现并报道幼虾(Penaeus vannamei)感染TSV。YHV开始流行主要在东南亚一带,1990年泰国首次发现Y HV引起黑虎虾(Black tiger shrimp)大量死亡。由于没有TSV和Y HV的有效防治措施,它们目前的影响已远超过了原有区域,尤其是TSV,近年来已严重危害着亚洲各国的水产养殖业。2005年3月至2006年3月,使用RT-PCR方法,上海出入境检验检疫局从浦东国际机场口岸入境的195批鲜活草虾中检出TSV阳性草虾12批、Y HV阳性草虾7批,另检出TSV和Y HV混合感染草虾2批[5]。
美国纳斯达克上市的Luminex公司研发的液相芯片技术,又称悬浮阵列/流式荧光技术,具有高通量、敏感性高、速度快的特点,既可进行免疫学检测也可进行核酸检测[6-9]。本研究利用液相芯片技术对Y HV、TSV和WSSV同时进行检测,并评价该方法的灵敏度和特异性,以期为多种虾病的快速检测和诊断提供一种敏感、快速和高效的方法。
1 材料和方法
1.1 质粒和样品
1.1.1 阳性对照 虾黄头病毒(Y HV)、虾桃拉综合症病毒(TSV)、白斑综合症病毒(WSSV)、疱疹病毒(koi herpes virus,K HV)、动物流行性溃疡综合症病毒(Epizootic ulcerative syndrome virus,EUS)、流行性造血器官坏死病毒(Epizootic haematopoietic necrosis virus,EHNV)和传染性皮下及造血组织坏死病毒(Infections hypodermal and hematopoietic necrosis virus,IHHNV)由上海出入境检验检疫局动植物与毒理实验室构建和保存。所有样品均为进境鲜活水产品草虾样品。
1.1.2 试剂和仪器 链霉素-亲和素-藻红蛋白(SAPE)购自美国Invitrogen公司;表面羧基化的荧光编码微球购自美国Bio-Rad公司;Luminex 200液相芯片检测仪为美国Luminex公司产品。
1.2 方法
1.2.1 探针及引物的设计和合成 根据GenBank登录的WSSV基因序列,应用DNAStar软件找出基因中最保守的25个寡核苷酸(oligo nucleotide,nt)作为液相芯片检测探针,探针的Tm值尽量保持在56℃~58℃,分别在探针的上下游设计特异性的扩增引物,应用Primer Primier 5.0软件设计引物。引物、探针送Invitrogen公司合成,下游引物的5'端标记生物素,Probe的5'-C6标记氨基,探针反向互补序列RC-Probe的5'端标记生物素。Y HPPI:5'-ATTCAGCACCTGGGCTCGTCTC-3',Y HV-P2:5'-GGT A T CA CCGT T CA GT GT CT TG-3',探针:5'-GTCGCATACACTAAACTACA -3';TSV-P1:5'-ATTGAATACTTAGCACAGCGA CC-3',TSV-P2:5'-GAACACCACTACCATAGGG GAG-3',探针:5'-GCTCAACAGATACACTATCA -3';WSSV-PI:5'-ACGTGTTGGAAGAAGCGTC GTCG-3',WSSV-P2:5'-TGCTGCACACGTCAAT GAGGG-3',探针:5'-AGAGAGGTCCTACAATAC TC-3'。引物用水溶解成200μ mol/mL贮存母液备用。
1.2.2 寡核苷酸探针与微球的共价偶联 将所有试剂恢复至室温,重悬微球,取200 μ L微球(5×106)至1.5 mL的聚丙烯微量离心管中,离心去上清,加入MES(0.1 mol/L,pH=4.5)50 μ L混匀,加入相应的寡核苷酸探针0.2 nmol/μ L。再加入新鲜配制的EDC溶液(10 mg/mL)10 μ L,充分混匀,室温避光孵育30 min,重复1次。用1 mL Tween-20(0.02 %V/V)和1 mL SDS(0.1% w/v)各洗涤1次,最后用适量的MES(0.1 mol/L,pH=4.5)重悬微球,采用血球计数法对制备的荧光编码微球进行计数,计算出荧光编码微球的浓度,2℃~8℃避光保存。
1.2.3 液相芯片体系的优化
1.2.3.1 杂交温度的优化 杂交反应在45 min条件下,根据探针的Tm值,选定42℃、44℃、46℃、48℃、50℃、52℃六个温度梯度为研究对象,考察不同杂交温度下液相芯片的检测效果。
1.2.3.2 杂交时间的优化 分别选取30、45、60、75、90 min五个杂交时间,选择最适宜的杂交时间。
1.2.3.3 SAPE浓度对于液相芯片体系的影响 同1.2.3.1步骤操作,采用优化好的杂交温度和杂交时间,研究使用不同浓度的SAPE参与反应对检测信号的影响。
1.2.3.4 液相芯片检测体系阈值 提取使用其他方法确定的TSV、Y HV阴性样品20份的RNA,经RT- PCR扩增;提取WSSV PCR阴性样品20份的DNA为模板扩增。所得到的 PCR产物用于液相芯片的检测试验,检测20份样品的MFI可以计算变异系数。
1.2.3.5 液相芯片检测体系灵敏度 将TSV、Y HV、WSSV基因组的RT-PCR产物或者PCR产物构建的质粒进行10倍系列稀释,得到10-1、10-2、10-3、10-4、10-5、10-6、10-7这7种稀释度的稀释液,用建立的液相芯片法进行检测。
1.2.3.6 液相芯片检测体系特异性 将Y HV、TSV、WSSV、IHHNV、EUS、EHNV和KHV基因组的RTPCR产物或者PCR产物,用建立的液相芯片方法进行检测。
2 结果与讨论
2.1 杂交温度对液相芯片检测方法的影响 分别Y HV、TSV和WSSV的目标片段,将其与探针微球杂交,设置不同的杂交温度(42℃、44℃、46℃、48℃、50℃、52℃)进行杂交,液相芯片法检测MFI结果见图1。随着杂交温度的提高,3种病毒的平均荧光强度都出现先增加后降低的趋势,当杂交温度为46℃时3种病毒的平均荧光强度均达到最高值,故选择46℃为检测体系的杂交温度。
寡核苷酸探针杂交的最佳条件要既能保证杂交的特异性,又能在适当的速率下形成稳定的杂交体。探针序列越长,越易形成杂交体,但缺乏特异性,且杂交速率减慢。短探针具有较高的特异性,但存在不稳定的杂交体缺陷。温度对杂交效果有明显的影响,因此选择最适当的杂交温度可以增强杂交的特异性,降低非特异性杂交的荧光强度。本试验中,根据探针的Tm值,选定42℃、44℃、46℃、48℃、50℃、52℃六个温度梯度为研究对象,考察不同杂交温度下液相芯片的检测效果。结果表明,MFI随着温度的升高平缓上升,但温度达到46℃时,MFI达到最大值,杂交温度达到48℃时,平均荧光强度骤,存在显著性差异,故最终选择46℃作为最佳反应温度进行后续实验。
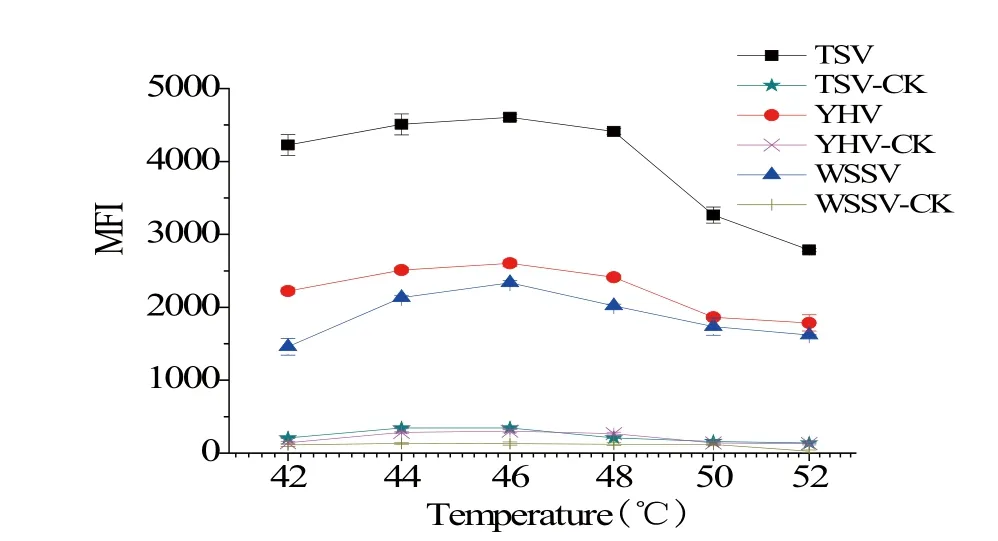
图1 不同杂交温度下YHV、TSV和WSSV的液相芯片检测结果Fig.1 The detection result of YHV, TSV and WSSV byliquichip technique at different hybrid temperature
2.2 杂交时间对液相芯片检测方法的影响 分别选取30、45、60、75、90 min为杂交时间,进行Y HV、TSV和WSSV的液相芯片检测反应的MFI值,结果显示,随着杂交时间的增加Y HV的MFI先增加,至45 min后进入一段平台期,75 min后MFI值略有下降;TSV的MFI值随着时间的增加而平稳增加,直至75 min时到达最高点,随后逐渐下降;WSSV的MFI值为30~75 min,随时间推移,数值上升,后则呈下降趋势(图2)。综上所述,选择60 min为3个病毒共用的杂交反应时间。
2.3 SAPE浓度对液相芯片检测方法的影响 将YHV、TSV和WSSV目的片段与微球在46℃杂交60 min后,加入70 μ L的SAPE,浓度分别为1、2、4、8、16 ng/mL反应完毕后检测MFI。结果显示,随着SAPE浓度的增加,样品和空白对照的MFI值都显著增加,当SAPE浓度由1 ng/mL增加至8 ng/mL时,Y HV、TSV和WSSV的MFI值显著增加。SAPE后浓度继续增加至16 ng/mL时 ,Y HV和TSV的MFI值增加缓慢,而WSSV则略有下降。以Y HV为例,当SAPE浓度为1 ng/mL时,MFI的值为285.7;当SAPE浓度变为2 ng/mL时MFI值增至2.1倍;SAPE浓度分别增加至4、8、16 ng/mL时,MFI值则分别是1 ng/ mL时MFI值的4.3倍、7.8倍和8.8倍。TSV和WSSV的变化趋势与之相仿,故选择8 ng/mL作为后期实验的SAPE浓度。
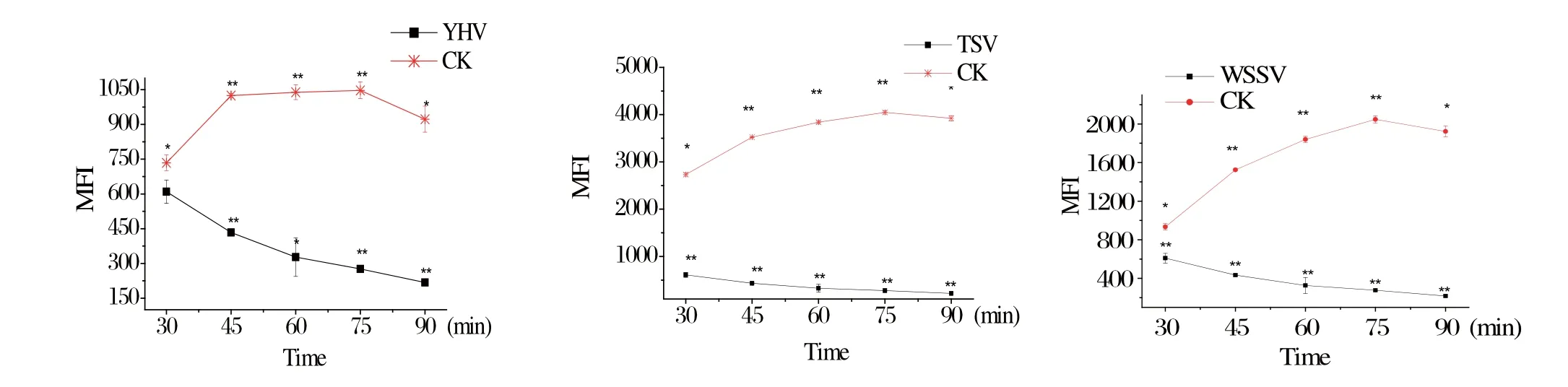
图2 不同杂交时间下YHV、TSV和WSSV的液相芯片检测结果Fig.2 The detection result of YHV, TSV and WSSV by liquichip technique at different hybridization time
本研究对杂交温度、杂交时间、SAPE浓度等进行探索的过程中,发现在分析结果时,尽量圈定微球相对集中区域,这样可以确保结果的准确性。
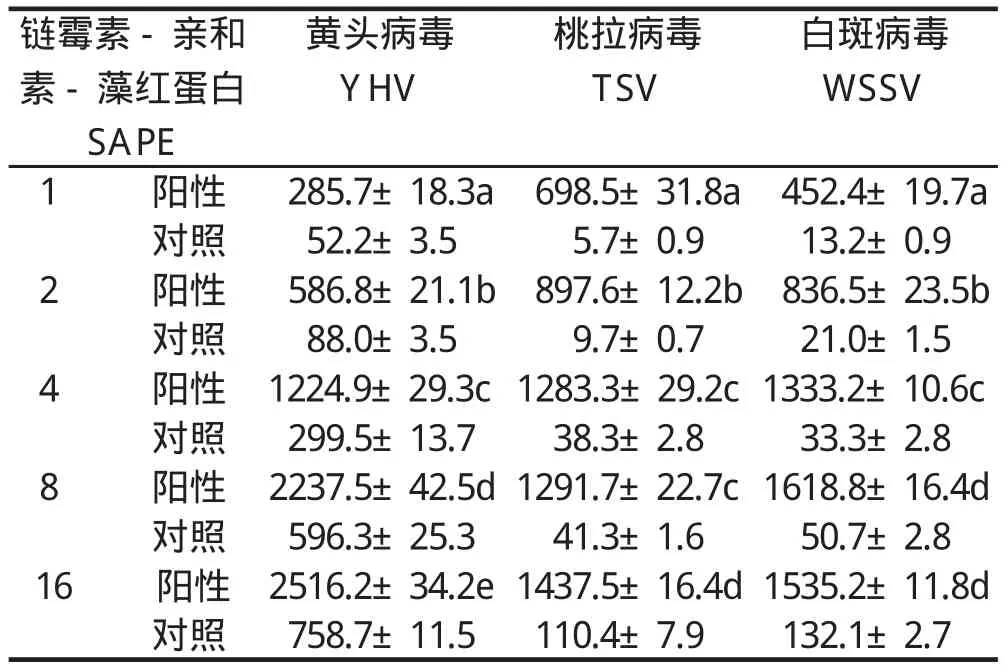
表1 SAPE浓度对液相芯片检测方法的影响Table 1 The effects of concentration of SAPE on liquichip technique
2.4 液相芯片检测方法阈值的确定 提取其他方法确定的TSV、Y HV阴性样品20份的RNA,经RT-PCR扩增;提取WSSV PCR阴性样品20份的DNA为模板扩增。所得到的PCR产物用于液相芯片的检测试验,用液相芯片法测得MFI的均数和标准差,计算阈值,结果见表2,Y HV、TSV和WSSV的阈值分别为214.55、143.86和108.48,当样品的MFI值高于cut-off值时视为阳性。
2.5 液相芯片检测体系灵敏度的检测 将TSV、Y HV、WSSV基因组模板作梯度稀释,选择稀释倍数为101倍、102倍、103倍、104倍、105倍、106倍和107倍稀释,作为PCR扩增模板,用PCR体系进行扩增后于建立的液相芯片检测体系中进行检测。检测结果如图3所示,MFI值于稀释度的log值存在线性关系,即TSV:MFI=-448.2logX+4307;WSSV:MFI=-130.3logX+984.2; Y HV:MFI=-103.3 logX+768.5,其中MFI表示平均荧光强度,X表示稀释度,该回归曲线的R2分别为0.993、0.954和0.997,可以根据平均荧光强度MFI对病毒的污染量做半定量分析,将表2中的阈值带入回归曲线方程,求得TSV、Y HV和WSSV灵敏度达401.5、251.5、75.2 copies。
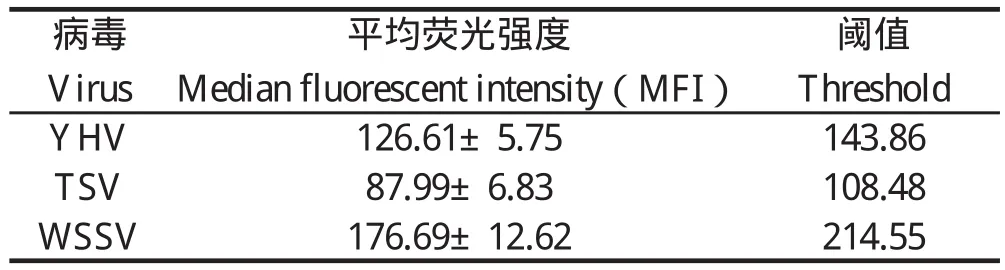
表2 液相芯片检测方法的阈值Table 2 MFI value of liquichip for YHV, TSV and WSSV
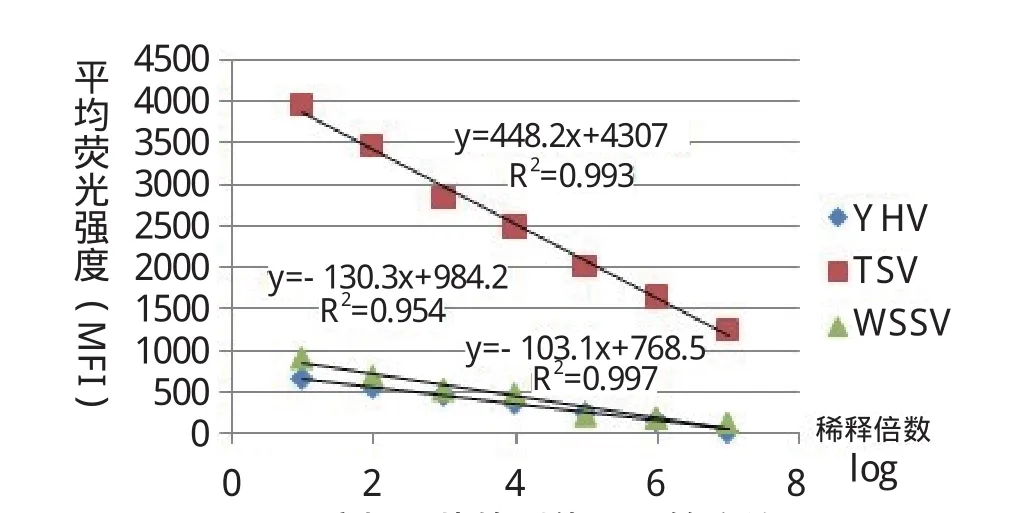
图3 液相芯片检测体系灵敏度结果Fig.3 The sensitivity test of liquichip for YHV, TSV and WSSV
2.6 液相芯片检测体系特异性试验结果 提取其他方法确定Y HV、TSV、WSSV、IHHNV、EUS、EHNV、KHV分别为阳性样品的基因组RNA(提取RNA转化为cDNA)作为PCR扩增模板用PCR体系进行扩增后于建立的液相芯片检测体系中进行检测,结果如图4所示。特异性结果表明建立的液相芯片方法能特异性检出Y HV、TSV、WSSV,其他阳性对照均为阴性。
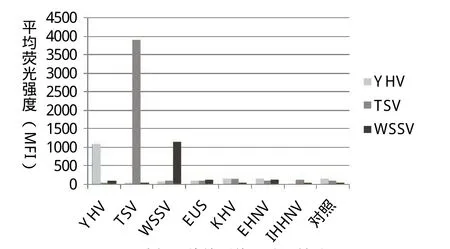
图4 液相芯片检测体系特异性结果Fig.4 The specificity test of liquichip for YHV, TSV and WSSV
尽管目前RT-PCR是检测TSV和Y HV的国标用方法,但其难以检出虾在慢性感染期所携带的低拷贝的病毒[10],液相芯片方法可以避免常规RT-PCR凝胶电泳中EB对环境造成的不良影响,而且液相芯片在高通量方面有无法取代的优势,并且能够同时对片段大小相近的样品进行快速检测。同时本研究从样品处理到出结果仅需2.5 h,由于液相芯片的反应体系更加接近生物反应体系,同时又设计选用了具有高特异性地引物探针,使得该方法的特异性和特异性高于传统的检测方法。
[1] OIE-Listed diseases,infections and infestations in force in 2017, World Organisation For Animal Health.
[2] Manual of Diagnositc Tests for Aquatic Animals, 2017, World Organisation For Animal Health.
[3] Rejan P R, Ramesamy P. A white spot disease-like syndrome in the pacific blue shrimp as a form of bacterial shell disease [J]. Aquaculture, 2000, 183: 25-30.
[4] 谢芝勋, 庞耀珊, 刘加波, 等. 二温式多重PCR检测鉴别对虾白斑综合征病毒(WSSV)和传染性皮下及造血器官坏死病毒(IHHNV)的研究与应用[J]. 海洋科学, 2005, 29(12): 9-12.
[5] 熊炜, 邱璐, 李健, 等. 上海检验检疫局从泰国进境草虾中检出虾黄头病毒[J]. 检验检疫科学, 2006, 6(16): 61-62.
[6] Bay J T, Garred P. Rapid bead-based immunoassay for measurement of mannose-binding lectin[J]. Scand J Immunol, 2009, 69(6): 570-575.
[7] Arellano-Garcia M E, Hu S, Wang J, et al. Multiplexed immunobead-based assay for detection of oral cancer protein biomarkers in saliva[J]. Oral Dis, 2008, 14 (8): 705-712.
[8] Livingston A D, Campbell C J, Wagner E K, et al. Biochip sensors for the rapid and sensitive detection viral disease[J]. Genome Biol, 2005, 6(6):112-115.
[9] L inkov F, Y urkovetsky Z, L okshin A. Hormones as biomarkers: practical guide to utilizing Luminex technologies for biomarker research[J]. Methods Mol Biol, 2009, 520: 129-141.
[10] Y eh H Y, Shoemaker C A, Klesius P H. Evaluation of a loop-mediated isothermal amplification method for rapid detection of channel catfish Ictalurus punctatus important bacterial pathogen Edwardsiella ictaluri [J]. J Microbiol Methods, 2005, 63(1): 36-44.
PRELIMINARY DEVELOPMENT OF LIQUICHIP DETECTION TECHNIQUE FOR YELLOW HEAD VIRUS, TAURA SYNDROME VIRUS AND WHITE SPOT SYNDROME VIRUS
WANG Zheng1, JIANG Jing2, ZHANG Lei-ping2, WANG Yan2
(1. Agricultural Product Safety Testing Center of Shanghi Pudong New District, Shanghai 201202, China; 2. Shanghai Entry-Exit Inspection and Quarantine, Shanghai 200135, China)
A liquichip technique for detection of Yellow head virus(YHV), Taura syndrome virus(TSV) and White spot syndrome(WSSV) was developed in the present study by using Luminex 200 to catch fluorescence signal. In this method, specific primers and their corresponding oligonucleotide probes were designed, synthesized and modified. Then individual YHV, TSV and WSSV probes were labeled with biotin and coupled with fluorescence-coded microspheres. The results showed that this method displayed good specificity to YHV, TSV and WSSV and no reaction to other shrimp viruses. The sensitivity test indicated the detection limit for YHV, TSV and WSSV reached to 401.5、251.5 and 75.2 copies. A liquichip technique was preliminarily developed for detection of YHV, TSV and WSSV.
TSV; YHV; WSSV; Luminex
S852.659.1
B
1674-6422(2017)02-0077-05
2016-09-01
上海检验检疫局科技计划项目(HK006-2011)
王政,男,硕士研究生,预防兽医学专业
王艳,E-mail: wang_yan@shciq.gov.cn

