梅毒螺旋体膜蛋白Tp0971经TLR2/NF-κB诱导巨噬细胞分泌细胞因子①
张跃军 蒋传好 刘良专 蒋最明 顾 敏 吴移谋
(湖南省株洲市中心医院临床检验中心,株洲412007)
梅毒螺旋体膜蛋白Tp0971经TLR2/NF-κB诱导巨噬细胞分泌细胞因子①
张跃军 蒋传好②刘良专②蒋最明 顾 敏 吴移谋②
(湖南省株洲市中心医院临床检验中心,株洲412007)
目的:探讨梅毒螺旋体(Treponema pallidum,Tp)膜蛋白Tp0971诱导巨噬细胞分泌细胞因子的分子机制。方法:以Tp Nichols株基因组为模板,PCR扩增Tp0971基因并构建重组质粒pET28a(+)/Tp0971,随后将其转化至表达宿主菌E.coli Rosseta中,IPTG诱导表达,Ni-NTA亲和层析柱纯化重组蛋白。经去除Tp0971重组蛋白中的内毒素后,将其刺激巨噬细胞,ELISA检测细胞因子IL-8、IL-1β和IL-6的分泌水平。并采用Toll样受体2(TLR2)中和抗体或TLR2 siRNA,以及核转录因子κB(NF-κB)抑制剂PDTC处理细胞,观察TLR2和NF-κB在介导细胞因子分泌中的作用。结果:成功构建pET28a(+)/Tp0791原核表达载体,并表达出一相对分子量为29 kD的重组蛋白。ELISA结果显示,0.5~10 μg/ml Tp0791能以剂量依赖性方式诱导巨噬细胞分泌IL-8、IL-1β和IL-6。采用siRNA沉默TLR2表达,或用TLR2中和抗体封闭后,IL-8、IL-1β和IL-6分泌明显减少。此外,Tp0791也能增加细胞核中NF-κB p65的表达水平,采用NF-κB抑制剂PDTC处理后,细胞因子分泌水平也显著降低。结论:Tp0971经TLR2/NF-κB可诱导巨噬细胞分泌细胞因子。
梅毒螺旋体;膜蛋白;细胞因子;Toll样受体2
梅毒螺旋体(Treponema pallidun,Tp)是导致性传播疾病梅毒的病原体,它不仅可导致人体多器官损害,同时也可经胎盘由母体垂直传播给胎儿,从而导致先天性梅毒的发生,给出生人口质量带来极大危害[1,2]。目前Tp的致病机制尚未完全明了,探讨其致病因子的生物学作用是防治本病的关键环节。研究表明,Tp感染后的炎症和持续的获得性免疫应答是导致机体病理损伤的主要因素[3]。本课题组的前期研究表明,Tp中的多种膜蛋白具有促炎活性,如Tp47能通过TLR2激活核转录因子κB,从而诱导巨噬细胞表达和分泌TNF-α、IL-1β、IL-6、IL-12和IL-8等细胞因子[4]。Tp0971是近年发现的膜脂蛋白之一,其结构显示Tp0971能与哺乳动物体内的乳铁蛋白和Zn2+结合,而Zn2+是Tp代谢的重要辅助因子,因此Tp0971可能在Tp的新陈代谢中发挥一定作用[5]。本课题组前期研究表明,Tp0971具有较好的免疫原性[6],但其是否还具有致炎活性目前仍不明确。本研究旨在观察Tp0971潜在的致炎活性,并初步探讨其调控机制。
1 材料与方法
1.1 主要实验材料 Tp Nichols标准株由上海皮肤性病医院顾伟鸣主任惠赠;E.coli JM109、Rosetta、表达载体pET28a(+)和THP-1细胞均为南华大学病院研究所保存;质粒小量提取试剂盒、DNA纯化提取试剂盒购自Axygen; Ni-NTA 6×His亲和层析纯化试剂盒、Detoxi-GelTM内毒素去除胶、RPMI1640培养基以及核蛋白提取试剂盒为Thermo Fisher Scientific产品; ECL蛋白印迹法检测试剂盒购自Amersham Biosciences;IL-8、IL-1β和IL-6试剂盒购自深圳欣博盛生物科技有限公司; BamHⅠ、Hind Ⅲ和EcoRⅠ限制性内切酶和T4连接酶购自NEB;6-His-Tag(Mo)购自北京中杉金桥生物技术有限公司; BCA蛋白浓度测定试剂盒、辣根过氧化物酶(HRP)标记的兔抗鼠二抗购自碧云天生物技术研究所;胎牛血清购自四季青生物工程材料公司;TLR2 siRNA和中和抗体分别购自Santa Cruz和Imgenex。
1.2 方法
1.2.1 原核表达载体的构建及鉴定 从GenBank中获取Tp0971基因的碱基序列,分别设计上游和下游特异性引物5′-CGCG▼GATCC AAGAGGGTGAG-TTTGCTCGG-3′和5′-CCCA▼AGCTT CCACTGAGG-CCCCTTCCA-3′,并分别引入BamHⅠ和Hind Ⅲ酶切位点,于PCR仪上94℃预变性5 min;94℃变性50 s,56℃ 退火40 s,72℃延伸60 s,共35个循环;循环结束后再72℃终延伸10 min。纯化并回收PCR产物并,双酶切纯化产物和pET28a(+)质粒,经纯化回收、亚克隆以及转化筛选后获得重组质粒。
1.2.2 重组蛋白的诱导表达与鉴定 将重组质粒转化至感受态E.coli Rosetta中,Kanamycin(50 μg/ml)筛选阳性克隆,并进行大规模培养。当重组菌培养至A600=0.6左右时,向培养物中加入IPTG,37℃分别诱导表达。取各种菌液1.0 ml 13 000 r/min离心30 s,收集菌体沉淀,分别用100 μl 2×SDS凝胶加样缓冲液重悬,然后100℃水浴中加热5 min,13 000 r/min离心5 min,获取上清用于SDS-PAGE分析,并进行Western blot鉴定。
1.2.3 Tp0971重组蛋白纯化及内毒素的去除 将250 ml细菌培养液(OD600=1.5~3.0)与1 000 r/min离心10 min,收集细菌沉淀并重悬于10ml B-PER试剂中并充分混匀,14 000 r/min离心15 min收集上清;打开镍螯合柱盖子后依次加入10 ml B-PER试剂以及10 ml 样本使其从柱中流出。并分别用洗液1和洗液2洗涤,最后用洗脱液洗脱6×His标签蛋白。将获取的蛋白样品加至真空处理的Detoxi-Gel柱中,并用无致热源水洗脱,收集洗脱液。随后将Detoxi-Gel柱中加入5倍体积1%去氧胆酸钠漂洗,再加入3~5倍无致热源水洗涤使其再生后重复样品过柱1次。
1.2.4 细胞培养与刺激 接种于6孔板中的THP-1细胞用含10%胎牛血清,100 U/ml青霉素和100 mg/ml 链霉素的RPMI1640培养基中,于37℃、5%CO2条件下培养。待细胞生长至密度为80%时,加入终浓度为160 nmol/L的PMA使其分化为巨噬细胞。根据不同的实验目的,细胞加入不同浓度的上述蛋白刺激后用于下一步研究。
1.2.5 ELISA检测IL-8、IL-1β和IL-6分泌 巨噬细胞经Tp0971刺激结束后,吸取细胞上清,1 000 r/min离心10 min,取100 μl上清液加至预包被有IL-8、IL-1β或IL-6抗体的酶标板中,37℃孵育2 h。经洗涤后加入试剂盒提供的一抗,与37℃下避光孵育 90 min。充分洗涤后加入生物素化抗体孵育30 min,DAB显色。酶标仪下获取其吸光值,并根据标准曲线计算出上清液中的细胞因子浓度。
1.2.6 RNA干扰 接种于6孔板中的巨噬细胞用1%血清RPMI1640培养基培养18 h,随后按照Qiagen公司提供的转染试剂盒转染TLR2 siRNA,100 nmol/L TLR2 siRNA或对照siRNA与转染试剂混合后加至细胞培养上清中共同孵育18 h,随后用无血清培养基漂洗后更换为10%浓度血清的完全培养基用于下一步研究。
1.2.7 核蛋白、细胞膜蛋白提取与Western blot 巨噬细胞处理结束后,胰酶消化并吹打成细胞悬液,无菌PBS漂洗2次,加入100 μl RAPI裂解液充分裂解细胞,胞浆蛋白和核蛋白根据试剂盒提供的步骤进行,并采用Bradford法测定蛋白浓度。按照参考文献提供的方法提取细胞膜蛋白[7],即,将细胞重悬浮于含有蛋白酶抑制剂的松弛缓冲液中(relaxation buffer,100 mmol/L KCl、3 mmol/L NaCl、3.5 mmol/L MgCl2、1 mmol/L EGTA、10 mmol/L Hepes、0.5 mmol/L PMSF)。经超声破碎后,4℃ 800 r/min离心10 min以去除细胞核即未破碎细胞。获取上清液后4℃ 14 000 r/min超速离心30 min,继续用松弛缓冲液重悬浮沉淀并充分振荡后再次4℃14 000 /rmin超速离心30 min,上清即为细胞膜成分。将获取的蛋白加入等体积2×上样缓冲液混合并煮沸5 min后,取20 μl蛋白用于SDS-PAGE,电泳结束后将其转印至PVDF膜上,用TBST漂洗后,用5%脱脂奶粉室温封闭2 h,随后分别与一抗和HRP标记二抗孵育,化学发光、显影。
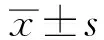
2 结果
2.1 Tp0971基因的PCR扩增与重组载体的酶切鉴定 PCR扩增产物经1.0%琼脂糖凝胶电泳后显示,在612 bp位置可见一条清晰的条带,与预期片段大小相符(图1A)。随后重组质粒pET28a(+)/Tp0971分别采用BamHⅠ 和Hind Ⅲ酶切,所获得的条带与预期片段相符(图1B)。2.2 Tp0971诱导表达和鉴定 Tp0971重组表达体分别加入不同浓度IPTG诱导表达,图2显示,37℃下蛋白为可溶性表达,但加入0.2~1.5 mmol/L IPTG对Tp0971表达无明显影响。

图1 Tp0971基因的PCR扩增与重组载体的酶切鉴定Fig.1 PCR amplification of Tp0971 gene and enzyme digestion of recombinant vectorNote: A.Electrophoretic analysis of Tp0971 PCR product in 1% agarose gel.1.DNA marker;2.PCR product;3.Negative control;B.Restriction mapping of recombinant plasmid pET28a(+)/Tp0971 digested with BamH Ⅰ and Hind Ⅲ.1,4.DNA marker;2.PCR product;3.Recombinant plasmid pET28a(+)/Tp0971 digested with BamH Ⅰ and Hind Ⅲ.
2.3 重组蛋白的鉴定 Tp0971表达产物经SDS-PAGE后,加入TBST稀释后的6-His-Tag单抗为一抗,采用Western blot方法鉴定表达产物,结果显示在29 kD初可见明显的条带,而对照组无相应条带(图3)。
2.4 重组蛋白的纯化 重组菌用B-PER裂解并经Ni-NTA过柱后,用Buffer1、Buffer2以及Eluent进行洗脱。SDS-PAGE结果显示Buffer2能洗脱所有杂蛋白,而最终Eluent洗脱后产物得到了进一步纯化(图4)。
2.5 Tp0971蛋白对巨噬细胞分泌细胞因子的影响 因CD11b和CD36是巨噬细胞表面的特征性分子,因此我们在Tp0971蛋白刺激巨噬细胞之前,采用Western blot检测了PMA处理THP-1细胞前后细胞膜上CD11b和CD36表达的变化。结果显示,未经PMA处理的THP-1细胞表面CD11b和CD36表达水平低下,经160 nmol/L PMA诱导后,细胞膜上CD11b和CD36明显增高,而内参Gα蛋白保持恒定(图5),表明THP-1成功诱导为巨噬细胞。此外,未经蛋白刺激的巨噬细胞细胞因子分泌水平很低。而用不同浓度Tp0971蛋白刺激后24 h后,细胞上清中IL-8、IL-1β和IL-6水平显著增高(表1)。为排除细胞因子分泌为重组蛋白中内毒素污染的可能,刺激蛋白经去内毒素后,鲎实验结果显示内毒素含量<10 pg/ml(结果略)。

图2 不同IPTG对Tp0971在大肠杆菌中表达的影响Fig.2 Effect of different IPTG on expression of Tp0971 in Escherichia coliNote: Lane 1,3,5,7 and 10.Supernatant of the pET28a(+)/Tp0971 expressing bacteria induced by 0.2,0.5,0.8,1.0 and 1.5 mmol/L IPTG;Lane 2,4,6,8 and 11.Precipitation of the pET28a(+)/Tp0971 expressing bacteria induced by 0.2,0.5,0.8,1.0 and 1.5 mmol/L IPTG;Lane 12.No IPTG-induced bacteria;13.Bacteria transfected with pET28a(+);14.E.coli Rosetta.

图3 Tp0971重组蛋白的Western blot鉴定Fig.3 Western blot identification of Tp0971 recombin-ant proteinNote: Lane 1.pET28a(+)/Tp0971 recombinant protein;Lane 2.Purificated recombination protein;Lane 3.Expression bacteria with pET28a(+).

图4 Tp0971重组蛋白纯化效果Fig.4 Purification effect of Tp0971 recombinant proteinNote: Lane 1.Supernatant of broken Tp0971 recombinant protein;Lane 2.Cell lysate flow-through;Lane 3.Buffer 1 washed protein;Lane 4.Buffer 2 washed protein;Lane 5.Buffer eluated protein;Lane 6.Protein marker.

图5 PMA诱导THP-1细胞表达CD11b和CD36Fig.5 PMA induces THP-1 cells expression of CD11b and CD36
表1 不同浓度Tp0971对细胞因子分泌的影响
Tab.1 Effects of different concentrations of Tp0971 on secretion of cytokines

GroupsIL-8(ng/ml)IL-6(ng/ml)IL-1β(pg/ml)Control9.6±5.215.5±8.122.3±5.2Tp0971(0.1mmol/kg)30.7±7.31)46.2±7.51)32.5±4.41)Tp0971(1.0mmol/kg)85.1±6.21) 147.9±18.61) 163.8±14.51)Tp0971(5.0μg/ml)113.5±5.51)251.3±5.01)209.4±5.61)Tp0971(10.0μg/ml) 131.6±10.61)272.5±6.71) 212.6±10.21)
Note:1)P<0.05,as compared with the control group.

图6 TLR2 siRNA干扰效果Fig.6 Silence of TLR2 expression by siRNA

图7 Tp0971或TLR2抗体对细胞核中p65含量的影响Fig.7 Effect of Tp0971 or TLR2 antibody on content of p65 in nucleus
表2 抑制TLR2和NF-κB对巨噬细胞分泌细胞因子的影响
Tab.2 Inhibition of TLR2 and NF-κB on secretion of cytokines in macrophages

GroupsIL-8(ng/ml)IL-6(ng/ml)IL-1β(pg/ml)Control9.6±5.215.5±8.122.3±5.2 Tp0971131.6±10.61)272.5±6.71)212.6±10.21)Tp0971+controlAb127.6±14.3 280.9±8.1 203.3±7.1 Tp0971+TLR2Ab63.5±10.52)114.8±9.32)70.6±8.82)Tp0971+TLR2controlsiRNA118.7±11.1 279.3±6.8 199.7±16.7Tp0971+TLR2siRNA48.9±6.62)106.6±7.02)61.4±9.42)Tp0971+PDTC44.7±10.32)113.7±8.22) 80.3±17.52)
Note:1)P<0.05,as compared with the control group; 2)P<0.05,as compared with 10.0 μg/ml Tp0971.
2.6 TLR2/NF-κB与细胞因子分泌有关 巨噬细胞在用Tp0971刺激前,先用10 μg/ml TLR2单克隆抗体孵育30 min,然后以10.0 μg/ml Tp0971刺激24 h,ELISA结果显示,TLR2抗体能显著抑制IL-8、IL-6和IL-1β的产生。同时采用TLR2 siRNA干扰其表达后(图6),也得到了类似的结果(表2)。Western blot结果也显示,Tp0971处理后,细胞核中p65含量显著增多,而用TLR2抗体孵育后,其含量明显减少(图7)。采用25 μmol/L NF-κB抑制剂PDTC预处理细胞1 h后,也可显著抑制IL-8、IL-6和IL-1β的分泌(表2)。
3 讨论
由于缺乏理想的人工培养基,Tp至今无法人工培养,因此研究Tp的致病机制依赖于体外研究。Tp0971蛋白位于细胞外膜,基因全长612 bp,编码220个氨基酸[5]。克隆表达该蛋白时,表达载体的选择至关重要。pET28a(+)是属于pET质粒家族的融合表达载体,其基因中含有6个组氨酸的编码序列,这在将外源重组蛋白带上纯化标签的同时,对外源重组蛋白的结构和功能影响非常小[8]。本研究在纯化Tp0971时,通过组氨酸与Ni2+的螯合作用,重组蛋白与Ni-NTA琼脂柱稳定地结合,获得较高纯度的重组蛋白[9]。为了观察Tp0971重组蛋白潜在的致炎活性,本研究选用成熟的巨噬细胞为研究对象,其原因是它对各种刺激因素很敏感,并且在Tp早期感染中发挥重要作用[10]。本研究发现,Tp0971膜蛋白能刺激巨噬细胞分泌IL-8、IL-6和IL-1β,且其分泌水平与Tp0971的浓度呈一定的剂量依赖关系。这些细胞因子的分泌在Tp感染过程中可能具有双重效应:一方面是能促进固有免疫系统清除病原体;另一方面也决定了炎症反应的结局,并可能是Tp感染病理损伤的重要因素。
TLR2是固有免疫系统识别Tp的重要受体。有研究表明,Tp膜蛋白在CD14分子的协同作用下,能将感染信号从胞外转入胞内[11]。本研究采用TLR2中和抗体以及siRNA处理后,结果显示细胞因子分泌水平显著减少。NF-κB是参与调控细胞因子分泌的主要核转录因子。细胞静息状态下,它位于细胞浆内。在应激因素或炎症刺激下能被激活,其p65亚基从细胞浆转位到细胞核内。因此细胞核中p65的含量是NF-κB激活的标志[12]。本研究也发现,Tp0971作用巨噬细胞60 min后,可显著诱导p65核转位,采用TLR2中和抗体孵育后,p65核转位明显降低,这表明NF-κB的激活与Tp0971和TLR2的结合有关。随后用NF-κB特异抑制剂PDTC预处理巨噬细胞后,结果发现PDTC可明显抑制Tp0971诱导细胞因子的分泌。由此可见,Tp0971诱导IL-8、IL-6和IL-1β的分泌与TLR2/NF-κB通路的激活有关。
总之,本研究初步证实Tp0971能够诱导巨噬细胞分泌细胞因子,这可能是引起梅毒免疫病理损伤的基础。同时发现Tp0971能够活化TLR2/NF-κB途径信号通路,并参与了IL-8、IL-6和IL-1β的分泌。但本研究发现即便采用siRNA或中和抗体、抑制剂处理均不能完全抑制细胞因子的分泌,这表明除了TLR/NF-κB通路外,还存在其他的受体介导的信号通路本研究是进行Tp致病因子筛选的一个新尝试,也初步表明Tp0971可能是Tp的毒力分子,结合其具有较好的免疫原性,因此在随后的研究中我们将对其功能开展进一步研究。
[1] Gopal P,Shah RB.Primary anal canal syphilis in men:the clinicopathologic spectrum of an easily overlooked diagnosis[J].Arch Pathol Lab Med,2015,139(9):1156-1160.
[2] Cunha CB,Friedman RK,de Boni RB,etal.Chlamydia trachomatis,Neisseria gonorrhoeae and syphilis among men who have sex with men in Brazil[J].BMC Public Health,2015,15:686.
[3] Houston S,Taylor JS,Denchev Y,etal.Conservation of the host-interacting proteins Tp0750 and pallilysin among treponemes and restriction of proteolytic capacity to treponema pallidum[J].Infect Immun,2015,83(11):4204-4216.
[4] Malemud CJ,Lewis AC,Wylie MA,etal.U0126,an inhibitor of mek1/2,increases tumor necrosis factor-α-induced apoptosis,but not interleukin-6 induced apoptosis in C-28/I2 human chondrocytes[J].J Autoimmune Disord,2015,9(1):1-4.
[5] Dufayard JF,Duret L,Penel S,etal.Tree pattern matching in phylogenetic trees:automatic search for orthologs or paralogs in homologous gene sequence databases[J].Bioinformatics,2005,21(11):2596-2603.
[6] 曾铁兵,刘小军,张跃军,等.梅毒螺旋体tp0971重组蛋白的表达及其在梅毒血清学诊断中的初步评价[J].中国病原生物学杂志,2010,5(6):411-413.
[7] Shao MX,Nadel JA.Dual oxidase 1-dependent MUC5AC mucin expression in cultured human airway epithelial cells[J].Proc Natl Acad Sci U S A,2005,102(3):767-772.
[8] Mirkalantari S,Amirmozafari N,Kazemi B,etal.Molecular cloning of virB12 gene of Brucella melitensis 16M strain in pET28a vector[J].Asian Pac J Trop Med,2012,5(7):511-513.
[9] Vázquez-Blomquist D,González S,Duarte CA.Effect of promoters on cellular immune response induced by recombinant fowlpox virus expressing multi-epitope polypeptides from HIV-1[J].Biotechnol Appl Biochem,2002,36(Pt 3):171-179.
[10] Marra CM,Tantalo LC,Sahi SK,etal.Reduced treponema pallidum-specific opsonic antibody activity in HIV-infected patients with syphilis[J].J Infect Dis,2016,213(8):1348-1354.
[11] Marra CM,Sahi SK,Tantalo LC,etal.Toll-like receptor polymorphisms are associated with increased neurosyphilis risk[J].Sex Transm Dis,2014,41(7):440-446.
[12] Bu Y,Li X,He Y,etal.A phosphomimetic mutant of RelA/p65 at Ser536 induces apoptosis and senescence:An implication for tumor-suppressive role of Ser536 phosphorylation[J].Int J Cancer,2016,138(5):1186-1198.
[收稿2016-09-05 修回2016-11-15]
(编辑 张晓舟)
Treponema pallidum membrane protein Tp0971 induce macrophages to produce cytokines via TLR2/NF-κB pathway
ZHANGYue-Jun,JIANGChuan-Hao,LIULiang-Zhuan,JIANGZui-Ming,GUMin,WUYi-Mou.
CenterofClinicalLaboratoryofZhuzhouCentralHospitalofHu′nanProvince,Zhuzhou412007,China
Objective:To investigate the production of cytokines from macrophages induced by Treponema pallidum membrane proteins Tp0971.Methods: The Tp0971 was amplified by PCR from a preparation of T.pallidum genomic DNA and then sub-cloned into the prokaryotic expression vector pET28a(+)to construct the recombinant plasmid pET28a(+)/Tp0971.The recombinant plasmids were transfected into E.coli Rosseta strain to express recombinant protein Tp0971 by IPTG induction.The expression products were purified by Ni-NTA affinity chromatography,and the concentration was determinated by BCA method.Detoxi-Gel was used to remove endotoxin contamination in during the protein preparation.After induced by PMA,cells were incubated with various concentrations of recombinant proteins Tp0971.The expression levels of IL-8,IL-1β and IL-6 were detected by ELISA.Cells were pretreated with anti-TLR2 antibody or TLR2 siRNA,or pyrrolidine dithiocarbamate,an inhibitor of NF-κB,for evaluation of the role of TLR2 and NF-κB in the production of cytokines by ELISA.Results: Tp0971 gene were amplified successfully by PCR,and the recombinant plasmids were confirmed by enzyme digestion and sequencing.SDS-PAGE results showed three recombinant proteins were expressed as the soluble with a relative molecular weight of 29 kD.0.5-10 μg/ml of Tp0971 could stimulate macrophages to produce IL-8,IL-1β and IL-6 dose-dependently.After cells were pretreated with siRNA or neutralizing antibody targeting TLR2 or the PDTC,the Tp0971 induced protein expression levels of proinflammatory cytokines were significantly reduced in macrophages.Conclusion: Tp0971 induces macrophages to produce proinflamatory cytokines via TLR2/NF-κB pathway.
Treponema pallidum;Membrane protein;Cytokines;Toll like receptor 2
10.3969/j.issn.1000-484X.2017.05.007
①本文受湖南省医药卫生科研计划(B2013-134)资助。
张跃军(1979年-),男,硕士,主管检验师,主要从事临床微生物检验方面研究,E-mail:xiaoyezhangjun@163.com。
及指导教师:吴移谋(1954年-),男,硕士,教授,主要从事病原体致病机制、快速诊断与防治研究,E-mail:yimouwu@sina.com。
R377
A
1000-484X(2017)05-0668-05
②南华大学病原生物学研究所,衡阳421001。

