活化蛋白-1在急性一氧化碳中毒迟发性脑病大鼠海马的表达变化
张益梅 张奕雯 何 林 李经伦
(西南医科大学附属医院,泸州646000)
活化蛋白-1在急性一氧化碳中毒迟发性脑病大鼠海马的表达变化
张益梅 张奕雯 何 林 李经伦
(西南医科大学附属医院,泸州646000)
目的:观察急性一氧化碳中毒后不同时间点大鼠海马AP-1的表达变化。方法:腹腔注射一氧化碳的方法制备一氧化碳中毒迟发性脑病模型,HE染色观察大鼠海马区病理变化,免疫组化及Western blot法检测AP-1的表达水平,TUNEL染色计数海马CA1区凋亡神经元。结果:HE染色,空气组(AC组)、空白组(BC组)各时间点海马区细胞形态正常;一氧化碳组(CO组)海马区细胞肿胀、细胞数目减少,排列紊乱,细胞间隙扩大,细胞核碎裂、深染、固缩。免疫组化:CO组各时间点AP-1表达量均高于AC组及BC组,3 d达峰值,组内第3天与其余各时间点比较差异有统计学意义(P<0.05)。Western blot:AP-1表达在时间分布趋势上与免疫组化结果一致。TUNEL染色:CO组各时间点凋亡指数均较AC组、BC组多,于毒染后7 d达高峰差异有统计学意义(P<0.05)。结论:大鼠海马区AP-1表达增高,可能进一步导致细胞凋亡和炎症免疫反应,成为DEACMP发病的重要机制之一。
急性一氧化碳中毒迟发性脑病;活化蛋白-1;细胞凋亡
一氧化碳(Carbon monoxide,CO)是一种无色无味的有毒气体,研究表明它与血红蛋白的亲和力是氧气的240倍[1],严重阻碍血红蛋白与氧气的结合和氧的解离,人体在短时间吸入一定程度的一氧化碳,将造成全身多系统多器官不同程度缺氧,尤其是对缺血缺氧耐受最差的大脑影响最显著。在我国,急性一氧化碳中毒的发病率和死亡率均占职业和非职业危害前位[2]。临床上有大约10%~30%的一氧化碳中毒患者经成功抢救急性中毒症状缓解后经过约3~60 d“假愈期”出现以痴呆、精神症状、锥体外系功能障碍等为主的神经精神症状,称为急性一氧化碳中毒迟发性脑病(Delayed encephalopathy after acute carbon monoxide poisoning,DEACMP)[3]。该病病程长、疗效差、预后不理想,严重影响患者的生活质量,给家庭及社会造成了极大的负担[4]。多年来,众多专家学者对其进行了大量研究,提出有神经递质紊乱、自由基损伤、细胞凋亡及自身免疫反应损伤等机制,但迄今无一理论可明确阐述其发病机制,因此探索其发病原因仍是目前医学界研究的热点和难点[5]。活化蛋白-1(Activated protein-1,AP-1)是一类反式调节因子,主要由c-Jun和c-fos组成的同源或异源二聚体,其作用广泛,各种理化、生物学刺激及细胞应激都可促进其表达活化,进而对细胞增殖、凋亡等生物学过程进行调控[6]。本研究检测急性一氧化碳中毒后不同时间点大鼠海马AP-1的表达变化。探讨AP-1与DEACMP之间的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性SD大鼠156只,体重180~300 g,由西南医科大学实验动物中心提供。动物饲养:每笼6只于12 h明暗交替的动物房温室饲养(18~23℃),自由进食摄水,定期清洁鼠笼。
1.1.2 实验材料 一氧化碳气体(体积分数为99.9%)由四川西南化工研究院提供;一抗AP-1兔抗鼠多克隆抗体,辣根过氧化物酶标记的羊抗兔二抗,美国CST公司;TUNEL试剂盒,北京生物科技公司。
1.2 实验方法
1.2.1 实验动物分组 将大鼠随机分为3组:急性一氧化碳中毒迟发性脑病组(CO组)60只、空气组(AC组)60只、空白对照组(BC组)36只。各组再随机均等分至毒染后1、3、7、14、21、28 d 6个时间点亚组,CO组、AC组各时间点10只,BC组各时间点6只。
1.2.2 动物模型的制备 采用改良式腹腔注射一氧化碳法[7]染毒制备急性一氧化碳中毒迟发性脑病动物模型。CO组首次腹腔注射一氧化碳100 ml/kg,间隔4 h追加注射一次,连续追加3次,追加剂量为首次剂量的1/2 ;AC组同法注射等量空气;BC组不做任何处理。3组大鼠分别在毒染前及每次注射后2、4 h取鼠尾血1 ml用全自动血气分析仪监测染毒大鼠血碳氧血红蛋白(Carbon monoxide hemoglobin,HbCO)浓度,以血中HbCO浓度维持在50%以上为中毒指标。用Morris水迷宫实验检测大鼠的认知能力。通过观察大鼠的症状体征并结合以上两项指标综合判断CO组大鼠是否发生了迟发性脑病。
1.2.3 标本制备 3组大鼠在相应的6个时间点随机选取一半进行麻醉、心脏灌洗、取材固定在4%多聚甲醛中,制作石蜡切片,用于HE、免疫组化及TUNEL染色。各组另一半直接断颈处死取出全部脑组织,在冰盘上快速分离两侧海马组织用于Western blot实验。HE染色:将石蜡切片经过脱蜡、脱苯、水洗、甩干、染色、分色、冲洗、复染、脱水、透明、固封等步骤后,将切片置于400倍光镜下观察病理改变,并采集图像。
免疫组化染色:采用SP法,石蜡切片脱蜡至水,于3%H2O2甲醛溶液中15 min,磷酸盐缓冲液洗5 min;浸入0.01 mol/L(pH6.0)枸橼酸盐缓冲液中,加热至98℃ 20 min(进行抗原修复),室温冷却30 min,磷酸盐缓冲液洗5 min;加正常山羊血清封闭液37℃孵育30 min,滴加一抗(1∶100 稀释,兔抗鼠AP-1多克隆抗体)4℃过夜;磷酸盐缓冲液洗5 min×3,加二抗37℃孵育30 min;磷酸盐缓冲液洗5 min×3, 二氨基联苯胺显色10 min。苏木精复染,脱水,透明,封片后显微镜下观察。
Western blot法观察AP-1表达方法:海马细胞总蛋白的提取;蛋白变性;BCA法测定蛋白含量;SDS-PAGE电泳;转膜;免疫反应;化学发光、显影、定影;凝胶图象分析,将胶片进行扫描或拍照,经β-actin校正后,用凝胶成像系统分析各组AP-1及内参表达条带的灰度值。
TUNEL染色:具体操作按照说明书进行。甘油明胶封片后光镜观察。
1.2.4 图像分析 免疫组化染色阳性细胞计数:将细胞胞浆、胞核染成淡黄色、棕黄色或棕褐色定义为阳性表达细胞。采用人工计数半定量分析法计数[8],取5个视野的平均数作为该张切片的阳性细胞表达数。
TUNEL染色结果计数:每张切片随机选取海马CA1区5个互不重叠视野,观察细胞核有棕黄色颗粒为阳性细胞,记录每个视野的凋亡细胞数和细胞总数,计算出凋亡指数(Apoptotic index,AI),AI=凋亡细胞数/细胞总数×100%,对5个视野内计数的均数进行统计分析。
2 结果
2.1 HE染色结果 AC组、BC组大鼠海马CA1区细胞排列紧密整齐,细胞形态正常,胞膜完整,核结构清晰,细胞间质均匀致密。且各时间点HE染色结果无明显变化。CO组1、3 d细胞肿胀,数目减少,并可见少许神经元变性坏死;7 d细胞数目明显减少,神经元变性、坏死增多,胞核碎裂、固缩明显;14 d细胞排列散乱、肿胀明显,并可见胶质细胞增生浸润;21、28 d细胞皱缩,胞核固缩、碎裂、深染明显,可见坏死神经元被吸收后留下的龛影(图1)。
2.2 免疫组化结果 AP-1阳性细胞呈棕黄色。AC组、BC组可见少量的阳性细胞,组内各时间点变化不明显,两组之间比较差异无统计学意义(P>0.05);CO组染毒后1 d升高,3 d达高峰,后逐渐下降,至28 d时仍有较高表达,CO组各时间点AP-1表达量均高于AC组及BC组,且差异有统计学意义(P<0.05),CO组内3 d与其余各时间点比较差异有统计学意义(P<0.05,图2、表1)

图1 各组大鼠7 d海马CA1区细胞HE染色情况(×400)Fig.1 HE staining of each group in hippocampal CA1 area of rats in 7 day(×400)Note: A.AC group;B.BC group;C.CO group.
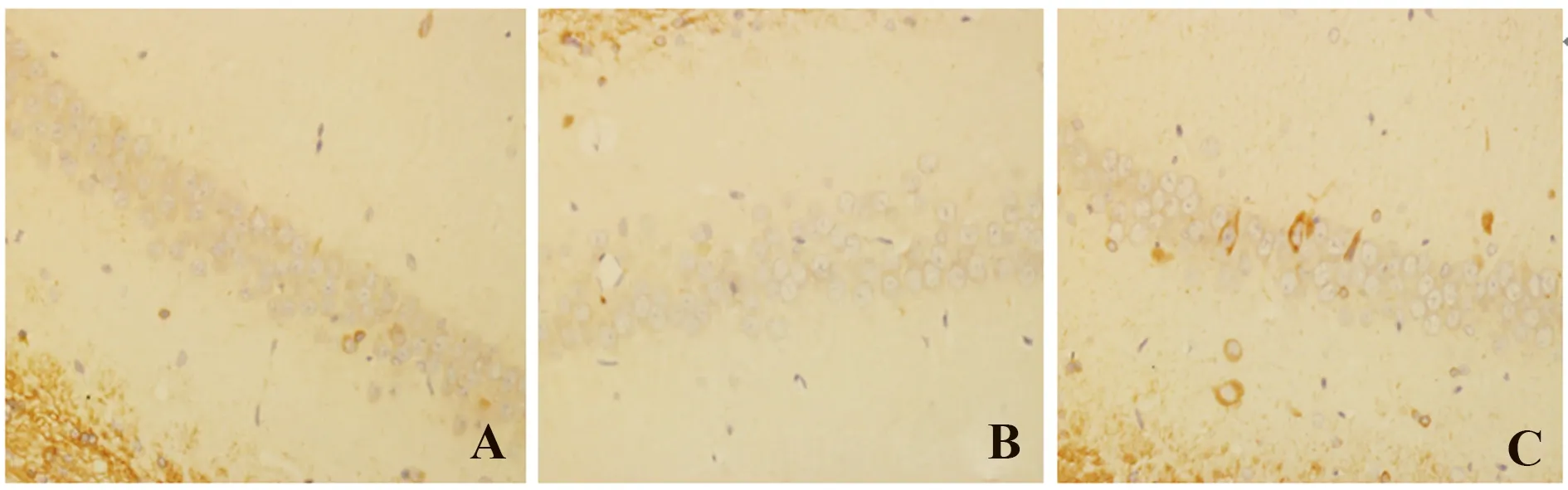
图2 各组大鼠3 d海马AP-1蛋白的免疫组化表达(×400)Fig.2 Immunohistochemistry staining of each group of AP-1 in hippocampal CA1 area of rats in 3 day(×400)Note: A.AC group;B.BC group;C.CO group.

图3 三组大鼠海马AP-1蛋白Western blot结果Fig.3 Western blot results of AP-1 in hippocampal of rats of three groups
2.3 Western blot结果 AC组、BC组大鼠海马AP-1表达量很少,CO组大鼠海马在1 d时增多,3 d时达高峰,7 d开始下降,至28 d时表达仍高于AC组和BC组。AP-1表达在时间分布趋势上与免疫组化结果一致(图3)。
2.4 TUNEL染色结果 AC组、BC组大鼠海马区各时间点凋亡细胞少,且变化不明显,两组间比较差异无统计学意义(P>0.05);CO组各时间点凋亡指数均较AC组、BC组多,差异有统计学意义(P<0.05),于毒染后7 d达高峰,CO组内7 d与其余各时间点比较差异有统计学意义(P<0.05,图4、表2)。
2.5 AP-1与凋亡指数的相关性分析 经Pearson直线相关分析,CO组大鼠海马CA1区AP-1蛋白的表达与细胞凋亡指数存在正相关关系(r=0.963,P<0.05)。


TimeCOACBC1d3.50±0.511)2)2.02±0.481.83±0.523d7.92±0.881)2)3)1.98±0.572.05±0.747d6.40±1.171)2)2.25±0.481.89±0.8114d5.25±1.011)2)2.30±0.592.01±0.7221d4.36±1.321)2)2.10±0.971.99±0.4428d3.74±0.691)2)2.16±0.542.17±0.50
Note:Vs AC group,1)P<0.05;vs BC group,2)P<0.05;vs other time point in CO proup,3)P<0.05.
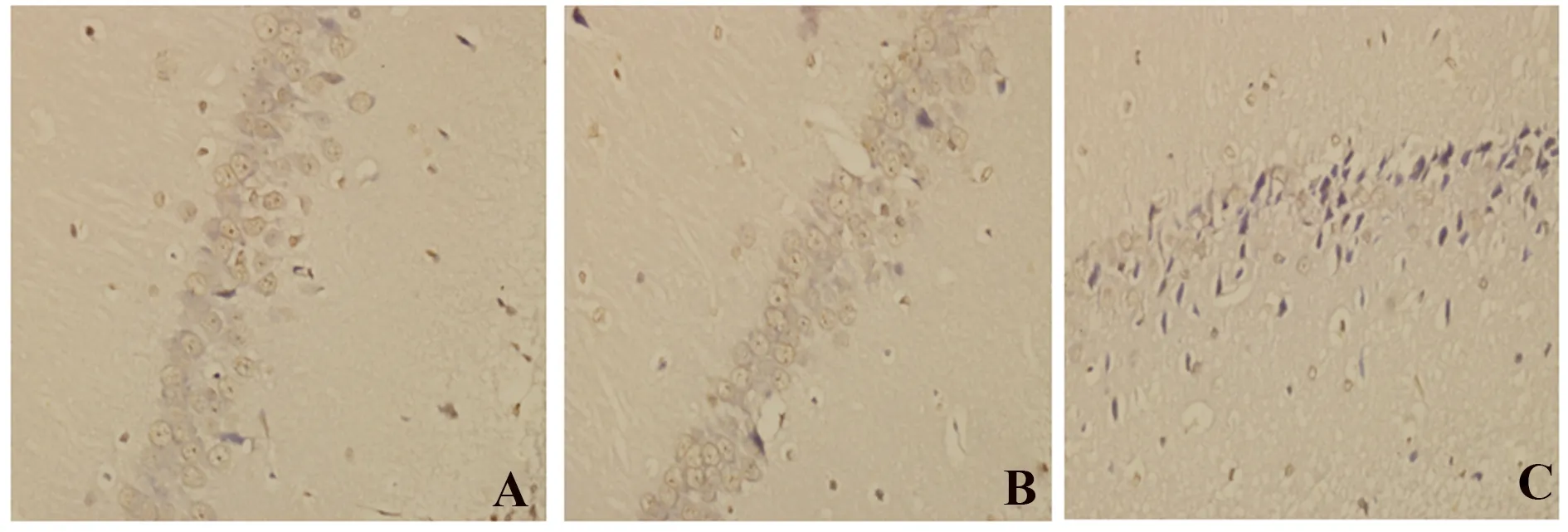
图4 7 d大鼠海马细胞凋亡情况(×400)Fig.4 Cell apoptosis of each group of in hippocampal of rats in 7 day(×400)Note: A.AC group;B.BC group;C.CO group.

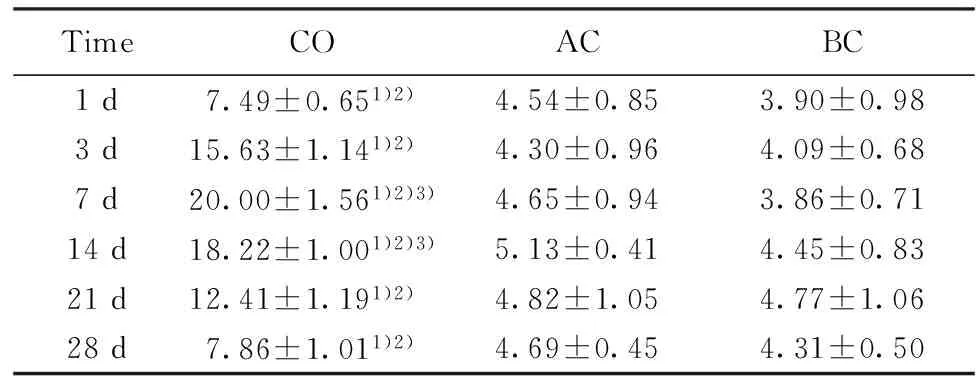
TimeCOACBC1d7.49±0.651)2)4.54±0.853.90±0.983d15.63±1.141)2)4.30±0.964.09±0.687d20.00±1.561)2)3)4.65±0.943.86±0.7114d18.22±1.001)2)3)5.13±0.414.45±0.8321d12.41±1.191)2)4.82±1.054.77±1.0628d7.86±1.011)2)4.69±0.454.31±0.50
Note:Vs AC group,1)P<0.05;vs BC group,2)P<0.05;vs other time point in CO group,3)P<0.05.
3 讨论
HbCO体内半衰期约为8 h,不到24 h能恢复到正常生理水平,DEACMP发生在一氧化碳排出体外HbCO恢复到正常生理水平之后,因此用单纯的一氧化碳导致的缺氧很难解释“假愈期”和DEACMP的迟发现象[9]。关里等[10]发现急性一氧化碳中毒早期凝血功能减退,血液稀释,待血中一氧化碳排出(末次注射一氧化碳1 d) 后,则出现血液浓缩、凝血功能大幅增强(PTA、PT、APTT 和Fib在7~14 d达高峰)的全脑缺血再灌注改变。这一血液流变学变化与DEACMP发病的病程相符。有专家提出了缺血再灌注损伤学说[11]。细胞凋亡是脑缺血再灌注损伤的重要病因,Piantadosi等[12]于1997年利用免疫组化和电镜首次证实一氧化碳中毒后大鼠脑内有细胞凋亡发生,其后对一氧化碳中毒死亡患者尸检也证实了上述现象的发生。本实验CO组各时间点凋亡指数均较AC组、BC组多,于毒染后7 d达高峰。该实验结果与穆永茂等[13]基本一致。说明DEACMP的发病过程中确实有细胞凋亡的发生。细胞凋亡又叫程序性的细胞死亡,是在基因调控下的细胞主动死亡过程,该过程涉及酶的参与、蛋白的合成和一系列信号激活。AP-1是一类重要的真核细胞转录因子,是诸多细胞信号传导途径在细胞核内的交汇点,能与许多基因上的AP-1位点结合,启动多种与细胞分裂和增殖相关基因的转录,参与细胞的增殖、分化和凋亡等过程。AP-1因细胞的类型、细胞所处的状态以及刺激信号的种类不同可呈现出促进细胞凋亡或细胞增殖的作用。研究证实,AP-1的高表达与缺血性卒中、神经系统退行性病变、癫痫以及新生儿缺血缺氧性脑损伤等疾病的神经元凋亡有关[14-18],但DEACMP的细胞凋亡是否与AP-1有关,目前在这方面的研究较少。我们的实验观察到CO组各时间点AP-1表达量均高于AC组及BC组,于染毒后3 d达高峰,各时间点的变化趋势与细胞凋亡一致,且表达的时间先于细胞凋亡发生的时间,通过Pearson直线相关分析表明AP-1的表达与细胞凋亡指数存在正相关关系(r=0.963,P<0.05),因而推测AP-1可能通过某些信号通路激活了凋亡相关靶基因的表达促进细胞凋亡,参与DEACMP 的发病过程。Thom 等[19]认为,免疫炎症损伤可能参与了DEACMP 的发病过程。DEACMP 患者发病初期血清中IL-1β、IL-8、IL-10 水平明显增高,并且随着病情的好转,血清中上述指标明显低于发病初期[20]。李自力等[21]发现,急性一氧化碳中毒患者血清中TNF-α和IL-8含量均明显增高。CRP是炎症反应的敏感指标之一,崔静等[22]报道DEACMP患者血清的CRP一直维持在较高水平。由此可见,在DEACMP 的发病过程确实有炎症反应的发生。炎症介质大多受转录因子的调控。AP-1是细胞炎症反应关键转录因子,它可以调节细胞炎性因子基因表达,导致炎症持续和发展[23]。有研究表明用AP-1 蛋白的突变形式封闭AP-1 活性后,发现IL-8的表达明显受到抑制[24]。因此,AP-1 的异常表达可引发异常的炎症反应。然而DEACMP的炎症反应是否与AP-1 的异常表达相关,目前尚无相关报道。本实验属于观察性实验,尚不能说明AP-1在DEACMP发病中的具体作用机制,还需要进一步研究。
综上,AP-1的高表达与DEACMP 的发病过程有密切关系,将AP-1作为一个分子治疗靶,有望成为临床上治疗DEACMP的新的突破口。
[1] Koylu R,Cander B,Dunder AD,etal.The importance of H-FABP in determining the severity of carbon monoxide poisoning[J].Clin Med Res,2011,3(6):296-302.
[2] 高春锦,葛 环,赵立明,等.一氧化碳中毒临床治疗指南(一)[J].中华航海医学与高压氧医学杂志,2012,19(2):127-129.
[3] Goldstein M.Carbon monoxide poisoning[J].J Emerg Nurs,2008,34(6):538.
[4] 龚德山,郭 辉,王开颜,等.内质网应激分子IRE1-α、JNK 在难治性颞叶癫痫患者脑组织中的表达[J].立体定向和功能性神经外科杂志,2015,12(5):272-275.
[5] Thom SR.Carbon monoxide inhalation increases microparticles causing vascular and CNS dysfunction[J].Toxicol Appl Pharmacol,2013,273(2):410-417.
[6] Yuan F,Xu Z,Yang M,etal.Overexpressed DNA polymerase iota regulated by JNK/c-Jun contributes to hypermutagenesis in bladder cancer[J].PLoS One,2013,8(7):e69317.
[7] 李勇军,刘 强,赵春梅,等.改良式腹腔注射CO法建立急性CO中毒迟发脑病大鼠模型[J].宁夏医科大学学报,2012,34(4):334-336.
[8] 于 萍,步 宏,王 华,等.免疫组化结果的图像分析与人工计数方法的对比研究[J].生物医学工程学杂志,2003,20(2):288-290.
[9] Gorman D,Lin HY,Williams C,etal. Early evidence of a regulated response to hypoxaemia in sheep that preserves the brain cortex[J]. Neurosci Lett, 2006, 394:174-178.
[10] 关 里,赵金恒,毛丽君,等.急性CO 中毒大鼠脑循环的变化特点研究[J].中国工业医学杂志,2016,29(2):83-87.
[11] Gorman D,Drewry A,Huang YL.The clinical toxicology of carbon monoxide[J].Toxicology,2003,187:25-38.
[12] Piantadosi CA,Zhang J,Levin SD,etal.Apoptosis and delayed neuron-al damage after carbon monoxide poisoning in the rat[J].Exp Neurol,1997,147:103-104.
[13] 穆永茂,王艳丽,李建明,等.急性一氧化碳中毒大鼠脑海马区细胞凋亡及脑红蛋白的表达变化[J].中医学报,2014,29(12):426-427.
[14] Gong J,Sun F,Li Y,etal.Momordica charantia polysaccharides could protect against cerebral ischemia/reperfusion injury through inhibiting oxidative stress medhted c-Jun N-ter mina1 kinase 3 signaling pathway[J].Neuropharmacology,2015,91:123-134.
[15] Akhter R,Sanphui P,Das H,etal.The regulation of p53 up-regulated modulator of apoptosis by JNK/c-Jun pathway in β-amyloid-induced neuron death[J].J Neurochem,2015,134(6):1091-1103.
[16] Park KH,Shin KS,Zhao TT,etal.L-DOPA modulates cell viability through the ERK-c-Jun system in PC12 and dopa minergic neuronal cells[J].Neuropharmacology,2016,101:87-97.
[17] Tao XF,Sun XC,Yin LH,etal.Dioscin ameliorates cerebral ischemia/reperfusion injury through the downregulation of TLR4 signaling via HMGB-1 inhibition[J].Free Radic Biol Med,2015,84:103-115.
[18] 李 艳,赵旭东.转录因子活化蛋白-1在颞叶癫痫模型小鼠海马的表达变化[J].中国免疫学杂志,2012,28(12):1103-1106.
[19] Thom SR,Bhopale VM,Fisher D,etal. Delayed neuropathology after carbon monoxide poisoning is immune-mediated[J].Proc Nat Acad Sci U S A,2004,101:13660-13665.
[20] 甄 龙,顾仁骏,张 萍,等.急性一氧化碳中毒后迟发性脑病患者血清中白细胞介素水平及其临床意义[J].中华劳动卫生职业病杂志,2008,26(9):561-563.
[21] 李自力,李培杰,陈天铎,等.急性一氧化碳中毒患者TNF-α和IL-8水平的变化及临床意义[J].中国急救医学,2002,22(11):661-662.
[22] 崔 静,申雪峰,申蕙芸,等.急性一氧化碳中毒迟发性脑病患者血清C 反应蛋白变化的临床意义[J].中国民康医学,2012,22(11):2706.
[23] Meade AJ,Meloni BP.AP-1 inhibitory peptides are neuropro-tective following acute glutamate excitotoxicity in primarycortical neuronal cultures [J].Neurochem,2010,112 (1):258-270.
[24] Auvin S,Mazarati A,Shin D,etal.Inflammation enhances epileptogenesis in the developing rat brain[J].Neurobiol Dis,2010,40(1):303-310.
[收稿2016-11-10 修回2016-12-24]
(编辑 许四平)
Study of changing levels of AP-1 in hippocampus of delayed encephalopathy after acute carbon monoxide poisoning rats
ZHANGYi-Mei,ZHANGYi-Wen,HELin,LIJing-Lun.
AffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China
Objective:To investigate the levels of AP-1 in hippocampus of rats at different time points after carbon monoxide poisoning.Methods: Carbon monoxide poisoning delayed encephalopathy model by using intraperitoneal injection of carbon monoxide.Uesd HE observed the pathological changes in hippocampus of rats.The levels of AP-1 was observed by immunohistochemistry and Western blot analysis.TUNEL was used to detect apoptotic neurons in hippocampal CA1 area.Results: HE dyeing conditions,the hippocampus cell of air group (AC) and blank group (BC) were normal at each time point.Pathological changes occurred in the hippocampus cell of Carbon monoxide group (CO),reduction in the number of cells,disorder of cells,intercellular space expansion,nuclear fragmentation,anachromasis and pyknotic.Immunohistochemical results,the AP-1 expression level at each time point in group CO were higher than group AC and BC.On 3th day it reached a peak.The comparison at all time points among the groups in the first three days were significantly different in statistics(P<0.05).Western blot results,the expression of AP-1 was consistented with the immunohistochemical results on the time distribution trend.TUNEL results,AI in group CO was higher than those in group AC and BC at all time points,there were significant differences(P<0.05) and 7th reached the peak of apopotsis.Conclusion: Inside the hippocampus of rats,there are increasing in AP-1 . Maybe it is one of the important pathogenesis of DEACMP .
DEACMP;AP-1;Apoptosis
10.3969/j.issn.1000-484X.2017.05.024
张益梅(1985年-),女,在读硕士,医师,主要从事脑血管疾病研究,E-mail:18384333913 @163.com。
及指导教师:李经伦(1970年-),男,在读博士,副教授,硕士生导师,主要从事脑血管疾病研究,E-mail:ljl031611@163.com。
R743.3
A
1000-484X(2017)05-0750-05

