香菇转色前后Atg8表达的变化规律研究*
房丽丽,杨 丽,李翠新,刘庆洪**
(1.西南林业大学生命科学学院,云南 昆明 650224;2.中国农业大学生物学院,北京 100094)
香菇转色前后Atg8表达的变化规律研究*
房丽丽1,2,杨 丽2,李翠新1,刘庆洪2**
(1.西南林业大学生命科学学院,云南 昆明 650224;2.中国农业大学生物学院,北京 100094)
比对香菇(Lentinula edodes)Atg8蛋白基因的同源序列,经反转录PCR确定香菇Atg8的外显子序列。构建其表达质粒,转化大肠杆菌BL21(DE3)plyS获得其表达菌株。采用镍柱和MonoQ纯化表达的Atg8蛋白,成功制备兔多隆抗体。通过western-blotting对转色前后Atg8蛋白的表达量进行对比。香菇Atg8蛋白基因长度为603 bp,Atg8蛋白分子量25 kDa左右,且为可溶性蛋白。转色后的香菇Atg8蛋白杂交条带较微弱,而转色前杂交条带几乎没有。表明转色后的香菇菌丝Atg8表达量比转色前含量高。
香菇;转色;自噬;Atg8
自噬(Autophagy)是通过包裹蛋白质、受损或破坏的细胞器,运送到溶酶体并降解,再释放到细胞质的过程。自噬分为3种:巨自噬、微自噬、分子伴侣介导自噬[1]。本文未特殊说明均为巨自噬(简称自噬)。自噬参与多种生理和病理活动,是生命活动中必不可少的代谢过程[2]。自噬蛋白(Autophagyrelated gene,ATG)Atg8是自噬过程的核心[3],其是自噬过程中保守的编码蛋白,故用Atg8作为自噬过程的指示蛋白[4-6]。目前自噬的研究主要集中在酵母、线虫、哺乳动物等,针对大型真菌方向的研究鲜见报道。
转色是香菇(Lentinula edodes) 生长过程中很重要的过程。转色的好坏直接关系到香菇的产量与品质[7-8]。目前香菇转色的相关研究主要集中在菌丝的长势、温度、光照、湿度等[9]。研究发现,碳元素与氮元素的比值直接影响香菇的转色[10],而碳元素与氮元素的比值改变(营养缺乏)又可以诱导自噬[11]。本研究探索香菇转色前后自噬Atg8蛋白是否存在差异,确定香菇转色与自噬之间是否存在联系,进一步探讨香菇转色的具体机制。
1 材料与方法
1.1 材料
香菇(Lentinus edodes) 菌种来自香港中文大学,菌种编号L54。
香菇菌棒来自北京顺义、怀柔、密云、房山等地。1.2 主要试剂
1.2.1 香菇菌丝总蛋白质提取液
香菇菌丝总蛋白质提取液的pH为7.5。
1.2.2 相关酶和抗体
TAQ DNA聚合酶、限制性内切酶、T4 DNA连接酶均购自TAKARA公司;M-MLV反转录酶购自Promega公司;DNA和RNA提取试剂盒均购自北京Biomed公司;M-MLVⅢReverse Transcriptasa购自Biomed公司;感受态细胞选用大肠杆菌 BL21(DE3)plyS,购自Biomed公司。
1.2.3 主要仪器
紫外分光光度计9100A,美国Labtech公司;快速蛋白液相色谱系统(FPLC),美国Amersham公司;MonoQ阴离子交换层析,美国GE公司;PCR仪,美国Bio-Rad公司;真空冷冻干燥机,北京六一仪器厂。
1.3 方法
1.3.1 香菇Atg8基因引物设计
使用primer premier5软件设计引物。正向引物:5’-ATGAGGTCAAAGTTCAAGGACGAGC-3’,反向引物:5’-TCATGCATCCATCGGCAGCT-3’。
1.3.2 香菇DNA提取与Atg8克隆
根据试剂盒说明提取香菇基因DNA。
采用1%琼脂糖电泳检测DNA。PCR体系为50 μL,其中 0.25 μL TaKaRa Taq(5 unites·μL-1),5 μL 10×PCR buffer(Mg2+free),3 μL Mg2+,4 μL dNTPs(2.5 mmol·L-1),引物各1 μL,计算DNA模板终浓度小于500 ng·μL-1,补水至50 μL。反应程序:预变性95℃反应30 s,95℃反应0.5 min,56℃反应30 s,35个循环。
1.3.3 mRNA提取与反转录PCR
根据试剂盒说明提取香菇RNA,用1%琼脂糖电泳检测其质量。
第1条cDNA链合成体系:Total RNA终浓度50 ng·μL-1~5 μg·μL-1,1 μL的 Oligo(dT) 20(0.5 μg·μL-1),1 μL的10 mmol·L-1dNTPs,4 μL的5× RT Buffer,0.5 μL的Ribonuclease inhibitor(10 unites·μL-1),1 μL的M-MLV III补水至20 μL,轻轻混匀,50℃孵育50 min。85℃加热15 min后MMLV III失活。PCR体系同上。
1.3.4 TA克隆
使用 TAKARA公司的“pMDTM19-T Vector Cloning Kit”进行TA克隆。
1.3.5 限制性内切酶酶切反应
Atg8片段在37℃酶切3 h。酶切后用1%的琼脂糖电泳进行回收,酶切体系为:20 μL的DNA片段,2 μL的EcoR I,2 μL的Xhol I,4 μL的10×H buffer,加入ddH2O补至50 μL。
pET30a质粒在37℃酶切4 h,酶切后用1%的琼脂糖电泳进行回收。酶切体系为:1 μL的pET30a,2 μL的 EcoR I,2 μL的 Xhol I,4 μL的 10×H buffer,加入ddH2O补至50 μL。
1.3.6 连接反应
插入片段与载体片段分子数的摩尔数比为7: 1,16℃连接过夜。连接体系:1 μL的 T4Ligase buffer,7 μL酶切后的目的片段,1 μL酶切后的载体,1 μL的T4Ligas,加水至10 μL。
1.3.7 表达菌株构建
(1)大肠杆菌转化
取2支感受态细胞放冰上融化后,分别加入1 μL的连接产物和1 μL的Pet-30a载体。冰上孵育30 min,42℃热击90 s后,冰浴2 min。加入500 μL新鲜的LB培养基。37℃,140 r·min-1培养45 min。吸取100 μL涂布在含有硫酸卡那霉素的LB培养基上。37℃倒置培养过夜。
(2)构建质粒鉴定
提取单菌落至20 mL含有硫酸卡那霉素的LB培养基中,37℃,170 r·min-1培养8 h左右,进行菌落PCR。1%琼脂糖电泳检测,与目的条带大小比较。委托公司进行测序,测序结果正确。确定构建正确的质粒。
(3)质粒提取与菌种保存
将含有正确载体的菌接到100 mL的含有硫酸卡那霉素的LB培养基中,采用博迈德质粒提取试剂盒提取质粒。将菌液离心后加入终浓度为20%的甘油,-80℃保存。
1.3.8 Atg8在大肠杆菌中诱导表达
用牙签沾取少量的表达菌株到20 μL含有硫酸卡那霉素的LB培养基中,37℃,170 r·min-1活化过夜。将活化的菌液吸取400 μL到20 mL含有硫酸卡那霉素的LB培养基中,37℃,170 r·min-1培养至菌液在600 nm波长处OD值为0.6~0.8。加入IPTG,37℃,170 r·min-1诱导培养2 h。含有pET30a的大肠杆菌作为阴性对照。取2 mL菌液离心后收集菌体上清,用SDS-PAGE检测表达是否成功。5 000 r·min-1,4℃离心15 min,获取菌株。用lysis buffer洗涤菌体1次,离心。超声波破碎细胞,9 000 r·min-1,4℃离心15 min,收集上清和沉淀。SDSPAGE检测目的蛋白质。
1.3.9 镍柱亲和层析
收集超声破碎上清液用不同浓度咪唑、100 mmol·L-1NaCl、50 mmol·L-1Tris-HCl(pH8.8)缓冲液进行洗脱,每管280 nm波长处检测OD值。绘制洗脱曲线。SDS-PAGE确定目的蛋白纯度。
1.3.10 MonoQ阴离子交换层析纯化
采用20 mmol·L-1Tris-HCl(pH8.0)为A液、1 mol·L-1NaCl和20 mmol·L-1Tris-HCl(pH8.0)为B液,进行线性洗脱收集洗脱液。绘制洗脱曲线。SDS-PAGE确定目的蛋白纯度。
1.3.11 兔多隆抗体制备
Atg8的兔多隆抗体委托华大公司进行制备。
2 结果与分析
2.1 香菇自噬Atg8基因序列比对
不同香菇的自噬基因Atg8序列比对结果见图1。
如图1所示,香港中文大学关海山教授提供的自噬Atg8序列和香菇L54菌丝自噬Atg8序列、与市售香菇的Atg8序列比对一致性高达94.32%。因此,香港中文大学关海山教授提供的自噬Atg8序列可以用于本实验研究。
2.2 香菇自噬Atg8蛋白的同源性
自噬Atg8蛋白的同源性比较见图2。

图1 不同香菇的自噬基因Atg8的序列比对结果Fig.1 Comparison of autophagy gene Atg8 sequence of different Lentinula edodes

图2 自噬Atg8蛋白的同源性Fig.2 Homology of autophagy Atg8 protein
从图2可以看出,香菇L54菌丝提取mRNA经反转录PCR后,再经DNAMAN预测蛋白质序列;将其预测的蛋白序列与NCBI上已有的平菇自噬Atg8蛋白序列、双孢菇自噬Atg8蛋白序列及酿酒酵母自噬Atg8蛋白序列,应用DNA MAN软件比对各Atg8蛋白结果一致性高达91.14%,并且香菇的自噬Atg8蛋白序列与其他大型真菌的自噬Atg8蛋白同源性更高,说明自噬Atg8蛋白的保守性。
2.3 香菇Atg8在大肠杆菌中的表达与纯化
2.3.1 香菇Atg8在大肠杆菌中的表达
大肠杆菌转化前后Atg8蛋白的SDS-PAGE检测结果见图3。
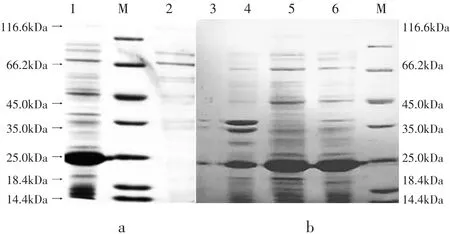
图3 大肠杆菌转化前后Atg8蛋白的SDS-PAGE检测结果Fig.3 SDS-PAGE results of Atg8 protein before and after Escherichia coli transformation
图3中a所示,香菇Atg8基因成功构建pET30a重组质粒,并顺利转化到大肠杆菌BL21(DE3)ply,再经0.5 mmol·L-1IPTG诱导后能够大量表达。
图3中b所示,目的蛋白Atg8超声破碎离心后存在于上清中,发现经超声破碎后得到的Atg8蛋白浓度更高,故目的蛋白为可溶性蛋白。
2.3.2 Atg8目的蛋白的纯化
(1)镍柱亲和层析
镍柱的洗脱曲线见图4。镍柱不同洗脱峰SDSPAGE检测见图5。
结合图4与图5可以看出,使用100 mmol·L-1咪唑+100 mmol·L-1NaCl+50 mmol·L-1Tris-HCl(pH8.8) 洗脱,以及在 150 mmol·L-1咪唑+100 mmol·L-1NaCl+50 mmol·L-1Tris-HCl(pH8.8) 镍柱亲和层析中都有目的蛋白Atg8被洗脱。图5中有多条明显的条带,条带不单一,证明经镍柱洗脱的目的蛋白Atg8含有杂蛋白。
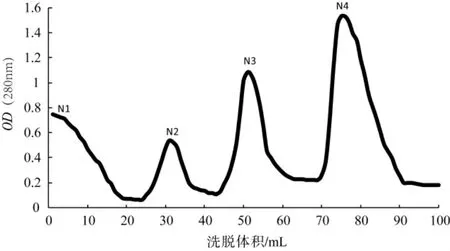
图4 镍柱的洗脱曲线Fig.4 Elution curve of nickel column

注:1:N1峰;2:N2峰;3和4:N3峰;5和6:N4峰;M:Marker。Note:1:N1 peak;2:N2 peak;3 and 4:N3 peak;5 and 6:N4 peak;M:Marker.
(2)MonoQ强阳离子交换层析
MonoQ洗脱曲线和MonoQ纯化后SDS-PAGE检测图见图6和图7。
含有杂蛋白的Atg8蛋白再用MonoQ柱进一步纯化后,通过SDS-PAGE检测目的条带的纯度,图7显示目的Atg8蛋白条带单一,证明2次纯化后目的蛋白Atg8纯度比较高。
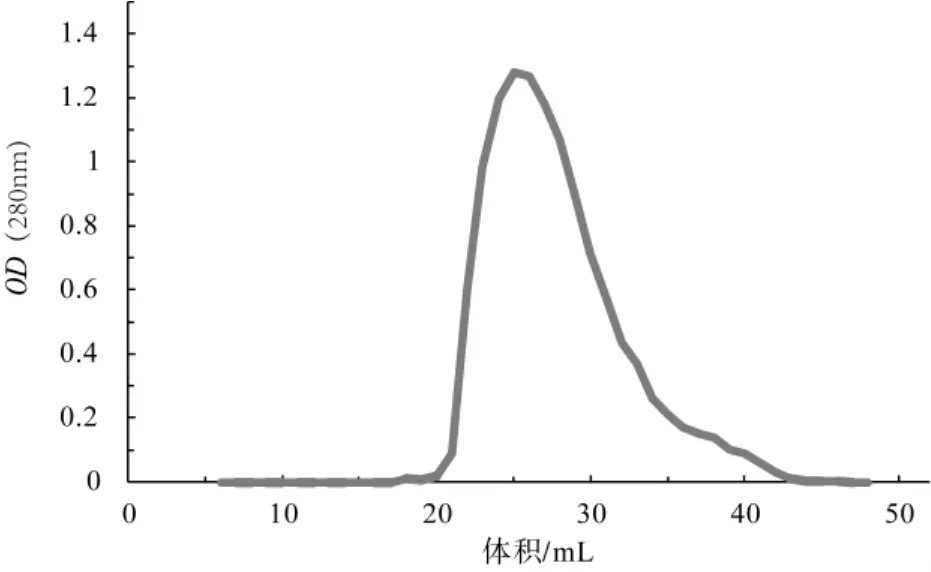
图6 MonoQ洗脱曲线Fig.6 MonoQ elution curve
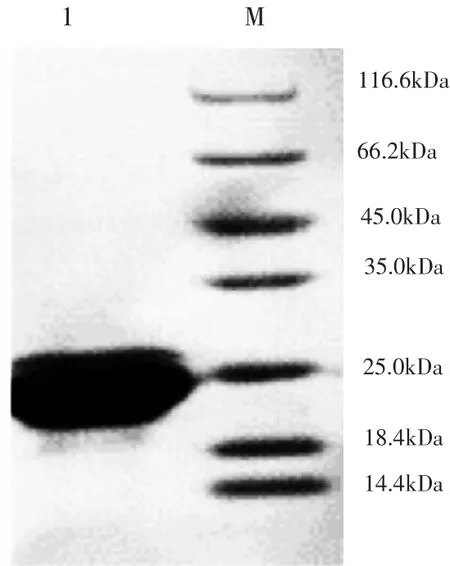
图7MonoQ纯化后SDS-PAGE检测图Fig.7 SDS-PAGE resoult after purification with MonoQ
2.3.3 香菇Atg8兔多隆抗体的制备
香菇Atg8兔多隆抗体的制备检测见图8。
将纯化后香菇Atg8蛋白经华大公司制备兔多克隆抗体,经SDS-PAGE检测纯度。从图8可以看出,抗体纯度很高,在50 kDa和25 kDa处呈现2条条带,与lgG重链与lgG轻链相对应。将兔多隆抗体按1:10 000、1:5 000、1:2 000、1:1 000、1:500稀释,将稀释后的抗体与抗原杂交,二抗按说明书要求稀释倍数,见图9。

图8 兔多抗体检测Fig.8 Rabbit antibody testing
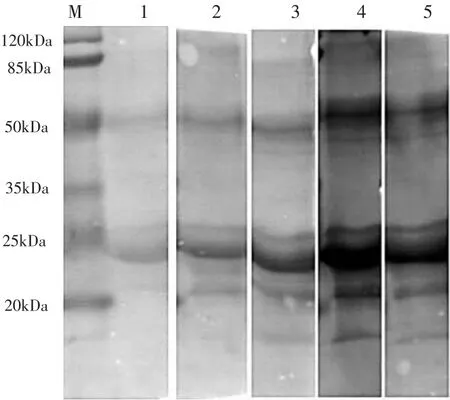
图9 抗体最佳使用浓度检测Fig.9 Antibody optimal concentration test
从图9可以看出,稀释倍数1∶1 000的杂交条带较为明显,故用此稀释倍数进行实验。
2.3.4 香菇转色前后Atg8表达量的变化
香菇转色前后情况对比见图10。转色前后免疫印迹结果见图11。
为进一步确定香菇转色前后Atg8蛋白有无变化,分别提取蛋白后与兔多克隆抗体进行杂交,如图11所显示的杂交条带:转色后条带较微弱,转色前条带几乎没有,普通市售香菇子实体条带显示比较明显。从这个结果可以说明香菇中含有Atg8蛋白,并且转色后的菌丝中Atg8含量较转色前高。也就是说转色后菌丝自噬Atg8蛋白表达量高于转色前香菇Atg8蛋白的表达量。因此,自噬可能参与了香菇转色这一过程。

图10 香菇转色前后对比Fig.10 Comparison of Lentinula edodes before and after the color-turning

图11 转色前后免疫印迹结果Fig.11 Western-blotting results before and after color-turning
3 讨论
自噬能够降解损伤、丧失功能的细胞器和物质,维持细胞内更新和稳态,与机体的多种生理和病理过程密切相关。营养缺乏可诱导自噬[12],而营养缺乏同时引起香菇转色[13]。香菇转色是生产中独特的1种现象,正常转色直接关系到香菇生产中产量的高低、质量的优劣。
本研究成功克隆香菇Atg8蛋白,其基因序列长度为603 bp,目的蛋白分子量25 kDa左右。利用纯化后Atg8蛋白成功克隆兔多隆抗体,与转色前后总蛋白进行免疫印迹检测。研究发现转色前杂交条带几乎没有,而转色后杂交条带比较微弱。但足以说明转色后的菌丝自噬Atg8蛋白含量高于转色前。也从另一方面说明自噬可能参与转色过程。实验中也存在一些不足:因从菌棒上剥离菌丝比较困难,导致提取的总蛋白含量较低,最终导致条带不是很清晰。
香菇转色直接影响香菇的品质和质量,但目前仍局限在调控物理性条件温度、湿度、光照、营养因素等来控制香菇转色[14-15]。物理性因素控制不好将影响香菇的转色是否成功,从而进一步影响香菇的质量和品质。本次研究显示自噬存在香菇转色这一过程;首次成功将目的基因转化至大肠杆菌,且自噬Atg8蛋白能够在大肠杆菌中成功表达。希望通过转基因技术增加自噬基因的诱导表达,从而降低香菇转色受温度、湿度、光照、营养因素等外界环境的影响程度。
[1]Chan EY,Tooze SA.Evolution of Atg1 function and regulation [J].Autophagy,2009,5(6):758-765.
[2]Simon Michaeli,Gad Galili,Pascal Genschik,et al.Autophagy in Plants-What’s New on the Menu[J].Trends in Plant Science,2016,21(2):134-144.
[3]王赢,张叶军,黄慧,等.鳞翅目昆虫中自噬相关分子Atg8的研究进展[J].昆虫学报,2015(2):210-216.
[4]Matthieu Régnacq,Pierre Voisin,Yann,et al.Identification of Atg8 from Acanthamoeba castellanii by genetic complementation in Saccharomyces cerevisiae[J].Molecular and Biochemical Parasitology,2016,210(1):55-57.
[5]Ronny Kellner,Juan C.De la Concepcion,Abbas Maqbool,et al.ATG8 expansion:a driver of selective autophagy diversification?[J].Trends in Plant Science,2017,22(3):204-214.
[6]Dan Pei,Wei Zhang,Hong Sun et al.Identification of autophagy-related genes ATG4 and ATG8 from wheat(Triticum aestivum L.) and profiling of their expression patterns responding to biotic and abiotic stresses[J].Plant Cell Reports, 2014,33(10):1697-1710.
[7]庞杰,孙国琴,于静,等.香菇菌棒转色机理及影响因素的研究进展[J].贵州农业科学,2016(3):99-101.
[8]唐利华.光诱导香菇菌丝转色形成机理的研究[D].上海:上海交通大学,2014.
[9]钱玉夫.影响袋栽香菇转色的七大因素[J].今日科技,1988(2):13.
[10]王广慧,魏雅冬,于德涵.秸秆袋料栽培香菇培养料配方的优化[J].山西农业科学,2015(2):164-166.
[11]郭倩倩,刘志燕,姜丽丽,等.营养缺乏对人肺癌细胞自噬的诱导作用[J].南方医科大学学报,2014(5):627-630.
[12]郭献灵.缺营养诱导的自噬和端粒酶在肝癌细胞对化疗药物不敏感中作用的研究[D].上海:第二军医大学,2009.
[13]于海龙,吕贝贝,宋春艳,等.复合氮源对香菇生长及产量的影响分析[J].上海农业学报,2016(3):63-66.
[14]杨春华,马树新,白琼岩.香菇菌棒转色是出好菇的关键环节[J].北京农业,2010(36):21-23.
[15]杨春华,马树新,白琼岩.香菇菌棒转色是出好菇的关键环节[J].中国食用菌,2010(6):63-64.
Research on Color-turning Changes of Atg8 Protein Expression in Lentinula edodes
FANG Li-li1,2,YANG Li2,LI Cui-xin1,LIU Qing-hong2
(1.College of Life Science,Southwest Forestry University,Kunming 650224,China; 2.Biology College,China Agricultural University,Beijing 100094,China)
After comparison of Atg8 protein homologous sequences in Lentinula edodes genome,the atg8 sequence of L.edodes was determined by reverse transcription PCR.And then,the expression plasmids were constructed by restriction enzyme digestion.It was transformed into Escherichia coli BL21(DE3)plyS to obtain its expression strain.The expressed Atg8 protein was purified by nickel column and MonoQ,subsequently rabbit polyclonal antibody was successfully prepared.The expression of Atg8 protein was detected by western-blotting before and after the color-turning.The Atg8 gene of L.edodes was 603 bp in length and the molecular weight of Atg8 protein was about 25 kDa,which was soultable.Atg8 protein hybridization bands were weak in white L.edodes mycelium,while Atg8 protein bands were almost none in brown.The results showed that Atg8 protein content in brown mycelium of L.edodes was higher than that in white mycelium.
Lentinula edodes;color-turnning;autophagy;Atg8
S646.1
A
1003-8310(2017)03-0044-06
10.13629/j.cnki.53-1054.2017.03.011
国家现代农业技术产业体系食用菌产业专项(CARS-024)。
房丽丽(1989-),女,在读硕士研究生,主要研究方向为药用及食用真菌。E-mail:fanglili1224@126.com
*通信作者:刘庆洪(1967-),男,博士,副教授,主要从事药用及食用真菌研究。E-mail:qhliu@cau.edu.cn
2017-03-22

