不同品种薄壳山核桃光合及快速叶绿素荧光诱导动力学特性1)
刘壮壮 骆敏 彭方仁 杨标 陈涛 李永荣
(南京林业大学,南京,210037) (南京绿宙薄壳山核桃科技有限公司)
不同品种薄壳山核桃光合及快速叶绿素荧光诱导动力学特性1)
刘壮壮 骆敏 彭方仁 杨标 陈涛 李永荣
(南京林业大学,南京,210037) (南京绿宙薄壳山核桃科技有限公司)
以‘Pawnee’、‘Mahan’、‘Stuart’、‘Kanza’和‘Jinhua’5个薄壳山核桃品种结果树为研究对象,对其光合特性及快速叶绿素荧光诱导动力学特性差异进行了研究。结果表明,不同品种薄壳山核桃的光合特征参数存在一定差异,‘Stuart’光合能力最弱,‘Mahan’和‘Pawnee’的光合能力及对光环境的适应能力均大于其它品种,但‘Mahan’对弱光的利用能力较弱;‘Mahan’暗呼吸速率最低,有利于光合产物的积累,‘Stuart’暗呼吸速率最高,消耗较多光合产物;对光合基本指标及其光响应特性的分析结果表明,气孔导度、蒸腾速率及瞬时羧化效率是影响净光合速率的重要因素,其中瞬时羧化效率对净光合速率有更直接显著的影响;相较于其它品种,‘Pawnee’抗旱能力较差,而‘Jinhua’抗旱能力较强;JIP-测定结果中,‘Stuart’质体醌容量(Sm)及电子传递活性较大,其各相荧光信号较弱,热耗散的能量较少,导致用于电子传递的能量较多,‘Kanza’的这些特性与‘Stuart’相反;品种间性能指数存在显著差异,‘Stuart’光合机构性能最优,‘Kanza’则较差;综合光合能力及光反应阶段的指标,发现5个薄壳山核桃品种中‘Stuart’光反应活性最大,但其光合能力最弱,可能和气孔限制因素、暗呼吸作用较强及光合机构形成的同化力较多地用于氮、硫同化等其它的代谢有关。
薄壳山核桃;光合特性;叶绿素荧光
薄壳山核桃(CaryaillinoensisKoch),又名美国山核桃或长山核桃,是胡桃科山核桃属植物,原产美国和墨西哥北部,是世界著名干果、木本油料、景观绿化及材用树种,集显著的经济、生态、社会效益于一身。中国引种栽培薄壳山核桃已有100多年的历史,从美国引进及国内选育的薄壳山核桃品种有100多个,但至今仍未实现产业化[1-2]。近年来,薄壳山核桃作为重要的经济林木,发展迅速,但在多数地区尚未完成区域化栽培试验及形成一套切实可行的栽培管理技术体系。光合作用是植物生长发育的物质基础,是决定薄壳山核桃果树生长及果实发育的重要生理过程。因此,探究薄壳山核桃的光合作用的反应过程及其特性对于薄壳山核桃的引种、栽培和育种具有重要的指导意义。
目前,国内外对薄壳山核桃光合特性的研究以气体交换及光合碳同化效率的研究为主,而对其光反应阶段的研究较少。早期的研究发现光合原初反应和叶绿素荧光存在着密切关系[3],随着研究的深入,人们逐步认识到荧光诱导动力学曲线中蕴藏着丰富的信息。叶绿素荧光诱导动力学曲线的测定,可采用调制脉冲式和连续激发式(JIP-测定)2种不同的荧光仪,调制脉冲式探测的是光合作用碳同化等反应启动后的光能捕获、转化及利用的情况,连续激发式荧光仪主要是通过短时间照光后,荧光信号的瞬时变化反映暗反应活化前PSII的光化学变化,与调制式荧光仪相比,连续激发式荧光仪有获得信息量大、操作简便快捷、测定易于多次重复、仪器便于携带、存储量大、价格低廉等优点[4]。目前,以JIP-测定为基础的快速叶绿素荧光诱导动力学分析,被广泛应用于植物光合作用研究中,但是仅国外学者Henriques和Lombardini等人[5-8]在薄壳山核桃的研究中运用了这一技术,而且仅简单分析了最小荧光强度(Fo)、最大荧光强度(Fm)、可变荧光(Fv=(Fm-Fo))、最大量子产额(Fv/Fm)等基本参数,没有对测得的丰富信息进行系统深入的研究。而且,现在国内关于薄壳山核桃品种光合特性的比较研究中,早期的研究对象主要集中在薄壳山核桃品种的实生树和无性系嫁接苗上[9-12],近2 a开始有关于薄壳山核桃优良品种光合特性的报道,研究重点在苗期的光合特性[13-14],而对薄壳山核桃主推品种结果树光合特性的研究还未见报道。因此,本试验以‘Pawnee’、‘Mahan’、‘Stuart’、‘Kanza’和‘Jinhua’ 5个薄壳山核桃优良品种的结果树为研究对象,利用快速叶绿素荧光动力学分析(JIP—测定)结合光合作用参数分析,比较不同薄壳山核桃品种光合荧光特性的差异,以期为叶绿素快相荧光动力学技术在薄壳山核桃光合作用研究中的广泛应用和薄壳山核桃品种的科学选育与栽培管理提供理论基础。
1 试验地概况
试验于2016年5月17日在南京市六合区山北村,南京绿宙薄壳山核桃科技有限公司果园内进行,地理坐标为北纬32°19′17.896″~32°19′29.136″、东经118°53′34.924″~118°53′45.159″;属亚热带湿润气候,年平均气温15.3 ℃,年平均降水量1 013 mm,年平均日照时间为2 122 h,≥10 ℃年积温4 889 ℃,无霜期224 d;土壤中性偏酸。5月份平均气温20.4 ℃,日照时间207.0 h,平均降水量84.7 m[15]。
2 材料与方法
供试品种为从美国引进的4个优良品种及国内选育的1个优良品种,均为6年生果树(5 a砧木的嫁接树),均已挂果。品种分别为‘Pawnee’(‘波尼’)、‘Mahan’(‘马罕’)、‘Stuart’(‘斯图尔特’)、‘Kanza’(‘堪萨’)和‘Jinhua’(‘金华’),其中品种‘Jinhua’于1980年由浙江省科学院亚热带作物研究所选育。每个品种选取立地条件相同、无遮挡、生长较一致的3棵健康果树进行试验,以南向树枝上复叶的第4对健康向阳叶片为各指标测定对象。
2.1 光合特性测定
每株目标树选1个叶片用于光合特性的测定,每个叶片重复测定3次。测定于2016年5月17日天气晴朗的上午08:30—11:30进行。采用CIRAS-2便携式光合系统测定光合参数,使用CO2钢瓶供气,细胞间隙CO2摩尔分数设定为380 μmol/mol,控制叶温25 ℃,于2 000、1 500、1 000、600、300、200、100、80、50、0 μmol/(m2·s)的10个光强下进行活体测定。测定的参数包括净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、细胞间隙CO2浓度(Ci)、水分利用效率(Pn/Tr)和瞬时羧化效率(Pn/Ci)。
2.2 荧光动力学特性测定
每品种相同的3株果树用来测定叶绿素荧光动力学特性,每株测3个叶片。叶绿素快相荧光动力学曲线(OJIP曲线),及其参数采用连续激发式荧光仪进行测定,同光响应曲线测定同时进行。叶片暗适应30 min后,在3 000 μmol/(m2·s)饱和红闪光照射2 s下,以10 μs的间隔记录荧光信号。
2.3 数据处理
净光合速率—光响应曲线通过SPSS利用直角双曲线修正模型[16]进行拟合,并估算光饱和点(LSP)、最大净光合速率(Amax)和暗呼吸速率(Rd)等光响应特征参数;通过SPSS线性回归方程拟合光补偿点(LCP)和表观量子效率(AQY)。荧光参数及随时间变化记录的荧光信号强度通过软件PEA Plus 1.10导出。利用Excel 2010和SPSS 22.0软件对数据进行统计处理和相关分析,采用SigmaPlot 12.5软件绘图。
3 结果与分析
3.1 不同品种薄壳山核桃光合指标的光响应曲线
从净光合速率—光响应曲线(图1A)可知,5个品种的薄壳山核桃净光合速率起初随着光照强度的增强逐渐增大,且增幅较大而后逐渐变缓,其中‘Kanza’和‘Jinhua’出现光抑制的现象。5个品种中‘Pawnee’的光响应曲线基本保持在最高的水平,‘Mahan’起初光合速率较低,在1 000 μmol·m-2·s-1后仅次于‘Pawnee’,‘Stuart’最低。说明‘Pawnee’的光合能力较强,‘Stuart’较弱,‘Mahan’利用弱光的能力较弱,利用强光的能力较强。
由图1B可知,5个品种的气孔导度随光强的变化幅度不大,各光强下‘Kanza’气孔导度最大,‘Stuart’最小。相对来说,‘Kanza’、‘Jinhua’和‘Pawnee’的气孔导度波动较大并在1 000 μmol·m-2·s-1光强后‘Kanza’和‘Jinhua’出现下降趋势。说明其气孔会在较强光照下减小开放程度,抑制外界CO2向叶细胞内的扩散,从而减缓净光合速率。
如图1C所示,‘Pawnee’、‘Mahan’、‘Jinhua’和‘Stuart’的蒸腾速率先是迅速升高而后逐渐减缓;而‘Kanza’起初急速增加,然后在200 μmol·m-2·s-1时突然下降,而后继续维持下降趋势,可能因为其光适应范围较小,对光环境较为敏感所导致。整体上‘Pawnee’的蒸腾速率最大,‘Stuart’和‘Jinhua’较小,‘Kanza’蒸腾速率虽有下降趋势,仍然比‘Stuart’和‘Jinhua’大。
不同品种细胞间隙CO2摩尔分数随光强的变化趋势相似(图1D),在0~600 μmol·m-2·s-1光强时,细胞间隙CO2摩尔分数急剧地减小,说明随着光强的增加,光合作用在显著加强,光合反应所需的CO2的量就越多;600 μmol·m-2·s-1后各品种的下降趋势逐渐趋于平缓。总的看,‘Kanza’各光强下的细胞间隙CO2摩尔分数最大,‘Stuart’和‘Mahan’的较小。
因‘Kanza’蒸腾速率的减弱导致其水分散失较少,在较大光强下水分利用率仍有增大的趋势,而其它品种在各光强下均呈先升后降的趋势(图1E)。较弱光强下各品种的水分利用率增加较快,但差异不大;其后品种间水分利用率差异逐渐增大,1 000 μmol·m-2·s-1光强后各品种水分利用率变动幅度较小,整体上‘Jinhua’的水分利用率最大,而‘Pawnee’的最小。
5个品种的瞬时羧化效率均是一直增大并最终达到饱和状态,变化趋势和净光合速率—光响应曲线相一致(图1F)。起初各品种瞬时羧化效率迅速增大,品种间差异也逐渐增大;而后逐渐减缓并在1 000 μmol·m-2·s-1后逐渐达到饱和。总的来说,各光强下‘Pawnee’的瞬时羧化效率最大,‘Stuart’的最小,‘Mahan’在300~1 000 μmol·m-2·s-1光强时的增幅最大,在1 000 μmol·m-2·s-1之后和‘Pawnee’的瞬时羧化效率非常接近,并大于其它品种。
对2 000 μmol·m-2·s-1光强(饱和光强)下测得的光合基本参数进行Pearson相关性分析(表1),结果表明,净光合速率和蒸腾速率、气孔导度及瞬时羧化效率均呈极显著正相关;蒸腾速率和气孔导度呈显著正相关,与水分利用率及瞬时羧化效率分别呈极显著负相关和极显著正相关;与气孔导度呈极显著正相关。
3.2 不同品种薄壳山核桃光合特征参数
通过净光合速率—光响应模型可估算出最大净光合速率、表观量子效率、光饱和点、光补偿点和暗呼吸速率等光合特征参数。方差分析及Welch检验结果表明,5个薄壳山核桃品种间的光合特征参数在P<0.05水平上无显著差异,但品种间最大净光合速率和光饱和点在P<0.15水平差异显著。由表2可知,‘Pawnee’的最大净光合速率最大,‘Mahan’次之,分别是‘Stuart’最大净光合速率(最小)的1.5和1.4倍。‘Mahan’的光饱和点最大,‘Pawnee’次之,‘Kanza’最小,‘Mahan’是‘Kanza’光饱和点的1.3倍;‘Stuart’和‘Jinhua’的光补偿点较大,依次是‘Kanza’‘Pawnee’和‘Mahan’,从光饱和点和光补偿点可看出,‘Mahan’和‘Pawnee’的光适应范围较广。但是‘Mahan’的表观量子效率最小,其利用弱光的能力较弱,‘Jinhua’利用弱光的能力则较强。‘Stuart’暗呼吸速率最大,是‘Mahan’(最小)的2.3倍,说明‘Stuart’暗呼吸作用较强,在黑暗条件下消耗有机物过多,而‘Mahan’消耗较少,有利于有机物的储备。

表1 不同品种薄壳山核桃光合参数的相关性分析
注:*表示在0.05水平差异显著;** 表示在0.01水平差异极显著。

表2 不同品种薄壳山核桃光响应曲线特征参数
注:方差同质性检验结果表明,在P<0.05水平品种间光饱和点、最大净光合速率和表观量子效率具有方差齐性,光补偿点和暗呼吸速率方差不齐。5个品种光饱和点、最大净光合速率和表观量子效率的方差分析结果表明,薄壳山核桃5个品种的光饱和点、最大净光合速率和表观量子效率在P<0.05水平上无显著差异,但最大净光合速率(P=0.104),光饱和点(P=0.123)差异显著;品种间光补偿点和暗呼吸速率的Welch检验结果表明,5个品种的光补偿点和暗呼吸速率在P<0.05水平亦无显著差异。表中数值为平均值±标准误。
3.3 不同品种薄壳山核桃快速叶绿素荧光动力学特性分析
根据公式(Ft-Fo)/(Fm-Fo)将不同时间的荧光强度(Ft)标准化,标准化后的荧光信号用Vt表示,以Vt绘制成OJIP标准曲线(图2A)。由图2A可以看出,5个薄壳山核桃品种均为典型的叶绿素快相荧光动力学曲线,具有O、J、I、P等相点。5个品种的曲线形状相似,而且到达P相点的时间均保持一致。为了能更清晰比较品种间荧光信号强度的差异,将‘Pawnee’作为对照,用其它4个品种与‘Pawnee’的标准化荧光差值(ΔVt)重新作图(图2B)。结果显示,品种间荧光的差异主要集中在K相(300 μs)和I相(30 ms)之间,在J相附近的差异最大。从图2中可明显地发现,从O相到P相的过程中,大部分时间点‘Kanza’的荧光信号最强,‘Stuart’的最小。
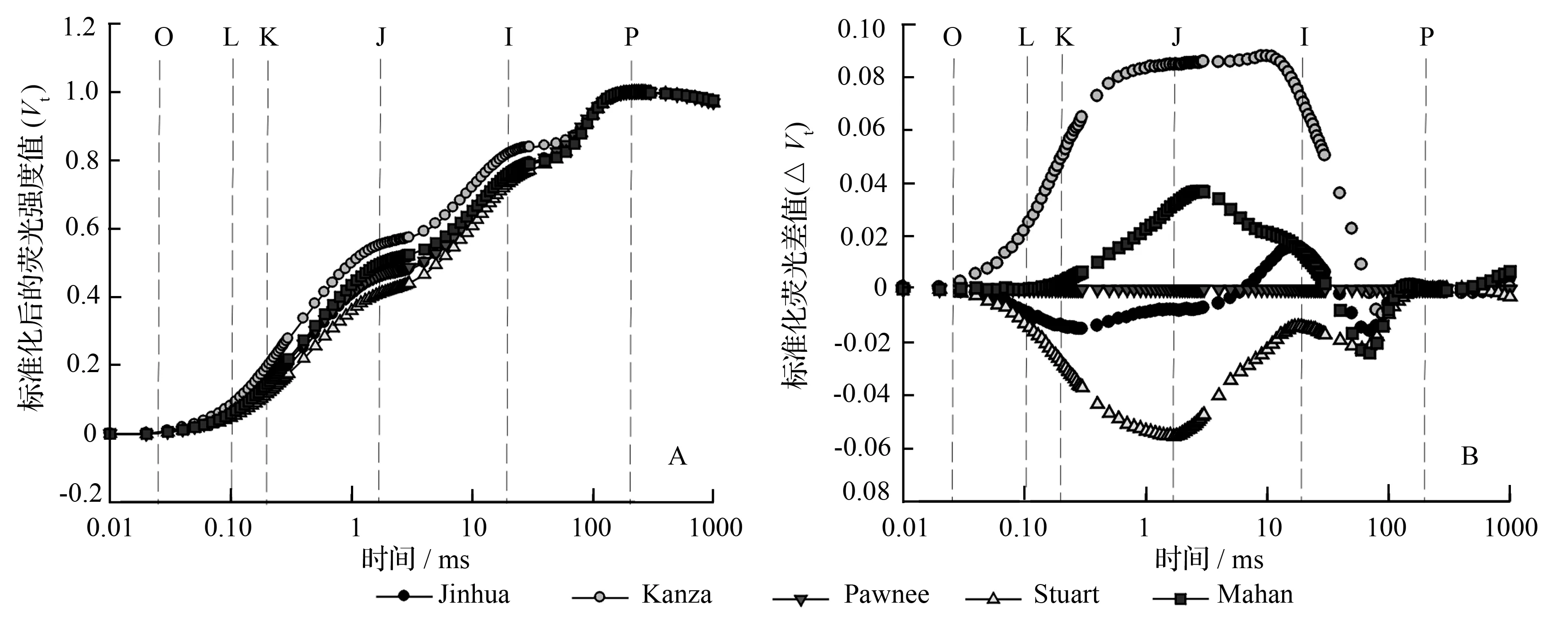
O、L、K、J、I、P为OJIP曲线不同的相,分别位于0.05、0.10、0.30、2.00、30.00 ms时达到最大荧光强度的时间。
从快相荧光动力学曲线可以得出多个荧光参数,本文选取了具有重要生理意义的基础参数,以‘Pawnee’作为参照,用其它品种的荧光参数与‘Pawnee’的比值绘制成雷达图(图3)。5个薄壳山核桃品种暗适应后最小荧光强度(Fo)、I相荧光强度(F5)、最大荧光强度(Fm)及到达最大荧光所需的时间t(Fm)差异不大,但‘Kanza’O、L、K、J相(F1~F4)的荧光强度均高于其它品种,同时其在100 μs(L相)和300 μs(K相)时光反应中心关闭净速率及照光2 ms(J相)时有活性的反应中心的关闭程度(Vj)最大,‘Stuart’的则最小。‘Kanza’初级醌受体(QA)被还原的最大速率(Mo)最大,其QA被还原的次数(N)却最小,PSII反应中心受体侧质体醌库(QP)的大小(Sm)和质体醌库还原速率(Sm/t(Fm))也均最小,‘Stuart’最大速率最小,QA被还原的次数、Sm及Sm/t(Fm)均最大。
比活性参数可以更确切地反映植物的光合器官对光能的吸收、转化和耗散等状况[4]。在相同光照下薄壳山核桃5个品种间单位激发态面积吸收的光能和单位激发态面积捕获的光能差异不大,但‘Stuart’单位激发态面积有活性反应中心数目较多,反应中心密度大,使得相同光照下的每个有活性反应中心吸收与捕获的光能较少。但‘Stuart’单位有活性反应中心及单位激发态面积热耗散也较少,因而有利于用于电子传递能量的分配,体现在其单位有活性反应中心和单位激发态面积用于电子传递的能量较多。5个品种中,‘Kanza’光合器官对光能的吸收、转化和耗散状况与‘Stuart’相反。在能量分配比率中,品种间PSII反应中心捕获的最大量子产额最大量子产额差异不大。但热耗散的量子比率Fo/Fm、用于推动电子传递到电子传递链中超过QA的其它电子受体的激子占用于推动QA还原激子的比率(ψo)、用于电子传递的量子比率(φEo)以及PSI受体侧末端电子受体的量子产额(φro)均有一定的差异。其中‘Stuart’Fo/Fm最小,‘Kanza’最大,而‘Stuart’ψo、φEo及φro均最大,‘Kanza’最小。
从雷达图(图3)中可看出,5个薄壳山核桃品种间性能指数有着很大的差异。对性能指数进行Kruskal-Wallis非参数检验及逐步降低多重比较的结果表明(表3),5个品种的性能指数存在显著差异,其中‘Stuart’的3个指数均最大,依次是‘Jinhua’、‘Pawnee’、‘Mahan’,‘Kanza’最小,‘Stuart’性能指数极显著大于‘Kanza’。说明‘Stuart’光反应活性较强,‘Kanza’则较弱。
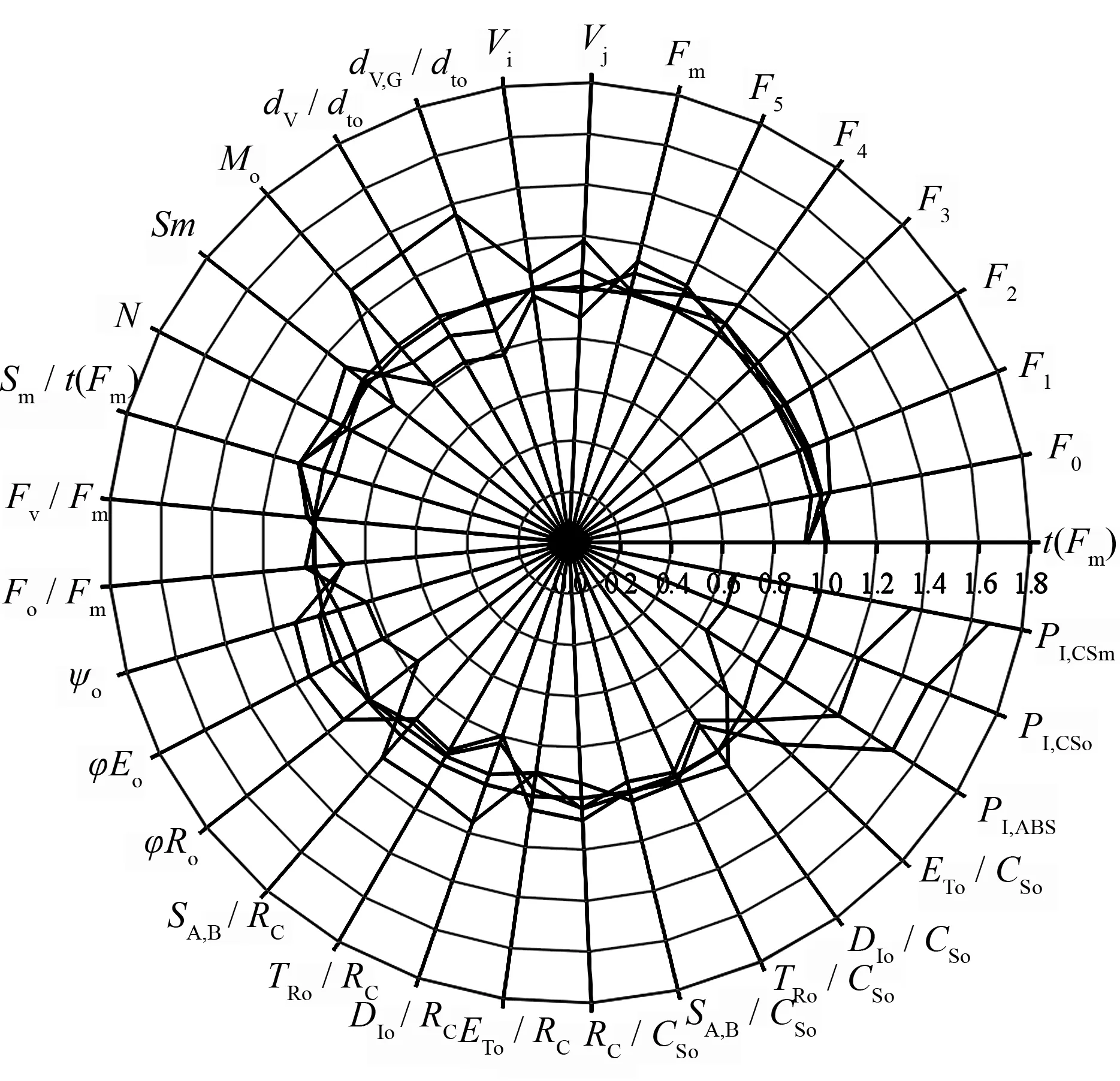
t(Fm)为叶片暗适应后从照光到达最大荧光所需的时间;Fo为叶片暗适应后的最小荧光强度;F1、F2、F3、F4、F5为0.05 ms(O相)、0.1 ms(L相)、0.3 ms(K相)、2 ms(J相)、30 ms(I相)的荧光强度;Fm为叶片暗适应后的最大荧光强度;Vj为J相时的相对可变荧光强度,反映了照光2 ms时有活性的反应中心的关闭程度;Vi为I相时的相对可变荧光强度;dv,g/dto为100 μs时光反应中心关闭净速率;dv/dto为300 μs时光反应中心关闭净速率;Mo为OJIP荧光诱导曲线的初始斜率,反映QA被还原的最大速率;Sm为PSII反应中心受体侧质体醌库QP的大小;N为从开始照光至到达Fm的时间段内QA被还原的次数;Sm/t(Fm)为质体醌库还原速率;Fv/Fm为PSII反应中心捕获的最大量子产额;Fo/Fm为热耗散的量子比率;ψo为用于推动电子传递到电子传递链中超过QA的其它电子受体的激子占用于推动QA还原激子的比率;φEo为用于电子传递的量子比率;φro为PSI受体侧末端电子受体的量子产额;Sa,b/Rc为单位活性反应中心吸收的光量;Tro/Rc:单位活性反应中心捕获的光量;Dio/Rc:单位活性反应中心热耗散的能量;Eto/Rc为单位活性反应中心用于电子传递的能量;Rc/Cso为单位激发态面积反应中心数目;Sa,b/Cso为单位激发态面积吸收的光量;TRo/CSo为单位激发态面积被反应中心捕获的光量;Dio/Cso为单位激发态面积热耗散的能量;Eto/Cso为单位激发态面积用于电子传递的能量;Ip,abs为以吸收光能为基础的性能指数;Ip,cso为以吸收基础荧光(Fo)为基础的性能指数;Ip,csm为以吸收最大荧光(Fm)为基础的性能指数。

图3 不同品种薄壳山核桃叶绿素荧光参数比较雷达图
注:3个性能指数均进行非参数检验(Kruskal-Wallis检验),采用逐步降低方法进行比较。同一列不同大小写字母分别表示不同品种间在P<0.01与P<0.05水平差异显著。表中数值为平均值±标准误。Ip,abs为以吸收光能为基础的性能指数;Ip,cso为以吸收基础荧光(Fo)为基础的性能指数;Ip,csm为以吸收最大荧光(Fm)为基础的性能指数。
4 结论与讨论
不同品种薄壳山核桃的光合特征参数存在一定差异,其中品种间最大净光合速率和光饱和点存在较显著的差异。最大净光合速率可以很大程度衡量植物的光合能力,由净光合速率—光响应模型拟合的结果看,‘Stuart’最大净光合速率最小,‘Pawnee’和‘Mahan’最大净光合速率是‘Stuart’的1.5和1.4倍,光合能力较强。光是影响光合作用的重要环境因子,对光的广幅适应是植物对环境适应能力强的重要表现[17],光补偿点低、光饱和点高的植物对光环境的适应性强,而光补偿点高、光饱和点低的植物对光强的适应范围窄[18]。本研究中,‘Mahan’和‘Pawnee’的光饱和点较高,光补偿点较小,在一定程度上说明‘Mahan’和‘Pawnee’对光环境的适应能力强于其它品种。何海洋等[13]对不同品种薄壳山核桃1年生嫁接苗光合特性的研究结果表明,‘Mahan’和‘Pawnee’的光合能力较突出,‘Mahan’的光适应范围大,这和本研究结果相一致。表观量子效率是反映植物在弱光下吸收、转换和利用光能能力的指标[19],‘Mahan’在5个品种中表观量子效率最小,因此其对弱光的利用效率及能力较小。暗呼吸速率反映的是植物在没有光照条件下的呼吸速率[20],暗呼吸速率越大,说明在黑暗条件下的呼吸作用越强,消耗的光合产物就越多。本研究中,‘Stuart’暗呼吸作用最强,在黑暗条件下消耗光合营养过多,而‘Mahan’消耗最少,有利于光合营养的储备与利用。
植物能针对外界环境条件变异与植株自身状况,通过调节气孔的开闭程度,在保持植株正常生理活动前提下,达到最大CO2固定量与最小水分散失量[21]。本研究中随着光强的增加,5个薄壳山核桃品种气孔导度及蒸腾速率的变化趋势略有差异,气孔导度的波动较大,说明其对光环境及自身状况的响应较为敏感,通过与蒸腾速率、细胞间隙CO2摩尔分数、水分利用率及瞬时羧化效率的联系进而影响净光合速率。其中,各品种瞬时羧化效率随光强的变化趋势与净光合速率非常相似,光合指标的相关性分析同样表明,瞬时羧化效率和净光合速率呈极限著正相关(P=0.949),说明瞬时羧化效率对净光合速率具有直接显著的影响。相关性分析同时表明,气孔导度和E与净光合速率具有极显著正相关关系,是影响光合速率的重要指标。5个品种中,‘Stuart’各光强下气孔导度、蒸腾速率、细胞间隙CO2浓度及净光合速率均最低,说明可能是因为气孔的原因导致进入细胞的CO2较少,从而限制其净光合速率,因此其光合能力很可能受到气孔因素的制约。研究表明,相同的环境条件下,蒸腾速率越小,植物的抗旱能力越强。水分利用效率由植物的净光合速率和蒸腾速率两方面决定,通常将其作为评价植物生长适宜程度的综合指标被广泛应用[22]。本试验中,各光强下‘Pawnee’光合速率虽然较大,但整体上蒸腾速率较大,水分利用率较小,‘Jinhua’蒸腾速率较小,水分利用率较大,说明‘Pawnee’抗旱能力较差,在少雨季节应增加灌溉次数,‘Jinhua’抗旱能力较强,更易保持树体水分。薄壳山核桃作为一种喜湿树种,抗旱能力仅是品种间的相对比较而言,至于适不适合在少雨或干旱地区生长还有待探究。
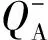
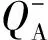
植物捕获的光能除用于电子传递外,还以热和荧光的形式耗散掉,这三者之间是相互竞争的关系。本研究中,‘Kanza’热耗散量子比率Fo/Fm、热耗散的能量(Dio/Rc和Dio/Cso)较多,荧光信号最强,其用于电子传递的能量(Eto/Rc和Eto/Cso)较少;‘Stuart’Fo/Fm、Dio/Rc和Dio/Cso较小,荧光信号最弱,用于电子传递的能量(Eto/Rc和Eto/Cso)较多。因此可以看出,热耗散能量和荧光显著地减少用于电子传递的能量分配。有相关研究指出,植物在受到光胁迫时,会加剧D1蛋白的降解,导致电子传递体,特别是QB容易从蛋白复合体上脱落下来,造成受体库的减少;同时,一些PSII反应中心失去活性可以耗散掉多余的能量,从而使其他PSII反应中心免受到光损害,而这些损害光合机构功能的行为都会降低光能转化效率[23]。5个品种中‘Kanza’的光饱和点最小,容易受到光胁迫,因此在荧光动力学测定中受到饱和红闪光照射时,其受体库较小可能跟D1蛋白的降解有关;而‘Kanza’热耗散的能量及比率较大可能跟反应中心的失活有关,表现在其单位有活性反应中心较少,反应中心密度小,使单位有活性反应中心吸收及捕获的光能增大,单位反应中心间能量流动进而增加,热耗散的能量就越多[24],‘Kanza’在较强光下有可能通过这种机制来保护其光反应中心免受损害。
5个品种间最大量子产额差异不大,有研究指出,Fo/Fm这一参数只有在植物处于不良环境时才会发生变化,反应并不灵敏[25]。性能指数包含了3个相互独立参数[Rc/Sa,b(或Rc/Cs)、φpo和ψo],可以更准确地反映植物光合机构的状态[10]。本研究中,‘Stuart’性能指数最大,极显著大于‘Kanza’,这和前述对其它参数的分析结果相一致,说明5个薄壳山核桃品种的光反应阶段中,‘Stuart’和‘Kanza’表现出最大的差异,且‘Stuart’的光合机构性能较突出,‘Kanza’较弱。在光合作用中,光反应通过电子传递及质子梯度的建立可为暗反应提供所需的同化力。不少研究结果表明,光反应活性越大,光合能力则越强[25-28],而综合光合能力及光反应阶段的指标发现本研究5个品种中‘Stuart’光反应活性最大,但其光合能力最弱,可能是因为气孔因素制约及其暗呼吸作用较强的影响。有学者指出,当光合机构形成的同化力完全用于光合碳同化而不用于氮、硫同化等其它代谢时,光合碳同化的量子效率与PSⅡ的光化学效率之间有很好的直线关系[29],因此推测‘Stuart’光合机构所形成的较强同化力并未体现在光合能力上也可能因为部分同化力被用于氮、硫同化等其它的代谢。这也体现了光合作用过程的复杂性。
[1] 彭方仁,李永荣,郝明灼,等.我国薄壳山核桃生产现状与产业化发展策略[J].林业科技开发,2012,26(4):1-4.
[2] 张日清,李江,吕芳德,等.我国引种美国山核桃历程及资源现状研究[J].经济林研究,2003,21(4):107-109.
[3] KAUTSKY H, HIRSCH A. Neue Versuche zur Kohlensäureassim-ilation[J]. The Science of Nature,1931,19(48):964-964.
[4] 李鹏民,高辉远,STRASSER R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报,2005,31(6):559-566.
[5] HENRIQUES F S. Gas exchange, chlorophyll a fluorescence kinetics and lipid peroxidation of pecan leaves with varying manganese concentrations[J]. Plant Science,2003,165(3):239-244.
[6] HENRIQUES F S. Reduction in chloroplast number accounts for the decrease in the photosynthetic capacity of Mn-deficient pecan leaves[J]. Plant Science,2004,166(4):1051-1055.
[7] LOMBARDINI L, RESTREPO-DIAZ H, VOLDER A. Photosynthetic light response and epidermal characteristics of sun and shade pecan leaves[J]. Journal of the American Society for Horticultural Science,2009,134(3):372-378.
[8] LOMBARDINI L, VOLDER A, NESBITT M L, et al. Consequences of Injury Caused by Cameraria caryaefoliella (Lepidoptera: Gracillariidae) on Pecan Gas Exchange and Chlorophyll Fluorescence[J]. Journal of the American Society for Horticultural Science,2013,138(4):263-266.
[9] 高云,傅松玲.两个美国山核桃品种的光合生理特性比较[J].南京林业大学学报(自然科学版),2011,35(4):34-38.
[10] 唐文莉.美国山核桃引种品种苗期特性及生理生态特性研究[D].合肥:安徽农业大学,2005.
[11] 徐德聪.不同品种美国山核桃叶绿素荧光特性的研究[D].长沙:中南林学院,2004.
[12] 吕芳德,徐德聪,蒋瑶.美国山核桃无性系叶绿素的荧光特性[J].中南林业科技大学学报,2006,26(2):13-16.
[13] 何海洋,彭方仁,张瑞,等.不同品种美国山核桃嫁接苗光合特性比较[J].南京林业大学学报(自然科学版),2015,39(4):19-25.
[14] 凌骅,黄坚钦,温国胜,等.5种美国山核桃苗叶片光合生理特性比较[J].林业科学,2014,50(8):174-178.
[15] 莫正海,张计育,翟敏.薄壳山核桃在南京的开花物候期观察和比较[J].植物资源与环境学报,2013,22(1):57-62.
[16] 叶子飘.光合作用对光和CO2响应模型的研究进展[J].植物生态学报,2010,34(6):727-740.
[17] 孙旭生,林琪,赵长星,等.施氮量对超高产冬小麦灌浆期旗叶光响应曲线的影响[J].生态学报,2009,29(3):1428-1437.
[18] 俞继红.3种彩叶植物的光合特性比较[J].西北林学院学报,2014,29(4):21-25.
[19] 李合生.现代植物生理学[M].北京:高等教育出版社,2002.
[20] COLEY P D. Herbivory and defensive characteristics of tree species in a lowland tropical forest[J]. Ecological Monographs,1983,53(2):209-233.
[21] 林保花,刘金祥,肖生鸿,等.粤西乡土香根草光合生理生态特征日动态分析[J].应用生态学报,2006,17(11):2041-2045.
[22] 李育花,任坚毅,林玥,等.独叶草的光合生理生态特性[J].生态学杂志,2007,26(7):1038-1042.
[23] 贾浩,郝建博,曹洪波,等.遮荫对‘保佳红’桃树叶片快速叶绿素荧光诱导动力学曲线的影响[J].西北植物学报,2015,35(9):1861-1867.
[24] 邱念伟,周峰,王颖,等.松树与杨树叶片叶绿素快相荧光动力学特征比较[J].林业科学,2013,49(3):136-143.
[25] 邱念伟,周峰,顾祝军,等.5种松属树种光合功能及叶绿素快相荧光动力学特征比较[J].应用生态学报,2012,23(5):1181-1187.
[26] 孟鹏,安宇宁,白雪峰,等.沙地赤松光合及叶绿素a快相荧光动力学特性[J].生态学报,2016,36(11):3469-3478.
[27] 周婷,张往祥,范俊俊,等.不同栀子光合和荧光特性比较[J].林业科技开发,2015,29(5):18-23.
[28] 范俊俊,张往祥,周婷,等.不同女贞光合和荧光特性比较[J].林业科技开发,2015,29(3):39-43.
[29] 余叔文,汤章城.植物生理与分子生物学[M].2版.北京:科学出版社,1998.
Characteristics of Photosynthesis and Fast Chlorophyll Fluorescence Induction Dynamics in Different Pecan Cultivars//
Liu Zhuangzhuang, Luo Min, Peng Fangren, Yang Biao, Chen Tao(Nanjing Forestry University, Nanjing 210037, P. R. China); Li Yongrong(Nanjing Green Universe Pecan Science & Technology Co., Ltd)//
Journal of Northeast Forestry University,2017,45(4):36-42.
With the fruiting trees of five pecan cultivars, ‘Pawnee’, ‘Mahan’, ‘Stuart’ ‘Kanza’ and ‘Jinhua’, we examined the difference in photosynthetic characteristics and fast chlorophyll fluorescence induction dynamics characteristics within the cultivars. There was some difference in photosynthetic characteristic parameters among the five cultivars. The weakest photosynthetic capacity was found in ‘Stuart’, and the photosynthetic capacity and adaptability to the environment of ‘Mahan’ and ‘Pawnee’ were stronger than those of other cultivars, but the ability to use low light in ‘Mahan’ was relatively small. The Rd of ‘Mahan’ was smallest, which was good for accumulating the photosynthetic product, while ‘Stuart’ appeared the biggest ability inRd, which would consume more photosynthetic product. Through analyzing photosynthetic basic indexes and optical response,Gs,Trand CUE were the important factors in influencingPn, and CUE had a more direct and significant impact onPn. Among all the cultivars, the weaker and stronger ability in drought resistance were found in ‘Pawnee’ and ‘Jinhua’ respectively. JIP-test results showed that ‘Stuart’ had biggerSmand electron transport activity, and weaker fluorescence signal of different phases as well as heat dissipation, resulting in more energy provided for electron transport, while ‘Kanza’ showed the opposite tendency in those characteristics. There were significant differences in performance indexes of different cultivars. ‘Stuart’ showed optimal photosynthetic apparatus performance and ‘Kanza’ showed relatively poor performance. By comprehensively analyzing photosynthetic capacity and the indexes of photoreaction stage, it was found that photo reactivity of ‘Stuart’ was the biggest, but appeared the weakest photosynthetic capacity. This may be explained by stomatal limitation, strong dark respiration and the reason that more assimilatory power formed by photosynthetic apparatus was used for N, S assimilation and other metabolisms.
Pecan; Photosynthetic characteristics; Chlorophyll fluorescence
1)江苏省林业三新工程项目[LYSX[2016]44];国家林业局“948”项目(2015-4-16);林业公益性行业科研专项(201304711)。
刘壮壮,男,1991年11月生,南京林业大学林学院,博士研究生。E-mail:zzliu91@163.com。
彭方仁,南京林业大学林学院,教授。E-mail:frpeng@njfu.edu.cn。
2016年12月20日。
S792.99
责任编辑:潘 华。

