基于RNAi抗PRSV番木瓜株系的培育及其分子特征验证
黄静 贾瑞宗 孔华 郭静远 王绪朋 郭安平
摘 要 根据RNAi原理构建的抗海南番木瓜环斑病毒(PRSV)植物表达载体pCAMBIA2300-35S-CP-RNAi-OCS,通过基因枪法将载体导入番木瓜的愈伤组织中,经卡那霉素抗性筛选后再分化成为植株。描述转化植株的分子特征同时进行抗病毒试验分析其抗病性。实验结果显示:转基因株系474为单拷贝插入的杂合子,插入位点在第7号染色体supercontig_61的717 141位置;抗病毒试验中,在接种病毒后28 d内非转基因株系1280有高浓度的病毒积累并很快表现出明显的病症,而转基因株系474基本无病毒积累且无发病症状。表明转基因株系474具有较好的PRSV抗性,有待于进一步田间试验。
关键词 番木瓜环斑病毒;番木瓜;RNAi
中图分类号 S188 文献标识码 A
Abstract RNAi-mediated virus resistance strategy was used to develop PRSV resistance papaya lines. A plant expression vector pCAMBIA2300-35S-CP-RNAi-OCS was constructed. The vector was transferred into papaya callus by particle bombardment, selected on kanamycin media. Transformation papaya lines were validated by PCR, RT-PCR, ddPCR, etc. The transgenic lines were further challenged with viral inoculation. The results showed that transgenic line 474 was single copy insertion and insertion site was located in papaya chromosome 7 supercontig_61 at 717 141 bp; non-transgenic line 1280 accumulated higher concentration of virus and developed symptoms, while transgenic line 474 was almost no virus accumulation. Transgenic line 474 was resistance to PRSV, which needed field test.
Key words Papaya ringspot virus(PRSV); papaya; RNAi
doi 10.3969/j.issn.1000-2561.2017.03.021
番木瓜(Carica papaya L.)广泛种植于热带和亚热带地区,由于其产量高、营养价值丰富和无季节性等特点,被认为是重要的热带水果之一[1-2]。番木瓜环斑病毒(Papaya ringspot virus,PRSV)是危害番木瓜生产的致命性病原,并制约番木瓜产业的发展。番木瓜环斑病毒为马铃薯Y病毒科(Potyviridae)马铃薯Y病毒属(Potyvirus)的单分体正链RNA病毒,主要经蚜虫以非持久方式传播[3]。
通过番木瓜的基因组分析发现,番木瓜因缺乏抗病的相关基因而比其他植物更易感病[4]。一些常规的抗病毒育种策略往往收效甚微,目前对于PRSV的防治以基因工程育种为主。实际利用的番木瓜抗病毒基因多数是来自病毒本身,如病毒的外壳蛋白基因、复制酶基因、核酶基因、运动蛋白基因等,其中外壳蛋白基因[5]和复制酶基因[6]运用的较为成功。
夏威夷转基因番木瓜抗病毒的策略是根据“致病菌衍生的抗病性”(PDR)原理,采用病毒来源的基因序列,通过基因枪法将其转入不抗病的番木瓜品种中[5]。RNAi(RNA interference)即RNA干扰,亦称为转录后基因沉默(PTGS)或共抑制,是植物抵抗外来核酸(转座子、转基因或病毒)入侵,并保护自身基因组完整性的一种防御机制,被认为是RNA介导的病毒抗性,双链RNA分子被认为是最适宜的RNA沉默启动因子。构建反向重复(IR)序列能够显著提高转基因植物的抗性[7],一般来说转病毒单链正义或者反义基因只有20%左右转基因植株对病毒产生抗性,但是转入能够产生dsRNA的IR序列却有高达90%的转基因植物对病毒产生抗性[8]。
PRSV存在地理分化,各地的病毒分子差异较大。由于存在序列同源依赖性,因而限制了转夏威夷PRSV外壳蛋白(CP)基因番木瓜在夏威夷以外地区的应用[9]。转夏威夷或台湾PRSV外壳蛋白基因的品种只对夏威夷或台湾的PRSV株系具有抗性,不抗海南的PRSV株系[10]。目前,中国还缺乏表现良好的具有广谱抗性的番木瓜品种,也因此番木瓜产业受到环斑病的严重威胁。
为了培育出对海南地区PRSV种群具特异抗性的番木瓜新品种,前期已对海南昌江、乐东、澄迈、文昌和三亚5个主要番木瓜产区的病毒病发生情况进行调查取样,获取了海南PRSV代表分离物以及海南PRSV CP基因的保守区域。利用CP基因保守区域构建RNAi发夹结构,将发夹结构导入pCAMBIA2300-35S-OCS植物表达载体并酶切验证[11],本研究对转入以海南PRSV代表分离物CP基因保守区域构建的反向重复序列番木瓜进行了分子特征的描述以及抗病性分析。
1 材料与方法
1.1 材料
番木瓜品種SunRise和SunUp分别为来自夏威夷的非转基因及商品化转病毒CP基因的番木瓜,番木瓜品种SunRise的种子和经过片段化处理之后的番木瓜品种SunUp的DNA均由夏威夷农业研究中心朱芸博士提供。转化受体材料来源于番木瓜品种SunRise愈伤组织亦由夏威夷农业研究中心朱芸博士提供。
大肠杆菌(Escherichia coli)DH5α购于北京全式金生物技术有限公司,pMD18克隆载体购于宝生物工程(大连)有限公司,植物表达载体pCAMBIA2300-35S-CP-RNAi-OCS由本实验室构建并保存[11],采自海南的PRSV HainanⅠ、HainanⅡ和HainanⅢ 3个分离物由本实验室保存。
PCR试剂盒购于北京全式金生物技术有限公司,质粒提取试剂盒、植物基因组DNA提取试剂盒和DNA凝胶回收试剂盒均购于Omega公司,RNA提取试剂盒购于Qiagen公司,反转录试剂盒购于Promega公司,荧光定量PCR试剂盒购于宝生物工程(大连)有限公司,所有实验用到的酶全部购于Thermoscientific公司,其他常用试剂为分析纯。引物序列见表1,合成以及DNA测序均由生工生物工程(上海)股份有限公司完成。
1.2 方法
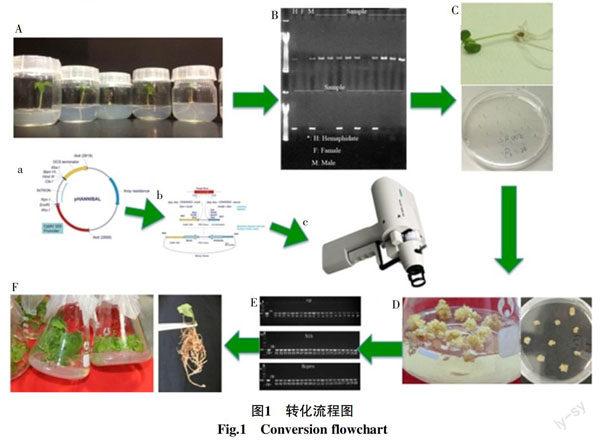
1.2.1 转化及转基因植株筛选 参照Kung等[12]方法诱导番木瓜胚性愈伤组织。参考Fitch等[13]的方法进行基因转化,转化采用PDS 1000型基因枪(Bio-Rad,Hercules,Calif.;http://www.bio-rad.com)。用卡那霉素(100 mg/L)抗性筛选培养基培养1~2个月,成苗后再进行外源基因PCR检测。将检测为阳性的植株生根处理后移栽到土壤中,置于温室中培养。转化流程图见图1。
1.2.2 PRSV分离与接种 海南PRSV HainanⅠ、Ⅱ和Ⅲ这3个类型的病毒分离物保存于实验室。接种前将病毒接种到番木瓜上活化[14],表现出病症的番木瓜叶片制备病毒接种液。参考魏亚军[15]接种PRSV的方法并做了适当的修改。取同时含有海南PRSV的HainanⅠ、Ⅱ和Ⅲ 3个类型病毒的番木瓜叶样适量,按照1 ∶ 10(w/V)的比例加入磷酸缓冲液,充分研磨。将匀浆液加入到1.5 mL离心管中,在4 ℃条件下5 000 r/min,冷冻离心10 min。冰上放置,取上清液作为病毒接种液。PRSV接种液-20 ℃保存并在48 h内使用,提取接种液中的RNA逆转录为cDNA,利用qPCR方法测定接种液里的PRSV含量。
选取4~6叶期的苗,在叶正面撒上少量石英砂,滴加10 μL接种液由叶脉向叶尖顺势轻轻摩擦均匀涂布叶片表面。接种结束后,立即用蒸馏水冲洗接种叶表面。转基因株系为实验组,非转基因株系为对照组,同时设置不接种任何液体(CK)和接种PBS缓冲液的2种对照处理,每种处理设3个生物学重复。将接种后的植株置于温室中培养,每隔4 d观察记录发病情况同时取新生幼叶用来检测病毒量。由于PRSV在番木瓜上是系统性感病,排除其他因素对于病毒量的影响,故取新生幼叶检测病毒量。采用逆转录PCR(RT-PCR)和qPCR检测接种病毒后天数(Day After Inoculation,DAI)在第0、4、8、12、16、20、24、28天的病毒积累量。
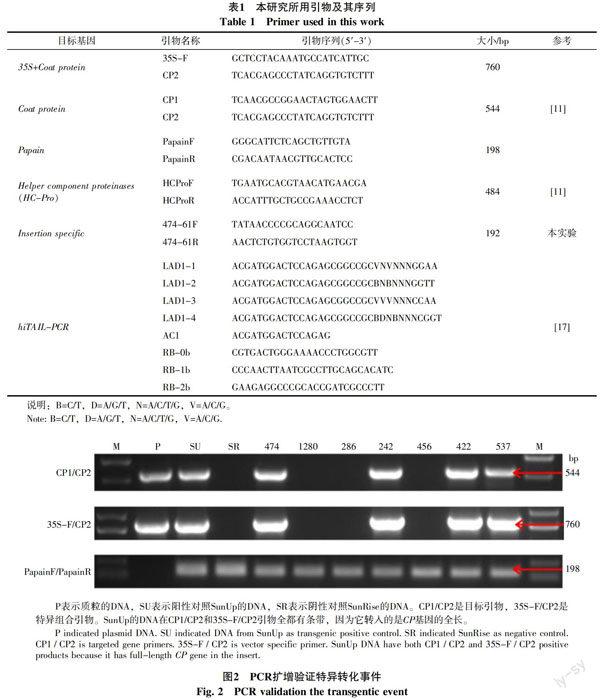
1.2.3 PCR筛选阳性转化苗 用转化事件特异PCR进行阳性转化苗的筛选。使用的引物分别是目标基因CP引物(CP1/CP2)、转化事件特异性引物(35S-F/CP2)和内参引物(PapainF/R)(表1)。PCR扩增条件是:94 ℃,3 min预变性;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃再延伸10 min。这3对引物扩增条件一致,只有35S-F/CP2引物扩增是延伸时间为1 min,其余条件不变。反应结束后,用1.0%的琼脂糖凝胶电泳检测。
1.2.4 微滴数字PCR(ddPCR)分析插入的拷贝数
参考姜羽等[16]用ddPCR分析转基因的外源基因拷贝数的方法,分析阳性植株的插入的拷贝数。本实验采用QX100TM Droplet DigitalTM PCR系统(Bio-Rad,美国,包括微滴生成仪和微滴读取仪),按照说明书进行相关操作,扩增程序设置如下:95 ℃,5 min预变性;95 ℃变性20 s,58 ℃退火30 s,共45个循环,扩增结束后进行在98 ℃条件下10 min热失活。每个模板重复3个平行检测。使用软件Quanta Soft V1.3.2.0分析实验数据,获得转化阳性植株绝对定量结果。
1.2.5 hiTAIL-PCR验证插入位点 hiTAIL-PCR参考Liu等[17]描述的方法(引物见表1),验证阳性植株的插入位点。第一轮和第二轮扩增产物电泳检测,将条带割胶回收后连接到pMD18克隆载体上,最后转化到大肠杆菌DH5α感受态中,每个挑选3个重复阳性菌送到生工生物工程(上海)股份有限公司进行测序。将测序结果在Phytozome v11.0(https://phytozome.jgi.doe.gov)网站上进行比对,以确定插入的位点信息。
1.2.6 PRSV的抗性检测 用RNeasy Plant Mini Kit(QIAGEN)试剂盒提取8个时间段采集的番木瓜幼叶样本的RNA以及PRSV接种液的RNA后,使用ImProm-II Reverse Transcription System(Promega) 试剂盒逆转录生成cDNA。由于转化事件是CP基因片段,因此用RT-PCR和qPCR检测转基因番木瓜的PRSV积累量时使用的是HC-Pro特异引物(表1)。
RT-PCR按照试剂盒说明书进行操作,将RNA、引物和水的混合物在70 ℃下变性5 min,立即在冰上静置5 min,短暂离心用来配置反应体系。反应条件是25 ℃,5 min;42 ℃,60 min;70 ℃,15 min,4 ℃保存。
PCR病毒检测的扩增条件是94 ℃ ,3 min预变性;94 ℃變性30 s,60℃ 退火30 s,72 ℃延伸30 s,共35个循环;72 ℃ 再延伸10 min。qPCR反应程序如下:95 ℃,5 min预变性;95℃变性 20 s,58 ℃退火30 s,共45个循环,在退火步骤中采集荧光信号。每个模板重复3个平行扩增。扩增结束后使用SDS 2.4软件分析实验数据,获得实时荧光定量PCR结果。
2 结果与分析
2.1 PCR筛选分析
用于PCR检测的这3对引物CP1/CP2、35S-F/CP2和PapainF/R扩增片段大小分别是544、大约760和198 bp。阳性对照SunUp转入的是PRSV的 CP基因全长[18]。图2是PCR筛选阳性转化事件的部分结果,其中1280株系为非转化株系,其检测结果与阴性对照SR结果一致,电泳结果表明CP基因引物的检测结果与组合引物结果一致,与阳性对照的结果相符,可判定474、242、422、537为阳性植株。
2.2 ddPCR定量结果分析
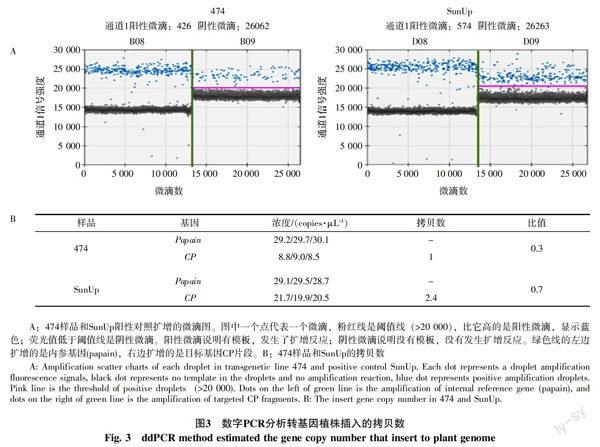
微滴生成是ddPCR记录信号的关键步骤,只有当微滴数大于10 000时,DNA分子的分布符合泊松分布的统计学原理,系统可以对阳性和阴性微滴进行计数[19]。ddPCR扩增微滴形成由图3-A可见,反应中形成的微滴数处于15 000~30 000之间,均大于10 000,满足ddPCR微滴的分析要求。ddPCR系统生成的阴性微滴和阳性微滴区分明显,系统可准确判读出阳性微滴和阴性微滴数目。数据表明,实验建立的ddPCR体系微滴生成稳定,重复性良好,能够用于转基因生物外源基因拷贝数的分析。
根据软件读取的外源基因和内参基因的浓度,通过公式:外源基因拷贝数=外源基因浓度/内参基因浓度,计算得出转基因番木瓜474和阳性对照SunUp的外源基因(CP)的拷贝数。ddPCR分析显示,转基因番木瓜474含有1.0拷贝的CP基因,SunUp则含有2.4拷贝的CP基因,见图3-B。由于SunUp是(CP/CP)纯合子,结果和以前的报道一致[18]。
2.3 hiTAIL-PCR验证转化插入的位点
474样品的hiTAIL-PCR第一轮和第二轮电泳结果如图4-A,将测序结果进行分析(Carica papaya ASGPB v4.0, https://phytozome.jgi.doe.gov),发现比对上7号染色体的supercontig_61,Score=1 314 bits(663),Expect=0.0,Identities=669/671(99%)插入位点在717 141的位置(图4-B)。转基因植株474中,外源基因未插入到番木瓜编码基因中,插入位点上游+1.2 kb 处有evm.TU.supercontig_61.23;上游+3.9 kb处有evm.TU.supercontig_61.22;上游 +10.4 kb处有evm.TU.supercontig_61.21;上游+174.2 kb处有evm.TU.supercontig_61.20。下游-2.6 kb有evm.TU.supercontig_61.24这是一个编码反转录酶(RNA-dependent DNA polymerase,RVT_2)的基因;下游
-96.8 kb处有evm.TU.supercontig_61.25。
为了验证插入的真实性,根据插入位点上下游片段设计引物进行验证。在supercontig_61上的717141位点的上游和下游各约200 bp处,利用NCBI网站(http://www.ncbi.nlm.nih.gov/)设计引物474-61F/R,扩增片段大小为192 bp。在反应体系中加入474-61F/R+CP2,如果存在CP基因插入时,CP基因的一条引物和设计引物组合扩增出的片段大小应该为1.2 kb左右(CP正向插入+35S启动子+右边界+基因组的扩增右翼)。474样品的电泳结果(图4-C)有2条带其中一条带大小与阴性对照一致192 bp,另一条带约1.2 kb这大小符合有CP基因插入的预测,根据结果可判断474样品为杂合子。
2.4 转基因番木瓜对PRSV的抗性评价
在接种病毒后28 d内,1280株系和474株系抗病性差异明显。3株接种病毒的1280植株表现一致,均感病具体表现为在12 DAI时表现出病症,随着时间的延长,病症日益明显,在24 DAI时出现病症典型;同时接种病毒的3株474植株整个过程均无病症,表型正常,见图5-A。对在8个时间点采集的样品进行PCR检测病毒积累量,电泳结果见图5-B。在相同模板量下,非转基因1280株系凝胶检测灰度程指数增长趋势,即随着时间的延长感染病毒量逐渐递增,转基因474株系基本没有变化,即几乎没有病毒的感染(图5-C)。
2.5 荧光定量PCR检测病毒积累
采用相对荧光定量PCR 2-△△Ct[20]处理数据,△△Ct=(CtPRSV样品-Ctpapain样品)-(CtPRSV校準-Ctpapain校准),结果见图5-D。对照组非转基因1280株系样品和实验组转基因474株系样品在不同时期中PRSV HC-Pro基因的转录水平存在显著差异,1280样品中HC-Pro表达量比474样品高。随着时间的延长,1280植株HC-Pro表达量逐渐增多且变化显著,而474植株HC-Pro只有少量的表达且无明显变化,1280株系和474株系HC-Pro表达量存在显著差异。因此,实验组与对照组的病毒积累量有显著差异,实验组虽然有极少量病毒但是无症状,对照组变化明显,有大量病毒积累并表现出病症。
3 讨论
番木瓜病毒病是限制番木瓜生产的主要因素。为了调查海南番木瓜发病情况,进行环海南岛采集番木瓜样品,发现由于PRSV肆虐,海南的一些番木瓜种植区已经出现了绝产绝收的现象。海南PRSV具有极高的突变率,已报道海南PRSV HainanⅠ,HainanⅡ和HainanⅢ这3个分离物在海南不同区域间分布不同[21],通过分析海南这3个分离物找到它们的共同保守区域片断,采用RNAi原理构建植物表达载体。有研究表明,基因沉默效果与表达载体构建有关。构建发夹结构目标基因片断长度小于200 bp或者大于600 bp 的效果不好;在200~600 bp之间的转化后干扰效率最高[22],本实验选择的CP基因片段大小为544 bp,在此范围内。
在本研究中,利用海南PRSV代表分离物共同保守区域CP基因片段构建反向重复序列植物表达载体,采用基因枪法将载体导入番木瓜的愈伤组织中,经卡那霉素抗性筛选进而再分化成为植株。转化苗经过PCR筛选、ddPCR分析插入拷贝数、hiTAIL-PCR验证特异插入位点以及抗病毒试验。PCR检测为阳性的474样品ddPCR分析结果为单拷贝插入,hiTAIL-PCR显示插入位点在第7号染色体supercontig_61的717 141位置,设计特异引物验证插入位点时发现474株系为杂合子。转基因474植株和非转基因1280植株通过摩擦接种PRSV的抗病毒试验表明,474植株对PRSV的侵染产生了抗性,认为这是由于转基因番木瓜474株系体内导入了由反向重復载体转录形成的dsRNA启动了RNA沉默机制的结果,即转入CP基因反向重复载体能够形成dsRNA,从而有效抑制了PRSV对番木瓜的侵染;PRSV在番木瓜中是系统侵染,非转基因番木瓜1280株系中病毒可以由接种叶片扩散到新生幼叶;而在转基因番木瓜叶片上接种病毒,植株无病症。图5-D显示,转基因植株中存在病毒HC-Pro基因的极少量(不到2 dRn)表达,随着时间的推移表达量无明显变化,表明病毒少量存在转基因植株中不扩增更不发病;但图5-B显示,转基因植株中RT-PCR检测不到病毒基因表达,这是由于病毒量极少扩增条带不被识别,因此检测不到病毒表达。
利用来源植物病毒本身的基因或核苷酸序列导入植物来得到抗病毒的工程株成为增强抗病性的主要措施之一,由RNA介导抗性使含单拷贝的转基因植株能产生高度抗病性;短片断核苷酸序列也可以起到抗病作用;入侵病毒的RNA能迅速被降解、不需表达蛋白质等优点使抗病毒策略具有潜在的应用价值并能引起广泛关注和深入研究[23]。魏军亚等[14]研究同源CP基因区段dsRNA对PRSV侵染的干扰作用,发现瞬时表达的dsRNA能够特异地干扰PRSV侵染;张帆等[24]将PRSV CP基因的dsRNA载体pHG12-CPIR转入番木瓜中,检测结果显示PRSV在野生型中有大量积累,而在转基因植株中没有积累;Wang等[25]证实表达病原dsRNA的转基因植物能够对相应的病毒侵染产生抗性,结果表明在植物细胞中表达dsRNA能够引起导入序列的植物的基因沉默。本实验采用RNA介导抗性,转入以海南PRSV代表分离物CP基因保守区域构建的反向重复序列,若要获得广谱抗PRSV的植株,有待于进一步田间试验。
参考文献
[1] Paz L, Vázquez-Yanes C. Comparative seed ecophysiology of wild and cultivated Carica papaya trees from a tropical rain forest region in Mexico.[J]. Tree Physiology, 1998, 18(4): 277-280.
[2] Niklas K J, Marler T E. Carica papaya (Caricaceae): a case study into the effects of domestication on plant vegetative growth and reproduction[J]. American Journal of Botany, 2007, 94(6): 999-1 002.
[3] Gonsalves D, Vegas A, Prasartsee V, et al. Developing papaya to control Papaya ringspot virus by transgenic resistance, intergeneric hybridization, and tolerance breeding[J]. Plant Breeding Reviews, 2010, 26: 35-78.
[4] Ming R, Hou S, Feng Y, et al. The draft genome of the transgenic tropical fruit tree papaya(Carica papaya Linnaeus)[J]. Nature, 2008, 452(7 190): 991-996.
[5] Fitch M M M, Manshardt R M, Gonsalves D, et al. Virus resistant papaya plants derived from tissues bombarded with the coat protein gene of Papaya ringspot virus[J]. Nature Biotechnology, 1992, 11(11): 1 466-1 472.
[6] 阮小蕾, 王加峰, 李华平. VIGS介导的转复制酶基因番木瓜对PRSV的抗性[J]. 华中农业大学学报, 2009, 28(4): 418-422.
[7] Kyrychenko A M, Telegeyeva T A, Kovalenko O G. Molecular and genetic mechanisms of resistance of plants to viruses[J]. Cytology & Genetics, 2007, 41(2): 125-135.
[8] Waterhouse P M, Helliwell C A. Exploring plant genomes by RNA-induced gene silencing[J]. Nature Reviews Genetics, 2003, 4(1): 29-38.
[9] Castillo X A O, Fermin G, Tabima J, et al. Phylogeography and molecular epidemiology of Papaya ringspot virus[J]. Virus Research, 2011, 159(2): 132-140.
[10] Zhao H, Jia R Z, Zhang Y L, et al. Geographical and genetic divergence among Papaya ringspot virus populations within Hainan province, China[J]. Phytopathology, 2016, 106(8): 937-944.
[11] 趙 辉, 张雨良, 孔 华, 等. 番木瓜环斑病毒海南株系植物RNAi表达载体的构建[J]. 热带作物学报, 2015, 36(12): 2 210-2 215.
[12] Kung Y J, Yu T A, Huang C H, et al. Generation of hermaphrodite transgenic papaya lines with virus resistance via transformation of somatic embryos derived from adventitious roots of in vitro shoots[J]. Transgenic Research, 2010, 19(19): 621-635.
[13] Fitch M M M, Manshardt R M. Somatic embryogenesis and plant regeneration from immature zygotic embryos of papaya (Carica papaya, L.)[J]. Plant Cell Reports, 1990, 9(6): 320-324.
[14] 魏军亚, 刘德兵, 周 鹏. dsRNA介导的PRSV-CP基因3′-端同源序列瞬时表达对番木瓜环斑病毒侵染的影响[J]. 热带作物学报, 2007, 28(3): 78-82.
[15] 魏军亚. 番木瓜花粉管转基因技术及RNA介导广谱抗病性的初步研究[D]. 海口: 海南大学, 2006.
[16] 姜 羽, 胡佳莹, 杨立桃, 等. 利用微滴数字PCR分析转基因生物外源基因拷贝数[J]. 农业生物技术学报, 2014, 22(10): 1 298-1 305.
[17] Liu Y G, Chen Y. High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences.[J]. Biotechniques, 2007, 43(43): 649-656.
[18] Suzuki J Y, Tripathi S, Fermín G A, et al. Characterization of insertion sites in rainbow papaya, the first commercialized transgenic fruit crop[J]. Tropical Plant Biology, 2008, 1(3): 293-309.
[19] Morisset D, Novak P K, Zupanic D, et al. GMOseek: a user friendly tool for optimized GMO testing[J]. Bmc Bioinformatics, 2014, 15(1): 1-13.
[20] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT, method[J]. Methods, 2001, 25(4): 402-408.
[21] 张雨良, 黄启星, 郭安平, 等. 海南番木瓜PRSV和PLDMV病毒发生情况及分子鉴定[J]. 热带作物学报, 2013, 34(12): 2 436-2 441.
[22] Wesley S V, Helliwell C A, Smith N A, et al. Construct design for efficient, effective and high-throughput gene silencing in plants.[J]. Plant Journal for Cell & Molecular Biology, 2001, 27(6): 581-590.
[23] Voinnet O. RNA silencing as a plant immune system against virus[J]. TRENDS in Genetics, 2001, 17(8): 449-459.
[24] 张 帆, 姜 玲. dsRNA 介导的番木瓜环斑病毒(PRSV)抗病性研究[J]. 植物科学学报, 2011, 29(3): 385-391.
[25] Wang M B, Metzlaff M. RNA silencing and antiviral defense in plants[J]. Current Opinion on Plant Biology, 2005, 8: 216-222.

