解淀粉芽胞杆菌的GFP标记及定殖能力
薛松 汪军 王国芬 杨腊英 丁兆建 周游 黄俊生
摘 要 采用改良的海藻糖电转化法获得GFP标记菌株X5-GFP、BQA2-GFP,显微镜观察标记菌株在土壤和水培中的番茄根际的定殖情况。结果表明:标记菌株单独或与青枯菌先后加入进行处理,番茄根际标记菌株的种群数量变化趋势都是一致的。在土壤番茄根际中,X5-GFP单独处理后当天的菌量为1.05×106 CFU/g,随之菌量逐渐下降;处理30 d后,为1.50×103 CFU/g;而BQA2-GFP单独处理后当天菌量为1.68×106 CFU/g,随之菌量也逐渐下降;处理30 d后,为2.50×103 CFU/g;在水培番茄根际中,X5-GFP单独处理后当天的菌量为2.70×105 CFU/g,随之菌量逐渐下降;处理30 d后,为1.00×103 CFU/g;而BQA2-GFP单独处理后当天菌量为3.60×105 CFU/g,随之菌量同样逐渐下降;处理30 d后,为1.50×103 CFU/g。这表明解淀粉芽胞杆菌X5、BQA2均在番茄根际有较强的定殖能力。
关键词 解淀粉芽胞杆菌;绿色荧光蛋白;定殖
中图分类号 S432 文献标识码 A
Abstract In this study, green fluorescent protein tagged strains X5 and BQA2 were obtained by improvement in electroporation transformation efficiency of gene for Bacillus amyloliquefaciens with trehalose. X5-GFP and BQA2-GFP colonization in the rhizosphere of tomato were observed by microscope. The experimental results indicated that changing tendency of population quantity in marking strains of tomato rhizosphere was consistent after dealing with individual marking strains or adding Ralstonia solanacearum successively. In the soil, the population of X5-GFP on the roots of tomato reached 1.05×106 CFU/g after inoculating X5-GFP alone, and then decreased 30 days later, eventually remained at 1.50×103 CFU/g. The population of BQA2-GFP on the roots of tomato reached 1.68×106 CFU/g after inoculating BQA2-GFP alone, and then decreased 30 days later, eventually remained at 2.50×103 CFU/g. In Hydroponics, the population of X5-GFP on the roots of tomato reached 2.70×105 CFU/g after inoculating X5-GFP alone, and then decreased 30 days later, eventually remained at 1.00×103 CFU/g. The population of BQA2-GFP on the roots of tomato reached 3.60×105 CFU/g after inoculating BQA2-GFP alone, and then decreased 30 days later, eventually remained at 1.50×103 CFU/g. The results showed that B. amyloliquefaciens X5 and B. amyloliquefaciens BQA2 displayed good colonization ability in the rhizosphere of tomato.
Key words Bacillus amyloliquefaciens; green fluorescent protein; colonization
doi 10.3969/j.issn.1000-2561.2017.03.026
由于人们对粮食质量安全要求的提高,绿色环保粮食已经受到人们的青睐。在生产绿色环保粮食过程中,生物防治由于其環保、低毒等优点受到了广泛的关注[1]。据报道,生防菌在植物上的定殖能力和病害防治效果紧密相关[2-3],有关研究也成为目前生防菌研究领域的热点之一[4-5]。很多标记方法被开发用于标记目标微生物,使其与其它微生物区别开来,以阐明生防菌的定殖能力。抗生素标记作为最早使用的标记方法,主要有硫酸链霉素、卡那霉素、四环素、氨苄青霉素等标记法[6-7],但抗生素标记法不能区别出对标记抗生素有同样抗性的其它微生物。随着标记基因技术的不断进步,由于绿色荧光蛋白(Green Fluorescent Protein, GFP)具有易于检测、灵敏度高、稳定性较好、构建载体方便、对宿主细胞无毒害作用、不受假阳性干扰、广谱性等优点,现已成为探究目标微生物与寄主植物相互作用的重要工具[8]。刘邮洲等[9]将GFP转到枯草芽胞杆菌PTS-394中,标记菌株PTS-GFP与野生菌株PTS-394在生长性状和平板抑菌效果等方面基本相同。杨秀荣等[10]用GFP标记生防细菌 B579,结果表明标记菌株B579-gfp可在黄瓜根部大量定殖并形成生物膜状。Cao等[11]发现枯草芽胞杆菌SQR 9能使黄瓜枯萎病的发病率降低49%~61%,同时发现GFP转化的枯草芽胞杆菌SQR 9在黄瓜根部的定殖数量能达到106 CFU/g,这说明枯草芽胞杆菌SQR 9能很好的防控黄瓜枯萎病。Gao等[12]用GFP标记Bacillus subtilis 168和它的2株衍生菌OKB105、OKBHF(菌株OKB105和OKBHF能产生脂肽物质),将他们接种至番茄根部,结果发现OKB105、OKBHF这2个菌株在番茄根部的定殖数量是B. subtilis 168菌株定殖数量的2~3倍。这说明枯草芽胞杆菌可能通过脂肽物质的产生来提高定殖效率,从而促进植物生长。Yuan等[13]发现解淀粉芽胞杆菌YL-25能有效防控香蕉枯萎病的发生,同时也能促进植物生长。
在前期,本实验室从香蕉根际分离到2株解淀粉芽胞杆菌X5和BQA2,它们对番茄青枯病菌(Ralstonia solanacearum)和香蕉枯萎病菌(Fusarium oxysporum f. sp. cubense)具有较强的拮抗作用。为了深入研究解淀粉芽胞杆菌X5和BQA2在植物上的定殖能力,本研究对他们进行GFP标记,并通过显微镜观察X5-GFP和BQA2-GFP在番茄根部定殖数量的变化,为将来开发利用解淀粉芽胞杆菌X5和BQA2作为生防菌奠定基础。
1 材料与方法
1.1 材料
菌株:解淀粉芽胞杆菌(Bacillus amyloliquefaciens)X5和BQA2及番茄青枯病菌(Ralstonia solanacearum)R4、香蕉枯萎病菌(Fusarium oxysporum)FOC-B2均由中国热带农业科学院环境与植物保护研究所微生物资源研究与利用研究室提供。
TTC琼脂培养基:0.1%酸水解酪蛋白1 g、蛋白胨10 g、葡萄糖5 g、琼脂17 g、蒸馏水1 000 mL(1%氯化三苯基四氮唑盐酸盐(TTC)在使用前待灭菌的基础培养基冷却至55 ℃时再加入)。PDA培养基: 马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 000 mL。LB培养基:酵母粉5 g、胰蛋白胨10 g、NaCl 10 g、琼脂15 g、蒸馏水1 000 mL。电击洗液:海藻糖0.5 mol/L、山梨醇0.5 mol/L、甘露醇0.5 mol/L、甘油10%。恢复液:分别含0.5 mol/L海藻糖、0.5 mol/L山梨醇、0.38 mol/L甘露醇的LB。
番茄品种:樱桃番茄京丹1号品种,由中国热带农业科学院环境与植物保护研究所微生物资源研究与利用研究室提供。
试剂:海藻糖从北京索莱宝科技有限公司购买,Taq DNA聚合酶从宝生物工程(大连)有限公司购买。带有绿色荧光蛋白标记的表达载体P101-P4322由中国热带农业科学院环境与植物保护研究所微生物资源研究与利用研究室提供。引物合成和基因测序由上海生工生物工程技术服务有限公司来完成。
1.2 方法
1.2.1 解淀粉芽胞杆菌X5和BQA2的盆栽实验
将长出20片真叶的番茄苗移栽至装有灭菌土壤的盆钵中,每盆1株,设置8个重复。本实验共设置3个处理组:(1)加入5 mL解淀粉芽胞杆菌X5菌液(菌液浓度为108 CFU/mL)和5 mL青枯菌R4菌液(菌液浓度为108 CFU/mL);(2)加入5 mL解淀粉芽胞杆菌BQA2菌液(菌液浓度为108 CFU/mL)和5 mL青枯菌R4菌液(菌液浓度为108 CFU/mL);(3)加入5 mL的灭菌水和5 mL青枯菌R4菌液(菌液浓度为108 CFU/mL);
分别在移栽后7、15、30 d调查番茄苗的发病情况。病情指数分级标准:0级为番茄苗无萎蔫症状;1级为番茄苗叶片≤25%萎蔫;2级为番茄苗叶片26%~50%萎蔫;3级为番茄苗叶片51%~75%萎蔫;4级为番茄苗叶片76%~100%萎蔫或者死亡。
病情指数=×100
防治效果=×100%
1.2.2 解淀粉芽胞杆菌X5和BQA2的GFP标记
从解淀粉芽胞杆菌X5、BQA2的平板中挑取单菌落,接接至LB液体培养基中,于37 ℃、170 r/min过夜培养,待菌液OD600为2.0时停止培养,将菌液冰浴10 min后,再于4 ℃、5 000 r/min离心6 min。用预冷的电击洗液冲洗菌体之后,在4 ℃、5 000 r/min离心10 min,共洗涤4次。最后用500 μL电击洗液悬浮菌体,则得到X5和BQA2的感受态细胞。
电转化时取60 μL的感受态细胞与1 μL质粒(190.6 ng/μL)混匀后转入到冰置电击杯(1 mm电击缝隙)中,冰浴8 min后进行电击,电击条件是2.6 kV/mm,电击1次,电击时间为4.5 ms。电击后立即加入1 mL恢复液(LB含0.5 mol/L海藻糖、0.5 mol/L山梨醇、0.38 mol/L甘露醇),于37 ℃、100 r/min孵育3 h后,涂布于含有20 μg/mL四环素的LB平板上,过夜37 ℃倒置培养观察转化子。利用primer5.0软件设计gfp基因的特异性引物,W3:ATGAGTAAAGGAGAAGAACTTTTCACTGG,W16:AAAGAATTCCTATTTGTATAGTTCATCCATGCCATG。
1.2.3 X5-GFP和BQA2-GFP生長特性 将X5-GFP和BQA2-GFP的单菌落接种至30 mL含40 μg/mL四环素的LB液体培养基中,于37 ℃、170 r/min培养过夜。取100 μL培养过夜的菌液接种至60 mL含40 μg/mL四环素的LB液体培养基中,于37 ℃、170 r/min培养过夜。用野生菌株 X5、BQA2作为对照,在相同的处理下进行培养,每2 h测量菌液OD600值1次,从而得到X5、BQA2和X5-GFP、BQA2-GFP 的生长特性。
1.2.4 X5-GFP和BQA2-GFP的平板拮抗性能
从TTC琼脂平板挑取青枯病菌的菌落接种至LB中,于28 ℃、190 r/min速度培养过夜,用无菌水稀释至菌含量达108 CFU/mL,取稀释后的青枯病菌液100 μL涂布至TTC琼脂平板,用牙签挑取X5-GFP和X5点到直径方向左右两侧(距平板边缘20 mm),在28 ℃下恒温培养24 h,每次处理3个重复。设清水对照。而BQA2-GFP和BQA2作相同处理。待对照平板青枯菌长满平板时,调查抑菌圈直径。
挑取香蕉枯萎病菌接种至PDA液体培养基中,于28 ℃、190 r/min速度培养过夜,用无菌水稀释菌液浓度至108 CFU/mL。取稀释后的香蕉枯萎病菌液100 μL涂布至PDA琼脂平板,用孔径6 mm的灭菌打孔器在直径方向左右两侧(距平板边缘20 mm)处各打一个孔,分别滴加X5-GFP和X5菌液20 μL,在28 ℃下恒温培养24 h,每次处理3个重复。设清水对照。而BQA2-GFP和BQA2作相同处理。等到对照平板香蕉枯萎病菌长满平板的时候,测量抑菌圈的直径。
1.2.5 X5-GFP和BQA2-GFP质粒的稳定性测试
将X5-GFP的单菌落接种至含40 μg/mL四环素和不含四环素的20 mL液体LB培养基当中,于37 ℃、170 r/min培养过夜记为0代,隔24 h后取100 μL的过夜培养的菌液分别接种至含40 μg/mL四环素和不含四环素的液体LB培养基中,于37 ℃、180 r/min连续培养10代。每培养24 h后取100 μL传代菌液涂布到不含四环素的LB平板,37 ℃培养过夜后取20个单菌落接种至含有40 μg/mL四环素的LB平板上,37 ℃培养24 h后在荧光显微镜下统计发光的菌落数。而BQA2-GFP作相同处理。计算标记菌株质粒的稳定性[14]:质粒的稳定性=发光菌落数/20。
1.2.6 X5-GFP和BQA2-GFP番茄根际的定殖情况
将长出8片真叶的番茄苗种植至装有灭菌土的盆钵中,每盆种植1株,设置9个重复。青枯菌R4接种前需要刺伤番茄的根部[15]。本实验共设置3个处理组:(1)加入X5-GFP菌液3 mL;(2)先加入X5-GFP菌液3 mL,隔1 d后加入青枯菌液1 mL;(3)先加入青枯菌液1 mL,隔1 d后再加入X5-GFP菌液3 mL。BQA2-GFP同样设上述的3个处理组。
加入X5-GFP菌液4 h后取1 g番茄根,将其磨碎后,取100 μL涂板37 ℃培养24 h后统计菌落数,即为第0天X5-GFP的定殖量。随后第2,4,6,8,10,15,30天分别取样测定。同时,显微镜观察标记菌株在番茄根际的定殖情况。BQA2-GFP定殖量的测定方法和上述方法相同。
将长出8片真叶的番茄苗种植至装有60 mL灭菌水的锥形瓶中,每盆种植1株,设置9个重复。青枯菌R4接种前同样需要刺伤番茄的根部[15]。处理组的设置和标记菌株定殖数量测定与观察和上述方法相同。
1.3 数据处理
采用EXCEL2013软件对X5、BQA2和X5-GFP、BQA2-GFP的OD600值进行处理。
2 结果与分析
2.1 解淀粉芽胞杆菌X5和BQA2的盆栽防效
解淀粉芽胞杆菌X5和BQA2的盆栽防治效果见表1。由表1可知,解淀粉芽胞杆菌X5和BQA2的盆栽防治效果分别为61.8%和80.9%,两者都能较好的抑制青枯病的发生,经比较,解淀粉芽胞杆菌BQA2的盆栽防治效果更好。
2.2 解淀粉芽胞杆菌X5和BQA2的GFP标记
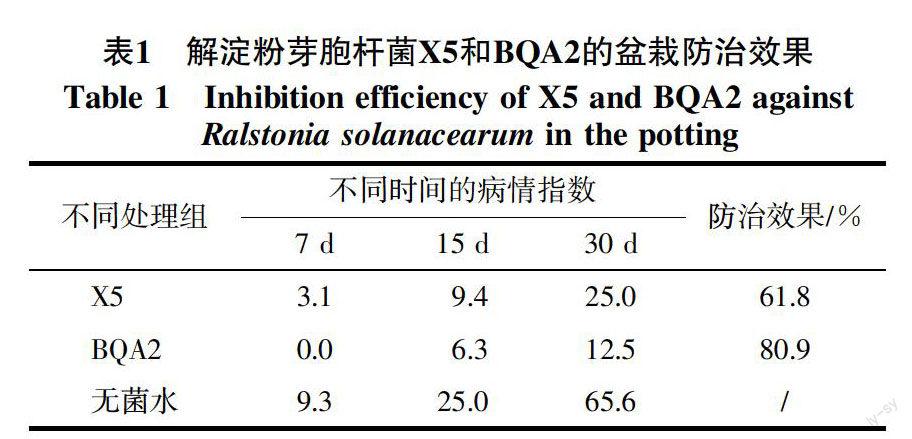
将重组质粒P101-P4322电击转入野生型菌株X5和BQA2中,结果发现,用荧光显微镜观察标记菌株发出的绿色荧光(图1)。
2.3 X5-GFP、BQA2-GFP的生长特性
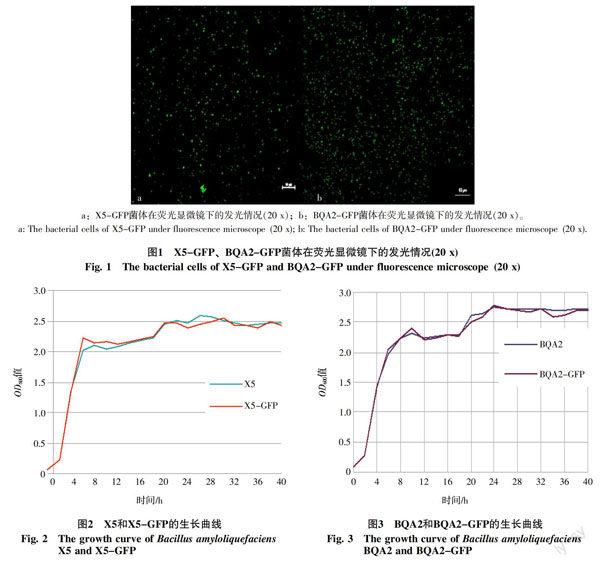
X5和X5-GFP的生长曲线相似(图2)。菌株的对数生长期的在培养后2 h,稳定生长期是在6 h后,随后一直较为稳定。这表明野生菌株X5进行GFP标记后,质粒P101-P4322未对菌株X5的生长产生明显影响。
BQA2和BQA2-GFP的生长曲线也是相似(图3)。菌株的对数生长期是在培养后2 h,稳定生长期是在培养10 h后,随后也是一直较为稳定。这同样表明野生菌株BQA2进行GFP标记后,质粒P101-P4322未对菌株BQA2的生长产生明显影响。
2.4 X5-GFP和BQA2-GFP的平板拮抗
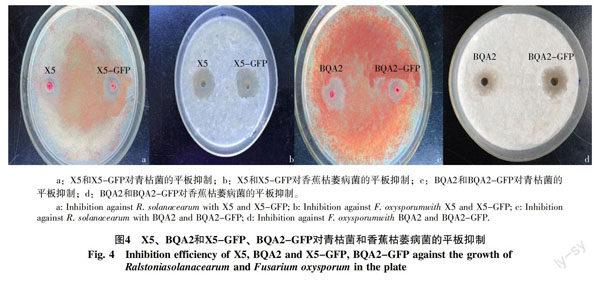
与野生菌株x5和BQA2相比, X5-GFP和BQA2-GFP对番茄青枯病菌和香蕉枯萎病菌的平板抑菌活性无明显差别(图4)。X5和X5-GFP对番茄青枯病菌的抑菌圈的直径为1.5 cm;X5和X5-GFP对香蕉枯萎病菌的抑菌圈的直径为1.9 cm;BQA2对番茄青枯病菌的抑菌圈的直径为1.7 cm;BQA2-GFP对番茄青枯病菌的抑菌圈的直径为1.5 cm;BQA2对香蕉枯萎病菌的抑菌圈直径为1.6 cm;BQA2-GFP对香蕉枯萎病菌的抑菌圈直径为1.5 cm。
2.5 X5-GFP和BQA2-GFP的质粒稳定性
菌株X5-GFP在LB培养基中培养,连续培养4代后,质粒的稳定性是100%,培养8代后质粒的稳定性是95%,培养10代以后为90%;而菌株BQA2-GFP连续培养4代后,质粒的稳定性是95%,培养8代质粒的稳定性是85%,培养10代后为80%。在含四環素的LB培养基培养时, X5-GFP、BQA2-GFP在培养10代后的质粒稳定性均为95%。结果表明,质粒P101-P4322在X5-GFP和BQA2-GFP中能够稳定遗传,并且随着连续的培养质粒P101-P4322的稳定性而降低。
2.6 X5-GFP和BQA2-GFP在番茄根际的定殖情况
X5-GFP在番茄根际的定殖情况见图5和图6。BQA2-GFP在番茄根际的定殖情况见图7和图8。X5-GFP和BQA2-GFP在处理当天都能大量定殖在番茄根际;随后标记菌株数量逐渐下降,处理30 d后,标记菌株仍有不少的菌体定殖在番茄根际。
在土壤番茄根际中,X5-GFP单独处理后,当天的菌量为1.05×106 CFU/g;随之菌量逐渐下降,4 d后,菌量达1.82×104 CFU/g;6 d后,菌量达1.26×104 CFU/g;8 d后为9.00×103 CFU/g;15 d后菌量为2.50×103 CFU/g;30 d后为1.50×103 CFU/g。先接种X5-GFP后接种青枯菌的处理组,当天的菌量为9.55×105 CFU/g;处理6 d,为4.27×103 CFU/g;15 d后菌量为2.00×103 CFU/g;处理30 d,为1.00×103 CFU/g;而先接种青枯菌后接种X5-GFP的处理组,当天的菌量为9.33×105 CFU/g;处理6 d,为3.89×103 CFU/g;处理30 d,为5.00×102 CFU/g。与先加入青枯病菌R4再加入X5-GFP的处理组相比,在0~6 d内,先加X5-GFP再加入青枯病菌R4的处理组,X5-GFP在番茄根部的定殖数量更高。
在水培番茄根际中,X5-GFP单独处理后当天初始菌量为2.70×105 CFU/g;随之菌量逐渐下降,4 d后,菌量为1.00×104 CFU/g;6 d后,菌量为7.94×103 CFU/g;8 d后菌量为7.00×103 CFU/g;15 d后菌量为2.00×103 CFU/g;30 d后菌量为为1.00×103 CFU/g。先接种X5-GFP后接种青枯菌的处理组,当天的菌量为2.19×105 CFU/g;处理4 d,菌量为8.91×103 CFU/g;处理30 d,菌量为5.00×102 CFU/g。而先接种青枯菌后接种X5-GFP的处理组,当天的菌量为2.04×105 CFU/g;处理4 d,菌量为7.94×103 CFU/g;处理30 d,菌量为5.00×102 CFU/g。与先加入青枯病菌R4再加入X5-GFP的处理组相比,在0~4 d内,先加X5-GFP再加青枯病菌R4的处理组,X5-GFP在番茄根部的定殖数量更高。
在土壤番茄根际中,BQA2-GFP单独处理后当天初始菌量为1.68×106 CFU/g;随之菌量也逐渐下降,4 d后,菌量为9.80×104 CFU/g;6 d后,菌量为7.41×104 CFU/g;8 d后菌量为6.60×104 CFU/g;15 d后菌量为5.00×103 CFU/g;处理30 d后菌量为2.50×103 CFU/g。先接种BQA2-GFP后接种青枯菌的处理组,当天的菌量为1.10×106 CFU/g;处理8 d,菌量为6.17×104 CFU/g;处理30 d,菌量为1.51×103 CFU/g。先接种青枯菌后接种BQA2-GFP的处理组,当天的菌量为1.07×106 CFU/g;处理8 d,菌量为4.47×104 CFU/g;处理30 d,菌量为2.00×103 CFU/g。与先加青枯病菌R4再加BQA2-GFP的处理组相比,在0~8 d内,先加BQA2-GFP再加青枯病菌R4的处理组,BQA2-GFP在番茄根部的定殖数量更高。
在水培番茄根际中,BQA2-GFP单独处理后当天初始菌量为3.60×105 CFU/g;随之菌量也逐渐下降,4 d后,菌量为3.20×104 CFU/g;6 d后,菌量为2.40×104 CFU/g;8 d后菌量为7.50×103 CFU/g;15 d后菌量为2.50×103 CFU/g;30 d后菌量為1.50×103 CFU/g。先接种BQA2-GFP后接种青枯菌的处理组,当天的菌量为1.66×105 CFU/g;处理6 d,菌量为2.09×104 CFU/g;处理30 d,菌量为1.00×103 CFU/g。先接种青枯菌后接种BQA2-GFP的处理组,当天的菌量为1.51×105 CFU/g;处理6 d,菌量为1.35×104 CFU/g;处理30 d,菌量为1.00×103 CFU/g。与先加青枯病菌R4再加BQA2-GFP的处理组相比,在0~6 d内,先加BQA2-GFP再加青枯病菌R4的处理组,BQA2-GFP在番茄根部的定殖数量更高。
综上所述,在这3种不同的处理组中,在番茄根际的标记菌株地定殖数量的变化趋向是一致的。与标记菌株和青枯病菌R4混合加入的处理组相比,单独加入标记菌株的处理组的标记菌株在番茄根部的定殖数量更高。同时,通过统计X5-GFP、BQA2-GFP在番茄根部的定殖数量,这表明X5-GFP、BQA2-GFP在番茄根部都有较好的定殖能力并且比刘邮洲等[9]报道的枯草芽胞杆菌PTS-394定殖能力强,两者相比较而言,BQA2-GFP在番茄根部的定殖能力略好于X5-GFP。而就土壤和水培的2种不同培养方式而言,土壤中番茄根际的标记菌株的定殖数量多于水培中的番茄根际标记菌株的定殖数量。
3 讨论
生防菌的应用已经成为生物防治的一个重要方面,而生防菌在植物根际的定殖能力与抑制植物根际有害微生物的能力紧密相关。目前,世界上已经有很多科研人员对生防菌定殖能力进行了研究[8,16-19]。与其他的标记方法相比,由于GFP标记方法具有易于检测、灵敏度高、稳定性较好、构建载体方便等优点受到了科研工作者的广泛应用。
本研究采用海藻糖改良的电转化法进行GFP标记菌株X5-GFP、BQA2-GFP,分别进行了X5-GFP、BQA2-GFP的生长速率、X5-GFP、BQA2-GFP的抑菌活性等实验,结果表明:X5-GFP、BQA2-GFP和X5、BQA2在生长特性、对青枯病菌R4和香蕉枯萎病菌的平板抑制效果等方面没有明显不同。张昕等[20]研究认为无选择压力的条件下,随着传代次数越来越多,外源质粒的稳定性会降低,如菌株ZJY-1G连续传10代,质粒保存率是82.1%;连续传70代,质粒保存率是9.1%;菌株ZJY-116G连续传10代,质粒保存率是69.3%;连续传70代,质粒保存率是0。本研究中,X5-GFP在无四环素选择压力的条件下,连续传6代后质粒的稳定性是95%,连续培养10代后为90%;X5-GFP在有四环素选择压力的条件下,连续传6代后质粒的稳定性为100%,连续培养10代后高达95%;而BQA2-GFP在无四环素选择压力的条件下,连续传6代后外源质粒的稳定性为90%,连续传10代后为80%;BQA2-GFP在有四环素选择压力的条件下,连续传6代后质粒的稳定性为100%,培养10代后为95%。X5-GFP、BQA2-GFP接种后在番茄根际的定殖数量逐渐下降,这与刘邮洲等[9]的报道一致。但不同的芽胞杆菌在植物根际定殖数量的变化趋势并不都是一样的,刘庆丰等[21]报道的枯草芽胞杆菌XF-1能定殖到大白菜的根部,在大白菜的根际定殖数量变化趋向是先降低后上升再降低,最后基本保持稳定;而在根内部定殖数量的变化趋向是先上升后降低。本实验结果发现,与标记菌株和青枯病菌R4混合加入的处理组相比,单独加入标记菌株的处理组的标记菌株在番茄根部的定殖数量更高的原因可能是生防菌和青枯菌R4有营养和根际定殖位点的竞争,从而使标记菌株X5-GFP、BQA2-GFP的定殖数量减少。同时生防菌与青枯菌R4的接种顺序的不同也会影响生防菌在番茄根际的定殖数量,原因可能是先接种青枯病菌后,它会提前抢占番茄根际的定殖位点提前进入番茄根际及优先利用土壤和水中的营养物质来进行繁殖成为优势菌种,从而使得番茄根际的定殖位点和外界环境中的营养物质减少,进而使得生防菌在番茄根际的定殖数量减少,这需要进一步的验证。而在土壤中番茄根际的标记菌株的定殖数量多于水培中的番茄根际标记菌株的定殖数量。这可能是由于土壤中能够为生防菌提供更全面的营养,有利于生防菌的生长和繁殖,从而使其在番茄根际的定殖数量更多。
参考文献
[1] 梅汝鸿, 徐维敏. 植物微生态学[M]. 北京: 中国农业出版社, 1998.
[2] Mazzola M, Cook R J, Thomashow L S. Contribution of phenazine antibiotic biosynthesis to the ecological competence of fluorescent pseudomonas in soil habitats[J]. Applied and Environmental Microbiology, 1992, 58(12): 2 616-2 624.
[3] Roberts D P, Kobayashi D Y, Dery P D. An image analysis method for determination of spatial colonization patterns of bacteria in plant rhizosphere[J]. Applied Microbiology and Biotechnology, 1999, 51(4): 653-658.
[4] 李永刚, 宋兴舜, 赵雪莹, 等. 生防枯草芽抱杆菌L1特性的初步研究[J]. 植物保护, 2008, 34(1): 57-61.
[5] 王光华, Raaijmakers J M. 生防细菌产生的拮抗物质及其在生物防治中的作用[J]. 应用生态学报, 2004, 15(6): 1 100-1 104.
[6] Nautiyal C S, Johri J K, Singh H B. Survival of the rhizosphere-competent biocontrol strains Pseudomonas fluorescens NBR12650 in the soil and phytosphere[J]. Canadian Journal of Microbiology, 2002, 48(7): 588-601.
[7] Ramos H J O, Roncatomaccari L D B, Souza E M, et al. Monitoring Azospirillum-wheat interaction using the gfp and gusA genes constitutively expressed from a new broad-host range vector[J]. Journal of Biotechnology, 2002, 97(2): 243-252.
[8] 田 濤, 王 琦. 绿色荧光蛋白作为分子标记物在微生物学中的应用[J]. 微生物学杂志, 2005, 25(1): 68-73.
[9] 刘邮洲, 梁雪杰, 乔俊卿, 等. 枯草芽胞杆菌PTS-394的GFP标记及其定殖能力[J]. 植物保护学报, 2014, 41(4): 416-422.
[10] 杨秀荣, 田 涛, 孙淑琴, 等. GFP标记生防细菌B579及其定殖能力检测[J]. 植物病理学报, 2013, 43(1): 82-87.
[11] Cao Y, Zhang Z, Ling N, et al. Bacillus subtilis SQR 9 can control Fusarium wilt in cucumber by colonizing plant roots[J]. Biology and Fertility of Soils, 2011, 47(5): 495-506.
[12] Gao S, Wu H, Wan g W, et al. Efficient colonization and harpins mediated enhancement in growth and biocontrol of wilt disease in tomato by Bacillus subtilis[J]. Letters in Applied Microbiology, 2013, 57(6): 526-533.
[13] Yuan J, Yu L, Ling N, et al. Plant-growth-promoting traits and antifungal potential of the Bacillus amyloliquefaciens YL-25[J]. Biocontrol Science and Technology, 2015, 25(3): 276-290.
[14] 殷幼平, 袁训娥, 李 强, 等.生防菌枯草芽胞杆菌CQBS03的绿色荧光蛋白基因标记及其在柑橘叶片上的定殖[J]. 中国农业科学, 2010, 43(17): 3 555-3 562.
[15] 杨琦凤, 尹贤贵, 潘光辉, 等. 重庆番茄青枯病病原鉴定及抗源材料筛选[J]. 西南农业学报, 2004, 17(1): 57-60.
[16] 彭 祎, 谭悠久, 黄永春. GFP标记的多粘芽孢杆菌1114在番茄根际的定殖[J]. 中国生物防治, 2010, 26(3): 307-311.
[17] 郝变青, 马利平, 乔雄梧. GFP标记的植物促生菌B96-Ⅱ-gfp的定殖能力研究[J]. 中国生态农业学报, 2010, 18(4) : 861-865.
[18] 张 彦, 车建美, 刘 波, 等. 蜡样芽孢杆菌ANTI-8098A在番茄内的定殖和对青枯病的防治研究[J].中国生物防治学报, 2011, 27(2): 221-227.
[19] 范晓静, 邱思鑫, 吴小平, 等. 绿色荧光蛋白基因标记内生枯草芽孢杆菌[J]. 应用与环境生物学报, 2007, 13(4): 530-534.
[20] 张 昕, 张炳欣, 喻景权, 等. 生防菌ZJY-1及ZJY-116的GFP标记及其在黄瓜根围的生态适应性[J]. 应用生态学报, 2005, 16(11): 2 144-2 148.
[21] 刘庆丰, 熊国如, 毛自朝, 等. 枯草芽胞杆菌XF-1的根围定殖能力分析[J]. 植物保护学报, 2012, 39(5): 425-430.

