一株抗香蕉枯萎病DSE菌株的筛选鉴定及抗病机理初探
农倩 张雯龙 蓝桃菊 苏琴 陈艳露 张艳 覃丽萍 谢玲


摘 要 通過平皿和盆栽共生对抗法,筛选到1株对香蕉枯萎病具有防治作用的深色有隔内生真菌L-14,2种方法的防效分别达到72.4%和56.5%,接种该菌株可显著提高香蕉幼苗的鲜重。形态观察和28S rDNA序列比对分析结果表明,该菌株为裂壳菌(Schizothecium sp.)。使用该菌株浸根处理接种香蕉苗后,植株系列抗氧化保护酶如苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)及超氧化物歧化酶(SOD)的活性均显著高于对照,而菌株L-14与香蕉枯萎病菌混合接种处理样品的PPO和SOD活性显著高于单独接种处理,表明接种该生防菌能增强香蕉的抗氧化防护系统,提高其对香蕉枯萎病的抗性。
关键词 裂壳菌;深色有隔内生真菌;香蕉枯萎病;生物防治
中图分类号 S436.681 文献标识码 A
Abstract A dark septate endophytic(DSE)fungus L-14 was screened for further activity among the ten DSEs. The disease control efficacies of L-14 against the Fusarium wilt was found up to 72.4% in the culture dish and 56.5% in the pot culture method. After inoculation of this strain into the banana seedling, the fresh weight of banana seedlings significantly increased over the control plant. Morphological observation and 28S rDNA sequence alignment analysis showed that the strain belonged to the genus Schizothecium. After inoculation of L-14 with banana seedlings, the antioxidant enzymes such as phenylalanine ammonia lyase(PAL), peroxidase(POD), polyphenol oxidase(PPO)and superoxide dismutase(SOD)were significantly higher over the control. The activity of PPO and SOD was found to be higher in case of mix inoculation of L-14 strain and banana Fusarium wilt disease pathogen. The results suggested that DSE strain L-14 could improve the resistance to banana Fusarium wilt disease of the seedling by triggering the over expression of antioxidative defense system.
Key words Schizothecium sp.; dark septate endophytes; banana Fusarium wilt disease; biological control
doi 10.3969/j.issn.1000-2561.2017.03.027
香蕉枯萎病又称香蕉巴拿马病、黄叶病、凋萎病,是制约香蕉生产的一种毁灭性土传病害。该病由镰刀菌属尖孢镰刀菌古巴专化型(Fusarium oxysporum f. sp. cubense)侵染引起[1-2],近年来对华南蕉区的为害日趋扩大。至今尚无有效防治香蕉枯萎病的药剂,抗病香蕉品种又无法达到产量的要求[3-4]。生物防治作为防治香蕉枯萎病的措施之一,具有良好的发展和应用前景,国内外学者对此开展了不少研究,已报道的具有应用前景的防治微生物包括真菌、细菌和放线菌等。柯仿钢等[5]研究发现通过连续施用木霉菌株gz-2菌剂对香蕉枯萎病的防治效率可达74.4%;石妞妞等[3]于接种香蕉枯萎病菌前4 d和前2 d,施用枯草芽孢杆菌T122F,对香蕉枯萎病防效可达66%。茹祥等[6]分离到2株对香蕉枯萎病有较好防治效果的放线菌DL-24和DL-28,盆栽平均防效分别达76.5%和83.6%,田间防效为67.5%和47.5%。尽管香蕉枯萎病防治微生物资源的收集筛选研究已经广泛开展,但因田间环境因素复杂,适用于大规模田间应用的微生物资源依然很少。
深色有隔内生真菌(Dark Septate Endophyte, DSE)是一类能与寄主植物互惠共生的微生物,其定殖宿主具有非专一性,且在逆境环境中,DSE也分布广泛[7-8]。DSE能够定殖于宿主体内形成互惠共生体,相比其它完全暴露在根际土壤中的生防微生物,受到环境的影响相对较小,可能在田间应用中更容易获得稳定良好的防治效果。本研究通过平皿和盆栽共生对抗法,对香蕉枯萎病生防DSE菌株进行筛选,由形态观察和28S rDNA序列分析,对生防菌株进行鉴定。通过测定香蕉植株系列抗氧化保护酶如苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)和超氧化物歧化酶(SOD)活性的变化,探索生防菌防治香蕉枯萎病的机理,为进一步开发利用生防菌株提供理论基础。
1 材料与方法
1.1 材料
香蕉组培苗:桂蕉6号(广西植物组培苗有限公司提供);DSE菌株:由本实验室从甘蔗根围分离保存,共10株(编号分别为L-1、C29-7-2、L-14、B-1、G-X、C23-5-1、G、N3、EWM和M-1);香蕉枯萎病病原菌:镰刀菌4号生理小种(FOC4)。
1.2 方法
1.2.1 平皿抗性篩选 DSE菌株活化后接种于燕麦培养基上(燕麦粉10 g/L,琼脂18 g/L,MgSO4·7H2O 1 g/L1,KH2PO4 1.5 g/L,NaNO3 1 g/L),每皿接3个菌块,培养10 d后,选择长势一致香蕉组培苗移栽至菌落上,根系平铺于菌落表面,每个菌落移栽1株。移栽后的培养皿放至组培瓶,在25 ℃,光强180 μmol/(m2·s)、光周期16 h ∶ 8 h的培养箱中培养15 d后,镜检香蕉根部组织,且进行DSE菌株再分离。以不接种菌株处理为对照,每处理3个重复,每重复7皿。
将镰刀菌活化后接于水琼脂培养基上,每皿接种3个菌块,28 ℃培养4 d待用。将上述DSE-香蕉苗共生体连同培养基移至长有镰刀菌的培养基,于28 ℃,光强180 μmol/(m2·s),湿度80%条件下培养15 d。对照直接接入带有镰刀菌的水琼脂平板上。观察记录病级、计算病情指数和防治效果。病情分级标准:0级为外观无可见症状;1级为植株长势无明显受阻,全株黄萎面积≤35%;2级为植株弱小,35%<全株黄萎面积≤80%;3级为全株黄萎面积>80%。
防效计算公式为:病情指数=∑(病株级数×代表数值)/(株数总和×最高病级代表值);防治效果=(对照病情指数-处理病情指数)/对照病情指数×100%。
1.2.2 盆栽试验 取3~4叶期长势一致的香蕉幼苗种于营养杯中(直径×高:19 cm×20 cm),杯中放置灭菌土壤。将活化后的DSE菌块接入PDB培养基中,25 ℃,120 r/min震荡培养14 d,用灭菌纱布过滤收集菌丝,灭菌水洗涤菌丝数次后,将菌丝打碎配制成5×105 cfu/mL的菌液。每株香蕉苗灌根50 mL DSE菌液,每隔15 d灌1次,共灌3次。于最后一次灌根后10 d,随机选取各处理及重复的6株香蕉苗,测量其株高和鲜重,检验其促生效果,其余植株留作抗病试验。镰刀菌活化后,配制成浓度为1×106 cfu/mL的孢子液。于最后一次灌根结束10 d后,对香蕉苗进行伤根并接种镰刀菌孢子液,随时观察植株发病情况。于接种后25 d解剖香蕉球茎,观察记录发病情况并计算防效。每处理3个重复,每重复8株苗,以清水灌根并接种镰刀菌孢子液的处理为对照。病情分级标准:0级为球茎健康无变色;1级为球茎变色面积占球茎面积<20%;2级为20%≤球茎变色面积占球茎面积<40%;3级为40%≤球茎变色面积占球茎面积的<60%;4级为60%≤球茎变色面积占球茎面积<80%;5级为球茎变色面积占球茎面积≥80%。防效和防治效果计算公式同1.2.1。
1.2.3 菌株的分类鉴定 形态观察:将待检菌株接种至PDA培养基上,培养3周后观察菌落形态特征。用插片法将纯化的菌株接于燕麦培养基,25 ℃培养2~4周,于明显看到菌丝着生在盖玻片上时,取出玻片,光学显微镜下进行观察。
分子鉴定:将菌株接种于PDB培养基中,于28 ℃、120 r/min震荡培养14 d后,过滤收集菌丝。菌丝体总DNA采用CTAB法[9]提取,28S rDNA扩增引物为LROR:5′-ACCCGCTGAACTTAAGC-3′和LR5:5′-TCCTGAGGGAAACTTCG-3′。扩增体系25 μL,其中含:MasterMix(TIANgel)9 μL,20 μmol/L正反引物各1 μL,DNA 1 μL,ddH2O用14 μL。扩增程序:94 ℃预变性5 min;94 ℃变性1 min,53 ℃退火1 min,72 ℃延伸1 min,35个循环;最后72 ℃延伸10 min。产物测序由上海生工生物工程技术有限公司完成。通过NCBI Blastn对获得序列进行比对分析,使用MEGA6.0程序进行系统进化树构建。
1.2.4 抗氧化酶活性的测定 取长势一致的3叶期香蕉组培苗,无菌水彻底洗净根部,每瓶10株并加入不同的菌液进行浸根处理:菌株L-14菌液20 mL(L-14);FOC4孢子悬浮液20 mL(FOC4);菌株L-14菌液20 mL,浸根12 h后加入Foc4孢子悬浮液2 mL(L-14+ FOC4);无菌水20 mL(CK)。L-14菌液及Foc4孢子悬浮液浓度分别为:5×105 cfu/mL和1×106 cfu/mL。分别于浸根后的第1、3、5、7、9天,剪取香蕉顶端叶片,参照薛玉潇等[10]的方法制备酶液。抗氧化酶活性测定参照杨述省[11]的方法。
2 结果与分析
2.1 菌株平皿抗病性鉴定
对接种后的香蕉植株根部进行显微检测,结果发现有DSE菌丝(图1-A),通过根部内生真菌再分离培养及形态学观察确定为原接种的DSE菌株,从而明确DSE-香蕉苗共生体已建立。平皿共生对抗法结果显示,10株DSE菌株对香蕉枯萎病表现出强弱不等的抑菌能力。其中L-1平皿防治效果最高,达83.5%,C29-7-2和L-14的防效分别为75.6%和72.4%,但两者间防效差异不显著(图1-B),选取防效前5位的菌株继续进行盆栽抗病试验。
2.2 菌株盆栽抗病性鉴定
选取平皿防效前5位的L-1、C29-7-2、L-14、B-1及G-X进行盆栽抗病性鉴定。结果表明,L-14菌株防效高达56.5%,显著高于其他菌株处理,B-1处理防效仅为7.2%(表1)。香蕉株高和总鲜重的测量结果显示,各处理的香蕉株高和鲜重均高于对照,尤以菌株L-14促生作用最明显,2次测定数值均显著高于对照(表1),因此,取该菌株作进一步的鉴定。
2.3 L-14的形态学鉴定
L-14在PDA培养基上长速较快,28 ℃培养14 d后菌落直径为60~65 mm,菌落圆形,棕色至深棕色,呈粉状。显微镜观察可见有隔光滑菌丝,菌丝浅黄褐色。分生孢子梗呈保龄球状至长瓶状,顶端有明显囊领,部分弯曲。分生孢子梗不分枝或偶有1~2个分枝,浅黄褐色,表面光滑,有0~2个分隔,分隔处稍有缢缩或不缢缩。分生孢子梗长为7.9~25.7 μm,梗最宽部位为1.7~3.8 μm,最窄部位为0.7~1.7 μm。分生孢子于分生孢子梗顶部链生,浅黄褐色,呈梨形、倒卵球形或楔形,基部有平整截面,光滑无隔,大小约为1.9~3.3 μm×1~2 μm,能产生厚垣孢子,直径大小为2.0~7.0 μm(图2)。上述特征与为裂壳菌(Schizothecium sp.)属真菌的形态特征基本相符[12]。
2.4 L-14的分子鑒定
对菌株L-14的扩增序列进行比对分析,结果表明,该菌株和Schizothecium fimbratum(登录号AY999092)的相似性达98%,并以94%的支持率与Schizothecium fimbratum单独聚为一支(图3),因此认为L-14菌株属于Schizothecium sp.真菌。
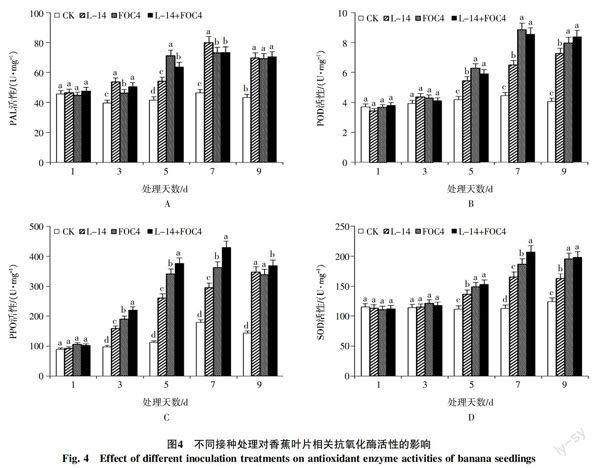
2.5 相关抗氧化酶活性的变化
苯丙氨酸解氨酶(PAL):在第1天时,不同处理间的PAL活性无明显差异(图4-A);从第3天开始,不同接种处理的PAL活性均明显高于对照,且均在第7天时达到峰值,此时单独接种L-14处理的PAL活性为处理间最高,是对照的1.5倍;在处理的第9天时,不同接种方式间的PAL活性无显著差异(图4-A)。
过氧化物酶(POD):在处理的前3 d,不同接种处理间的POD活性差异不显著,自第5天开始,所有处理的POD活性显著高于对照,其中单独接种FOC4及L-14+FOC4混合接种处理的POD活性均显著高于单独接种L-14处理,但这2个处理间的活性差异不显著(图4-B)。
多酚氧化酶(PPO):第3~7天,不同处理间的PPO活性差异显著,而以L-14+FOC4混合接种处理的PPO活性最高,极值在第7天,此时的活性为对照的2.1倍,在第9天时该处理的PPO活性虽然有所下降,但仍然比其他2个单独接种的处理显著提高(图4-C)。
超氧化物歧化酶(SOD):由图4-D可知,各接种处理的SOD活性在第1天和第3天差异不显著,从第5天后活性水平显著升高,在第7天达到峰值水平。处理间以L-14+FOC4混合接种处理的SOD活性最高,单独接种FOC4的活性次之,单独接种L-14处理的最低,但仍然显著高于对照。
3 讨论
已有研究结果表明,DSE分布的生境广泛,从沿海滩涂到内陆高原山地,从热带、温带到冻原地区及南北极地区都有分布[13],且没有宿主特异性,在菌根植物和莎草科、十字花科、藜科等传统非菌根植物的根中均发现其定殖[14]。有关DSE的种类组成,尚未有十分全面的描述,但可培养性为采用传统形态学和分子生物学方法对其进行分类鉴定提供了基础[15]。已报道的DSE包括10多个属,近30个种的真菌。本研究通过形态学特征分析,结合28S rDNA基因序列的比对和系统发育树构建,并与前人[12-13]研究结果综合比较,将分离得到菌株L-14鉴定为Schizothecium sp.,并已向中国普通微生物菌种保藏管理中心申请菌种专利保藏,编号为CGMCC NO.12240。随着菌根研究领域的日益发展,DSE被广泛证实能与宿主互惠共生,改善宿主植物的营养状况,增强宿主植物对有机和无机营养的吸收利用,增加植株根系长度和生物量[16]。本研究中所接种的5株DSE菌株对香蕉幼苗的生物量都有明显的提高,其中接种L-14的植株比对照鲜重增加50%以上。研究显示,DSE真菌可分泌出多种胞外水解酶,包括纤维素酶、漆酶、淀粉酶等多种水解酶,上述酶的存在保证其对各种形态营养元素的利用,从而实现DSE对宿主的促生功能[16-17],本研究中的DSE菌株的促生功能是否与此相关还需进一步研究揭示。
已有研究证实,植物形成与DSE形成菌根后可提高宿主的抗病能力[18-20]。目前认为DSE抑制或减轻植物病原菌危害的机理主要有3个方面:竞争作用,DSE可与根际病原菌竞争植物光合产物,DSE的定殖消耗植物根系的碳源,在一定程度上抑制病原菌的发生和发展;代谢抑菌物质,对病原菌形成抗生作用;引发植物的防御性反应,诱导植物产生系统抗性,预防后续病原菌感染,而植物抗氧化防护系统在其中扮演重要角色[21-22]。在本研究中,不管是单独接种还是混合接种,相关抗氧化防护酶的活性都较对照显著增加,而混合接种的PPO活性和SOD活性更是显著高于单独接种,这表明接种DSE菌株L-14能够进一步增强香蕉的抗氧化防护系统,提高其对枯萎病的抗性。
4 结论
从甘蔗根围土壤分离筛选获得深色有隔内生真菌L-14,结合形态学特征,序列分析将其鉴定为Schizothecium sp.,接种该菌株可显著提高香蕉苗的鲜重,并能有效诱导香蕉植株相关的抗氧化防护酶活性,提高其对香蕉枯萎病的抗性。
参考文献
[1] Pegg K G, Moore N Y, Bentley S. Fusarium wilt of banana in Australia: a review[J]. Australian Journal of Agricultural Research, 1996, 47(4): 637-650.
[2] Ploetz R C. Fusarium wilt of banana is caused by several pathogens referred to as Fusarium oxysporum f. sp. cubense[J]. Phytopathology, 2006, 96(4): 653-656.
[3] 石妞妞, 杜宜新, 阮宏椿, 等. 枯草芽孢杆菌T122F内生定殖及对香蕉枯萎病的防治效果[J]. 植物保护, 2015, 41(1): 95-99.
[4] 余 超, 肖荣凤, 刘 波, 等. 生防菌FJAT-346-PA的内生定殖特性及对香蕉枯萎病的防治效果[J]. 植物保护学报, 2010, 37(3): 493-498.
[5] 柯仿钢, 黄思良, 付 岗, 等. 西贡蕉枯萎病生防木霉菌株gz-2的鉴定及生物学特性研究[J]. 西南农业学报, 2010, 23(5): 1 533-1 539.
[6] 茹 祥, 曾 涛, 莫坤联, 等. 海南吊罗山原始林区抗香蕉枯萎病土壤放线菌的分离及田间防治效果试验[J]. 中国农学通报, 2012, 28(13): 97-102.
[7] Mandyam K, Jumpponen A. Seeking the elusive function of the root-colonising dark septate endophytic fungi[J]. Studies in Mycology, 2005, 53(1): 173-189.
[8] Knapp D G, Kovács G M, Zajta E, et al. Dark septate endophytic pleosporalean genera from semiarid areas[J]. Persoonia, 2015, 35(1): 87-100.
[9] Saghai M A, Soliman K M, Jorgensen R A, et al. Ribosomal DNA spacer-length Polymorphism in barley: mendellian inheritance chromosomal location and population dynamics[J]. PNAS, 1984, 81(24): 5 014-5 018.
[10] 薛玉瀟, 贾慧升, 王国芬, 等. 接种生防菌和病原菌对香蕉抗枯萎病的诱导[J]. 热带生物学报, 2012, 33(1): 62-65, 68.
[11] 杨述省. 生防菌JK-2粗霉素活性物质分析及对香蕉枯萎病诱导抗性的研究[D]. 福州: 福建农林大学, 2009.
[12] Cai L, Jeewon R, Hyde K D. Phylogenetic evaluation and taxonomic revision of Schizothecium based on ribosomal DNA and protein coding genes[J]. Fungal Diversity, 2005, 19(1): 1-21.
[13] 刘茂军, 张兴涛, 赵之伟. 深色有隔内生真菌研究进展[J]. 菌物学报, 2009, 28(5): 888-894.
[14] Jumpponen A, Mattson K G, Trappe J M. Mycorrhizal functioning of Phialocephala fortinii: interactions with soil nitrogen and organic matter[J]. Mycorrhiza, 1998, 7(2): 261-265
[15] Tejesvi M V, Ruotsalainen A L, Markkola A M, et al. Root endophytes along a primary succession gradient in northern Finland[J]. Fungal Diversity, 2010, 41(1): 125-134
[16] Andrade-Linares D R, Grosch R, Restrepo S, et al. Effects of dark septate endophytes on tomato plant performance[J]. Mycorrhiza, 2011, 21(2): 413-422
[17] Upson R, Read D J, Newsham K K. Nitrogen form influences the response of Deschampsia antarctica to dark septate root endophytes[J]. Mycorrhiza, 2009, 20(1): 1-11
[18] Hashiba T, Narisawa K. The development and endophytic nature of the fungus Heteroconium chaetospira[J]. FEMS Microbiol Lett, 2005, 252(1): 191-206
[19] Narisawa K, Hambleton S, Currah R S. Heteroconium chaetospira, a dark septate root endophyte allied to the Herpotrichiellaceae(Chaetothyriales) obtained from some forest soil samples in Canada using bait plants[J]. Mycoscience, 2007, 48(2): 274-281
[20] Khastini R O, Ohta H, Narisawa K. The role of a dark septate endophytic fungus, Veronaeopsis simplex Y34, in Fusarium disease suppression in Chinese cabbage[J]. J Microbiol, 2012, 50(3): 618-624
[21] Mandyam K, Jumpponen A. Diversity and function of fungal endophytes of a tallgrass prairie[J]. Proceedings of the Annual Meeting of the Mycological Society of Japan, 2005, 49(1): 156.
[22] Mandyam K. Dark septate fungal endophytes from a tallgrass prairie and their continuum of interactions with host plants[D]. USA: Kansas State University, 2008.

