蝴蝶兰与萼脊兰光合特性的比较
许申平 梁芳 蒋素华 张燕 王默霏 崔波


摘 要 以蝴蝶兰和萼脊兰为材料,对其叶片的CO2吸收速率、可滴定酸含量和叶绿素荧光参数的昼夜变化进行研究。结果表明:蝴蝶兰和萼脊兰的CO2交换方式都具景天酸代谢途径(CAM)的特点,其叶片的净CO2吸收速率分别在22 : 00和凌晨0 : 00左右达到最大值。蝴蝶兰暗适应下的叶绿素荧光参数最小荧光Fo、最大荧光Fm、最大可变荧光Fv、可变荧光产量与最大荧光产量之比Fv/Fm、光系统Ⅱ潜在活性Fv/Fo均高于萼脊兰。蝴蝶兰和萼脊兰叶绿素荧光参数日动态变化结果表明,蝴蝶兰所需要的光照强度显著低于萼脊兰,太高的光强将引起植株的光抑制,从而引起光化学效率的下降。总的来说,蝴蝶兰为专性CAM兰花,萼脊兰属兼性CAM兰花,在蝴蝶兰与萼脊兰杂交后代的栽培中,在避免过高的光强引起其光抑制的同时,可提供特定的环境条件以诱导其叶片更多地进行C3途径光合,尽量减少CAM途径光合,从而有效地促进其干物质的积累,促进杂交后代的生长。
关键词 蝴蝶兰;萼脊兰;光合途径;叶绿素荧光
中图分类号 S682.31 文献标识码 A
Abstract The net CO2 uptake, titratable acidity contents and chlorophyll fluorescence characteristics of Phalaenopsis and Sedirea japonica were comparatively studied. The results showed that both orchid of Phalaenopsis and S. japonica were CAM orchid with the net CO2 uptake rate reached the maximum at 22 : 00 and 0 : 00, respectively. The results of chlorophyll fluorescence from dark-adapted state showed that minimal fluorescence(Fo), maximal fluorescence(Fm), maximum variable fluorescence(Fv), maximum quantum efficiency of PSII photochemistry(Fv/Fm)and potential photochemical efficiency of PS II(Fv/Fo)of Phalaenopsis was higher than those of S. japonica. The measurement of the daily chlorophyll fluorescence parameters with sunlight as the photochemical light indicated that the suitable light intensity in Phalaenopsis was lower than that in S. japonica, and strong light might cause the photo-inhibition of photosynthesis, which reduce the photochemistry efficiency. Generally speaking, Phalaenopsis was a CAM orchid and S. japonica a facultative CAM orchid. The cultivation of cross offspring from Phalaenopsis and S. japonica should provide suitable light intensity to prevent photo-inhibition of photosynthesis, and the special conditions could increase the C3-type photosynthesis by decreasing CAM-type photosynthesis, which might promote the growth through accelerating the dry material accumulation.
Key words Phalaenopsis; Sedirea japonica; photosynthetic pathway; chlorophyll fluorescence
doi 10.3969/j.issn.1000-2561.2017.03.004
蝴蝶蘭(Phalaenopsis)因其花姿优美、花色艳丽、花期长等优点,是国际花卉市场上最受欢迎的热带兰之一,被誉为“兰花皇后”,常作盆栽或切花,具有极高的观赏价值。目前蝴蝶兰育种仍是以传统的杂交育种为基础,虽然杂交品种日益增多,但蝴蝶兰的香味和耐寒性指标一直困扰众多育种者,多年来未有突破[1]。与其他兰花相比,蝴蝶兰的研究相对较多,早在1998年有研究者认为蝴蝶兰为专性CAM(Crassulacean Acid Metabolism)兰花[2],随后陆续被其他研究者印证[3-4]。经过多年的研究发现,蝴蝶兰的碳同化虽然为CAM途径,但其光合特性并不是完全按照其他CAM植物的节律,在蝴蝶兰原生种Phalaenopsis amabilis的研究中发现,其夜间净CO2吸收速率最大值的时刻点与温度和湿度紧密相关[5];而在蝴蝶兰杂交种‘Hercules的研究中也发现,净CO2吸收速率的最大值受季节条件的影响[3]。由此可知,蝴蝶兰光合及光化学效率与品种和环境条件紧密相关,在人工栽培下对其进行系统研究具有重要意义。
萼脊兰(Sedirea japonica)为兰科(Orchidaceae)萼脊兰属(Sedirea)多年附生草本植物,产于中国浙江、云南等地,为国家二级保护植物,日本和朝鲜也有分布,是一种观赏价值很高的附生兰[6]。茎短,具数枚叶,花葶从叶腋发出,其总状花序疏生6~10朵花,花中等大,具浓郁的香气,为蜜汁型兰花[7],在野外主要靠昆虫进行传粉[8]。因其花小而素雅,花色清丽,具有奇妙的幽香,养护简单且耐寒性强(低温半致死温度为1.7 ℃)[9],故有研究者以其为亲本与蝴蝶兰杂交[10],期望培育出抗寒性强并具有香味的蝴蝶兰新品种,这对蝴蝶兰的生产将具有重大意义。目前,已有研究结果发现蝴蝶兰与萼脊兰杂交具有很好的亲和性[11]。Kim等[10]进行了160组蝴蝶兰与萼脊兰的杂交,结果发现杂交后代幼苗性状更倾向于蝴蝶兰,但具有更强的耐寒性。目前,关于萼脊兰光合特性方面的研究较少,主要集中在生物学特性[9,11]、育种[10]、组织培养[12]和分子生物学[13-14]等方面,报道萼脊兰为兼性CAM兰花[15],关于其叶绿素荧光特性则未见有报道。由于兰花的光合研究相对较少,关于蝴蝶兰与萼脊兰光合作用的对比研究尚未见报道,因此对蝴蝶兰与萼脊兰杂交后代的光合特性无法预测,不利于其杂交后代的栽培与养护。本研究拟通过对萼脊兰和蝴蝶兰光合作用和叶绿素荧光参数的日变化规律的观测,对比蝴蝶兰和萼脊兰的光合特性,为蝴蝶兰、萼脊兰及其杂交后代的栽种提供理论依据。
1 材料与方法
1.1 材料
供试材料蝴蝶兰和萼脊兰都为长势一致的成熟苗(具4片健康叶),种植于直径为12 cm的白色透明塑料花钵内,以水苔为基质。栽培在郑州师范学院兰花工程研究中心的大棚内,环境湿度控制在60%以上,温室顶棚覆盖遮阳网。
1.2 方法
1.2.1 叶绿素和可滴定酸含量的测定 依据Lichtenthaler[16]的方法,利用80%丙酮进行叶绿素含量的测定,均采用鲜重。可滴定酸含量的测定采用指示剂滴定法[17],于測定CO2吸收日变化的相应时间选取蝴蝶兰和萼脊兰倒数第2片功能叶(自上而下)的中部,液氮速冻,备用。
1.2.2 CO2吸收日变化测定 试验于2016年6~8月进行,每个月选取3个连续晴天中的一天,利用便携式光合作用测定仪(Li-6400,Li-Cor,Lincoln,NE,USA)对蝴蝶兰和萼脊兰叶片的净CO2吸收速率、光照强度、温度和相对湿度等指标进行测定。从早上8 : 00开始,每2 h测定1次,每次重复3次,至次日清晨8 : 00结束。每个时间点选取5株植株,测定使用2 cm×3 cm普通透明叶室,在自然光照条件下进行。
1.2.3 叶绿素荧光参数的测定 使用PAM-2100便携式叶绿素荧光分析仪(Walz,Effeltrich,Germany)测定叶片叶绿素荧光参数。测定参照Pollet等[3]和Rohácke[18]的方法进行:最小荧光(Fo)、最大荧光(Fm)、最大可变荧光(Fv=Fm-Fo)、PSⅡ最大光能转换效率(Fv/Fm)、PSⅡ的潜在活性(Fv/Fo)及PSⅡ实际的光化学反应量子效率[ΦPSⅡ=(F′m-Fs)/F′m]、非循环电子传递速率[ETR=(F′m-F)/F′m×PFD×0.5×0.84]、光化学猝灭系数[qP=(F′m-Fs)/(F′m-F′o)]和非光化学猝灭系数[NPQ=(Fm-F′m)/F′m]。其中Fo、Fm、Fv/Fo测定前,叶片需经过一夜充分暗适应。以太阳光为光化学光,荧光参数的日变化从当日早上8 : 00至次日8 : 00,每隔2 h与CO2吸收速率同步进行测定。
1.3 数据分析
试验数据用Microsoft Excel 2010软件整理作图,利用SPSS 20.0数理统计软件进行分析。
2 结果与分析
2.1 叶片光合色素含量测定
叶绿素是植物进行光合作用的重要色素,不但有传递与吸收光量子的能力,同时其含量的多少也直接影响着植物的光能利用能力,其含量的变化往往与叶片的生理活性、植物对环境的适应性和抗逆性有关[19]。蝴蝶兰和萼脊兰叶片的叶绿素 a、叶绿素b和总叶绿素含量均存在一定的差异(表1)。蝴蝶兰的叶绿素含量显著高于萼脊兰,相应的叶绿素a和叶绿素b也显著高于萼脊兰;但叶绿素a/b则无显著差异;另外,在2种兰花中,叶绿素a含量都大于叶绿素b的含量。该数据表明蝴蝶兰与萼脊兰在吸收利用光能的能力方面差异较大,而且在2种兰花吸收利用光能的过程中,叶绿素a起着重要的作用。
2.2 CO2吸收的日动态变化
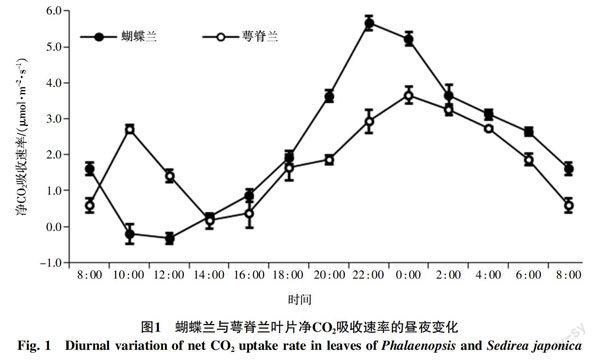
蝴蝶兰与萼脊兰叶片的CO2吸收速率的日变化见图1,二者的整体变化趋势有显著不同。萼脊兰的净CO2吸收速率呈双峰型曲线,第一个峰值出现在10 : 00,其叶片净CO2吸收速率达2.72 μmol/(m2·s);第二个峰值出现在凌晨0 : 00左右,达3.67 μmol/(m2·s)。虽然萼脊兰叶片的净CO2吸收速率整体形势表现为夜间CO2吸收较高,白天较低,符合CAM植物的光合特性,但是上午的8 : 00~12 : 00时,萼脊兰叶片的净CO2吸收速率仍保持较大值,该数据表明萼脊兰的碳同化途径表现为兼性CAM特性。与萼脊兰不同,蝴蝶兰的净CO2吸收速率呈单峰型曲线,晚间的净CO2吸收速率较高,最大值出现在晚上22 : 00左右,达5.67 μmol/(m2·s),白天的净CO2吸收速率较低,在10 : 00~12 : 00时甚至出现负值。这一变化趋势与典型的CAM途径相似,因此,蝴蝶兰的碳同化途径表现为专性CAM途径。
2.3 可滴定酸的日动态变化
CAM植物在夜间吸收CO2,在磷酸烯醇式丙酮酸羧化酶的作用形成有机酸大量积累于液泡中,白天有机酸脱羧产生大量CO2进行光合产物的合成[20]。因此,对于CAM植物来说,叶片净CO2吸收速率和可滴定酸的积累具有密切相关性,可滴定酸含量可作为其光合性能的另一种表现形式[21]。由图2可知,蝴蝶兰和萼脊兰叶片的可滴定酸含量的日变化均呈单峰曲线。蝴蝶兰叶片的可滴定酸含量在6 : 00~8 : 00时达到最高峰,随后逐渐下降,到18:00时降到最低值,随着气孔的打开呈现持续增加的趋势。萼脊兰叶片的可滴定酸含量在8 : 00时左右达到最高峰,在8 : 00~18 : 00时间内持续下降,随后逐渐上升。与蝴蝶兰不同,即使在18 : 00时,萼脊兰叶片的可滴定酸含量也能维持较大值,其含量是蝴蝶兰的4倍;而且萼脊兰叶片的可滴定酸含量整体高于蝴蝶兰,主要原因可能与其上午仍能进行较大的CO2吸收有关,长时间的CO2吸收可能增强了液泡贮藏苹果酸的能力,这也许是设施栽培中的兰花大多都比野生兰花生长速度快的原因之一。
2.4 PSⅡ光化学特性比较
蝴蝶兰与萼脊兰暗适应下叶绿素荧光参数见图3。根据方差分析结果表明,蝴蝶兰暗适应下的叶绿素荧光参数最小荧光Fo、最大荧光Fm、最大可变荧光Fv、可变荧光产量与最大荧光产量之比Fv/Fm、光系统Ⅱ潜在活性Fv/Fo均高于萼脊兰。最小荧光Fo在某种程度上与叶绿素存在线性关系,由此可知,蝴蝶兰叶片的叶绿素含量显著低于萼脊兰,这与叶片叶绿素含量测定的数据一致,由于蝴蝶兰的叶绿素含量高,因此其具备较高的光能利用潜力;Fv/Fm和Fv/Fo分别用于度量植物叶片PSⅡ原初光能转换效率和PSⅡ潜在活性[20],本研究数据结果表明,蝴蝶兰具有较高的光合电子传递活性,其光合器官能把所捕获的光能较充分并高效地转化为生物化学能,从而形成更多的ATP和NADPH,为光合碳同化提供充分的能量和还原力。
2.5 叶绿素荧光参数的昼夜变化
蝴蝶兰和萼脊兰叶绿素荧光参数日动态进程,结合气象因子的日变化规律(图4),可以看出随着一天中光照强度、温度和相对湿度等外界因子的变化,2种兰花的实际光化学反应量子效率(ΦPSⅡ)、非循环电子传递速率(ETR)、光化学猝灭(qP)和非光化学猝灭(NPQ)也相应发生变化。
在自然条件下,蝴蝶兰叶片的实际光化学反应量子效率ΦPSⅡ在下午(17 : 00~19 : 00)高于萼脊兰,其余时间都小于萼脊兰(图5)。这一变化趋势与萼脊兰的光合特性相关,在人工栽培下,萼脊兰为兼性CAM兰花,在上午的时候仍在进行CO2吸收,PSⅡ反应中心比较活跃,有利于光能的捕获。夜间,萼脊兰的ΦPSⅡ显著高于蝴蝶兰,较高的ΦPSⅡ值有利于提高植物的光能转化效率,为暗反应的光合同化积累更多所需的能量,以促进碳同化的高效运转和有机物的积累[22],这样,较多的光合产物在促進植株生长的同时增加了其液泡的储藏能力[23-24],这可能是萼脊兰叶片所含的可滴定酸含量整体高于蝴蝶兰的原因之一。
PSⅡ的非循环电子传递速率反映实际光照条件下的表观电子传递效率。从图6可看出,萼脊兰的ETR与光照强度(图4)表现出相似的变化规律,随着光强的增加,ETR逐渐增大,中午12 : 00时达到最大,下午随着光强的减弱,又逐渐降低。蝴蝶兰的ETR与萼脊兰的ETR在一天中的变化规律不同,蝴蝶兰的ETR在中午(12 : 00)光照最强的时候有一个显著的降低,但到下午又有所升高。
叶绿素荧光猝灭是叶绿体耗散能量的一种途径,有光化学猝灭(qP)和非光化学猝灭(NPQ)2种形式。经测定,蝴蝶兰与萼脊兰qP的日变化有显著差异,萼脊兰的qP随着光照强度的增加而增加,而蝴蝶兰则随着光强的升高逐渐下降,特别是在10 : 00~12 : 00期间,降低到最小值(图7)。2种兰花的NPQ日变化整体趋势相似,都是白天的NPQ显著小于晚上,但不同之处在于白天萼脊兰的NPQ大于蝴蝶兰,但在晚上则小于蝴蝶兰(图8)。在温度和光照强度较高而相对湿度较低的白天,蝴蝶兰NPQ值较小,在14 : 00时降到最低值0.58,在夜间气孔打开吸收CO2的时候,蝴蝶兰的NPQ一致保持较大值。萼脊兰上午仍在进行CO2的吸收,因此,在上午其吸收的光能以热能的形式耗散的部分比蝴蝶兰多。
3 讨论
高等植物的光合碳同化途径分为C3途径、C4途径和景天酸代谢(CAM)途径,相应的植物因其固定的最初产物不同分别称为C3、C4和CAM植物[25]。兰科植物是被子植物中的一个大家族,是高等植物中除菊科外最大的科,其光合途径也相对复杂,3种光合途径在兰科植物中都有分布,仅CAM兰花就有9 000种,占所有CAM植物种类的一半[26]。在人工栽培的条件下,有些CAM兰花表现为兼性CAM植物的特性,包括金钗石斛[27-28]、铁皮石斛[29]和萼脊兰[15]等。本研究中,蝴蝶兰叶片净CO2吸收速率的日变化呈典型的单峰型曲线,最大值出现在夜间22 : 00 左右,白天较低,甚至出现负值,这一结果与以前普遍认为蝴蝶兰为CAM 植物的观点一致。萼脊兰叶片净CO2吸收速率的最大值出现在凌晨0 : 00左右,与典型的CAM植物相比,萼脊兰叶片白天的净CO2吸收相对较高。这说明在人工栽培条件下,萼脊兰表现为兼性CAM植物特性。因此,蝴蝶兰与萼脊兰杂交后代的光合途径很可能处于CAM和兼性CAM途径之间。不同光合碳同化途径植物的光合特性是不同的,一般认为CAM植物的干物质积累速率低于C3和C4植物[20]。对于蝴蝶兰与萼脊兰杂交后代的栽培而言,提供特定的环境条件以诱导其叶片更多地进行C3途径光合,尽量减少CAM途径光合,就能有效地促进其干物质的积累,从而促进杂交后代的生长。
本研究中,在经过一夜的暗处理后,蝴蝶兰的叶绿素荧光参数均高于萼脊兰,这表明蝴蝶兰PSⅡ的实际光能捕获效率较高,能够把所捕获的光能更多地用于光化学反应,因此,蝴蝶兰的潜在光合效率大于萼脊兰。蝴蝶兰和萼脊兰叶绿素荧光参数的日变化结果表明,受到光照、温度和相对湿度等环境因子的影响,各叶绿素荧光参数都有不同的变化。其中蝴蝶兰的PSⅡ实际光化学反应量子效率(ΦPSⅡ)和非循环电子传递速率(ETR)在中午12 : 00时显著降低,这可能与此时的强光引起的光抑制有关。目前,蝴蝶兰的最适光照强度没有统一结论[30]:有研究认为蝴蝶兰的最适光照强度为130~180 μmol/(m2·s)[31-32];也有研究认为其最适光照强度为280~380 μmol/(m2·s)[3]。不同于蝴蝶兰,萼脊兰白天的ΦPSⅡ和ETR与光照强度的变化趋势相同,这表明测定时的光强并未引起萼脊兰出现光抑制现象,有研究表明萼脊兰的最适光照强度为400~600 μmol/(m2·s),而此时的最大光强为406 μmol/(m2·s),并未超过萼脊兰的适宜光强范围。由此可知,蝴蝶兰所需的光照强度显著低于萼脊兰,太高的光强将引起植株的光抑制,从而影响生长。因此,对于蝴蝶兰和萼脊兰的杂交后代,需要进行进一步的研究,以探索其最适宜的光照强度。
综上所述,蝴蝶兰与萼脊兰的光合途径皆为CAM途径,但在人工栽培条件下,萼脊兰的可塑性更强,表现为兼性CAM兰花,而蝴蝶兰为专性CAM兰花。在蝴蝶兰与萼脊兰杂交后代的栽培中,在提供适宜光照强度的同时,也需要对其他环境条件加以控制,以诱导其叶片更多地进行C3途径光合,从而促进杂交后代的生长。
参考文献
[1] 许申平, 张腾飞, 廖飞雄, 等. 蝴蝶兰种质资源与育种研究[J]. 中国园艺文摘, 2010(5): 27-30.
[2] Lootens P, Heursel J. Irradiance, temperature, and carbon dioxide enrichment affect photosynthesis in Phalaenopsis hybrids[J]. HortScience, 1998, 33(7): 1 183-1 185.
[3] Pollet B, Steppe K, Dambre P, et al. Seasonal variation of photosynthesis and photosynthetic efficiency in Phalaenopsis[J]. Photosynthetica, 2010, 48(4): 580-588.
[4] 许申平, 曾兰婷, 叶庆生. 长期增施CO2对蝴蝶兰生长与开花的影响[J]. 园艺学报, 2015, 42(8): 1 599-1 605.
[5] Chen C, Li S. CO2 uptake patterns in Phalaenopsis amabilis[J]. African Journal of Agricultural Research, 2012, 7(1): 128-141.
[6] 陈心启, 吉占和. 中国兰花全书[M]. 北京: 中国林业出版社, 1998: 282.
[7] Stpiczynska M, Davies K L, Kaminska M. Comparative anatomy of the nectary spur in selected species of Aeridinae (Orchidaceae)[J]. Ann Bot, 2011, 107(3): 327-345.
[8] Suetsugu K, Tanaka K. Pollination of Sedirea japonica (Orchidaceae) by Bombus diversus (Hymenoptera: Apidae)[J]. Eur J Entomol, 2013, 110(3): 545-548.
[9] 徐晓薇, 林绍生, 姚丽娟, 等. 短茎萼脊兰生境与特性初步研究[J]. 浙江农业科学, 2008(3): 297-298.
[10] Kim D G, Kim K K, Been C G. Development of intergeneric hybrids between wind orchids (Sedirea japonica and Neofinetia falcata)and moth orchids (Phalaenopsis alliances)[J]. Horticulture Environment and Biotechnology, 2015, 56(1): 67-78.
[11] 林绍生, 徐晓薇, 周青疆, 等. 短茎萼脊兰种质特性研究[J]. 中国林副特产, 2010(3): 18-20.
[12] 崔 波, 沈俊辉, 马 杰, 等. 萼脊兰胚培养与快速繁殖研究[J]. 安徽农业科学, 2009, 37(13): 5 861-5 863.
[13] 蔣素华, 李艳辉, 王洁琼, 等. 萼脊兰总RNA提取方法的比较研究[J]. 河南农业大学学报, 2015, 49(4): 468-471.
[14] 蒋素华, 王默霏, 宋彩霞, 等. 萼脊兰EF1α基因片段的克隆及序列分析[J]. 贵州农业科学, 2016, 44(5): 5-8.
[15] 许申平, 蒋素华, 梁 芳, 等. 萼脊兰光合特性的初步研究[J]. 热带作物学报, 2016, 37(6): 1 081-1 085.
[16] Lichtenthaler H K. Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes[J]. Methods in Enzymology, 1987, 148: 350-382.
[17] Lin M J, Hsu B D. Photosynthetic plasticity of Phalaenopsis in response to different light environments[J]. J Plant Physiol, 2004, 161(11): 1 259-1 268.
[18] Rohácek K. Chlorophyll Fluorescence Parameters: The definitions, photosynthetic meaning, and mutual relationships[J]. Photosynthetica, 2002, 40(1): 13-29.
[19] 刘 宝, 陈存及, 林达定, 等. 21个闽楠种源叶片光合色素含量及叶绿素荧光参数分析[J]. 江西农业大学学报, 2014, 36(1): 115-121.
[20] 羅红艺. C3植物、 C4植物和CAM植物的比较[J]. 高等函授学报(自然科学版), 2001, 14(5): 35-38.
[21] Griffiths H, Smith J A C, Andrew C S. Photosynthetic pathways in the Bromeliaceae of Trinidad: relations between life-forms, habitat preference and the occurrence of CAM[J]. Oecologia, 1983, 60(2): 176-184.
[22] 李 晓, 冯 伟, 曾晓春. 叶绿素荧光分析技术及应用进展[J]. 西北植物学报, 2006, 26(10): 2 186-2 196.
[23] Nobel P. Crop ecosystem responses to climatic change: Crassulacean acid metabolism crops[M]. New York: CABI Publishing, 2000: 315-331.
[24] Pollet B, Steppe K, van Labeke M C, et al. Diurnal cycle of chlorophyll fluorescence in Phalaenopsis[J]. Photosynthetica, 2009, 47(2): 309-312.
[25] 潘瑞炽. 植物生理学[M]. 北京: 高等教育出版社, 2004: 321.
[26] Luttge U. Ecophysiology of crassulacean acid metabolism (CAM)[J]. Ann Bot, 2004, 93(6): 629-652.
[27] 刘张栋. 石斛属植物C3/CAM代谢转换中形态结构及生理生化转变研究[D]. 武汉: 华中农业大学, 2014.
[28] 任建武, 王 雁, 彭镇华, 等. 3种石斛叶片苹果酸含量日变化动态研究[J]. 江西农业大学学报, 2010, 32(3): 547-552.
[29] 苏文华, 张光飞. 铁皮石斛叶片光合作用的碳代谢途径[J]. 植物生态学报, 2003, 27(5): 631-637.
[30] Lin M J, Hsu B D. Photosynthetic plasticity of Phalaenopsis in response to different light environments[J]. J Plant Physiol, 2004, 161(11): 1 259-1 268.
[31] Lootens P, Heursel J. Irradiance, temperature and carbon dioxide enrichment affect photosynthesis in Phalaenopsis hybrids[J]. Hortscience, 1998, 33(6): 1 183-1 185.
[32] Ota K, Morioka K, Yamanoto Y. Effects of leaf age, inflorescence, temperature, light intensity and moisture conditions on CAM photosynthesis in Phalaenopsis[J]. J Jpn Soc Hort Sci, 1991, 60(1): 125-132.

