镉胁迫对水蕨幼苗叶绿素荧光参数和生理指标的影响
姜永雷等

摘要:以一年生水蕨幼苗为试验材料,用不同浓度的CdCl2[0(对照组)、20、40、60 mg/L]溶液进行胁迫处理,研究其叶绿素荧光特性对重金属Cd2+胁迫的响应。结果表明:随着Cd2+浓度的增加,水蕨幼苗叶片的初始荧光Fo和非光化学猝灭系数(qN)呈显著增加趋势,而PSⅡ最大光化学效率(Fv/Fm)、PSⅡ实际光合效率(Yield)、光化学猝灭系数(qP)和电子传递ETR显著降低,说明CdCl2溶液处理下的水蕨幼苗PSⅡ受到损伤,且损伤程度随着处理浓度的增大而加剧。此外,Cd2+胁迫引起水蕨幼苗叶绿素含量下降;且随着Cd2+浓度的增加,细胞内膜脂过氧化产物丙二醛(MDA)和脯氨酸(proline)含量也显著增加。说明水蕨幼苗代谢机制只能抵御较低浓度的Cd2+胁迫,而高浓度的Cd2+处理将对该植株的叶绿素荧光性状及生长发育造成严重的伤害。
关键词:镉胁迫;水蕨幼苗;叶绿素荧光;PSⅡ;生理指标
中图分类号: Q945.78;S682.350.1文献标志码: A文章编号:1002-1302(2015)09-0357-04
重金属是一类重要的环境污染物,每年我国的土地由于工业废水的排放、农药的滥用和一些化肥的应用而受到了严重污染,使得大量的重金属离子(如铅、汞和镉等)通过生长在污染的土地上的作物进入到人和动物的体内,严重影响人们的生活质量。大量的重金属离子也通过河道、江河湖泊等严重污染我们的饮用水源,有研究表明,我国的黄河、淮河、松花江、辽河等十大流域的重金属超标断面的污染程度均为超 V类[1]。在这些重金属中,镉、铅、汞、砷等都有剧毒,且是植物生长所不需要的重金属元素,一旦进入到植物体内并长期大量积累,对植物的光合作用、水分代谢和营养元素的吸收都会起到显著抑制作用,进而导致植物生长迟缓、叶片发黄和根系弱小等症状,最终导致植物不能较好地生长而死亡。在众多的对重金属影响植物的研究报道中发现,镉是植物生长不需要、毒性很强且容易被植物吸收并积累的一种重金属元素,严重影响植物正常的生长发育和生理品质[2]。在植物的光合作用方面,镉胁迫能显著降低叶绿素的含量,影响植物正常的光合和呼吸代谢;此外,镉离子(Cd2+)处理浓度的增加能够抑制植物的光合电子传递速率(ETR)、光能利用效率、降低PSⅡ捕光复合体(LHCⅡ)捕获光能的能力和激发电能的效率[3-5]。另外,植物在受到这些重金属的胁迫时,体内的一些防御机制也会积极响应来降低其受到的胁迫伤害。有研究表明,植物在受到Cd2+胁迫时,体内抗氧化酶系统的活性会提高,一些代谢产物(可溶性蛋白质、可溶性糖和脯氨酸等)含量会显著提高以降低其受到伤害的程度和提高其抗性[6]。
蕨类植物是古老的维管植物,也是植物界系统演化中一个独特的自然类群,蕨类植物具有药用及观赏等多方面的功用。在抑菌、抗癌等方面多种蕨类均具有较高的开发利用价值,同时蕨类优美的叶形、精致的叶脉以及奇特的孢子囊群使得它具有古朴、典雅、清纯等特点和独一无二的观赏价值。水蕨(Ceratopteris thalictroides)为水蕨科(Parkeriaceae)水蕨属(Ceratopteris)一年生水生或湿生植物,国家二级重点保护野生植物。叶簇生,两型,常生于池沼、水田或水沟的淤泥中,产于云南、广东、福建、江西、浙江等地[7]。从目前研究结果看,对蕨类植物的研究主要集中在其食用性、药用性和观赏性方面。另外,蕨类植物更是研究植物性别决定、配子体的形态建成等的模型植物之一。但是近年来,国内湿地(主要是湖泊、河流和滨海湿地)重金属污染的情况已经十分严重。长期以来,特别是近几十年来,由于人类活动的影响,重金属通过工业废水排放到河流洪坡中,导致水蕨生长环境恶化,致使水蕨在我国的分布范围和种群数量正日趋减少,濒临灭绝。大部分现存种群个体数偏少,且绝迹种群所在地的原生境已遭到严重的重金属污染,但是对其响应重金属胁迫的机制方面的研究较少。本试验以我国濒危的水蕨为研究对象,模拟不同梯度的重金属Cd2+污染程度,通过测定不同条件下水蕨的叶绿素荧光特性、叶绿素含量、脯氨酸(proline)含量、丙二醛(MDA)含量等一系列生理特性指标的变化,从而反映出水体中不同浓度重金属镉对水蕨植物体的影响,可为水蕨响应重金属的胁迫机制提供一定的理论依据和数据参考。
1材料与方法
1.1材料与试验处理
1.1.1试验材料与试验设计本试验所用材料为西南林业大学园林学院后山上长势一致的水蕨成株,使用珍珠岩 ∶蛭石=2 ∶1的无机基质,并配以1/2Hoagland 营养液进行培养。经20 d适应性培养后,分别改用加入不同梯度CdCl2(0、20、40、60 mg/L)溶液的营养液培养,每处理组10盆,每盆1株,每隔3 d更换处理组相对应CdCl2浓度的营养液,试验培养时间1个月。本试验共设4个组:对照0 mg/L,Cd2+(20、40、60 mg/L)处理组。试验大棚内白天温度范围为20~30 ℃,夜间温度范围为9~18 ℃,相对湿度为35%~80%。处理时间从2013年9月中旬到10月中旬,共1个月时间。所有指标测定在处理结束时进行,每株选取从上到下的第3片至第5片完全展开的叶作为荧光参数及脯氨酸(proline)和丙二醛(MDA)含量的测定样品,每处理至少5株重复。
1.1.2叶绿素荧光参数的测定用Imaging-PAM M-series调制叶绿素荧光成像系统(德国WALZ公司)测定叶绿素荧光参数。植物材料经充分暗适应后,先用测量光[0.5 μmol/(m2·s)]测定初始荧光Fo,饱和光脉冲 2 700 μmol/(m2·s)(脉冲时间0.8 s)诱导Fm,作用光强度为186 μmol /(m2·s)。将待测叶片置于样品台上,选定多个直径1 cm的AOI后,在软件的Kinetics窗口检测各叶绿素荧光参数的动力学变化曲线,相应数据直接从Report窗口导出。每处理至少5个重复。叶片初始荧光(Fo)、反应中心 PS Ⅱ 潜在最大光合效率(Fv/Fm)、PS Ⅱ实际光合效率(Yield)、荧光淬灭系数(qP)、非光化学淬灭系数(qN)、电子传递速率(ETR)等参数的计算,由仪器自动给出。
1.1.3其他生理指标测定丙二醛MDA含量测定参照Hodges等的方法[8]。游离脯氨酸含量测定参照Bates等的方法[9]。叶绿素含量测定参照Inskeep等的方法[10],称取0.1 g植物叶片,用冷的二甲基甲酰胺黑暗中4 ℃下浸提48 h,于663.8 nm和646.8 nm下比色。计算单位叶鲜质量的叶绿素a和叶绿素b含量。
1.2统计分析
所有的数据分析都利用SPSS 19.0统计分析软件进行一元方差分析(one-way ANOVA),平均数间的多重比较采用Duncans检验方法,P<0.05时差异显著。
2结果与分析
2.1Cd2+处理对水蕨幼苗PSⅡ叶绿素荧光参数Fv/Fm、Yield、qN和qP的影响
Cd2+处理对水蕨幼苗PSⅡ叶绿素荧光参数的影响如表1所示,各处理组与对照组(0 mg/L)相比差异显著。PSⅡ最大光化学效率(Fv/Fm)、PSⅡ实际光合效率(Yield)和光化学猝灭系数(qP)都显著下降(P<0.001),且随着Cd2+浓度的增加,其值下降的幅度增大,且远远低于对照组。在Cd2+浓度为60 mg/L时,Fv/Fm、Yield和qP下降最大,与对照相比分别下降11.07%、62.37%和51.38%。非光化学猝灭系数(qN)的值随着Cd2+浓度的增加呈现出极显著增加的趋势,在Cd2+浓度为60 mg/L时达到最大值,与对照相比,增加了10898%,且各处理组之间差异显著(P<0.001)(表1)。表1Cd2+处理对叶绿素荧光参数的影响
镉浓度(mg/L)PSⅡ最大光化学效率Fv/FmPSⅡ实际光合效率Yield非光化学猝灭系数qN光化学猝灭系数qP00.721 8±0.020 11c0.506 3±0.036 48c0.285 0±0.009 45a0.752 0±0.030 50d200.685 3±0.032 02b0.379 5±0.102 11b0.376 5±0.103 27b0.612 1±0.133 24c400.646 1±0.023 21a0.254 6±0.034 31a0.507 3±0.057 45c0.470 1±0.046 50b600.641 9±0.018 01a0.190 5±0.042 30a0.595 6±0.064 50d0.365 6±0.070 74aP值0.000***0.000***0.000***0.000***注:同一列中不同字母表示差异显著(邓肯式新复极差法),P<0.05。每个值代表5个重复的平均值±标准误;ns,差异不显著;*表示在0.05水平上差异显著(P< 005);**表示在0.01水平上差异显著(P<0.01);***表示在0.001水平上差异显著(P<0.001)。下表同。
2.2Cd2+处理对水蕨幼苗PSⅡ叶绿素荧光参数Fo和ETR的影响
图1结果表明,随着Cd2+浓度增大,水蕨幼苗叶片的初始荧光参数Fo和PSⅡ叶绿素荧光参数ETR的变化趋势相反。在Cd2+处理下,叶片初始荧光Fo显著增加,各处理组之间差异显著,且在60 mg/L处理下达到最大值,与对照相比升高了91.76%。ETR是PSⅡ植物电子传递速率的一个重要参数,在Cd2+浓度增大时,其值下降且与对照差异极显著,在Cd2+浓度为60 mg/L处理下,下降幅度最大(达到62.61%)。
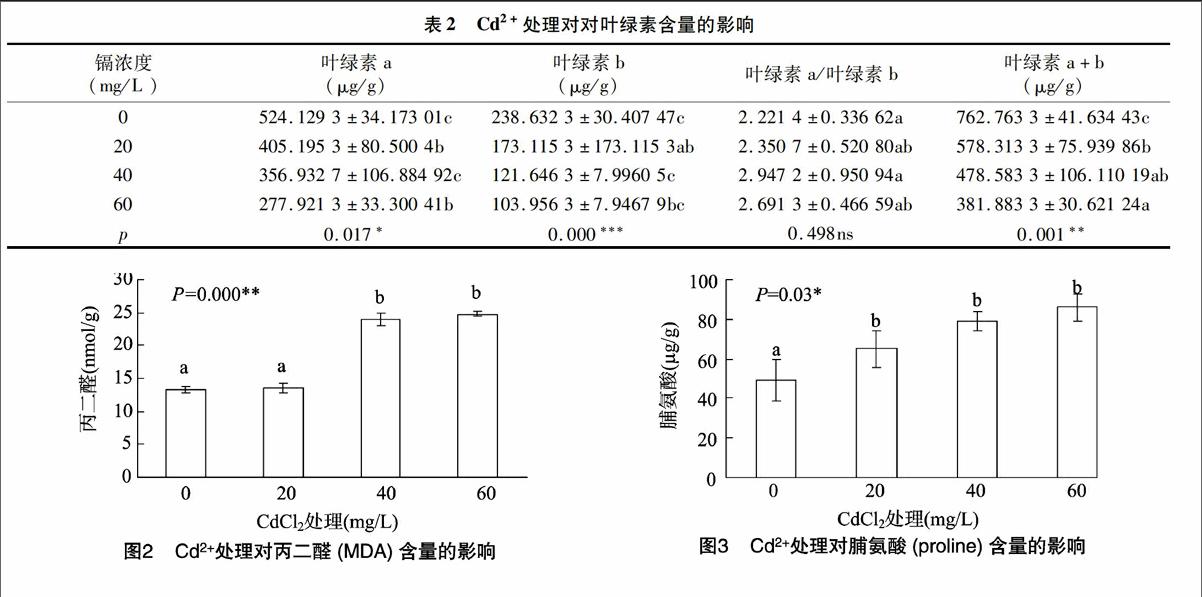
2.3Cd2+处理对叶绿素含量的影响
当Cd2+处理浓度增大时,水蕨幼苗叶片中叶绿素a、叶绿素b和叶绿素 (a+b)与对照相比显著下降(表2)。在Cd2+浓度为60 mg/L时,其下降幅度达到最大,下降率分别为4697%、47.48%和49.93%。而叶绿素a/b比值的变化趋势与其相反,呈上升趋势但是变化不显著。
2.4Cd2+处理对水蕨幼苗叶片MDA含量的影响
丙二醛(MDA)含量的变化是植物在受到外界环境胁迫时,反映植物细胞膜脂过氧化强弱的一个重要的生理指标。膜脂过氧化程度越严重,MDA含量越高。由图2可以看出,
随着Cd2+处理浓度的增加,水蕨幼苗叶片中的丙二醛(MDA)含量与对照相比都显著增加(图2),且在60 mg/L时MDA含量达到最大值,与对照相比增加了84.97%。
2.5Cd2+处理对水蕨幼苗叶片脯氨酸含量的影响
脯氨酸(proline)含量与MDA的变化趋势一致(图3)。植物在受到逆境胁迫时,植物细胞内的脯氨酸作为一种重要的渗透调节物质,在调节细胞膜内物质含量的平衡中有很重要的作用。图3结果显示,与对照组相比,Cd2+处理组的水蕨幼苗叶片内脯氨酸(proline)含量显著增加,在60 mg/L 的Cd2+浓度处理下增加了74.35%;但在不同浓度Cd2+处理组之间并无显著差异。
3结论与讨论
本试验结果表明,水蕨幼苗的叶绿素荧光特性受到了重金属镉胁迫的显著影响。在受到Cd2+胁迫时,水蕨幼苗的光合系统及脯氨酸(proline)和丙二醛(MDA)含量都受到了显著的影响,且随着镉离子处理浓度的增加其损伤程度加深。
植物在受到逆境胁迫时,其光合作用内部的各个反应过程都会受到抑制。此时,植物表现出复杂和细微的内部变化来应对逆境胁迫。有研究表明,叶绿素荧光与光合作用各个反应过程紧密相关,通过叶绿素荧光诱导动力学参数的变化能够准确方便地反映植物受生物或非生物胁迫的程度[11]。本试验中,水蕨幼苗在受Cd2+胁迫处理后,其叶绿素荧光参数Fv/Fm、Yield、qP和ETR均显著降低。而叶片初始荧光Fo和非光化学猝灭系数qN却显著上升。在叶绿素荧光中Fv/Fm是植物PSⅡ反应中心捕获光能激发能力和效率的重要指标,能反映植物PSⅡ受伤害的程度。在一般情况下其值的变化范围很小,不受物种和生长条件的影响[12]。在本试验中,水蕨幼苗的叶片Fv/Fm随着Cd2+处理浓度的增大而显著下降;说明水蕨幼苗叶片PSⅡ反应中心活性受到了Cd2+胁迫的损害或抑制,进而导致其捕获光激发能的效率降低;与Baszynski等对番茄幼苗的研究结果[3]一致。另外,相似的结果在钱永强等对3种柳树叶片的PSⅡ叶绿素荧光参数对Cd2+胁迫的光响应的研究中[11]也有过报道。而Yield是植物实际光合效率参数,其值的变化反映了植物PSⅡ反应中心在部分关闭情况下的实际原初光能捕获效率。大量的研究表明,在植物受到逆境胁迫后,PSⅡ反应中心会受到抑制而在很大程度上关闭,从而降低Yield的转化比例[13-14],相似的结果在本试验中也有证明,Cd2+浓度处理下的水蕨幼苗叶片Yield值显著降低,最大下降了62.37%。本试验结果与万雪琴等对杨树在响应镉胁迫的研究结果[10]一致,说明PSⅡ反应中心受到了较大程度的伤害,而非光化学猝灭系数(qN)及光化学淬灭系数(qP)与对照相比分别最大增加了108.98%和最大下降了51.38%,qN参数变化反映了植物PSⅡ天线色素吸收过量的不能用于光合电子传递的光能,而以热的形式散失掉的份额[15]。而qP则是植物PSⅡ吸收的用于光化学电子传递的比例[15]。该试验结果表明,水蕨幼苗在受到Cd2+胁迫时,qP值的降低在一定程度上降低了水蕨幼苗叶片PSⅡ反应中心的开放程度;qN的升高使水蕨幼苗叶片PSⅡ反应中心吸收的过量的光能能及时地以热耗散的形式散失出去。钱永强等认为植物的初始荧光Fo的变化与PSⅡ反应中心活性有关,是评价植物逆境伤害的一个重要指标[11]。而本试验中植物初始荧光Fo显著上升,说明水蕨幼苗在受到Cd2+胁迫时通过PSⅡ反应中心的活性提高来积极响应其受伤害的程度。植物在受到Cd2+胁迫时不仅光合机构受到了损伤,同时ETR也受到了影响。本试验中,与对照相比,水蕨幼苗叶片ETR显著受到抑制。这可能是水蕨在受到Cd2+胁迫时,通过增加qN来耗散掉过剩的光能,保护PSⅡ反应中心的活性[16],在一定程度上提高对Cd2+胁迫的耐性。
研究表明,植物在逆境胁迫下,不仅会引起光合机构的损伤,同时也影响植物用于光合作用的色素。光合色素在植物的光能吸收、传递和转化中起着不可或缺的作用,其含量的多少对光合速率有直接的影响[17]。本试验中,无论是叶绿素a、叶绿素b或者叶绿素(a+b)在Cd2+胁迫时,与对照相比都极显著下降(P<0.001),且随着Cd2+浓度的增大下降幅度增大。说明水蕨幼苗叶片在Cd2+胁迫下叶绿素被破坏或直接导致植物合作用下降。该试验结果与王春梅等对茶树的研究结果[22]一致。叶绿素a/b值的变化是植物光合器官生理状况的重要指标[18]。在本试验中,叶绿素a/b的值呈上升趋势。有研究表明,叶绿素a/b值的变化反映了植物细胞叶绿体类囊体的垛叠程度,在严重的逆境胁迫下,叶绿素a/b值上升导致其叶绿体内类囊体的垛叠程度升高[19],在一定程度下降低逆境胁迫下光抑制的发生。本试验结果说明在Cd2+胁迫下水蕨幼苗叶片类囊体的垛叠程度增大,降低光抑制的发生。
植物受到生物或非生物胁迫也能通过生理指标含量的变化来表现出来。其中,反映植物遭受逆境胁迫伤害的一个重要的生理指标就是植物细胞的脂质过氧化产物MDA。植物细胞内MDA的含量越高说明其受到的伤害程度越大[20]。本试验研究结果表明,随着Cd2+浓度的增加MDA含量呈显著增加趋势。这与廖克波等[21]和覃勇荣[22]等的研究结果一致,说明水蕨幼苗的细胞在受到Cd2+胁迫时发生了严重的膜脂过氧化,严重影响了幼苗正常的生理代谢。此外,作为植物细胞内最重要的渗透性调节物质脯氨酸(proline)含量的变化也是反映植物响应逆境胁迫的一个重要指标。Csonk等[23]和Pang等[24]研究发现,脯氨酸(proline)含量积累能有效调节细胞渗透平衡、增强细胞结构稳定性、阻止超氧自由基的产生和降低细胞膜脂过氧化的作用。本试验中,在Cd2+胁迫下脯氨酸(proline)的含量亦显著增加,说明水蕨幼苗可通过提高脯氨酸含量来提高细胞的渗透势,维持细胞正常代谢,提高抗逆性;但随着Cd2+处理浓度的增加,脯氨酸含量并无进一步的增加趋势,说明水蕨幼苗应对Cd2+胁迫的渗透调节只能在一定程度内发挥其作用。
综上所述,随着Cd2+浓度的增加,水蕨幼苗叶片的叶绿素荧光参数Fv/Fm、Yield、qP和ETR显著下降,而非光化学猝灭系数(qN)却显著上升。另外,与光合作用密切相关的叶绿素a和叶绿素b,以及总的叶绿素含量都显著降低,而丙二醛(MDA)和脯氨酸(proline)含量显著增加;说明水蕨幼苗的光合作用和生理代谢在Cd2+胁迫下受到了严重的损伤。另外,综合各项指标可以看出,水蕨幼苗通过自身的光保护机制和生理代谢机制只能抵御较低浓度的Cd2+胁迫,而40~60 mg/L的高浓度Cd2+处理将对植株的生理生化性状及生长发育造成严重的伤害。
参考文献:
[1]董元火,王青锋. 中国濒危水生蕨类植物研究进展[J]. 武汉大学学报:理学版,2011,57(4):335-342.
[2]李兆君,马国瑞,徐建民,等. 植物适应重金属Cd胁迫的生理及分子生物学机理[J]. 土壤通报,2004,35(2):234-238.
[3]Baszynski T,Wajda L,Krol M,et al. Photosynthetic activities of cadmium-treated tomato plants[J]. Physiologia Plantarum,1980,48(3):365-370.
[4]Bernier M,Popovic R,Carpentier R. Mercury inhibition at the donor side of photosystem Ⅱ is reversed by chloride[J]. FEBS Letters,1993,321(1):19-23.
[5]姚广,高辉远,王未未,等. 铅胁迫对玉米幼苗叶片光系统功能及光合作用的影响[J]. 生态学报,2009,29(3):1162-1169.
[6]李梦梅,龙明华. 植物抗镉胁迫的研究综述[J]. 广西农业科学,2005,36(4):319-322.
[7]吴翠. 水蕨濒危机制的生态学研究[D]. 武汉:武汉大学,2005:1-54.
[8]Hodges D M,Delong J M,Forney C F,et al. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J]. Planta,1999,207(4):604-611.
[9]Bates C J,Waldren R P,Teare I D. Rapid determination of free proline for water-stress studies[J]. Plant Soil,1973,39:205-207.
[10]Inskeep W P,Bloom P R. Extinction coefficients of chlorophyll a and b in N,N-dimethylformamide and 80% acetone[J]. Plant Physiology,1985,77(2):483-485.
[11]钱永强,周晓星,韩蕾,等. Cd2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响[J]. 生态学报,2011,20(20):6134-6142.
[12]Kramer D M,Johnson G,Kiirats O,et al. New fluorescence parameters for the determination of q(a) redox state and excitation energy fluxes[J]. Photosynthesis Research,2004,79(2):209-218.
[13]Qin T C,Wu Y S,Wang H X,et al. Effect of cadmium,lead and their interaction on the physiological and ecological characteristics of root system of Brassica chinensis[J]. Acta Ecological Sincia,1998,18(3):320-325.
[14]李卜,吴妤,李奕松. 镉胁迫对枣树幼苗叶片生理特性的影响[J]. 北京农学院学报,2012,27(1):22-25.
[15]李晓,冯伟,曾晓春. 叶绿素荧光分析技术及应用进展[J]. 西北植物学报,2006,26(10):2186-2196.
[16]王利,杨洪强,范伟国,等. 平邑甜茶叶片光合速率及叶绿素荧光参数对氯化镉处理的响应[J]. 中国农业科学,2010,43(15):3176-3183.
[17]姜永雷,鲁红鼎,邓莉兰,等. 镉胁迫对滇润楠幼苗生理特性的影响[J]. 江西农业大学学报,2013,35(4):769-774.
[18]夏建国,兰海霞,吴德勇. 铅胁迫对茶树生长及叶片生理指标的影响[J]. 农业环境科学学报,2010,29(1):43-48.
[19]王飞翔,王妙媛,李达,等. 土壤铅和镉胁迫对红花檵木叶片光合特性及色素含量的影响[J]. 湖南农业科学,2012(15):103-105,112.
[20]陈会,任艳芳,陈秀兰,等. 镉胁迫下不同耐性水稻植株幼苗生长和抗氧化酶的变化[J]. 江西农业大学学报,2012,34(6):1099-1104.
[21]廖克波,刘昆成,谢安德,等. 镉胁迫对观光木幼苗生理特性的影响[J]. 广东农业科学,2012,39(5):47-49.
[22]覃勇荣,冯济梅,梁文忠,等. 镉胁迫下的桑树幼苗叶片丙二醛含量动态分析[J]. 河池学院学报,2012,32(2):17-21,59.
[23]Csonka I N.Physiological and genetic response of bacteria to osmotic stress[J]. Microbial Rev,1989,53:121-147.
[24]Pang J,Chan G S,Zhang J,et al. Physiological aspects of vetiver grass for rehabilitation in abandoned metalliferous mine wastes[J]. Chemosphere,2003,52(9):1559-1570.

