不同营养方案在胆源性重症急性胰腺炎患者中的应用效果
王荣华,庄晓灿,许卫兵
胰腺作为人体重要的消化器官之一,全身各系统及重要器官均可因其病理生理异常而出现不同程度损伤。胰腺炎是由复杂病因导致的胰酶激活而使胰腺发生水肿、组织自身消化及出血,严重者甚至出现坏死等一系列病理性炎症症状[1,2]。重症急性胰腺炎(severe acute pancreatitis,SAP)是以胰腺坏死、出血为主要特征,其在临床上主要表现为突发恶心呕吐、急性上腹痛和血、尿淀粉酶异常升高[3]。临床上SAP患者通常并发腹膜炎、感染,甚至出现休克。同时作为一种急性全身消耗性疾病,SAP患者机体持续保持合成代谢低于分解代谢,且由于胃肠紧邻胰腺,故当胰腺出现炎症后机体对营养物质的消化和吸收会遭受严重影响,众多因素共同导致患者的免疫系统功能异常及机体的严重营养不良,进一步引起多脏器功能异常或衰竭[4,5]。虽然在急性胰腺炎中SAP患者只占全部的两成左右,但由于其对多器官的功能均可造成极大伤害,故其死亡率高、病情凶险且病程较长。所以临床上要对SAP患者进行例如营养支持等多学科干预方案。近来大量的文献研究显示合理的营养支持方案可调节机体代谢平衡,显著改善SAP患者的危险状态,安全度过急性期,并可改善消化道功能及结构的完整性,使机体所需营养得以保证[6]。肠内营养(enternal nutrition,EN)支持和肠外营养(parenteral nutrition,PN)支持是目前临床上主要的营养支持方案。通过将笔者所在医院2014年5月—2016年7月的90例SAP患者分为肠内营养组,肠内、肠外联合营养组及完全肠外营养组,对三组患者的疗效进行对比分析,结果报告如下。
1 资料与方法
1.1 一般资料 选取笔者所在医院2014年5月—2016年7月的90例符合纳入标准的SAP患者。按照患者接受营养支持方案的不同将入选患者分为肠内营养组(A组,n=30),完全肠外营养组(B组,n=30)和阶段性营养支持组(C组,n=30)。3组试验对象的相关临床资料见表1。
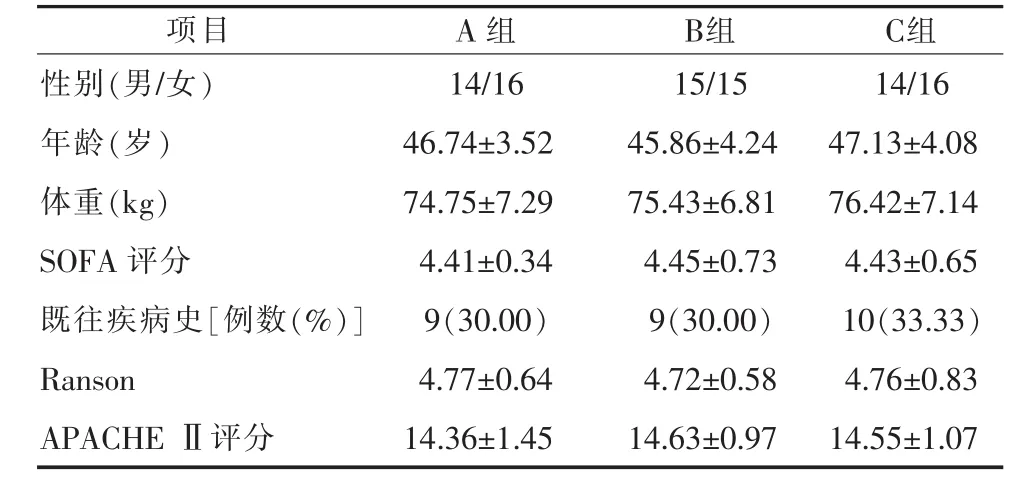
表1 各组临床资料对比
1.2 入选及诊断标准 (1)所有患者或家属均对本实验均知情,且签署知情同意书。(2)参考《中国急性胰腺炎诊治指南草案》对SAP的定义标准结合患者的临床表现、病史、影像学结果及实验室检查排除其他疾病,确诊为SAP。(3)所有患者无合并假性囊肿及胰腺坏死、脓肿。(4)排除消化道活动性出血患者或完全梗阻的患者。(5)无其他脏器严重损伤,且肝肾功能正常。(6)所有患者对肠内营养成分均无过敏情况发生。(7)排除血流动力学治疗后72h内仍不正常的患者,或药物无法控制的严重恶心、呕吐患者。(8)该研究提请笔者所在医院伦理委员会批准通过。
1.3 方法 各组患者入院后3 d内均进行相关常规治疗干预,例如:恢复电解质、水的平衡及液体复苏;针对性地对不同患者的脏器功能进行相应保护措施;采取相应的抑制胰酶分泌措施并给予解痉、镇静和镇痛治疗;给予各组对应的营养支持保证各组患者能获取同等量的氮量与热量,即氮量 0.15~0.20 g/kg·d 、热卡 104.6~125.5 kJ/kg·d;通过皮下注射胰岛素或胰岛素静脉泵将血糖维持在120~150 mg/dl;肠道细菌应用抗生素进行治疗;使用大黄进行灌肠,芒硝外敷皮肤,25%硫酸镁导泻。治疗过程中需随时观察患者身体体征并根据患者实际情况及时采取相应干预措施。
A组:接受常规治疗的同时进行肠内营养支持,安置好鼻肠营养管当日先通过鼻肠管缓慢注入500 ml葡萄糖氯化钠对肠道适当刺激;隔天即从30 ml/h开始连续注入百普力并持续24 h,需达到(20±2)kcal/kg的能量和每日0.2 g/kg的氮量。B组:每日需达到(20±2)kcal/kg的能量和每日0.2 g/kg的氮量,氮源主要由平衡氨基酸提供,该院静配中心将各营养组分混合均匀置于3 L袋内,经过静脉于经输液装置于12 h内匀速输入机体。C组:结合患者胃肠道功能及病理变化情况实行3个步骤的阶段性营养支持,(1)患者入院3~10 d在进行TPN营养干预的基础上根据实际情况可选择性配合输注血浆或白蛋白;(2)EN联合PN阶段,在患者肠蠕动及腹胀等相关症状缓解后可将鼻肠管置入空肠,并选择百普素营养剂行肠内营养,若无明显不适反应则以500 ml/d的剂量通过输注泵将营养制剂静脉滴入机体,并视患者耐受情况逐渐增加滴速;(3)在实验室检查及影像检查结果的证实下,若胃肠功能基本恢复正常且胰腺炎症消退则可逐渐降低肠内营养用量,同时逐渐开始进食,直至完全恢复。
1.4 观察指标 统计分析三组患者住院费用、平均留院时间、相关并发症和手术发生率,检测三组患者接受相应治疗2周后外周静脉血的白细胞(WBC)、中性粒细胞(NE)、 C 反应蛋白(CRP)和白蛋白(ALB)等指标。
1.5 统计方法 采用SPSS 18.0统计学软件对数据进行分析,计数资料采用χ2检验,计量资料用x±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 三组患者住院费用、平均留院时间和手术发生率对比 同A组相比,B组患者的住院花费显著升高(P<0.05),C组患者的费用低于B组,而高于A组,但均无统计学意义;B组患者的手术发生率及相关并发症发生率均显著高于A、C两组(P<0.05),同时A组患者显著高于C组患者(P<0.05);三组患者的留院时间差异均无统计学意义(P<0.05)。见表2。
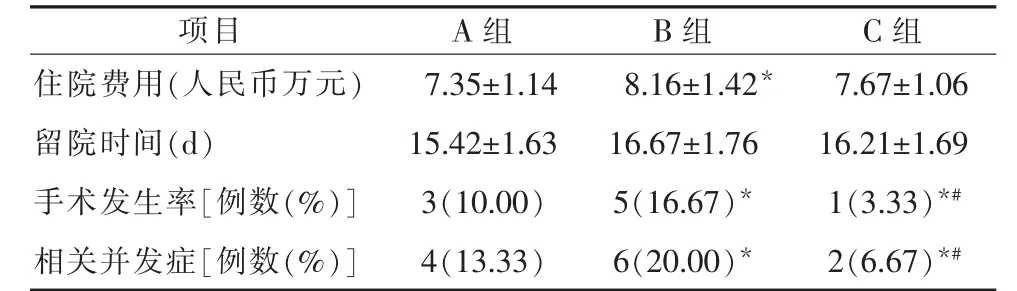
表2 三组患者住院费用、平均留院时间和手术发生率对比
2.2 治疗两周后三组患者相关指标对比 同B组相比,C组患者的ALB显著升高,WBC、NE和CRP则显著下降;B组相较于A组只有NE和CRP显著降低(P<0.05),而C组各指标相较于A组均无统计学意义(P>0.05)。 见表 3。
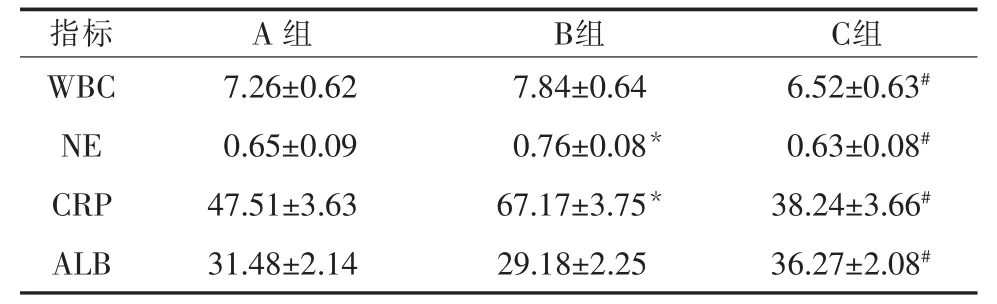
表3 治疗两周后三组患者相关指标对比
3 讨论
SAP作为病情发展迅速并可引发患者多器官功能异常的急性外科疾病,其最常见的病理改变为高代谢反应及严重应激反应,导致脂肪动员、蛋白质分解以及糖异生增加,直接引发机体营养异常及内环境严重紊乱,若不进行合理的营养支持可能会引发患者负氮平衡,导致机体出现难以恢复的免疫能力下降,并引发消化道梗阻、高热和胰周感染等并发症,造成患者病死率显著升高[7,8]。故在 SAP 发病初期进行合理的营养支持对病情预后及转归有着非常重要的意义。EN可促进黏膜细胞增生,恢复肠道黏膜屏障因损伤而异常的功能,在保证肠道完整性的同时保证了患者正常的营养代谢,同时EN经由鼻肠营养管进行营养支持不会导致输注营养液不会刺激胰腺分泌[9]。相关文献报道指出EN不仅可以减少感染和手术出现率,还可减少患者住院时间[10]。但怎样合理使用EN目前在临床上尚无定论,由于弥漫性腹膜炎和肠麻痹是SAP患者中较为常见的并发症,故若给予EN的时机不合理可能会使SAP患者的腹痛及腹部肿胀症状转重,不仅对患者病情的回转产生消极影响,还是胰腺炎加重和复发的重要诱因。
该研究通过对比肠内营养,完全肠外营养和阶段性营养支持对SAP患者的治疗效果发现阶段性营养支持组的手术发生率及相关并发症发生率较其他两组患者显著降低,虽然三组患者的住院时间无明显差别,但阶段性营养支持及肠内营养组的住院花费较完全肠外营养组低。合成于肝细胞的ALB是人体中重要的营养物质,可很好地反应SAP患者的营养状态[11]。由于WBC具有防御疾病和吞噬细菌的功能,故其数值可反映机体的感染情况。NE在机体内可发挥杀菌、吞噬和趋化的功能,其百分比可显示机体细菌感染的情况。CRP于感染和急性创伤时可异常升高,由于患者在SAP过程中炎症系统可被激活,从而导致CRP表达显著升高[12]。文献研究显示CRP的表达情况与感染病变程度呈现显著的正相关性,故CRP可作为检测SAP严重程度的重要指标,用以判断SAP的临床变化及预后[13]。本实验的结果显示阶段性营养支持患者的ALB显著高于完全肠外营养,WBC、NE和CRP则显著低于完全肠外营养。同时阶段性营养支持患者的ALB的升高,WBC、NE和CRP的下降与肠内营养组差别不显著,但有上升和下降的趋势。说明阶段性营养可明显促进SAP患者的负氮平衡,并改善了患者的营养情况,同时还可够减少患者细菌感染程度及患者的炎症反应程度。
综上所述,阶段性营养可显著下调SAP患者WBC、NE和CRP的水平,并显著改善患者的营养状态及自身免疫能力,显示阶段性营养对SAP的治疗安全有效,是一种合理的营养支持方案。
参考文献
[1]皮 英.急性重症胰腺炎早期肠内营养支持的疗效及护理[J].系统医学,2016,2(6):63-65.
[2] Zhao XL,Zhu SF,Xue GJ,et al.Early oral refeeding based on hunger in moderate and severe acute pancreatitis:a prospective controlled,randomized clinical trial [J].Nutrition,2015,31(2):171-175.
[3] Poropat G,Giljaca V,Hauser G,et al.Enteral nutrition formu-lations for acute pancreatitis[J].Cochrane Database Syst Rev,2015,23(3):CD010605.
[4] van Baal MC,van Rens MJ,Geven CB,et al.Association between probiotics and enteral nutrition in an experimental acute pancreatitis model in rats[J]. Pancreatology,2014,14(6):470-477.
[5] Zhu Y,Yin H,Zhang R,et al.Nasogastric nutrition versus nasojejunal nutrition in patients with severe acute pancreatitis:a meta-analysis of randomized controlled trials[J].Gastroenterol Res Pract,2016,7(2):6430632.
[6]田字彬,荆 雪.重症急性胰腺炎的营养支持疗法[J].中国实用内科杂志,2014,34(9):847-849.
[7] Stimac D,Poropat G,Hauser G,et al.Early nasojejunal tube feeding versus nil-by-mouth in acute pancreatitis:a randomized clinical trial[J].Pancreatology,2016,16(4):523-528.
[8] Bakker OJ,van Brunschot S,Farre A,et al.Timing of enteral nutrition in acute pancreatitis:meta-analysis of individuals using a single-arm of randomised trials[J].Pancreatology,2014,14(5):340-346.
[9]袁慧敏.早期肠内营养支持在急性重症胰腺炎治疗中的临床疗效[J]. 临床医学,2015,1(12):67-68.
[10] Li X,Ma F,Jia K.Early enteral nutrition within 24 hours or between 24 and 72 hours for acute pancreatitis:evidence based on 12 RCTs[J].Med Sci Monit,2014,20(5):2327-2335.
[11] Semenov DIU,Osmanov ZKH,Tonoian AG,et al.Results of dynamic assessment of melatonin receptor expression in lymphocytes in patients with acute mild and severe pancreatitis[J].Vestn Khir Im II Grek,2014,173(1):44-46.
[12]张 霞.浅谈早期肠内营养在急性重症胰腺炎治疗中的应用[J]. 中国现代药物应用,2015,9(11):98-99.
[13] Peng L,Wu LG,Li B,et al.Early enteral nutrition improves intestinal immune barrier in a rat model of severe acute pancreatitis[J].J Hepatobiliary Pancreat Sci,2016,23(11):681-687.

