狄诺塞麦和双膦酸盐治疗绝经后妇女骨质疏松症效果及安全性的Meta分析
杨 洋,张福华,魏新建,高 捷
骨质疏松症(osteoporosis,OP)是一种表现为骨量下降和骨微细结构破坏为主要特征的代谢性疾病。据目前相关数据统计,成年人年龄>50岁时,约半数人会患有不同程度的骨质疏松症,其中绝经后妇女占70%[1]。2000年全球约有900万OP患者合并骨折,其中20%是髋部骨折。在欧美国家中,每年平均有230万患者因OP而骨折[2]。骨折一旦发生,患者的生活质量将会受到严重影响,浪费不必要的医疗费用,甚至引发患者死亡。随着社会进步及人类平均寿命的延长,骨质疏松症已经成为全球性公共健康问题。因此积极防治OP已经成为刻不容缓的任务。
目前临床上的抗骨质疏松药主要分为三种,以甲状旁腺激素为代表的促骨形成药,以双膦酸盐类为代表的抗骨吸收药,以及以钙剂和VitD及其类似物为代表的基本补充剂。其中双膦酸盐类是目前临床上治疗OP的一线用药[3],常用的如伊班膦酸钠、唑来膦酸钠、利塞膦酸钠、阿仑膦酸钠等。狄诺塞麦(Denosumab)是一种以破骨细胞调节因子为靶点的人源性IgG2型的单克隆抗体类生物制剂,对人核因子-κB受体激活配体(RANKL)具有高度的特异性及亲和力,其与RANKL的结合,可以显著减少骨的吸收,从而提高骨密度,减少骨折的发生率。这为骨质疏松的治疗开拓了新的思路[4]。2009年美国食品药品管理局正式批准狄诺塞麦可以用于绝经后妇女OP的治疗,同样美国临床内分泌医师学会在2010年将狄诺塞麦列为治疗绝经后妇女OP诊疗指南中的一线用药[5,6]。狄诺塞麦和双膦酸盐类两种药物虽然作用机制不同,但适应证十分相近。为进一步对比两药的有效率以及安全性的差异,国际学者近年来进行了多项多中心随机对照试验。该文旨在将两类药物治疗绝经后妇女OP的疗效及安全性差异进行Meta分析,为临床治疗提供参考依据。
1 资料与方法
1.1 文献纳入与排除标准 纳入标准:(1)2006年6月—2016年6月国内外已报道的关于妇女绝经后骨量减少或骨质疏松症方面的研究文献,并且文献中包含双膦酸盐注射组与狄诺塞麦注射组 (60 mg/半年)。(2)观察指标主要为各部位的骨密度相对基线的上升度、随访时是否存在骨折等。(3)随访时间超过1年。(4)样本量超过50例。
排除标准:(1)文章数据存在同一性的文献或样本交叉应用的文献。(2)非随机对照实验等设计不规范的文献,以及诊断或疗效评估谬误的文献。(3)患者曾有转移性骨病史。(4)文章不能下载或数据难以获得文献。
1.2 检索策略 根据Cochrane协作网系统评价的相关要求对检索方式进行制定。在以下几个数据库进行检索:中国生物医学文献数据库CBM、Embase、PubMED、CNKI、维普数据库以及Cochrane临床对照实验中心数据库。检索“骨密度、骨质疏松、双膦酸盐、狄诺塞麦”等中文检索词。检索“osteoporosis、bone mineral density、bisphosphonate、denosumab”等英文检索词。检索时限为2006年6月—2016年6月。为保证文章查全,收集文献时结合手工检索等方法。
1.3 数据提取与文献质量评价 由2名研究者独立进行文献查找,并按相关标准筛选获得数据和资料。收集的文献资料内容主要有题目、研究分组、第一作者、发表时间、样本数量、是否对照实验、随访时间、实验对象的统计学特征、BMD的变化幅度、干预与对照方法、骨折以及不良反应等。倘若文献数据不全或无原始数据,可与文献作者联系,进而获得相关资料,或从文献图表内自行测得数据。使用“Cochrane协作网的偏倚评价标准”评估纳入文献的质量,如随机分组、分配隐藏、实施盲法、测量盲法、结果完整性。如遇分歧,2名研究者可讨论解决,倘若还未能决定的,可征求第三方资深专家意见。
1.4 数据分析 应用RevMan 5.3软件进行Meta分析,首先使用Chi2与I2测试对文献进行异质性检验,若收集的文献存在同质性(当Chi2值的P>0.1,I2<50%),采用固定效应模型对文献资料进行计算并合并;若收集的文献异质性较显著(Chi2值的P<0.1,I2>50%),则采用随机效应模型对文献资料进行计算并合并,并分析产生异质性的原因,对可能导致异质性的因素进行亚组分析。使用相对危险度(RR)对计数资料进行处理,使用加权均数差(WMD)对计量资料进行处理,二者都用95%可信区间(CI)表示,用森林图对Meta分析结果进行显示[7]。
2 结果
2.1 纳入文献的概况及质量评价 网络检索获得1870篇关联性文献,经初步筛选,排除非临床研究、非随机对照等不符合本次数据分析的文献1855篇,剩余15篇,对剩余文献进行全文精读,排除3篇文献数据存在同一性或样本交叉应用的文献及3篇狄诺塞麦与安慰剂对照的文献,最后获得文献9篇,进行 Meta 分析[8-16]。
进行研究分析的9篇文献均为随机对照实验,其中狄诺塞麦组受试者总数3046例,双膦酸盐对照组为2525例。狄诺塞麦与阿仑膦酸钠进行对照的研究有 6 个[8-12,15],狄诺塞麦与伊班膦酸钠、利塞膦酸钠及唑来膦酸钠及进行对照的研究各 1 个[13,14,16]。除Nakamura等[15]的受试对象均是黄种人,且存在极少量老年男性患者外,其余9篇文献样本对象均为患有OP的绝经后妇女。9篇文献的干预方法包括狄诺塞麦组(60 mg/半年)与双膦酸盐对照组,其中Lewiecki等[8]实验还包含了皮下注射狄诺塞麦6、14、30、100 及 210 mg/半年的分组。除采取干预措施外,每位受试对象均予钙剂和VitD口服。观察指标包括各部位BMD相对基线的提升程度,且都运用了DXA进行测量,随访时间为1~2年。纳入研究文献的详细基本特征见表1。纳入研究文献的质量评估见表2。
2.2 Meta分析结果
2.2.1 有效性分析 在有效性分析中,对治疗1年后患者的腰椎、髋部及股骨颈BMD升高幅度进行比较,狄诺塞麦组干预措施均为皮下注射60 mg/0.5年。(1)纳入文献中,有8篇对治疗12个月后腰椎BMD提升程度(百分比)进行了报道,共4917名受试对象,如图1。对纳入文献异质性检查结果为统计值:I2=79%,P<0.0001,提示8个纳入的研究存在异质性,使用随机效应模型进行分析。分析结果得出:狄诺塞麦组腰椎BMD的升高幅度比双膦酸盐组高1.42%(95%CI:0.93%~1.90%),P<0.01; 按不同治疗方案行亚组分析后,组内异质性明显降低,表明异质性来源为双膦酸盐组治疗方案的不同。(2)8篇文献提供了4939例患者治疗1年后髋部BMD升高幅度(百分比)的资料,如图2所示。异质性检验提示差异不存在统计学意义(I2=39%,P=0.12),通过固定效应模型对数据进行处理后发现狄诺塞麦组腰椎BMD的升高幅度比双膦酸盐组高1.11%,差异有统计学意义 (95%CI:0.97%~1.25%,P<0.01)。(3)7篇文献提供了4847例患者治疗1年后股骨颈BMD升高幅度(百分比)的资料,如图3所示。异质性检验提示差异不存在统计学意义 (I2=28%,P=0.22),通过固定效应模型对数据进行处理后发现狄诺塞麦组股骨颈BMD的升高幅度比双膦酸盐组高1.01%,差异有统计学意义(95%CI:0.81%~1.22%,P<0.01)。(4)敏感性分析显示,去除任何一项研究再行Meta分析,狄诺塞麦组各部位BMD升高幅度仍然大于双膦酸盐组,结果具有显著统计学差异,表明本研究结果可靠性强。

表1 纳入研究的文献基本特征

表2 纳入研究的文献质量评价

图1 腰椎骨密度升高幅度(百分比)的meta分析
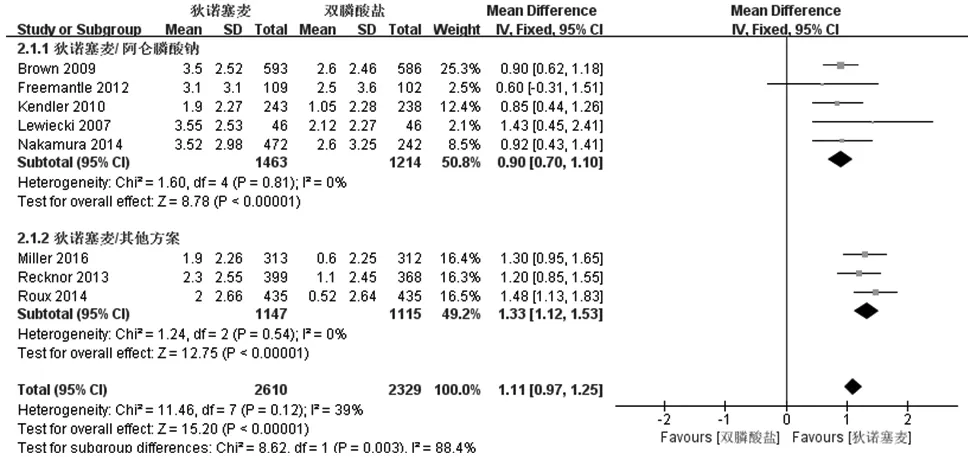
图2 髋部骨密度升高幅度(百分比)的meta分析

图3 股骨颈骨密度升高幅度(百分比)的meta分析
2.2.2 安全性分析 在安全性分析中,对试验开始后1年内发生的不良反应事件、严重不良反应事件、骨折、因不良反应导致的患者退出及死亡情况进行Meta研究,其中严重不良反应事件指的是肿瘤,感染,消化系统、呼吸循环系统出现的重大并发症。其中不良反应事件发生的相对危险度RR值为0.99(95%CI:0.96~1.02),P=0.62(图 4);发生严重不良反应事件的相对危险度RR值为1.03(95%CI:0.85~1.24),P=0.76 (图 5); 骨折的相对危险度RR 值为 1.06(95%CI:0.81~1.39),P=0.68(图 6);因不良反应导致患者退出的相对危险度RR值为0.49(95%CI:0.34~0.70),P=0.01(图 7);死亡的相对危险度 RR 值为 0.64 (95%:0.20~2.06),P=0.45(图8)。以上结果表明,狄诺塞麦组不良反应事件、严重不良反应事件、骨折及死亡的发生率和双膦酸盐组相似,无显著统计学差异;狄诺塞麦组因不良反应导致的患者退出率要低于双膦酸盐组,差异具有显著性统计学意义。

图4 不良反应事件发生率的meta分析

图5 严重不良反应事件发生率的meta分析

图6 骨折发生率的meta分析

图7 因不良反应导致的患者退出率的meta分析
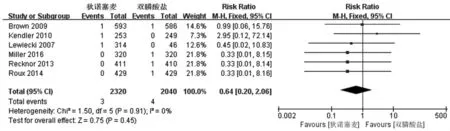
图8 病死率的meta分析
3 讨论
当老年人患有OP时,极易发生骨折,特别是绝经后妇女。该类骨折一般可经早期手术治疗恢复,可避免患者严重并发症出现,降低患者的病残、病死率。但部分OP患者骨量严重丢失,多发生粉碎性骨折,手术较为困难,且由于骨强度降低,内固定物植入后效果较差,甚至会在术中、术后发生新的骨折,对于此类患者,应治疗与预防兼顾。
狄诺塞麦为当今首个也是唯一一个获得批准的靶向RANKL的拮抗药,其可有效阻断配体与受体间的作用关系,进而使破骨细胞的生成受到抑制,减少溶骨,增强骨强度与骨密度。作为新型OP治疗药,狄诺塞麦在最近几年才上市,其临床效能还有待深究。该次笔者对各大文献库临床型随机对照试验的文献进行了收集整理,并使用Meta分析发现,相比于双膦酸盐,狄诺塞麦对绝经后OP妇女的髋部、腰椎、股骨颈等处的骨密度有明显提高,且安全性与双膦酸盐组基本相似,表明狄诺塞麦安全、可靠,可广泛应用于临床治疗中。
虽然该研究发现狄诺塞麦组患者治疗后腰椎、髋部及股骨颈BMD的升高幅度比双膦酸盐组高1%左右,但是两者骨折发生率的差异却无统计学意义。这可能是因为短期内BMD的提高并不能降低骨折的风险,需要长期的随访来进一步发现两种治疗方案的差异。但狄诺塞麦组因不良反应导致的患者退出率却明显低于双膦酸盐组,表明狄诺塞麦组患者治疗的耐受性及依从性较高。相比于阿仑膦酸钠的每周口服一次,狄诺塞麦只需要每半年皮下注射一次,其简便、高效的治疗方案使患者更易接受。Hiligsmann等[17]的研究发现,虽然单支狄诺塞麦的价格比双膦酸盐高,但是前者在长期治疗时却具有较高的效费比,因而在实际应用中对预防骨折具有重要意义。
该研究对不同部位BMD上升程度进行Meta分析时,发现存在一定的异质性,可能由各研究组间受试者基本特征不同及治疗方案差异所致。首先,各研究组中受试者基准BMD差异较大,曾有研究报道称,当患者基准BMD值较低时,应用双膦酸盐后,其 BMD 上升程度较大[18,19]。其次,在 Recknor和 Roux 等[13,14]的研究中,全部患者在干预措施前均进行了>30 d的阿仑膦酸钠治疗,Nakamura等[15]的研究对象均为黄种人且对照组每周口服阿仑膦酸钠为35 mg,这些差异都对异质性产生了一定影响。
该次研究也存在一些不足的地方:(1)纳入样本量较少,仅找到了英文文献,文献数量与受试者数量局限,且大部分受试者为白种人,可能会导致分配偏倚与选择偏倚发生,对Meta分析结果产生影响;(2)具有发表偏倚,纳入的均为已报道的文献,对阴性未报道的结果未进行统计,且研究基本由狄诺塞麦厂商-AMGEN公司提供资金资助,结论的真实性与客观性还有待考证;(3)所有的研究均将患者治疗前后不同部位BMD变化幅度作为主要观察指标,骨折发生情况仅作为次要观察指标在不良反应中述及,反映治疗有效性时依据不充分;(4)随访时间较短,只分析了皮下注射狄诺塞麦60 mg/半年随访1年的数据,其长期有效性及安全性有待进一步研究。
作为单克隆抗体人源性生物制剂,狄诺塞麦存在一定的免疫原性,Mcclung等[20]发现了2例抗狄诺塞麦抗体阳性患者,Bone等[21]发现了3例抗狄诺塞麦抗体阳性患者,但其对狄诺塞麦并不产生中和作用。对于狄诺塞麦的长期使用是否会引发中和抗体产生,进而对疗效产生影响,因此还需要大样本量及长周期的临床研究来进一步证实。
参考文献
[1] Simonelli C,Burke MS.Less frequent dosing of bisphosphonates in osteoporosis:focus on ibandronate[J].Curr Med Res Opin,2006,22(6):1101-1108.
[2] Johnell O,Kanis JA.An estimate of the worldwide prevalence and disability associated with osteoporosis fractures[J].Osteoporos Int,2006,17(12):1726-1733.
[3] Epstein S.Update of current therapeutic options for the treatment of postmenopausal osteoporosis[J].Clin Ther,2006,28(2):151-173.
[4] Lewiecki EM.Treatment of osteoporosis with denosumab[J].Maturitas,2010,66(2):182-186.
[5]郑振峰,林 珊.狄诺塞麦:治疗绝经期女性骨质疏松的新希望[J]. 国际内分泌代谢杂志,2011,31(3):161-164.
[6] Watts NB,Bilezikian JP,Camacho PM,et al.American Association of Clinical Endocrinologists Medical Guidelines for Clinical Practice for the diagnosis and treatment of postmenopausal osteoporosis[J].Endocr Pract,2010,16(S3):1-37.
[7] Green S.Cochrane handbook for systematic reviews of interventions version 5.1.0 updated March 2011[EB/OL].Cochrane Collaboration,2011.
[8] Lewiecki EM,Miller PD,Mcclung MR,et al.Two-year treatment with denosumab(AMG 162) in a randomized phase 2 study of postmenopausal women with low BMD[J].J Bone Miner Res,2007,22(12):1832-1841.
[9] Brown JP,Prince RL,Deal C,et al.Comparison of the effect of denosumab and alendronate on BMD and biochemical markers of bone turnover in postmenopausal women with low bone mass:a randomized,blinded,phase 3 trial[J].J Bone Miner Res,2009,24(1):153-161.
[10] Seeman E,Delmas PD,Hanley DA,et al.Microarchitectural deterioration of cortical and trabecular bone:differing effects of denosumab and alendronate[J].J Bone Miner Res,2010,25(8):1886-1894.
[11] Kendler DL,Roux C,Benhamou CL,et al.Effects of denosumab on bone mineral density and bone turnover in postmenopausal women transitioning from alendronate therapy[J].J Bone Miner Res,2010,25(1):72-81.
[12] Freemantle N,Satram-Hoang S,Tang ET,et al.Final results of the DAPS(Denosumab Adherence Preference Satisfaction)study:a 24-month,randomized,crossover comparison with alendronate in postmenopausal women[J].Osteoporos Int,2012,23(1):317-326.
[13] Recknor C,Czerwinski E,Bone HG,et al.Denosumab compared with ibandronate in postmenopausal women previously treated with bisphosphonate therapy:a randomized open-label trial[J].Obstet Gynecol,2013,121(6):1291-1299.
[14] Roux C,Hofbauer LC,Ho PR,et al.Denosumab compared with risedronate in postmenopausal women suboptimally adherent to alendronate therapy:efficacy and safety results from a randomized open-label study[J].Bone,2014,58(1):48-54.
[15] Nakamura T,Matsumoto T,Sugimoto T,et al.Clinical Trials Express:fracture risk reduction with denosumab in Japanese postmenopausal women and men with osteoporosis:denosumab fracture intervention randomized placebo controlled trial(DIRECT)[J].J Clin Endocrinol Metab,2014,99(7):2599-2607.
[16] Miller PD,Pannacciulli N,Brown JP,et al.Denosumab or Zoledronic Acid in Postmenopausal Women With Osteoporosis Previously Treated With Oral Bisphosphonates[J].J Clin Endocrinol Metab,2016,101(8):3163-3170.
[17] Hiligsmann M,Boonen A,Dirksen CD,et al.Cost-effectiveness of denosumab in the treatment of postmenopausal osteoporotic women[J].Expert Rev Pharmacoecon Outcomes Res,2013,13(1):19-28.
[18] Reid DM,Hosking D,Kendler D,et al.A comparison of the effect of alendronate and risedronate on bone mineral density in postmenopausal women with osteoporosis:24-month results from FACTS-International[J].Int J Clin Pract,2008,62(4):575-584.
[19] Bonnick S,Saag KG,Kiel DP,et al.Comparison of weekly treatment of postmenopausal osteoporosis with alendronate versus risedronate over two years[J].J Clin Endocrinol Metab,2006,91(7):2631-2637.
[20] Mcclung MR,Lewieckin EM,Cohen SB,et al.Denosumab in postmenopausal women with low bone mineral density[J].N Engl J Med,2006,354(8):821-831.
[21] Bone HG,Bolognese MA,Yuen CK,et al.Effects of denosumab on bone mineral density and bone turnover in postmenopausal women[J].J Clin Endocrinol Metab,2008,93(6):2149-2157.

