人工合成高效启动子用于基因治疗及疫苗研制
刘成倩,李 红,易建中,孙晓云,2
(1上海市农业科学院畜牧兽医研究所,上海 201106;2上海海洋大学水产与生命学院,上海 201306)
人工合成高效启动子用于基因治疗及疫苗研制
刘成倩1,李 红1,易建中1,孙晓云1,2
(1上海市农业科学院畜牧兽医研究所,上海 201106;2上海海洋大学水产与生命学院,上海 201306)
为了制备可用于基因治疗载体构建及疫苗研制的启动子,根据高效启动子的特点,人工合成了一段特异启动子(SEP)序列,通过酶切连接将其插入到含有绿色荧光蛋白的pEGFP-C1载体内,得到一新的启动子ESP,借助转染试剂LipofectamineTM2000将其和pEGFP-C1质粒转入BHK21细胞,通过荧光显微镜观察绿色荧光蛋白表达情况。结果显示:含有启动子ESP序列的pEGFP-ESP-C1荧光蛋白表达量明显高于pEGFP-C1,而且表达稳定。结果提示启动子ESP可以用于基因治疗载体的构建,将导入的基因在细胞内的表达水平提高,为基因治疗的最后成功打下基础。
启动子;基因治疗;疫苗研制
基因治疗是指将外源正常基因导入靶细胞,以纠正或补偿因基因缺陷和异常引起的疾病,达到治疗目的的方法。它是伴随着DNA重组技术的成熟而发展起来的,可以治疗多种疾病,被誉为治疗疾病的一种新手段。美国是最早尝试进行基因治疗的国家,随着1990年美国第一个临床试验治疗方案的批准,其他国家也开始了基因治疗的研究。在这些治疗方案中,恶性肿瘤治疗方案居多,还有心血管疾病、感染性疾病、神经性疾病等。但是在众多治疗方案实施后发现有肯定疗效者很少[1-2],专家们提出,现在是基因治疗回到基础研究上来的时候了。
基因治疗领域目前存在的主要问题是安全性和有效性。比如基因导入系统缺乏靶向性,这是基因治疗有待解决的核心问题;还有导入基因的表达量太低,治疗效果大打折扣,如果能将导入基因的表达量提高一倍甚至更多,则治疗效果会大大提高[3-4]。自1995年以来,基因治疗领域的学者们在改善基因导入系统和载体方面做了很多的努力,新的技术和方法层出不穷[5]。目前在基因导入载体方面研究应用较多的是病毒载体,然而基因治疗成功的关键是载体携带目的基因的靶向高效表达[6]。随着内含子、增强子、特异的启动子等的发现,将会掀起基因治疗新的热潮。
本研究根据高效启动子的机构特点,设计了一段特异启动子(SEP)序列,通过细胞转染试验发现新的启动子可以启动外源基因的高效表达,而且表达稳定。此启动子可以用于基因治疗载体的构建,将导入的基因在细胞内的表达水平提高,为基因治疗的最后成功打下基础。
1 材料与方法
1.1 质粒、菌种及试剂
大肠埃希氏菌(E.coli)种TOP10、BHK21细胞和含有绿色荧光蛋白的pEGFP-C1质粒,均由上海市农业科学院畜牧所病毒课题组提供。小量质粒抽提试剂盒购自上海嘉仪生物有限公司,转染试剂LipofectamineTM2000购自上海硕盟生物科技有限公司。
1.2 特异启动子SEP的合成
根据高效启动子的结构特点,设计了一对互补序列。标记为SEP-F/R,5’和3’端均引入了酶切位点Nhe I。序列送往上海捷瑞生物工程有限公司合成。
1.3 增强启动子ESP的构建
将合成好的SEP-F/R,各加入20μL ddH2O,用DNA寡核苷酸退火缓冲液进行退火处理。
经上述处理的SEP-F/R产物与pEGFP-C1质粒分别用内切酶Nhe I酶切,回收酶切后的目的片段,用T4连接酶连接过夜。连接产物转化E.coli TOP10,筛选出的阳性克隆送北京六合华大基因上海分公司测序。通过测序验证将插入序列正确的克隆命名为pEGFP-ESP-C1。
1.4 细胞转染试验
取出一瓶生长状态良好的BHK21细胞,传至24孔板中,转染前确保每个孔内贴壁细胞长至90%—95%。将质粒及转染试剂LipofectamineTM2000按比例稀释。质粒pEGFP-C1和pEGFP-ESP-C1分别转染0.25μg/孔,每个质粒样品设3个复孔。24 h后在荧光显微镜下观察表达情况,并拍照。
1.5 绿色荧光蛋白GFP基因检测
将转染24 h的细胞取出,弃掉上清液,用PBS洗3次,加入100μL细胞裂解液裂解细胞。取出75μL用ModulusTM单管型多功能检测仪检测GFP荧光值。
1.6 W estern-blot分析
将1.5中的细胞裂解液跑SDS-PAGE电泳,按半干转移法转PVDF膜,以抗GST标签鼠单克隆抗体为一抗孵育1.5 h,用PBST洗3次,每次5 min。再用HRP标记的山羊抗小鼠IgG为二抗孵育1.5 h,用PBST洗3次,每次5 min,再用PBS洗1次。最后在暗室内曝光显影。
2 结果与分析
2.1 pEGFP-ESP-C1菌落PCR筛选结果
SEP基因PCR产物与pEGFP-C1酶切连接后,挑取2个单菌落进行菌落PCR筛选,菌落PCR筛选结果见图1。
2.2 pEGFP-ESP-C1测序结果
通过该序列结果可以看出,人工合成的特异启动子SEP已经成功插入到质粒pEGFP-C1 CMV启动子下游,得到一段689 bp新的增强启动子ESP,命名为pEGFP-ESP-C1。其序列如下:

2.3 荧光显微镜观察结果
荧光显微镜下观察可以发现:含有ESP启动子的绿色荧光较多,荧光蛋白表达量明显高于只含CMV启动子的pEGFP-C1(图2和3)。

图2 质粒pEGFP-C1转染细胞荧光显微镜结果Fig.2 The fluorescencem icroscope observation of p lasm id pEGFP-C1 transfection cell

图3 质粒pEGFP-ESP-C1转染细胞荧光显微镜结果Fig.3 The fluorescencem icroscope observation of p lasm id pEGFP-ESP-C1 transfection cell
2.4 绿色荧光蛋白GFP基因检测
pEGFP-C1和pEGFP-ESP-C1转染后表达细胞裂解液用Modulus TM单管型多功能检测仪检测的GFP荧光值分别为7 108.05和26 908.44。说明含有ESP启动子的pEGFP-ESP-C1荧光值明显高于pEGFP-C1的荧光值,该结果和在荧光显微镜下观察的结果明显一致。
2.5 W estern-blot分析结果
裂解后的细胞经SDS-PAGE电泳,转PVDF膜后,能与GST标签单克隆抗体发生特异性反应,且GST蛋白表达量与2.3和2.4的结果一致(图4)。
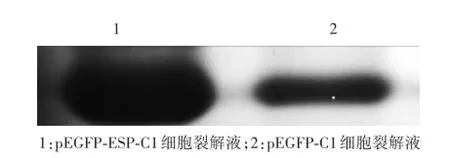
图4 W estern-blot分析结果Fig.4 W estern-blot analysis results
3 讨论
基因治疗涉及靶基因、靶基因载体和靶基因的表达调控,其中靶基因载体的选择是基因治疗的关键之一[7]。目前,病毒载体主要用于基因治疗,同样对于疫苗的研制,表达载体的选择也至关重要,特别是遇到一些基因不易于表达而且纯化困难,直接导致疫苗的生产成本高[8-10]。相比于载体系统的选择,治疗基因或者目的基因的表达调控的研究较为滞后,所以新的方法能使外源基因的表达水平提高,不仅对基因治疗有影响,而且对疫苗的研制也会带来新突破。
本研究设计和合成的特异启动子,属于首创。通过一系列试验也证明了该启动子可以启动外源基因的高效表达,而且表达稳定。此研究成果对基因治疗领域及疫苗研制方面都起到一定的推动作用。
[1]GURA T H.After a setback,gene therapy progresses gingerly[J].Science,2001,291(5509):1692-1697.
[2]WANG G,DONG X Y,TIANW H,et al.Evaluation ofmiR-122-regulated suicide gene therapy for hepatocellular carcinoma in an orthotopic mousemodel[J].Chinese Journal of Cancer Research,2013,25(6):646-655.
[3]邓洪新,田聆,魏子全.基因治疗的发展现状、问题和展望[J].生命科学,2005,17(3):196-199.
[4]林清凡,傅增顺.基因治疗的发展现状与展望[J].医药前沿,2012,2(3):133-134.
[5]MAJHEN D,AMBRIOVIC-RISTOV A.Adenoviral vectors—How to use them in cancer gene therapy?[J].Virus Res,2006,119(2):121-133.
[6]王振发,王列,卫立新.基因治疗病毒载体的研究进展[J].医学综述,2007,13(7):490-492.
[7]曹明媚,戚中田.基因治疗载体的研究进展[J].国外医学(肿瘤学分册),2004,31(1):22-26.
[8]刘成倩,王静,李红,等.鸡干扰素-α基因原核表达载体的构建及高效表达[J].中国畜牧兽医,2014,41(4):47-50.
[9]贺灵芝,曾庆友,许瑞安.基因治疗中高分子载体的发展现状[J].高分子通报,2010(10):46-52.
[10]LIAN M,WANG Q,FANG J,et al.Antagonism between gene therapy and epigenetic therapy on human laryngeal carcinoma tumor-bearingmice[J].Chinese Medical Journal,2013,126(2):248-253.
(责任编辑:张睿)
Preparation of artificial synthetic promoter for gene therapy and vaccine development
LIU Cheng-qian1,LIHong1,YIJian-zhong1,SUN Xiao-yun1,2
(1Animal Husbandry and Veterinary Research Institute,Shanghai Academy of Agricultural Sciences,Shanghai 201106,China;2College of Fisheries and Life Science,ShanghaiOcean University,Shanghai201306,China)
A promoter was constructed by this experiment,which could be used for the construction of gene therapy vector and vaccine development.According to the characteristics of the promoter,a sequence of specific promoter(SEP)was synthesized,which was inserted into pEGFP-C1 containing green fluorescent protein.The pEGFP-C1 plasmid containing a new promoter ESP was transfected into BHK-21 cells,the green fluorescent protein expression was observed by using a fluorescence microscopy.The results showed that the protein expression of pEGFP-ESP-C1 was significantly higher than that of pEGFP-C1,and the expression was stability.The results indicated that the promoter ESP could be used in the construction of gene therapy vector,and the expression level of the gene transferred into the cellwas improved,which laid the foundation for the final success of gene therapy.
Promoter;Gene therapy;Vaccine development
S852.65;R392
:A
1000-3924(2017)02-085-04
10.15955j.issn1000-3924.2017.02.16
2016-06-06
上海市科学技术委员会重点科技攻关项目(12391901900)
刘成倩(1984—),女,硕士,助理研究员,主要从事动物疾病的分子生物学及免疫学研究。E-mail:liuchengqian306@sohu.com
,E-mail:lihong20061029@163.com

