饱和溶液析出结晶水合物问题的多种解法
——以硫酸铜饱和溶液析出晶体的计算为例
河北省唐山市丰润区任各庄镇中学(064012) 周来友●
饱和溶液析出结晶水合物问题的多种解法
——以硫酸铜饱和溶液析出晶体的计算为例
河北省唐山市丰润区任各庄镇中学(064012)
周来友●
本文以硫酸铜饱和溶液析出晶体的计算为例,给出了饱和溶液析出结晶水合物问题的多种解法.
饱和溶液;结晶水合物;解法
饱和溶液析出结晶水合物的计算,由于析出的晶体带有结晶水,而溶质不含结晶水,致使这类计算始终困扰着一部分学生.这类计算主要有三种类型:一是向饱和溶液中加入不含结晶水的溶质析出晶体,二是饱和溶液蒸发溶剂析出晶体,三是饱和溶液降低温度析出晶体.怎样对饱和溶液析出结晶水合物的计算进行破解呢?下面,笔者以硫酸铜饱和溶液析出晶体的计算为例,给出每一类问题的多种解法.
一、向饱和溶液中加入不含结晶水的溶质析出结晶水合物
例1 已知T℃时CuSO4的溶解度是20g,向T℃时足量的CuSO4饱和溶液中加入16g无水CuSO4,析出CuSO4·5H2O的质量是多少?
解法1 硫酸铜饱和溶液所含硫酸铜的质量与加入硫酸铜的质量之和,等于析出的硫酸铜晶体中硫酸铜的质量与剩余饱和溶液所含溶质硫酸铜的质量之和.
不妨设原来T℃时饱和溶液质量为ag,所含硫酸铜质量为
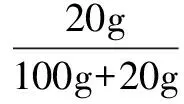

显然有下式成立
解得x=28.17g.
解法2 当温度不变时,向足量CuSO4饱和溶液中加入CuSO4粉末,析出CuSO4晶体的质量大于加入的CuSO4粉末的质量.晶体中CuSO4的质量减去加入的CuSO4粉末的质量就是饱和溶液失去的CuSO4的质量,这部分CuSO4的质量与晶体中结晶水的质量之比恰好等于该温度下CuSO4的溶解度与100 g溶剂水的比值.


解得x=28.17g.
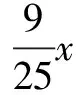
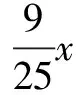
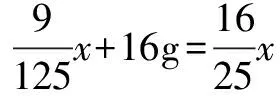
解法4 不妨设从溶液中析出的CuSO4(不是晶体)的质量为x,易知,这部分CuSO4与晶体中结晶水的质量之比恰好等于该温度下CuSO4的溶解度与100 g溶剂水的比值.如此看问题的话,那么析出晶体的质量就应该等于从溶液中析出的硫酸铜、晶体中的结晶水、加入的硫酸铜粉末这三者的质量之和.
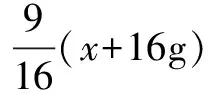
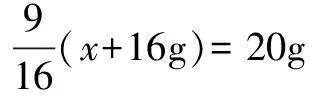
结晶水的质量为
析出的CuSO4晶体的质量为
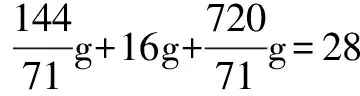

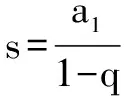
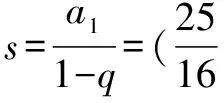
证明 bg硫酸铜加入到T℃时足量的硫酸铜饱和溶液中,可以看成先和水反应生成硫酸铜晶体,反应掉的水原来溶解的硫酸铜又析出来,接着析出的硫酸铜继续和水反应又生成硫酸铜晶体,以此类推,反应无限次进行下去,晶体就会无限次析出.结合硫酸铜和水在饱和溶液中反应生成硫酸铜晶体以及10℃时硫酸铜的溶解度,容易得到以下数据:



…….
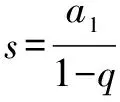
注:只要是求析出的晶体带有结晶水的问题,不管是哪一类问题,今后都有可能直接用这个结论求解.
二、当温度不变时蒸发溶剂析出结晶水合物
例2 已知30℃时硫酸铜的溶解度是25g,把30℃时的足量硫酸铜饱和溶液蒸发掉50g水,析出硫酸铜晶体的质量是多少?
解法1 硫酸铜饱和溶液蒸发掉50g水之前所含硫酸铜的质量,等于蒸发水以后析出的硫酸铜晶体中硫酸铜的质量与剩余饱和溶液所含溶质硫酸铜的质量之和.
不妨假设蒸发前饱和溶液质量为ag,所含硫酸铜质量为

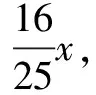
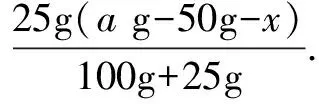
显然有下式成立
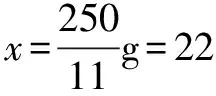

设析出CuSO4·5H2O的质量为x,则有

解得x=22.73g.

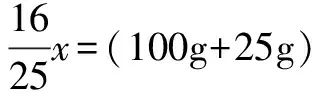
解得x=22.73g.

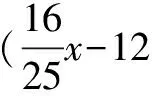
解得x=22.73g.
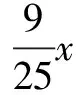
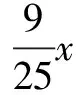
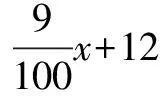
解法6 易知蒸发50 g水析出12.5 g硫酸铜(先不考虑结晶水),接下来可以看成把12.5 g硫酸铜加入到余下的硫酸铜饱和溶液中.不妨设从余下的溶液中析出的硫酸铜(不是晶体)的质量为x,易知,这部分硫酸铜与硫酸铜晶体中结晶水的质量之比恰好等于该温度下硫酸铜的溶解度与100 g溶剂水的比值.如此看问题的话,析出的硫酸铜晶体质量等于从余下的溶液中析出的硫酸铜、加入的12.5 g硫酸铜、晶体中的结晶水这三者的质量之和.
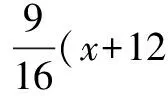
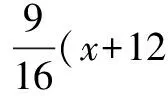
析出的CuSO4晶体的质量为8.182g+12.5g+2.045g=22.73g

三、给饱和溶液降低温度时析出结晶水合物
例3 已知30℃时CuSO4的溶解度是25g,10℃时是17.4g.把30℃时的CuSO4饱和溶液250g蒸发掉50g水后再降至10℃,析出CuSO4·5H2O的质量是多少?
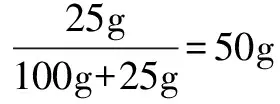
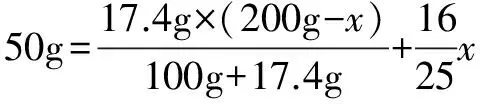
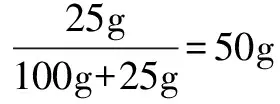

假设蒸发掉50g水之后没有晶体析出,则溶液中水的质量为200g-50g-28.125g=121.875g.


接下来,可以把问题转化成“把23.9 g硫酸铜加入到10℃时的176.1g硫酸铜饱和溶液中析出多少硫酸铜晶体?”这一问题.

解法5 问题转化同解法4.接下来针对“把23.9g硫酸铜加入到10℃时的176.1g硫酸铜饱和溶液中析出多少硫酸铜晶体?”这一问题作答.
解法6 前半部分同解法4.在这里继续探讨“把23.9g硫酸铜加入到10℃时176.1g硫酸铜饱和溶液中析出多少硫酸铜晶体?”这一问题的解法.
不妨设析出硫酸铜的质量为x,则这部分硫酸铜与晶体中结晶水的质量之比恰好等于该温度下硫酸铜的溶解度11.7g与100g溶剂水的比值.如此看问题的话,析出硫酸铜晶体质量等于从余下的溶液中析出的硫酸铜、加入的23.9g硫酸铜、晶体中的结晶水这三者的质量之和.

通过以上几个实例不难看出,饱和溶液析出结晶水合物的计算,尽管题型各异,但就解题策略而言是相似相通甚至是相同的.概括起来主要有以下三种思路:一是不管把溶质看成硫酸铜还是硫酸铜晶体,都要分清溶液、溶剂、溶质的量和来源,结合溶液的组成、晶体的化学式、溶解度等列比例求解;二是剖析硫酸铜晶体和溶液的组成变化,寻找等量关系,用守恒法巧妙解答;三是转化成数学中的无穷递缩等比数列求和公式进行求解;等等.以上这些技巧,希望大家在今后的学习中慢慢体会,真正做到熟能生巧,触类旁通.
[1]周来友.向硫酸铜饱和溶液中加入硫酸铜析出晶体问题的多种解法.数理化学习(高中版).2016,(9): 58+60.
G632
B
1008-0333(2017)10-0088-04
——饱和溶液与不饱和溶液

