姜黄素对菊花DNA甲基化及其生长发育的影响
刘艳华,李忠爱,李 杰,刘 晓,王子成*
(1.河南大学 生命科学学院,河南 开封 475004; 2.河南省邓州市刘集镇农业服务中心,河南 邓州 474150)
姜黄素对菊花DNA甲基化及其生长发育的影响
刘艳华1,李忠爱1,李 杰1,刘 晓2,王子成1*
(1.河南大学 生命科学学院,河南 开封 475004; 2.河南省邓州市刘集镇农业服务中心,河南 邓州 474150)
采用0、100、200、400 μmol/L不同浓度的姜黄素对菊花神马组培苗进行处理,利用甲基化敏感扩增多态性技术(MSAP)分析DNA甲基化水平,并观察植株生长状况。结果表明:姜黄素处理对菊花花期的影响达到了显著水平,以200 μmol/L姜黄素处理的菊花最早开花,花期可提前5~8 d。MSAP分析结果表明,经姜黄素处理的菊花组培苗的DNA甲基化比率随姜黄素浓度的升高而降低,在0、100、200、400 μmol/L姜黄素处理下,甲基化比率分别为58.40%、50.44%、48.24%和46.00%。经姜黄素处理的菊花组培苗矮化萎蔫,叶片数减少,分芽能力减弱。移植至室外后,植株矮化等表型抑制作用稳定遗传。表明姜黄素处理菊花可使其基因组甲基化水平降低,产生表观遗传变异,导致提前开花。
菊花; 姜黄素; DNA甲基化; 变异
表观遗传学范畴内的可遗传变异不同于基因表达改变的遗传变异[1]。表观遗传学是指DNA序列之外的改变而导致的可遗传变异,并可以在发育和细胞增殖过程中稳定传递的遗传学分支学科,主要包括DNA甲基化、组蛋白共价修饰、染色质重塑等调控机制[2-3]。DNA甲基化(DNA methylation)是指由DNA甲基转移酶(DNA methyltransferase,DNMT)催化S-腺苷甲硫氨酸作为甲基供体,在CpG和CpXpG受体位点添加甲基形成5-甲基胞嘧啶(5-Mc)[4]以及少量的N6-甲基腺嘌呤(N6-mA)及7-甲基鸟嘌呤(7-mG)[5]。DNA甲基化水平降低或不足会导致植株矮小、叶片大小和形状异常、繁殖能力下降、开花时间改变等[6-7]。
DNA甲基化水平可以通过调控甲基化酶表达[8]、组蛋白甲基化[9]及构建RNA干扰载体[10]等基因工程手段进行调控,从而改变植物表观性状,但是这需要较大的工作量及时间投入,而且引起的性状具有随机性且致死率较大。而利用DNA甲基化抑制剂处理的植株具有相对稳定的遗传特性,在操作过程中不需要专业人才过多的精力投入,一定程度上节省了人力和财力,因此,可为植物性状调控提供一种基于表观遗传学手段的途径与方法。
DNA甲基化抑制剂是指一类能使基因组甲基化水平降低的碱基类似物,包括核苷类DNA甲基转移酶抑制剂(5-氮杂胞嘧啶核苷和5-氮脱氧胞嘧啶)和非核苷类DNA甲基转移酶抑制剂[11-12]。它使甲基基团不能转移到腺嘌呤或胞嘧啶,导致 DNA 甲基化反应受阻,从而使基因组甲基化水平降低[13]。近年来 DNA 甲基化抑制剂已应用于植物组织发育的研究中,目前,最普遍使用的甲基化抑制剂是5-氮杂胞苷和地西他滨,但其价格昂贵,毒性比较大[14],在推广使用上受到了限制。寻找更稳定、毒性小、价格低廉的甲基化抑制剂是必要的。姜黄素(curcumin,CUR)是一种重要的中草药提取成分[15],与胞嘧啶以及5-氮杂胞苷的化学结构类似,因此,人们推测姜黄素可能是一种甲基化抑制剂[16]。姜黄素来源广泛,可从多种姜科植物中提炼加工,价格低廉,毒副作用小[17]。姜黄素在医学方面运用较多,临床上具有抗炎、抗氧化、抗肿瘤、抑制血小板聚集和降血脂等作用[18-19]。姜黄素在抑制癌变过程中发挥重要作用,它可以抑制宫颈癌、直肠癌、鼻咽癌、胰腺癌、肝癌等多个靶点肿瘤细胞的生长[20-23]。有研究发现,用甲基化抑制剂5-氮杂胞苷处理菊花可使其花期提前[24],但姜黄素对菊花是否有同样的效应,尚未见相关报道。鉴于此,采用姜黄素对菊花材料进行处理,对处理后材料的花期、株高和抗病虫害能力等主要表型性状及DNA甲基化与基因表达变化情况进行分析,为姜黄素作为一种潜在的DNA甲基化抑制剂应用于植物的花期调控等生长发育控制研究奠定基础。
1 材料和方法
1.1 材料
菊花神马采自开封市园林菊花研究所。神马对培养基、温度、湿度以及大田的生长环境都有良好的适应性。
1.2 试验方法
1.2.1 姜黄素对菊花形态及其DNA甲基化的影响试验 用田间生长健壮的神马菊花苗的幼嫩茎段作为外植体,2.5~3.0 cm长的茎段经70%乙醇和0.1%升汞消毒处理后,转接到MS+6-BA 1.0 mg/L+NAA 0.15 mg/L+3%蔗糖+0.7%琼脂粉的增殖培养基中培养,培养2~3代后进行姜黄素处理,即在添加有0、100、200、400 μmol/L姜黄素的增殖培养基上培养,每种浓度分别处理10个菊花不定芽。培养30 d后分别统计每个不定芽的平均株高、丛生芽数及叶片数。
采用甲基化敏感扩增多态性(MSAP)技术对姜黄素处理30 d后的菊花总DNA甲基化多态性进行检测分析。采用CTAB法提取并纯化DNA[25],然后使用DNA甲基化敏感型不同的2种酶分别与EcoRⅠ组合对DNA完全双酶切,连接接头后,进行预扩增反应[24]和选择性扩增反应[26-28],最后在全自动生物大分子分析仪上检测结果。MSAP分析引物序列见表1。
1.2.2 姜黄素处理下菊花的室外表现观察 经姜黄素处理的菊花不定芽分别进行增殖培养、生根培养(MS+3%蔗糖+0.7%琼脂粉)30 d后,将生根状况良好的植株转接至穴盘(基质配方为V珍珠岩∶V草炭=2∶1)培养,观察其生长状况。其中所有植株均在相同环境下生长。
在穴盘上培养20 d 后,将菊花植株移栽到田间生长,栽培基质配方为V垃圾土∶V珍珠岩∶V鸡粪=3∶2∶1。当其由营养生长进入到生殖生长时,测量株高。在移栽至大田后,及时摘除侧枝、脚芽、赘芽,及时抹蕾,保证1株菊花只开1朵花,便于对开花时间的统计。从上盆至第1个花瓣展开时间定为开花时间。
2 结果与分析
2.1 姜黄素对菊花形态及其DNA甲基化的影响
2.1.1 姜黄素处理对菊花形态的影响 经姜黄素处理的菊花生长30 d后,能明显观察到其形态表型的变化(图1)。100、200、400 μmol/L姜黄素处理的叶片变黄变小(图1b、c、d),数量明显少于对照(图1a),且植株矮化,丛生芽数量减少。高浓度处理(400 μmol/L)的植株不能正常生长,转接到没有添加姜黄素的增殖培养基上30 d后,100 μmol/L和200 μmol/L处理芽体均能恢复正常生长,但400 μmol/L处理芽体恢复效果不佳。可见,姜黄素对于菊花的正常生长有一定的影响,低浓度的姜黄素处理对菊花组培苗没有造成致命性伤害,但是高浓度(400 μmol/L)可能已经超出了菊花芽体正常生长所能承受姜黄素浓度的临界点。
由图2可知,不同浓度姜黄素处理的株高都有所下降,100、200、400 μmol/L处理的株高分别比对照降低21.58%、28.42%、35.53%。其中,100 μmol/L和200 μmol/L处理与对照差异显著(P<0.05),400 μmol/L处理与对照相比差异极显著(P<0.01)。丛生芽数也随姜黄素浓度升高而减少,100、200、400 μmol/L处理的丛生芽数分别比对照降低1.14%、2.14%、4.23%,只有400 μmol/L处理与对照差异极显著(P<0.01)。叶片数同样随姜黄素浓度的变化而改变,其中,200 μmol/L处理与对照差异显著(P<0.05),400 μmol/L处理与对照相比差异极显著(P<0.01),这2种处理的叶片数分别比对照减少25.71%和37.12%。

a、b、c、d分别为0、100、200、400 μmol/L姜黄素处理的菊花不定芽

*、**分别表示与对照差异显著(P<0.05)、极显著(P<0.01)
2.1.2 姜黄素处理下菊花的MSAP分析结果 用4种不同浓度的姜黄素分别处理菊花,30 d后分别提取DNA,再用已经筛选出的6对MSAP引物进行扩增,并统计分析条带(图3)。100、200、400 μmol/L姜黄素处理甲基化比率分别比对照(58.40%)极显著降低7.96、10.16、12.00个百分点。各姜黄素处理之间差异不显著(图4)。以上结果说明,菊花基因组DNA甲基化比率随姜黄素浓度的升高而呈下降趋势,但趋势不明显。
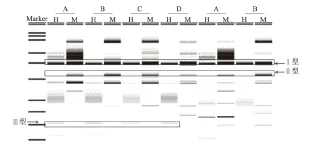
H和M分别代表HpaⅡ/EcoRⅠ和MspⅠ/EcoRⅠ酶切后扩增产生的条带。A、B、C、D分别代表0、100、200、

图4 不同浓度姜黄素处理下菊花的甲基化比率
2.2 姜黄素处理下菊花的室外表现
从图5a可以看出,对照组培苗的根系粗壮发达,侧根多,而经姜黄素处理后的菊花组培苗的根变细变长,侧根数量减少,其中,400 μmol/L处理的菊花组培苗不能正常生根,故该浓度处理没有移植室外的材料。炼苗过程中,各处理的抗性差异明显,对照菊花在炼苗过程中无任何染菌,100 μmol/L处理染菌率为40.00%,200 μmol/L处理染菌率较高,达56.25%。移栽至穴盘生长20 d后,对照和100、200 μmol/L处理的植株均长势良好(图5b)。

a从左到右依次为0、100、200、400 μmol/L姜黄素处理后的生根材料;b为生根材料移栽穴盘内表型,上部2排为对照材料,中部、下部分别为100、200 μmol/L姜黄素处理材料
将菊花植株移栽到田间生长,进入9月份后其由营养生长进入到生殖生长,对其株高进行测量(图6)。结果表明,株高随姜黄素处理浓度的升高而下降,200 μmol/L处理株高比对照极显著降低(P<0.01),100 μmol/L处理株高比对照低,但差异不显著(P>0.05)。

图6 经姜黄素处理后移植室外的菊花株高
从图7可以看出,当200 μmol/L处理的菊花进入盛花期时,对照菊花为现蕾期,100 μmol/L处理的菊花为初花期。200 μmol/L处理的开花时间早于100 μmol/L处理,100 μmol/L处理早于对照,200 μmol/L处理开花时间最早,较对照提前5~8 d。值得注意的是,在100 μmol/L处理中出现一单株菊花,其营养生长异常缓慢,且在其他菊花都进入成熟期后仍处在幼苗期,至单株死亡时都未现蕾开花。

从左到右依次为0、100、200 μmol/L姜黄素处理的神马菊花单株
3 结论与讨论
本研究结果表明,姜黄素处理菊花可使其DNA甲基化整体水平降低,结合在拟南芥[29]上的研究结果说明,姜黄素可以作为DNA甲基化抑制剂用于植物材料的处理,此外,姜黄素可以用于诱导菊花提前开花。但姜黄素在其他植物上是否有同样的效果,还需大量的试验来验证。本研究是在菊花组培苗阶段进行姜黄素处理,而花期改变在生长发育后期,因此,这种改变可能是由于表观遗传改变所引起的。最近的研究结果[30]表明,用短日照诱导菊花开花的过程中,菊花基因组DNA甲基化水平呈下降的趋势,这与本研究采用DNA甲基化抑制剂促进菊花提前开花的结论是相一致的。至于DNA甲基化水平降低引起菊花提前开花的内在机制,还需要进行更深入的探索。
菊花DNA甲基化降低程度随姜黄素处理浓度的升高而增大。用400 μmol/L姜黄素处理菊花组培苗,其DNA甲基化降低程度最高,以致植物不能正常生长。而200 μmol/L处理菊花组培苗的DNA甲基化降低程度次之,植物能够正常生长,且开花时间较对照提前了5~8 d。可见,DNA甲基化引起的表观遗传变异虽然与遗传变异相互影响,但应具有独立完整的维持和调控机制[31]。目前,表观遗传学研究中一个重要的问题是,表型的变异是DNA序列变化导致的结果,还是独立于任何基因序列突变的表观遗传变异,两者之间很难区别划分[32]。
本研究中的菊花材料经DNA甲基化抑制剂姜黄素处理后,利用全自动大分子分析仪分析其基因组DNA甲基化水平的变化,并结合材料的表型变化,探讨它们之间是否存在一定联系,但限于研究手段,还不能确定表型及花期的改变是某种变异的定向结果还是2种变异的互作。其具体的调控途径需要进一步研究。
综上,姜黄素可以使菊花基因组DNA甲基化水平降低,促使菊花花期提前,产生表观遗传变异。由此确定了姜黄素可以作为一种DNA甲基化抑制剂应用于植物的花期调控。这为植物性状调控提供了一种基于表观遗传学手段的新途径与方法。
[1] Bird A.Perceptions of epigenetics[J].Nature,2007,447(7143):396-398.
[2] Richards E J,Elgin S C.Epigenetic codes for heterochromatin formation and silencing:Rounding up the usual suspects [J].Cell,2002,108:489-500.
[3] Tariq M,Paszkowski J.DNA and histone methylation in plants [J].Trends Genet,2002,20:244-251.
[4] Gruenbaum Y,Naveh-Many T,Cedar H,etal.Sequence specificity of methylation in higher plant DNA[J].Nature,1981,292(5826):860-862.
[5] Dodge J E,Ramsahoye B H,Wo Z G,etal.De novo methylation of MMLV provirus in embryonic stem cells:CpG versus non-CpG methylation[J].Science Direct,2002,289(12):41-48.
[6] Kakutani T,Munakata K,Richards E J,etal.Meiotically and mitotically stable inheritance of DNA hypomethylation induced byddm1 mutation ofArabidopsisthaliana[J].Genetics,1999,151(2):831-838.
[7] Cao X F,Jacobsen S E.Locus-specific control of asymmetric and CpNpG methylation by theDRMandCMT3 methyltransferase genes[J].The National Academy of Sciences,2002,99(4):16491-16498.
[8] Cao D Y,Zheng J,Chao G,etal.Genome-wide identification of cytosine-5 DNA methyltransferases and demethylases inSolanumlycopersicum[J].Gene,2014,50:230-237.
[9] Momoko I,Akira I,Keiko S.Control of plant cell differentiation by histone modification and DNA methylation[J].Current Opinion in Plant Biology,2015,28:60-67.
[10] Muthusamy V,Bosenberg M,Wajapeyee N.Redefining regulation of DNA methylation by RNA interference[J].Genomics,2010,96(4):191-198.
[11] Sippl W,Jung M.DNA methyltransferase inhibitors[J].Epigenetic Targets in Drug Discovery,2009,42:163-183.
[12] Mai A,Altucci L.Epi-drugs to fight cancer:From chemistry to cancer treatment,the road ahead[J].International Journal of Biochemistry & Cell Biology,2009,41(1):199-213.
[13] Christina G,Jacques F,Ludovic H,etal.DNA methylation inhibitors in cancer:Recent and future approaches[J].Special Section on Epigenetics,2012,94(11):2280-2296.
[14] 李培坤,耿小平,朱立新.DNA甲基化抑制剂研究进展[J].国际药学研究杂志,2010,37(3):198-202.
[15] 罗廷顺,李洪文,刘正文,等.姜黄素的提取分离与药理作用研究进展[J].现代药物与临床,2011,26(2):102-107.
[16] Liu Z F,Xie Z L,Jones W,etal.Curcumin is a potent DNA hypomethylation agent[J].Bioorganic & Medicinal Chemistry Letters,2009,19(3):706-709.
[17] 佘美荣,蒋福升,丁志山.姜黄素的研究进展[J].中草药,2009,40(5):828-831.
[18] Shoji M,Nakagawa K,Watanabe A,etal.Comparison of the effects of curcumin and curcumin glucuronide in human heaptocelluar carcimoma HepG2 cells[J].Food Chemistry,2014,151:126-132.
[19] 狄建彬,顾振纶,赵笑东,等.姜黄素的抗氧化和抗炎作用研究进展[J].中草药,2010,41(5):18-21.
[20] Jiang A P,Wang X M,Shan X Y,etal.Curcumin reactivates silenced tumor suppressor gene RAR beta by reducing DNA methylation[J].Pharmacology & Pharmacy,2015,29(8):1237-1245.
[21] Guo Y,Shu L M,Zhang C Y,etal.Curcumin inhibits anchorage-independent growth of HT29 human colon cancer cells by targeting epigenetic restoration of the tumor suppressor geneDLEC1[J].Biochemical Pharmacology,2015,94(2):69-78.
[22] Zamani M,Sadeghizadeh M,Behmanesh M,etal.Dendrosomal curcumin increases expression of the long non-coding RNA geneMEG3 via up-regulation of epi-miRs hepatocellular cancer[J].Plant Sciences,2015,22(10):961-967.
[23] Nagaraju G P,Zhu S J,Wen J,etal.Novel synthetic curcumin analogues EF31 and UBS109 are potent DNA hypomethylating agents in pancreatic cancer[J].Cancer Letters,2013,341(2):195-203.
[24] 王子成,聂丽娟,何艳霞.离体条件下5-氮杂胞嘧啶核苷对菊花DNA甲基化和表型性状的影响[J].园艺学报,2009,36(12):1783-1790.
[25] Yi H L,Li L H.DNA methylation changes in response to sulfur dioxide stress inArabidopsisplants[J].Procedia Environmental Sciences,2013,18:37-42.
[26] Chen X J,Hu J H,Zhang H Y,etal.DNA methylation changes in photoperiod-thermo-sensitive male sterile rice PA64S under two different conditions[J].Gene,2015,537(1):143-148.
[27] Zhao Y,Chen M Y,Storey K B,etal.DNA methylation levels analysis in four tissues of sea cucumberApostichopusjaponicusbased on uorescence-labeled methylation-sensitive amplied polymorphism(F-MSAP) during aestivation [J].Comparative Biochemistry and Physiology,2015,181:26-32.
[28] Ba Q S,Zhang G S,Niu N,etal.Cytoplasmic effects on DNA methylation between male sterile lines and the maintainer in wheat(TriticumaestivumL.) [J].Gene,2014,549(1):192-197.
[29] 杜亚琼.四种药品处理对拟南芥DNA甲基化的影响[D].开封:河南大学,2011.
[30] Li Z A,Li J,Liu Y H,etal.DNA demethylation duringChrysanthemumfloral transition following short-day treatment[J].Electronic Journal of Biotechnology,2016,21:77-81.
[31] Cervera M T,Ruiz-Gareia L,Martinez-Zapater J M.Analysis of DNA methylationinArabidopsisthalianabased on methylation-sensitive AFLP markers[J].Molecular Genetics and Genomics,2003,268(6):832-833.
[32] Paszkowski J,Grossniklaus U.Selected aspects of transgenerational epigenetic inheritance and resetting in plants[J].Current Opinion in Plant Biology,2011,14(2):195-203.
Effects of Curcumin on DNA Methylation and Development of Chrysanthemum
LIU Yanhua1,LI Zhongai1,LI Jie1,LIU Xiao2,WANG Zicheng1*
(1.School of Life Science,Henan University,Kaifeng 475004,China; 2.Agricultural Service Center of Liuji Town,Dengzhou 474150,China)
In this study,the chrysanthemum plantlets were treated with 0,100,200,400 μmol/L of curcumin,methylation sensitive amplified polymorphism(MSAP) technology was used to analyse the DNA methylation level,and the plant growth status was observed.The results showed that the effect of curcumin on the flowering time of chrysanthemum reached a significant level,the earliest flowering time with 200 μmol/L was 5—8 days earlier than the control.MSAP results showed that the DNA methylation rate of treated tissue culture seedlings decreased with the increase of curcumin concentration,and the methylation rates were 58.40%,50.44%,48.24% and 46.00% under the curcumin concentration of 0,100,200,400 μmol/L,respectively.Seedlings plants showed dwarf,easily wilt,with less leaves and more weak buds.After transplantation to the outside,dwarfing phenotype was inherited stably.In conclusion,curcumin treatment can reduce genomic methylation level and produce epigenetic variation,leading to early flowering of chrysanthemum.
chrysanthemum; curcumin; DNA methylation; variation
2017-02-16
国家自然科学基金项目(31171982,31372090)
刘艳华(1990-),女,河南商丘人,在读硕士研究生,研究方向:菊花表观遗传。 E-mail:1376490880@qq.com
*通讯作者:王子成(1974-),男,河南开封人,教授,主要从事菊花表观遗传研究。E-mail:wzc@henu.edu.cn
S682.1+1
A
1004-3268(2017)05-0100-06

