半乳糖配体介导Cmyc反义锁核酸对肝癌细胞增殖和凋亡的影响
肖树荣++邓益斌++许桂丹++黄赞松��
【摘要】目的探討针对增殖相关基因(Cmyc)第二外显子翻译起始区的反义锁核酸对肝癌细胞增殖和凋亡的影响。
方法设计合成能特异性封闭Cmyc基因mRNA第二外显子翻译起始区的反义寡核苷酸、硫代寡核苷酸和锁核酸,分别以阳离子半乳糖配体介导转染HepG2细胞,采用RTPCR法检测细胞内Cmyc的mRNA表达变化;Western blot法检测细胞内Cmyc的蛋白表达变化;流式细胞技术检测细胞凋亡情况;MTT法检测反义锁核酸的细胞毒性作用。
结果转染第5 d后,反义锁核酸组Cmyc mRNA相对表达量为(0.335±0.016),明显低于对照组(1.014±0.022),差异有统计学意义(P=0.015);Cmyc蛋白相对表达量为(0.448±0.037),也明显低于对照组(1.00±0.00),差异有统计学意义(P=0.008);细胞凋亡比例为(32±6)%,显著高于对照组(0),差异有统计学意义(P=0.032)。
结论针对Cmyc第二外显子翻译起始区的反义锁核酸能有效抑制肝癌细胞增殖和促进细胞凋亡。
【关键词】肝细胞癌;Cmyc基因;反义锁核酸;外显子2
中图分类号:R961文献标识码:ADOI:10.3969/j.issn.10031383.2017.01.001
Effects of Cmyc locked nucleic acid mediated by galactose ligand on proliferation and apoptosis of hepatoma carcinoma cell
[HJ1*2][HJ]
XIAO Shurong,DENG Yibin▲,XU Guidan,HUANG Zansong
(Center for Medical Laboratory Science, Affiliated Hospital of Youjiang Medical University for Nationalities, Baise 533000, China)
[HJ2][HJ]
【Abstract】ObjectiveTo observe effect of proliferationassociated gene Myc locked nucleic acid(LNA) on the second exon of translation initiation region on proliferation and apoptosis of hepatoma carcinoma cell.
MethodsAntisense oligonucleotides, phosphorothioate oligonucleotides and nucleic acids on the second exon of translation initiation region which could specifically block Cmyc mRNA were designed and synthesized. And transfection HepG2 cells were mediated by cationic galactose ligand, mRNA expression in Cmyc was detected by RTPCR, expression of Cmyc protein in cells was detected by Western blot method, cell apoptosis was detected by flow cytometry, and cytotoxicity of locked nucleic acid was detected by MTT, respectively.
Results5 days after transfection, relative expression of Cmyc mRNA levels in LNA group was (0.335±0.016), significantly lower than that (1.014±0.022) of control group, difference was statistically significant(P=0015). Relative expression quantity of Cmyc protein of the LNA group was (0.448±0.037), also significantly lower than that(1.00±0.00) of the control group, difference was statistically significant(P=0.008). The ratio of cell apoptosis in the LNA group was(32±6)%, statistically higher than that(0) of the control group,difference was statistically significant(P=0.032).
ConclusionAntisense locked nucleic acid that targeting at the translation initiation region of Cmyc exon 2 shows strong inhibitory effects on the proliferation and apoptosis of hepatocellular carcinoma cells.
【Key words】hepatoma carcinoma cell; Cmyc gene; LNA; exon2
原发性肝细胞癌(Hepatocellular carcinoma,HCC)是世界上最常见的恶性肿瘤之一,占我国肝癌的90%以上,严重威胁着人类的生命健康,自20世纪90年代起,我国肝癌死亡率上升为肿瘤的第二位。增殖相关基因(Cmyc)是细胞原癌基因之一,与肿瘤的发生发展关系密切,位于人类染色体8q24区,由3个外显子和2个内含子组成,其中第1个外显子无编码序列,只起调控作用,第2、3外显子共同编码包含439个氨基酸残基的蛋白质,该蛋白主要与Max形成异二聚体后再与DNA核心序列结合,调控基因转录与表达[1~3]。据此推测,针对Cmyc第二外显子翻译起始区设计合成反义锁核酸有可能会影响Cmyc mRNA及蛋白的表达,进而影响肿瘤细胞增殖和凋亡,从而发挥抗肿瘤作用。因此,在前期研究基础上[4~5],我们进一步设计合成能特异性封闭Cmyc基因mRNA第二外显子翻译起始区的反义锁核酸(locked nucleic acid,LNA),以阳离子半乳糖配体介导转染HepG2细胞,观察其对Cmyc基因mRNA及蛋白表达的影响,以期为抗肝癌基因治疗寻找一种新型分子药物。
1材料与方法
1.1材料
HepG2肝癌细胞株(中国人民解放军广州军区空军医院刘光泽博士惠赠)常规培养于含G418(380 ITI1)、10%胎牛血清的DMEM培养基中,37℃、5% CO2条件下5~6 d传代1次。DMEM培养基和G418购自Gibco公司;胎牛血清购自杭州四季清公司;阳离子半乳糖配体购自美国Invitrogen公司;RNA抽提试剂盒购自美国Sangon公司;寡聚脱氧胸腺嘧啶核苷酸、禽成髓细胞瘤病毒逆转录酶、RNA酶抑制剂、Taq酶、缓冲液、三磷酸脱氧核苷酸等购自日本TaKaRa公司;Annexin VFITC细胞凋亡检测试剂盒购自南京凯基生物公司;BCA Protein Assay Kit试剂盒、十二烷基磺酸钠(SDS)、硝酸纤维膜、ECL Western blotting Kit试剂盒等购自美国Sigma公司;实时定量PCR仪(美国ABI公司);FACS AriaTM流式细胞分析仪(美国BD公司);半干电转系统(美国BioRad公司)。
1.2方法
1.2.1反义LNA设计与合成
根据反义寡核苷酸作用原理及设计原则,利用RNAstructure 5.0 软件设计并筛选出一条总自由能最低的互补于Cmyc的mRNA第二外显子翻译起始区(368390 nt)的寡核苷酸片段,修饰如下:(1)LNA:5TGA△AGCT△ACCGT△ACT△ACGA△C3;(2)硫代寡核苷酸:5TGA#AGCT#ACCGT#ACT#ACGA#C3;(3)未修饰寡核苷酸:5TGA AGCTACCGTACTACGAC3;(4)无关序列:5CGC TATGTAATGCGCTATGG3。其中,△代表LNA修饰,#代表硫代修饰。各序列经BLAST排除与人同源后由Genelink公司合成修饰并纯化。
1.2.2实验设计与脂质体转染
实验设对照组和实验组。对照组包括空白对照组(半乳糖配体DMEM混合液)和无关序列组。实验组包括未修饰寡核苷酸组(ODN)、硫代寡核苷酸组(SODN)和反义锁核酸组(AntiLNA)。将HepG2细胞按1×105个/ml接种于16孔培养板,每孔100 μL,共设6个组,每组各设6个复孔,待细胞贴壁后,分别在各组每孔中加入含LNA(或寡核苷酸)的半乳糖配体DMEM混合液1 ml,培养后第5 d收集细胞进行mRNA、蛋白等指标检测。转染按脂质体说明书操作。
1.2.3Cmyc mRNA检测
(1)RNA提取:于细胞收集管中加入RNA抽提试剂1 ml,迅速置于冰上,加入0.2 ml氯仿,室温静置15 min,4℃ 12 000 rpm离心15 min;取上清液,加入0.5 ml异丙醇,室温静置10 min,4℃ 12 000 rpm离心10 min;弃上清液,加入75%焦碳酸二乙酯乙醇溶液1 ml,4℃ 7500 rpm离心5 min;弃上清液室温干燥5 min,溶于焦碳酸二乙酯无菌水中。(2)RNA逆转录:根据目的基因片段碱基序列利用软件设计并评价引物,交由上海英骏生物技术有限公司合成纯化。在微反应管中配制模板RNA和引物(各组均取上游引物)混合液,总体积为12 μL。65℃保温5 min后,冰上迅速冷却;加入2×PCR预反应液8 μL,轻轻混匀,室温静置10 min,移入42℃恒温箱中保温60 min后,升至70℃保温10 min,移到冰中冷却2 min。(3)cDNA扩增:上述反应管移入PCR扩增仪中,按Cmyc基因设计的上游引物为5TCAACGTTAGCTTCACCAAC3;下游引物为5TGGGCGAGCTGCTGTCGT3,产物长度为245 bp。反应条件:94℃预变性5 min,94℃ 30 s,58℃ 30 s,72℃ 1 min,共35个循环;72℃终延伸10 min。取PCR扩增产物进行琼脂糖凝胶电泳,并与内参βactin(550 bp)电泳条带比较,计算相对灰度比值。
1.2.4Cmyc蛋白检测
(1)总蛋白提取:收集细胞弃上清,用RIPA细胞裂解液(0.01 M Tris.HCl pH75,0.15M NaCl,1% Triton X100,0.1% SDS pH7.4,临用前加入1 mM PMSF 100 μmol/ml)重悬,转入Eppendorf管,冰上静置1 h,4℃ 12 000 rpm离心15 min。取上清于新Eppendorf管,用BCA Protein Assay Kit定量,于-70℃保存。(2)电泳:取30 μg蛋白质样品与缓冲液(100 mM Tris.HCl pH6.8,200 Mm DTT,4% SDS,0.2%溴酚蓝,20%甘油)混合煮沸5 min变性后点样于预先制备好的12% SDSPAGE电泳胶板上,30~40 mA电泳,当溴酚蓝到达胶板底部时停止电泳。(3)转膜:取预处理过的2张3MM滤纸和1张硝酸纤维膜,按下列顺序放入半干电转仪的正极板上:滤纸、凝胶、硝酸纤维膜、滤纸,接好负极板后,10~12 V电转30 min。(4)Western blot分析:采用ECL Western blotting Kit试剂盒进行检测,并利用凝膠图像分析系统曝光、拍照和定量分析。
1.2.5HepG2細胞凋亡检测
采用Annexin VFITC/PI双染色流式细胞技术检测HepG2细胞凋亡情况。根据双变量流式细胞仪的散点图来判断结果,左上象限(Q1)为损伤细胞,右上象限(Q2)为坏死细胞,左下象限(Q3)为活细胞,右下象限(Q4)为凋亡细胞。严格按试剂盒说明书和仪器说明书操作。
1.2.6反义LNA的细胞毒性检测
采用MTT比色法检测反义LNA对细胞活性的影响。
1.3统计学方法
所有数据采用均数±标准差(±s)表示,应用SPSS 19.0统计软件分析,组间比较采用重复测量单因素方差分析的LSD检验,检验水准:α=0.05,双侧检验。
2结果
2.1反义LNA对Cmyc mRNA表达的抑制作用
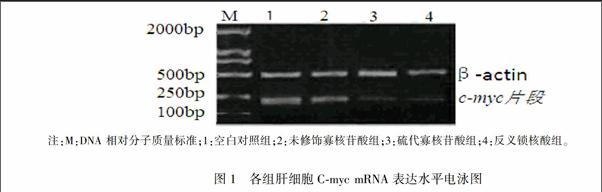
各组肝细胞Cmyc mRNA逆转录cDNA与内参βActin(设为1)灰度比值,1~4泳道分别为(1014±0022)、(0.843±0.028)、(0661±0021)和(0.335±0016),与对照组相比,硫代寡核苷酸组和反义锁核酸组肝细胞中Cmyc mRNA表达量均明显下调,其中反义锁核酸组下调尤为明显(P=0.015)。见图1。
注:M:DNA 相对分子质量标准;1:空白对照组;2:未修饰寡核苷酸组;3:硫代寡核苷酸组;4:反义锁核酸组。
图1各组肝细胞Cmyc mRNA表达水平电泳图
2.2反义LNA对Cmyc蛋白表达的抑制作用
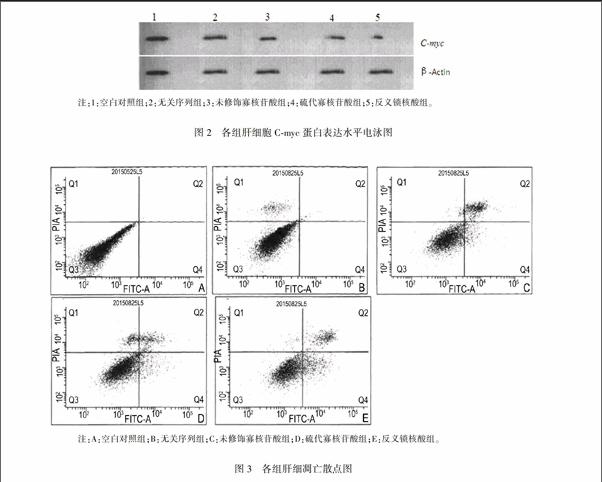
Western blot检测各组肝细胞中Cmyc蛋白相对表达量分别为(1.00±0.00)、(0.915±0.031)、(0.846±0041)和(0.448±0.037),与对照组相比,反义锁核酸组肝细胞中Cmyc蛋白相对表达量明显下降(P=0008)。见图2。
2.3反义LNA对HepG2细胞凋亡的影响
采用Annexin VFITC/PI双染色流式细胞技术检测HepG2细胞凋亡情况,结果发现转染第5 d后,凋亡细胞数比例,硫代寡核苷酸组(18±4)%和反义锁核酸组(32±6)%均显著高于对照组(0),差异有统计学意义(P=0.032),反义锁核酸组的细胞凋亡数比例更高一些。见图3。
2.4反义LNA对细胞的毒性作用
用药5 d后,采用MTT比色法测定各组A值,未修饰寡核苷酸组、硫代寡核苷酸组和反义锁核酸组的A值分别为(118±0.05)、(1.16±0.04)和(1.15±0.05),与空白对照组的(1.39±004)比较均无统计学意义(P>005)。
注:1:空白对照组;2:无关序列组;3:未修饰寡核苷酸组;4:硫代寡核苷酸组;5:反义锁核酸组。
图2各组肝细胞Cmyc蛋白表达水平电泳图
注:A:空白对照组;B:无关序列组;C:未修饰寡核苷酸组;D:硫代寡核苷酸组;E:反义锁核酸组。
图3各组肝细凋亡散点图
3讨论
目前认为,肿瘤细胞的恶性转化是一个由多细胞信号转导通路异常活化,使多种癌基因或抑癌基因表达异常,进一步促进癌症细胞异常增殖的多环节、多阶段、多步骤的复杂过程,而癌基因突变则是肿瘤细胞增殖的分子基础[6]。常见的癌基因有Cmyc、Nras(转化基因)等,其中Cmyc是新近研究发现的与肝细胞癌变密切相关的癌基因,是myc基因家族的重要成员之一,其编码蛋白属于核内转录因子,介导细胞生物信号转导,在细胞凋亡与增殖调控中发挥重要作用[7~8]。因而推测,封闭Cmyc第二外显子翻译起始区的基因表达有可能会影响Cmyc mRNA及蛋白的表达,进而可能会影响肿瘤细胞增殖和凋亡,从而发挥抗肿瘤作用。
本研究利用计算机辅助药物设计软件设计合成能特异性封闭Cmyc基因mRNA第二外显子翻译起始区的反义锁核酸片段,以阳离子半乳糖配体介导转染HepG2细胞,利用RTPCR、Western blot等分子生物学技术检测细胞内Cmyc mRNA及蛋白的表达情况,评估反义锁核酸的抗病毒效果。结果发现,反义锁核酸作用 5 d后,Cmyc mRNA及蛋白质表达均较对照组明显下降,差异有统计学意义(P<0.05),且细胞凋亡较对照组明显增多。这一结果与蒋建伟等[9]利用半乳糖配受体介导Cmyc反义寡核苷酸抑制肝癌移植瘤生长的研究结果基本一致,不同的是本研究所采用的锁核酸比寡核苷酸具有更强的抗核酸酶降解能力、热稳定性、分子杂交能力及脂溶性等优势,使锁核酸更容易穿过细胞膜进入细胞内,迅速精准识别并与靶基因位点结合,发挥“基因封闭”作用。此外,另一个不同点是本研究所封闭的基因位点为Cmyc基因第二外显子翻译起始区,封闭此位点可直接从翻译水平干扰Cmyc基因的表达,我们的实验结果也证实了这点。因此认为,针对Cmyc基因mRNA第二外显子翻译起始区的反义锁核酸可有效干扰Cmyc基因的表达,进而抑制肝癌细胞的增殖和促进癌细胞凋亡。
参考文献
[1]Cheng Q,Yuan F,Lu F,et al.CSIG promotes hepatocellular carcinoma proliferation by activating cMYC expression[J].Oncotarget,2015,6(7):17331744.
[2]Pannem RR,Dorn C,Ahlqvist K,et al.CYLD controls cMYC expression through the JNKdependent signaling pathway in hepatocellular carcinoma[J].Carcinogenesis,2014,35(2):461468.
[3]Chauhan A,Paul R,Debnath M,et al.Synthesis of fluorescent binaphthyl amines that bind cMYC Gquadruplex DNA and repress cMYC expression[J].J Med Chem,2016,59(15):72757281.
[4]罗艳红,邓益斌,邹佳峻. 反基因锁核酸体外阻断肝癌细胞系乙肝病毒S基因表达[J].基础医学与临床,2014,14(2):206210.
[5]Deng YB,Qin HJ,Luo YH,et al.Blocking the expression of hepatitis B virus S gene in hepatocellular carcinoma cell lines with anti gene locked nucleic acid in vitro[J].GENET MOL RES,2015,14(2):54455451.
[6]Ho C,Wang C,Mattu S,et al.AKT(vakt murine thymoma viral oncogene homolog 1) and NRas(neuroblastoma ras viral oncogene homolog)coactivation in the mouse liver promotes rapid carcinogenesis by way of mTOR(mammalian target of rapamycin complex 1),FOXM1(forkhead box M1)/SKP2,and Cmyc pathways[J].Hepatology,2012,55(3):833845.
[7]Xiao W,Wang J,Ou C,et al.Mutual interaction between YAP and Cmyc is critical for carcinogenesis in liver cancer[J].Biochem Bioplys Res Commun,2013,439(2):167172.
[8]Lin F,Ding R,Zhang S,et al.Decrease expression of microRNA744 promotes cell proliferation by targeting Cmyc in human hepatocellular carcinoma[J].Cancer Cell Int,2014,14:5860.
[9]蒋建伟,张洹.受体介导的Cmyc反义核酸抑制肝癌移植瘤生长[J].中国肿瘤临床,2006,33(22):13071311.
(收稿日期:2016-11-17修回日期:2016-12-30)
A:空白对照组;B:无关序列组;c:未修饰寡核苷酸组;d:硫代寡核苷酸组;e:反义锁核酸组。
图3 各组肝細胞凋亡散点图

