小麦TaLox-B等位变异对脂肪氧化酶活性和面粉色泽的影响
张福彦,陈锋,程仲杰,杨保安,范家霖,陈晓杰,张建伟,陈云堂,崔龙
(1河南省科学院同位素研究所有限责任公司/河南省核农学重点实验室,郑州 450015;2河南农业大学农学院/河南省粮食作物协同创新中心,郑州 450002)
小麦TaLox-B等位变异对脂肪氧化酶活性和面粉色泽的影响
张福彦1,陈锋2,程仲杰1,杨保安1,范家霖1,陈晓杰1,张建伟1,陈云堂1,崔龙1
(1河南省科学院同位素研究所有限责任公司/河南省核农学重点实验室,郑州 450015;2河南农业大学农学院/河南省粮食作物协同创新中心,郑州 450002)
【目的】小麦籽粒脂肪氧化酶(Lox)与面粉色泽密切相关,研究TaLox-B位点上的不同等位变异类型对Lox活性和面粉色泽的影响,为面粉色泽的改良和相关的品质育种工作提供参考依据。【方法】选用122份河南小麦品种(系)为试验材料,用紫外分光光度计和色差仪分别测定其Lox活性和面粉色泽,并利用控制脂肪氧化酶活性位于4BS上的TaLox-B1、TaLox-B2和TaLox-B3位点上的功能标记Lox16、Lox18和Lox-B23对参试材料的Lox基因型进行鉴定。【结果】不同品种间Lox活性及其色泽性状差异达到极显著水平。基因型鉴定结果表明,参试材料的TaLox-B1位点存在TaLox-B1a和TaLox-B1b两种等位变异,所占比例分别为63.9%和39.1%,TaLox-B2位点存在TaLox-B2a和TaLox-B2b两种等位变异,所占比例分别为57.4%和42.6%,TaLox-B3位点也存在TaLox-B3a和TaLox-B3b两种等位变异,所占比例分别为41.8%和48.2%。分析其基因型组合发现,参试材料中共有6种基因型组合类型,依次为TaLox-B1a/TaLox-B2a/TaLox-B3a、TaLox-B1a/TaLox-B2a/TaLox-B3b、TaLox-B1a/TaLox-B2b/ TaLox-B3b、TaLox-B1b/TaLox-B2a/TaLox-B3a、TaLox-B1b/TaLox-B2a/TaLox-B3b和TaLox-B1b/TaLox-B2b/ TaLox-B3b,所占比例分别为41.8%、15.6%、6.6%、28.7%、5.7%和1.6%。分析不同TaLox-B位点基因与Lox活性及红度(a*值)、黄度(b*值)、亮度(L*值)、白度(Wht值)等面粉色泽性状的关系表明,单基因等位变异对Lox活性和面粉色泽的影响不同,3个基因等位变异a*值差异均不显著,对Lox活性的效应,TaLox-B2a高于TaLox-B2b(P<0.05),TaLox-B3a高于TaLox-B3b(P<0.01),TaLox-B2a基因型的Wht值低于TaLox-B2b基因型(P<0.01),TaLox-B3a基因型的Wht值也低于TaLox-B3b基因型(P<0.05)。说明TaLox-B2和TaLox-B3对Lox活性和面粉色泽具有重要影响。进一步分析发现,拥有TaLox-B1a/TaLox-B2a/TaLox-B3a基因型组合的小麦品种(系)的Lox活性和b*值最高,a*值和Wht值最低,而TaLox-B1b/TaLox-B2b/TaLox-B3b基因型组合的小麦品种(系)的L*值、a*值和 Wht值最高,其 Lox活性和 b*值最低。【结论】河南小麦中所发现的 6种不同 Lox基因型组合中,拥有TaLox-B1a/TaLox-B2a/TaLox-B3a基因型组合的小麦品种(系)的Lox活性相对较高,Wht值相对较低(P<0.05),而拥有TaLox-B1b/TaLox-B2b/TaLox-B3b基因型组合的小麦品种(系)的Lox活性相对较低,Wht值相对较高(P<0.05)。Lox活性的遗传控制在面粉色泽品质改良进程中发挥着关键作用。
普通小麦;脂肪氧化酶基因;功能标记;面粉色泽;河南
0 引言
【研究意义】面粉色泽与其面制品的商品性能关系密切,是小麦重要的品质指标之一[1]。面粉中氧化酶类、黄色素以及蛋白质等对面粉色泽的影响较为明显[2],脂肪氧化酶(Lipoxygenase,Lox)是小麦中最为重要的氧化酶之一,对面粉和其面制品的表观色泽[3-4]、加工品质、营养品质以及储藏性能均具有重要影响[5-6],但目前对其研究仍不够深入。【前人研究进展】Lox是一种含有多聚不饱和脂类的酶蛋白,在动物、植物和微生物中普通存在,特别在植物种子含量较为丰富[7-8]。国内外学者关于Lox的研究广泛集中在大豆、大麦以及硬粒小麦等作物中,而在普通小麦中的相关研究相对较少。随着麦类作物中Lox相继被克隆和定位[9-11],有关普通小麦中 Lox的分子基础研究发展较为迅速。FENG等[12]在小堰54中同源克隆得到TaLox1和TaLox2,并分别将其定位在4DS和5DL染色体上,且发现在小麦籽粒 Lox活性方面,TaLox1比TaLox2的作用更加明显。之后,又利用大麦LoxB序列在普通小麦4A染色体上同源克隆发现TaLox3[13]。 GARBUS等[14]在普通小麦中克隆发现了与硬粒小麦中类似的Lpx-A1-like、Lpx-B1.2和Lpx-D1,并将其分别定位在4A、4B和4D染色体上。近年来,随着小麦基因组信息数据库的不断完善和同源克隆技术不断进步,普通小麦中Lox的克隆也取得快速发展。GENG等[15]和ZHANG等[16]利用同源克隆技术分别在普通小麦中 4B染色体上克隆得到 TaLox-B1、TaLox-B2和TaLox-B3。TaLox-B1全长4 289 bp,含有7个外显子和6个内含子,研究发现TaLox-B1存在TaLox-B1a和TaLox-B1b两种等位变异类型,且二者序列之间存在着单核苷酸多态性,根据其差异性开发了1对互补的共显性功能标记Lox16和Lox18[15]。相吉山等[17]和吴培培等[18]分别在普通小麦中对Lox16和Lox18功能标记进行实用性验证,发现此标记扩增条带清晰且稳定性好,能准确鉴定TaLox-B1a和TaLox-B1b类型,可基本满足小麦Lox活性辅助选择的需要。而ZHANG等[16]从普通小麦中克隆的TaLox-B2和TaLox-B3全长分别为4 267和4 246 bp,与TaLox-B1结构类似也均含有7个外显子和6个内含子,发现TaLox-B2存在TaLox-B2a和TaLox-B2b两种等位变异类型,分析发现TaLox-B2a与TaLox-B2b和TaLox-B3的gDNA序列相似性分别达到99.4%和85.1%,基于三者的gDNA序列的差异,开发共显性分子标记 Lox-B23,进一步研究发现Lox-B23标记在不同小麦品种(系)中存在多态性,且可以直接用PCR扩增的方法在不同材料中鉴定出TaLox-B2a、TaLox-B2b和TaLox-B3基因类型,进而筛选出高或低Lox活性优异种质资源直接应用于小麦育种。【本研究切入点】河南小麦生产在国家粮食安全中具有重要地位,河南小麦品种的遗传改良对河南乃至黄淮海地区的小麦生产发挥着不可估量的作用。截止目前,尽管已有关于对河南小麦籽粒硬度控制基因的相关报道,但有关脂肪氧化酶控制基因对Lox活性及面粉色泽的影响尚无报道。【拟解决的关键问题】本研究以122份河南小麦品种(系)为材料,利用功能标记Lox16、Lox18和Lox-B23对TaLox-B位点上的不同等位基因进行检测,同时利用分光光度计和色差仪对参试材料的Lox活性、L*值、a*值和b*值进行测定,分析河南小麦品种(系)中Lox等位变异的分布特征以及不同等位变异对Lox活性和面粉色泽的影响,旨在为培育出高白度面粉的小麦品种提供一些优异种质资源,也可为小麦Lox活性分子标记辅助育种提供参考依据。
1 材料与方法
1.1 试验材料
供试材料矮抗58、丰德存麦1号、富麦2008、豫同194、豫农211、周麦18、周麦32、郑麦366、秋乐2122、新麦20、温麦6号等122份河南小麦品种(系)来自河南省科学院同位素研究所小麦育种室收集的种质资源圃。这些材料涵盖了河南小麦主要种植区近20年来种植和使用的小麦品种(系)。2013—2014和2014—2015年度在河南省科学院新郑试验基地种植,每个材料种植3行,行长2 m,行距0.25 m,每行播50粒种子,定苗30株左右。田间管理同大田生产,正常成熟后及时收获。
1.2 表型测定
利用分光光度计法测定籽粒Lox活性,对参试材料每个品种(系)分别选取3粒较为完整、无明显破损的籽粒,重复3次,具体步骤参照ZHANG等[16]的测定方法。
取每份经过清选的种子0.5 kg,采用Chopin CD1型实验磨粉机(法国雷诺Chopin公司)对所有参试材料进行磨粉,详细方法参照陈锋等[19]方法进行。采用日本柯尼卡美能达公司生产的 CR-410色彩色差仪测定每个参试品种的色差仪参数,详细方法按照CR-410色彩色差仪的说明书进行,L*代表亮度轴,表示面粉的亮(白)度,其值越大,面粉越亮(白);a*代表面粉的红绿度,其值越大,面粉红度越高;b*代表黄蓝度,其值越大,面粉越黄。全部测试结果在2个月内完成。利用汪帆等[20]计算面粉亨特白度的方法计算参试材料面粉白度,其计算公式为:
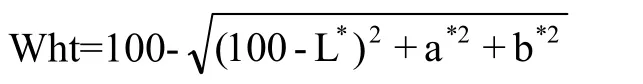
1.3 基因型鉴定
采用SLS(十二酰肌氨酸钠)快速提取小麦籽粒DNA法提取参试材料DNA,此方法是根据CHEN等[21]提取DNA的方法改进而成。
利用目前普通小麦中已开发 Lox功能标记检测对TaLox-B1、TaLox-B2、TaLox-B3的等位变异(表1)。PCR反应体系(20 μL)中含20 mmol·L-1KCl、20 mmol·L-1Tris-HCl(pH 8.4)、1.5 mmol·L-1MgCl2(pH 8.0)、200 μmol·L-1的dNTP、上下游引物各10 pmol·L-1、模板DNA 100 ng、Taq DNA聚合酶1.0 U(北京天根)。在Tprofessional standard型PCR仪(Biometra)中进行扩增,PCR反应程序参照GENG等[15]和 ZHANG等[16]扩增程序进行,反应程序结束后取5 μL PCR扩增产物用1.5%琼脂糖凝胶电泳分离、染色,用Fire Reader凝胶成像系统下扫描照相,并保存至计算机以备分析。

表1 普通小麦中检测TaLox-B位点不同等位变异的功能标记Table 1 Functional markers for detecting different alleles of TaLox-B genes in bread wheat
1.4 数据分析
利用Excel软件对所测定的Lox活性、L*值、a*值和b*值数据整理和分析,并对同一基因不同等位变异品种的表型进行t测验。利用SPSS 18.0软件对不同基因型组合品种的表型间进行差异显著性分析和方差分析(ANOVA),并利用LSD法进行多重比较。
2 结果
2.1 供试小麦品种(系)的Lox活性及面粉色泽性状分析
由表2可见,河南不同小麦品种(系)籽粒中Lox活性、面粉的L*值、a*值、b*值和Wht之间的差异极显著。供试材料的Lox活性平均值为72.70,变幅为58.60—84.51,变异系数为8.10%。面粉L*的平均值为95.15,变幅为93.16—96.35,变异系数为0.74%;面粉a*值变幅为-1.43—-0.03,变异系数为56.61%;面粉b*的平均值为8.51,在6.02—12.68范围内分布,变异系数为16.28%;而面粉Wht的平均值为90.18,变幅为86.03—92.86,变异系数为1.62%。由此可见,供试品种(系)间的Lox活性、面粉的L*值、a*值、b*值和Wht的差异较大,a*值的变异系数最大,变异最为丰富,其次为b*值和Lox活性;说明不同品种(系)间的面粉色泽参数也存在一定差异。
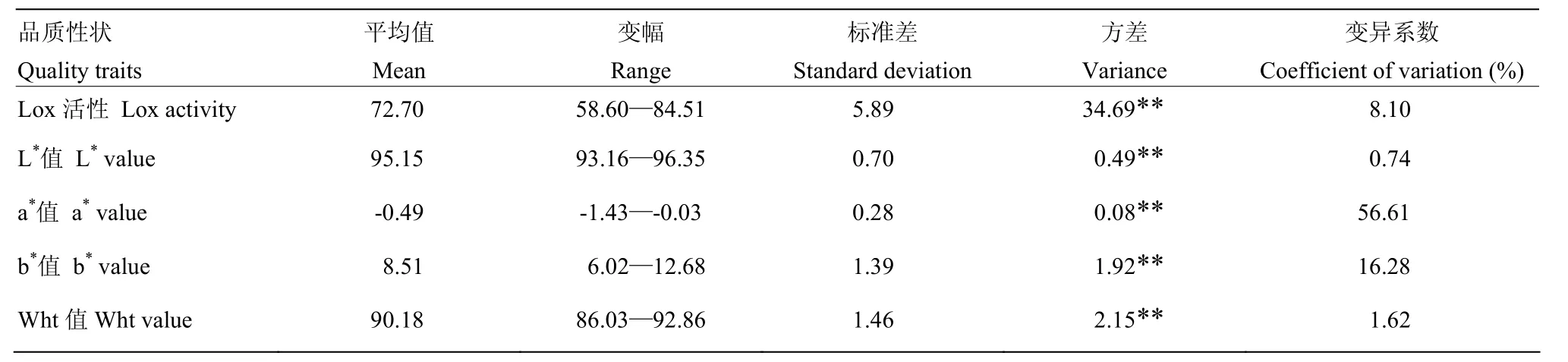
表 2 参试小麦品种(系)Lox活性及面粉色泽性状分析Table 2 Analysis of Lox activity and flour color traits in the cultivars and lines surveyed
2.2 Lox位点的多态性鉴定
利用Lox16和Lox18功能标记对所有参试材料进行检测TaLox-B1位点进行检测分析,结果表明,Lox16标记仅在郑麦9023、豫农211和豫同194等78份小麦品种(系)可扩增出489 bp的片段,属于TaLox-B1a类型(图1-A),而Lox18标记只在矮抗58、新麦9987和富麦2008等44份材料中可扩增出带型为791 bp的片段,属于TaLox-B1b类型(图1-B)。
用Lox-B23功能标记对122份小麦品种(系)进行检测(图2),发现豫农211、豫麦18和濮麦9号等70份材料中可扩增出带型为788 bp的片段,属于TaLox-B2a类型,而在偃展1号、兰考矮早8和新麦19等52份材料中扩增出带型为660 bp的片段,属于TaLox-B2b类型。TaLox-B3检测结果表明,矮抗58、豫麦47和泛麦5号等51份材料中扩增出677 bp的带型,属于TaLox-B3a类型,而余下的豫麦18、周麦22和郑麦004等71份材料中的TaLox-B3位点上没有扩增出任何带型,属于TaLox-B3b类型[16]。
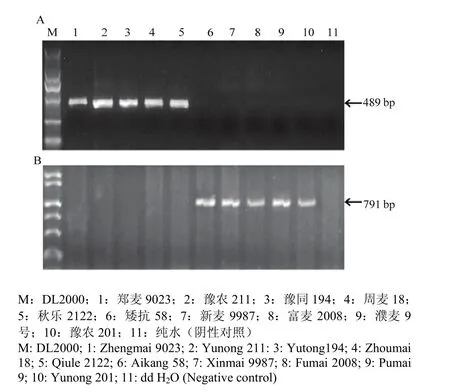
图1 Lox-16(A)和Lox-18(B)标记在部分参试小麦品种TaLox-B1位点上的扩增结果Fig. 1 Amplification of TaLox-B1 alleles by functional markers Lox 16 (A) and Lox 18 (B) in part common wheat cultivars

图 2 Lox-B23标记在不同小麦品种的扩增情况Fig. 2 Amplification of Lox genes by functional marker Lox-B23 in different common wheat cultivars
2.3 TaLox-B等位变异对Lox活性及面粉色泽的影响
在122份材料中,TaLox-B1、TaLox-B2和TaLox-B3位点上均检测到2种等位变异,发现a*值在检测所有等位变异中均无显著变化,说明TaLox-B位点上所有等位变异对面粉红度的影响均不明显。TaLox-B1和TaLox-B2上的不同等位变异对Lox活性、L*值、b*值以及 Wht值的影响也不尽相同,其中 TaLox-B1a和TaLox-B1b等位变异间只对 Lox活性有显著影响,TaLox-B2a和TaLox-B2b等位变异间在Lox活性、L*值、b*值以及 Wht值性状均存在显著性差异,而在TaLox-B3位点上,b*值、Wht值以及Lox活性在不同等位变异间也存在显著差异(表 3)。说明 TaLox-B位点上的3个基因的等位变异均会引起籽粒Lox活性的显著变化,而TaLox-B2和TaLox-B3等位变异也对面粉黄度和白度产生极其重要的影响。
2.4 TaLox-B等位变异组合对Lox活性及面粉色泽的影响
在所检测的122份小麦品种(系)中,TaLox-B1、TaLox-B2、TaLox-B3等位变异存在6种不同的组合类型,分别为TaLox-B1a/TaLox-B2a/TaLox-B3a、TaLox-B1a/TaLox-B2a/TaLox-B3b、TaLox-B1a/TaLox-B2b/TaLox-B3b、TaLox-B1b/TaLox-B2a/TaLox-B3a、TaLox-B1b/ TaLox-B2a/TaLox-B3b和TaLox-B1b/TaLox-B2b/TaLox-B3b,其品种(系)分别占参试材料的41.8%、15.6%、6.6%、28.7%、5.7%和1.6%(电子版附表1)。进一步分析不同组合类型与Lox活性及面粉色泽的关系表明,不同组合类型间L*值、a*值、b*值、Wht值以及Lox活性的差异显著。其中,拥有TaLox-B1a/TaLox-B2a/TaLox-B3a基因型组合的小麦品种(系)的 Lox活性和b*值最高,a*值和Wht值最低,而TaLox-B1b/ TaLox-B2b/TaLox- B3b基因型组合的小麦品种(系)的L*值、a*值和Wht值最高,而其Lox活性和b*值最低(表4)。说明TaLox-B位点上不同等位变异组合会引起面粉色泽和Lox活性的显著变化。同时还发现,参试的河南小麦品种(系)中,拥有低Lox活性、高白度的品种(系)所占的比例较低。
3 讨论
面粉色泽既是品质指标也是营养指标,一直以来中国居民消费以馒头、面条等面制食品为主,对白度要求较高,但是近年来随着人们对健康和食品安全重视,已不再过度追求高白度,市场上一些无漂白剂、营养价值高、色泽黄亮的面制食品也逐渐受到人们的青睐[22]。Lox活性过高或过低均对小麦面粉的色泽品质产生重要影响,Lox活性过高会加快氧化面粉中的类胡萝卜素、维生素等,促使面粉过度漂白而造成一些营养成分丧失[2];Lox活性过低则会影响面粉或面制品的色泽品质[4,23]。因此,研究Lox对籽粒Lox活性和面粉色泽的影响是非常必要的。同时,除了 Lox活性外,面粉及其面制品色泽也受到小麦籽粒中八氢番茄红素合成酶(Psy)、多酚氧化酶(Ppo)等其他酶活性、种皮颜色、储藏条件以及面制品加工工艺等多种因素影响,本文仅就Lox活性及其控制基因进行研究和讨论。
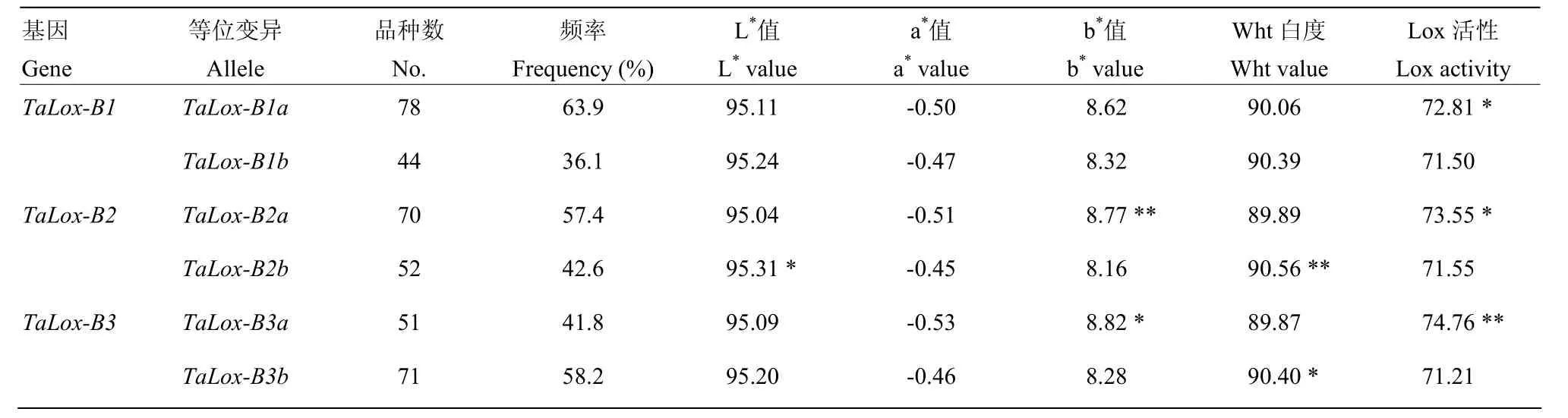
表 3 不同TaLox-B等位变异对Lox活性和面粉色泽的影响Table 3 The effect of alleles of different TaLox-B genes on Lox activities and flour colors

表 4 不同TaLox-B等位变异组合及其与Lox活性和面粉色泽差异Table 4 Lox activities and flour colors of different allelic combination on TaLox-B1, TaLox-B2 and TaLox-B3 loci
多数小麦品质性状属于数量性状,受基因型、外界环境、酸碱度、热敏感性等多种因素影响,且普遍存在基因与环境互作现象,但基因是影响小麦品质性状的决定性因素[24]。小麦籽粒Lox活性是一个复杂的数量性状,主要受4B染色体上的主效基因控制[25]。LEENHARDT等[26]研究发现不同染色体倍性的小麦籽粒中Lox活性显著不同,倍性越高的种属其Lox活性中含量也越高。吴培培等[18]和王慧等[27]研究认为不同生态环境对小麦Lox活性的影响存在较大差异,Lox活性在基因型间和环境间的差异呈极显著,且基因型效应 > 环境效应 > 基因型和环境互作效应,从而说明小麦Lox活性主要是受遗传因子控制。从本研究的表型结果来看,河南小麦品种的Lox活性绝大多数属于中间类型,且变异范围较小,拥有极高或极低Lox活性的品种较少。此外,籽粒Lox活性、面粉亮度、红度、黄度和白度在品种间均差异显著,这与前人研究结果基本一致[18,28]。因此,品种间具有遗传稳定性的品质性状显著差异也为筛选较高或较低的籽粒Lox活性种质资源创造了有利条件。
Lox活性是影响小麦品质性状的重要因素之一,前人在对小麦籽粒Lox活性进行定位的同时,发现一些与其紧密连锁的SSR标记,如Xbcd1262、Xksud2a、Xwmc312和Xgwm251等[29-30],但这些标记在实际应用中存在较大局限性。随着基因组学和现代分子生物技术的发展,小麦籽粒硬度、多酚氧化酶、麦谷蛋白亚基等品质性状以及小麦抗白粉病、穗发芽、锈病等抗性方面功能标记的开发较为迅速,目前已广泛应用于小麦分子标记辅助育种[31]。本研究选取GENG等[15]开发的共显性功能性标记Lox16和Lox18和ZHANG等[16]开发的Lox-B23功能性分子标记,从基因型的角度来分析小麦品种(系)的籽粒Lox活性和面粉色泽性状,结果发现河南小麦品种中,TaLox-B1、TaLox-B2、TaLox-B3位点共有6种等位变异组合类型,不同组合间的性状呈显著性差异,以 TaLox-B1a/TaLox-B2a/ TaLox-B3a基因型组合的Lox活性和黄度最高,红度和白度最低,而 TaLox-B1b/TaLox-B2b/TaLox-B3b基因型的具有最低的Lox活性和黄度,最高的亮度、红度和白度。同时发现,在TaLox-B1位点的不同等位变异间,河南小麦品种Lox活性存在显著性差异,而在其面粉黄度、白度等色泽参数的差异均不显著,这与相吉山等[28]研究的新疆小麦品种结果略有不同,可能由于环境地域间差异而造成的。
本研究选用了TaLox-B位点上的3个Lox,并利用其功能标记进行分子检测,结合其表型测定进行分析,结果发现少数品种基因型与Lox活性表型不一致的情况,推测这可能是在普通小麦形成过程中,Lox经过多次复制,在普通小麦中已经形成了一个多基因家族。
4 结论
河南小麦品种 TaLox-B位点上不同等位变异对Lox活性和面粉色泽的影响存在着明显差别,其中TaLox-B2对Lox活性、面粉亮度、黄度、白度均有显著影响,是影响Lox活性和面粉色泽的关键基因。参试材料中共有 6种 Lox基因型组合类型,其中TaLox-B1b/TaLox-B2b/TaLox-B3b等位变异组合是低Lox活性和高白度的优质基因型,所占比例仅为1.6%,而TaLox-B1a/TaLox-B2a/TaLox-B3a组合是高Lox活性和低白度的劣质基因型,所占比例高达41.8%。
[1] 胡新中, 卢为利, 阮侦区, 罗勤贵, 郑建梅, 欧阳韶晖, 张国权. 影响小麦面粉白度的品质指标分析. 中国农业科学, 2007, 40(6): 1142-1149.
HU X Z, LU W L, RUAN Z Q, LUO Q G, ZHENG J M, OUYANG S H, ZHANG G Q. Analysis of the quality indices affecting wheat flour whiteness. Scientia Agricultura Sinica, 2007, 40(6): 1142-1149. (in Chinese)
[2] BORRELLI G M, TROEEOLI A, FONZO N D, FARES C. Durum wheat lipoxygenase activity and other quality parameters that affect pasta color. Cereal Chemistry, 1999, 76(3): 335-340.
[3] LOISEAU J, VU B L, MACHEREL M H, DEUNFF Y L. Seed lipoxygeanses: Occurrence and functions.Seed Science Research, 2001, 11(3): 199-211.
[4] DONG Z Y, FENG B, LIANG H, RONG C W, ZHANG K P, CAO X M, QIN H J, LIU X, WANG T, WANG D W. Grain-specific reduction in lipoxygenase activity improves flour color quality and seed longevity in common wheat. Molecular Breeding, 2015, 35(7): 1-18.
[5] TRUFANOV V A, PERMYAKOVA M D, PSHENICHNIKOVA T A, ERMAKOVA M F, DAVYDOV V A, PERMYAKOV A V, BEREZOVSKAYA E V. The effect of intercultivar substitution of wheat Triticum aestivum L. Chromosomes on lipoxygenase activity and its correlation with the technological properties of flour. Applied Biochemistry and Microbiology, 2007, 43(1): 9l-97.
[6] PERMYAKOVA M D, TRUFANOV V A, PSHENICHNIKOVA T A, ERMAKOVA M F. Role of lipoxygenase in the determination of wheat grain quality. Applied Biochemistry and Microbiology, 2010, 46(1): 87-92.
[7] PORTA H, ROCHA-SOSA M. Plant lipoxygenases. Physiological and molecular features. Plant Physiology, 2002, 130(1): 15-21.
[8] LIAVONCHANKA A, FEUSSNER I. Lipoxygenases: Occurrence, functions and catalysis. Journal of Plant Physiology, 2006, 163(3): 348-357.
[9] VAN MECHELEN J R, SCHUURINK R C, SMITS M, GRANER A, DOUMA A C, SEDEE N J A, SCHMITT N F, VALK B E. Molecular characterization of two lipoxygenases from barley. Plant Molecular Biology, 1999, 39(6): 1283-1298.
[10] CARRERA A, ECHENIQUE V, ZHANG W, HELGUERA M, MANTHEY F, SCHRAGER A, PICCA A, CERVIGNI G, DUBCOVSKY J. A deletion at the Lpx-B1 locus is associated with low lipoxygenase activity and improves pasta color in durum wheat (Triticum turgidum spp. durum). Journal of Cereal Science, 2007, 45(1): 67-77.
[11] VERLOTTA A, SIMONE V D, MASTRANGELO A M, CATTIVELLI L, PAPA R, TRONO D. Insight into durum wheat Lpx-B1: A small gene family coding for the lipoxygenase responsible for carotenoid bleaching in mature grains. BMC Plant Biology, 2010, 10(1): 1.
[12] FENG B, DONG Z Y, XU Z B, AN X L, QIN H J, WU N, WANG D W, WANG T. Molecular analysis of lipoxygenase (LOX) genes in common wheat and phylogenetic investigation of LOX proteins from model and crop plants. Journal of Cereal Science, 2010, 52(3): 387-394.
[13] FENG B, DONG Z Y, XU Z B, WANG D W, WANG T. Molecular characterization of a novel type of lipoxygenase (LOX) gene from common wheat (Triticum aestivum L.). Molecular Breeding, 2012, 30(1): 113-124.
[14] GARBUS I, SORESI D, ROMERO J, ECHENIQUE V. Identification, mapping and evolutionary course of wheat lipoxygenase-1 genes located on the A genome. Journal of Cereal Science, 2013, 58(2): 298-304.
[15] GENG H W, XIA X C, ZHANG L P, QU Y Y, HE Z H. Development of functional markers for a lipoxygenase gene TaLox-B1 on chromosome 4BS in common wheat. Crop Science, 2012, 52(2): 568-576.
[16] ZHANG F Y, CHEN F, WU P P, ZHANG N, CUI D Q. Molecular characterization of lipoxygenase genes on the short arm of chromosome 4B in Chinese bread wheat (Triticum aestivum L.). Theoretical and Applied Genetics, 2015, 128(8): 1467-1479.
[17] 相吉山, 穆培源, 桑伟, 聂迎彬, 徐红军, 崔凤娟, 韩新年, 邹波.新疆小麦品种资源脂肪氧化酶活性TaLox-B1基因的分布特征研究.麦类作物学报, 2013, 33(24): 279-285.
XIANG J S, MU P Y, SANG W, NIE Y B, XU H J, CUI F J, HAN XN, ZOU B. Distribution characteristics of lipoxygenase gene TaLox-B1 in wheat varieties from Xinjiang. Journal of Triticeae Crops, 2013, 33(24): 279-285. (in Chinese)
[18] 吴培培, 宋双, 张福彦, 陈锋, 崔党群. 黄淮麦区部分小麦种质脂肪氧化酶活性分析及等位基因检测. 中国农业科学, 2015, 48(2): 207-214.
WU P P, SONG S, ZHANG F Y, CHEN F, CUI D Q. The allelic variation of lipoxygenase genes in bread wheat cultivars from the Yellow and Huai wheat areas of China. Scientia Agricultura Sinica, 2015, 48(2): 207-214. (in Chinese)
[19] 陈锋, 李欢欢, 张福彦, 尚晓丽, 许海霞, 崔党群. 小麦籽粒硬度基因鉴定及其与吹泡仪和混合仪参数关系分析. 作物学报, 2012, 38(5): 928-933.
CHEN F, LI H H, ZHANG F Y, SHANG X L, XU H X, CUI D Q. Association of wheat kernel hardness and puroindoline genes with alveographand mixolab parameters. Acta Agronomica Sinica, 2012, 38(5): 928-933. (in Chinese)
[20] 汪帆, 郑文寅, 黄建华, 王冠球, 崔文礼, 张文明, 姚大年. 20个小麦品种(系)籽粒LOX活性和类胡萝卜素含量及全麦粉色泽的研究. 麦类作物学报, 2012, 32(1): 68-73.
WANG F, ZHENG W Y, HUANG J H, WANG G Q, CUI W L, ZHANG W M, YAO D N. Lipoxygenase activity, carotenoids content and wholemill colors in grains of twenty wheat varieties. Journal of Triticeae Crops, 2012, 32(1): 68-73. (in Chinese)
[21] CHEN F, ZHANG F Y, XIA X C, DONG Z D, CUI D Q. Distribution of puroindoline alleles in bread wheat cultivars of the Yellow and Huai valley of China and discovery of a novel puroindoline a allele without PINA protein. Molecular Breeding, 2012, 29(2): 371-378.
[22] 张晓, 田纪春. 若干高白度小麦的色泽优势及形成因素分析. 中国农业科学, 2008, 41(2): 347-353.
ZHANG X, TIAN J C. The color advantage of Chinese wheat with high whiteness and analysis of factors affecting color formation. Scientia Agricultura Sinica, 2008, 41(2): 347-353. (in Chinese)
[23] 郑文寅,汪帆,司红起, 张文明, 姚大年. 普通小麦籽粒LOX、PPO活性和类胡萝卜素含量变异及对全麦粉色泽的影响. 中国农业科学, 2013, 46(6): 1087-1094.
ZHENG W Y, WANG F, SI H Q, ZHANG W M, YAO D N. Variations of LOX and PPO activities and carotenoid content as well as their influence on whole flour color in common wheat. Scientia Agricultura Sinica, 2013, 46(6): 1087-1094. (in Chinese)
[24] HRISTOV N, MLADENOV N, DJURIC V, KONDIC-SPIKA A, MARJANOVIC-JEROMELA A, SIMIC D. Genotype by environment interactions in wheat quality breeding programs in southeast Europe. Euphytica, 2010, 174(3): 315-324.
[25] 张福彦, 陈锋, 张建伟, 杨保安, 崔党群. 小麦籽粒脂肪氧化酶研究进展. 麦类作物学报, 2014, 34(8): 1067-1075.
ZHANG F Y, CHEN F, ZHANG J W, YANG B A, CUI D Q. Research advance of lipoxygenase (LOX) in wheat grains. Journal of Triticeae Crops, 2014, 34(8): 1067-1075. (in Chinese)
[26] LEENHARDT F, LYANA B, ROCKA E, BOUSSARDB A, POTUSB J, CHANLIAUDC E, REMESY C. Genetic variability of carotenoid concentration, and lipoxygenase and peroxidase activities among cultivated wheat species and bread wheat varieties. European Journal of Agronomy, 2006, 25(2): 170-176.
[27] 王慧, 郑文寅, 樊宏, 汪帆, 王青, 王冠球, 张文明, 姚大年. 不同小麦品种籽粒中LOX活性及基因型和环境互作分析. 中国粮油学报, 2011, 26(1): 11-14.
WANG H, ZHENG W Y, FAN H, WANG F, WANG Q, WANG G Q, ZHANG W M, YAO D N. Lipoxygenase activity and its genotype and environment interactions for different wheat varieties. Journal of the Chinese Cereals and Oils Association, 2011, 26(1): 11-14. (in Chinese)
[28] 相吉山, 穆培源, 桑伟, 徐红军, 聂迎彬, 崔凤娟, 庄丽, 韩新年,邹波. 新疆小麦Psy-A1、Ppo-A1、Ppo-D1、TaLox-B1等位变异对面粉色泽的影响. 作物学报, 2015, 41(1): 72-79.
XIANG J S, MU P Y, SANG W, XU H J, NIE Y B, CUI F J, ZHUANG L, HAN X N, ZOU B. Effects of Psy-A1, Ppo-A1, Ppo-D1, and TaLox-B1 alleles on flour color of Xinjiang wheats. Acta Agronomica Sinica, 2015, 41(1): 72-79. (in Chinese)
[29] PSHENIEHNIKOVA T A, OSIPOVA S V, PERMYAKOVA M D, MITROFANOVA T N, TRUFANOV V A, LOHWASSER U, RÖDER M, BÖRNER A. Mapping of quantitative trait loci (QTL) associated with activity of disulfide reductase and lipoxygenase in grain of bread wheat. Russian Journal of Genetics, 2008, 44(5): 567-574.
[30] GENG H W, ZHANG Y, HE Z H, ZHANG L P, APPELS R, QU Y Y, XIA X C. Molecular markers for tracking variation in lipoxygenase activity in wheat breeding. Molecular Breeding, 2011, 28(1): 117-126.
[31] LIU Y N, HE Z H, APPELS R, XIA X C. Functional markers in wheat: current status and future prospects. Theoretical and Applied Genetics, 2012, 125(1): 1-10.
(责任编辑 李莉)
Effects of TaLox-B Alleles on Lipoxygenase Activity and Flour Color in Wheats
ZHANG FuYan1, CHEN Feng2, CHENG ZhongJie1, YANG BaoAn1, FAN JiaLin1, CHEN XiaoJie1, ZHANG JianWei1, CHEN YunTang1, CUI Long1
(1Isotope Institute Co.,Ltd, Henan Academy of Sciences/Henan Key Laboratory of Nuclear Agricultural Sciences, Zhengzhou 450015;2Agronomy College, Henan Agricultural University/Collaborative Innovation Center of Food Crops in Henan Province, Zhengzhou 450002)
common wheat; lipoxygenase gene; functional marker; flour color; Henan
2016-11-08;接受日期:2016-12-15
河南省基础与前沿技术研究计划(162300410169)、河南省科技攻关计划(172102110069)、河南省小麦产业技术体系建设专项资金(Z2010-01-04)
联系方式:张福彦,E-mail:zhangfuyan704@163.com。通信作者张建伟,E-mail:zjw10308@163.com。通信作者陈锋,E-mail:chf0088@163.com
Abstract:【Objective】Lipoxygenase (Lox) is closely related to flour color. The objective of this study was to investigate the influence of different allelic variations at TaLox-B loci on Lox activity and flour color in wheat to provide a theoretical basis for improving flour color and related quality traits in breeding programs.【Method】A total of 122 wheat cultivars and advanced lines from Henan province were used to measure the Lox activities and flour color by spectrophotometer and colorimeter. The functional markers Lox16, Lox18 and Lox-B23 were used to identify the polymorphism of the Lox genes on chromosome 4BS in current Henan wheat cultivars and advanced lines.【Result】There were significant differences of Lox activities, L*, a*and b*values as well as Wht data among different cultivars. Genotyping results indicated two alleles TaLox-B1a and TaLox-B1b at TaLox-B1 locus in these wheat varieties, with 63.9% and 39.1%, respectively. At TaLox-B2 locus, two alleles TaLox-B2a and TaLox-B2b were identified by the functional marker Lox-B23, with 57.4% and 42.6%, respectively. It was also found two alleles TaLox-B3a and TaLox-B3b at the TaLox-B3 locus, with 41.8% and 48.2%, respectively. Six allele combinations of Lox genes, i.e., TaLox-B1a/TaLox-B2a/TaLox-B3a, TaLox-B1a/TaLox-B2a/TaLox-B3b, TaLox-B1a/TaLox-B2b/TaLox-B3b, TaLox-B1b/TaLox-B2a/TaLox-B3a, TaLox-B1b/TaLox-B2a/ TaLox-B3b and TaLox-B1b/TaLox-B2b/TaLox-B3b were found with 41.8%, 15.6%, 6.6%, 28.7%, 5.7% and 1.6%, respectively. Analysis of association of Lox alleles at different TaLox-B loci and Lox activities and flour color parameters indicated that the allelic variation at a single locus showed diverse effects on Lox activities and flour color. For a*value, the allelic effect was not significant. For Lox activities, the order of effect was TaLox-B2a > TaLox-B2b (P<0.05), TaLox-B3a > TaLox-B3b (P<0.01). The Wht value of TaLox-B2a was significantly lower than that of TaLox-B2b (P<0.01), and TaLox-B3a showed also a significant lower Wht value than TaLox-B3b (P<0.05). These results suggest that TaLox-B2 and TaLox-B3 significantly affect Lox activities and flour color. Further analysis found that the genotype TaLox-B1a/TaLox-B2a/TaLox-B3a had the highest Lox activity and b*and the lowest a*and Wht value, and TaLox-B1b/TaLox-B2b/TaLox-B3b had the lowest Lox activity and b*and the highest L*, a*and b*values. 【Conclusion】Among the 6 different combinations of three Lox genes in Henan wheat varieties, the genotype TaLox-B1a/TaLox-B2a/TaLox-B3a possess the highest Lox activity and the lowest Wht value (P<0.05), and wheat cultivars with TaLox-B1b/TaLox-B2b/TaLox-B3b have the lowest Lox activity and the highest Wht value (P<0.05). Therefore, the genetic control of Lox activities plays a key role in the improvement of wheat quality.

