捻转血矛线虫Hc-daf-22基因的原核表达及重组蛋白酶活性测定
郑秀平,丁豪杰,郭筱璐,杨怡,黄艳,陈学秋,周前进,杜爱芳
(1浙江大学动物科学学院/浙江省动物预防医学重点实验室,杭州 310058;2宁波大学生物技术系,浙江宁波 315211)
捻转血矛线虫Hc-daf-22基因的原核表达及重组蛋白酶活性测定
郑秀平1,丁豪杰1,郭筱璐1,杨怡1,黄艳1,陈学秋1,周前进2,杜爱芳1
(1浙江大学动物科学学院/浙江省动物预防医学重点实验室,杭州 310058;2宁波大学生物技术系,浙江宁波 315211)
【目的】捻转血矛线虫(Haemonchus contortus)是反刍动物主要的胃肠道线虫之一,该病在中国呈全国性流行。为研究捻转血矛线虫(Haemonchus contortus)脂肪酸代谢相关蛋白DAF-22的生化特性,对其基因进行了克隆、原核表达,并对重组蛋白进行了体外酶活性测定。以期了解捻转血矛线虫Hc-DAF-22蛋白在过氧化物酶体脂肪酸β氧化中的作用。【方法】根据NCBI公布的H. contortus ZJ株daf-22 cDNA序列(GenBank:HQ738470.1)设计特异性引物,克隆Hc-daf-22基因并构建重组质粒pET-22b-Hc-daf-22, 经测序鉴定正确后将其转化E. coli BL21,经终浓度为0.1 m mol·L-1IPTG(isopropyl-β-d-thiogalactoside)诱导表达4h,离心菌液,50 mmol·L-1浓度的PBS溶液重悬菌体溶液,冰浴超声破碎后上清沉淀分别进行SDS-PAGE分析。超声破碎后产物以镍柱亲和色谱法分离纯化重组蛋白Hc-DAF-22,并用SDS-PAGE检测蛋白纯化情况及以抗His血清作为一抗Western Blot鉴定。纯化后蛋白用超滤管浓缩除去盐分,并按照蛋白浓度测定试剂盒进行蛋白浓度测定。利用天然状态下的乙酰乙酰CoA(AcAc-CoA)分子会发生酮-烯醇互变形成烯醇化合物特性,酶活试验以乙酰乙酰辅酶a为底物建立标准曲线。硫解酶体外测活体系为(50 mmol·L-1Tris-Cl pH 8.1,20 mmol·L-1MgCl2,60 μmol·L-1CoA,10 μmol·L-1AcAc-CoA,加入约0.1 μg蛋白),通过记录反应过程中由于底物(AcAc-CoA)的减少而引起303 nm波长下的吸收值的变化,从而计算出硫解反应的初始反应速率,最终确定复性后的Hc-DAF-22的硫解酶活性。在相同条件下,取AcAc-CoA底物浓度为10μmol·L-1的反应体系(50 mmol·L-1Tris-Cl pH 8.1,20 mmol·L-1MgCl2,60 μmol·L-1CoA,10 μmol·L-1AcAc-CoA,加入约0.1 μg蛋白于室温起始反应),分别调节反应体系的温度及pH梯度,确定Hc-DAF-22最佳酶活反应温度及pH条件。【结果】成功克隆Hc-daf-22基因,测序结果与NCBI已公布的 H. contortus ZJ株 Hc-daf-22基因序列比对基因相似度为 99.9%,并实现重组子pET-22b-Hc-daf-22在 E. coli BL21体内进行表达,表达产物经 SDS-PAGE和 Western Blot检测显示,pET-22b-Hc-daf-22基因在大肠杆菌中成功表达,呈部分可溶性,融合蛋白的分子量约为59 kD,测得蛋白浓度为 1.70 μg·μL-1;针对该表达产物的酶活分析结果表明,原核表达的 Hc-DAF-22具有一定的硫解酶活性,其最适反应pH为8.0,最佳反应温度为37℃,酶学常数Km值和Vmax值分别为33.765 μmol·L-1和1 784 nmol·L-1·min-1。【结论】捻转血矛线虫DAF-22是过氧化物酶体脂肪酸β氧化的关键酶之一,本试验通过体外酶活试验成功测定Hc-DAF-22蛋白的酶活性,证明Hc-DAF-22具有一定硫解酶活性,但与秀丽隐杆线虫(Caenorhabditis elegans)同源蛋白相比硫解酶活性较低。
捻转血矛线虫;Hc-daf-22;原核表达;酶活测定;β氧化
0 引言
【研究意义】捻转血矛线虫(Haemonchus contortus)是反刍动物主要的胃肠道线虫之一,属毛圆科血矛属,成虫主要寄生于牛羊的真胃中。其引起的疾病以消瘦、贫血以及慢性消耗性症状为主,在感染严重的情况下可引起大批死亡[1]。该病在中国呈全国性流行,感染率在26.4%—80%之间[2-3]。目前捻转血矛线虫病的防控仍然是以药物预防为主,但线虫耐药问题的日益严重[4],因此迫切需要新型抗线虫药物缓解现状。近年来,药物靶标的筛选已成为药物开发的主流方向[5],而药物靶标的功能分析是其中重要的一环。理想的药物靶标通常存在于病原体感染、存活以及繁殖过程中所必需,而与宿主有明显区别的代谢通路中[6]。寄生线虫需氧的营自由生活与微氧的寄生生活两个阶段决定了其具有不同的脂肪酸代谢与能量代谢方式;尤其寄生生活阶段,线虫在宿主体外发生的脂肪酸β-氧化等生理过程将会因宿主体内的微氧环境而受到抑制,糖酵解成为寄生阶段线虫获能的主要方式[7-8]。因而线虫独特的脂肪酸代谢机制为新型药物的研发提供了潜在的药物靶位点。【前人研究进展】寄生线虫寄生阶段不能通过实验室进行模拟,使得有关真核生物代谢通路的机制研究均不能在其体内有效开展。秀丽隐杆线虫(Caenorhabditis elegans)主要通过滞育信息素感知外界环境,决定生长发育的方向[9-10]。其中,过氧化酶体的脂肪酸β-氧化过程是滞育信息素合成的主要途径[11]。长链脂肪酸或超长链脂肪酸依次在酰基辅酶 A氧化酶 ACOX-1、水合酶MAO-1、β-羟烷基辅酶A脱氢酶Ce-DHS-28及硫解酶Ce-DAF-22[12]催化的级联反应下逐步水解并生成滞育信息素。DAF-22作为脂肪酸代谢中过氧化物酶体 β-氧化的关键酶,对秀丽隐杆线虫的生存非常重要,若此过程不能进行即不能产生相应的滞育素来感知外界环境[12-14]。在这一过程中,Ce-DAF-22主要是将由脱氢酶 Ce-DHS-28催化生成的 β-酮脂酰辅酶 A 中间体硫解[15]。Ce-DAF-22功能缺失的线虫突变株不能合成滞育信息素,且虫体内出现大量的脂肪酸积聚,呈现病态[16]。已有研究报道分离自捻转血矛线虫体内的Hc-DAF-22是DAF-22的同源类似物,初步的研究表明 Hc-daf-22能够一定程度上补偿秀丽隐杆线虫因daf-22缺失引起的生理缺陷[17],猜测Hc-daf-22在捻转血矛线虫体内可能具有与daf-22相似的功能能明显改变该线虫的滞育表型,而且这个改变伴随有线虫体内脂肪颗粒积聚量的变化。而越来越来多的实验表明Hc-DAF-22可能作为关键酶参与了线虫的长链脂肪酸代谢,控制着线虫的发育[18]。分析发现 Hc-DAF-22的 N末端具有典型的参与长链脂肪酸代谢的 I 型脂肪酸硫解酶(即3-酮脂酰辅酶A硫解酶)功能域,在C末端具有典型的酰基辅酶A转移酶的保守功能域,推测具有类似于Ce-DFA-22硫解酶活性的潜力。【本研究切入点】目前对捻转血矛线虫 Hc-daf-22研究较多,对其Hc-DAF-22蛋白活性研究较少,本研究拟在已有研究基础上生物体外利用酶学相关技术研究Hc-DAF-22的硫解酶活性。【拟解决的关键问题】为进一步明确 Hc-daf-22的可能的生物学功能,通过对原核表达的Hc-DAF-22蛋白进行了体外酶活试验,确定 Hc-DAF-22蛋白的硫解酶活性,为进一步研究Hc-DAF-22蛋白的生物学功能奠定了基础。
1 材料与方法
试验于2015年5月至2016年12月在浙江大学预防兽医研究所寄生虫病理生物学研究室进行。
1.1 虫体、菌株与质粒
捻转血矛线虫ZJ株成虫由浙江省动物预防医学重点实验室分离,鉴定并保存;质粒pET-22b(+)vector、菌株E. coli TOP10和E. coli BL21(DE3)由浙江省动物预防医学重点实验室制备并保存;和质粒pMD19-T vector购自宝生物工程(大连)有限公司(TaKaRa)。
1.2 试剂与试剂盒
T4 DNA连接酶、TaKaRa LA TaqTM酶、限制性内切酶EcoRⅠ和SalⅠ等购自宝生物工程(大连)有限公司(TaKaRa)。质粒抽提试剂盒、DNA凝胶回收试剂盒均购自Axygen公司。乙酰乙酰辅酶a、辅酶a均购自Sigma公司;Millipore超滤管、Bio-Rad蛋白浓度测定试剂盒购自Promega公司;Ni-NTA亲和色谱树脂购自Qiagen公司。
1.3 捻转血矛线虫Hc-daf-22基因的克隆
根据NCBI已公布的H. contortus ZJ株Hc-daf-22基因序列(GenBank登录号:HQ738470.1)设计特异性引物,具体引物序列为Hc-daf-22-F: CGCGAATTC TAAATGGGTAAATCAAAAGTATATGT(下划线为限制性内切酶 EcoRⅠ的识别位点),Hc-daf-22-R: GCCGTCGAC GATTTTCGCTTTGAGCATTT(下划线为SalⅠ的识别位点),引物序列由生工生物工程(上海)有限公司合成。以捻转血矛线虫 RNA反转录的cDNA为模板,用LA TaqTM酶扩增,PCR条件:94℃5 min;94℃ 30 s;62℃ 30 s;72℃ 90 s;32个循环;72℃延伸10 min。PCR产物连接至pMD19-T载体,再将连接产物转入E. coli TOP10感受态细胞中,菌液PCR鉴定阳性菌落,将阳性菌液送至上海博尚生物技术有限公司测序分析。
1.4 捻转血矛线虫 Hc-DAF-22表达载体的构建及原核表达
选取测序正确的pMD19-T-daf22质粒与pET-22b质粒,同时用限制性内切酶EcoRⅠ和SalⅠ双酶切后回收目的片段与载体,用T4 DNA连接酶进行连接,继而转入E. coli TOP10感受态细胞,挑取克隆经PCR鉴定后,阳性克隆抽提质粒后用限制性内切酶 EcoRⅠ和SalⅠ双酶切鉴定。双酶切鉴定正确的重组质粒转化至表达型大肠杆菌株BL21(DE3),鉴定为阳性克隆的菌种于20%甘油中-80℃保存。
将BL21接种于200 mL(Amp 100mg·L-1)LB培养基中,30℃培养3h左右,至菌液OD600为0.6左右时,加入IPTG至终浓度为0.1 mmol·L-1。诱导表达4 h,完成后将培养基在4℃以8 000×g 离心10 min, 弃上清,用50 mmol·L-1PBS 缓冲液(pH=7.4)重悬细胞,冰浴条件下超声波破碎细胞。细胞破碎完成后,12 000×g,4℃离心30 min,收集上清。分别取10 μL上清液与沉淀液进行SDS-PAGE电泳检测表达情况。
1.5 捻转血矛线虫Hc-DAF-22蛋白的分离纯化
收集含DAF-22蛋白组分的细胞破碎上清液,加入到用PBS(pH=7.4)预先平衡的镍琼脂糖凝胶柱中,控制流速1 mL·min-1。经PBS平衡后用含不同浓度咪唑的缓冲液进行阶段洗脱,流速2 mL·min-1,收集洗脱液。含有目的蛋白的洗脱成分用超滤管过滤,收集除盐浓缩后的蛋白,SDS-PAGE检测蛋白回收情况。验证后,将纯化的Hc-DAF-22蛋白经SDS-PAGE电泳后,转至聚偏二氟乙烯(PVDF)膜上,经5%脱脂乳封闭,以抗His血清为一抗,羊抗兔HRP-IgG(1﹕4 000)为二抗,通过DAB底物显色进行Western Blot鉴定。按照Bio-Rad公司蛋白浓度测定试剂盒进行蛋白浓度测定。
1.6 酶活标准曲线的绘制
天然状态下的乙酰乙酰CoA(AcAc-CoA)分子会发生酮-烯醇互变形成烯醇化合物,该烯醇化合物能与 Mg2+结合后在 303 nm 处形成特征吸收峰(ε303=16.5 mM-1cm-1)[19]。将乙酰乙酰辅酶A(AcAc-CoA)配制成0、3、6、9、12、15 μmol·L-1等4个浓度梯度分别加入20 mmol·L-1MgCl2。测定不同浓度在303 nm 波长处的吸光值,根据吸光值与 AcAc-CoA浓度关系绘制AcAc-CoA标准曲线,按照AcAc-CoA标准曲线计算出反应产物浓度。
1.7 Hc-DAF-22蛋白酶活测定
我们利用AcAc-CoA烯醇化合物这一特征和硫解酶体外测活体系(50 mmol·L-1Tris-Cl pH8.1,20 mmol·L-1MgCl2,60 μmol·L-1CoA,10 μmol·L-1AcAc-CoA,加入约0.1 μg蛋白),通过记录反应过程中由于底物(AcAc-CoA)的减少而引起303 nm波长下的吸光值的变化,从而计算出硫解反应的初始反应速率。酶促反应的方程式如下所示:
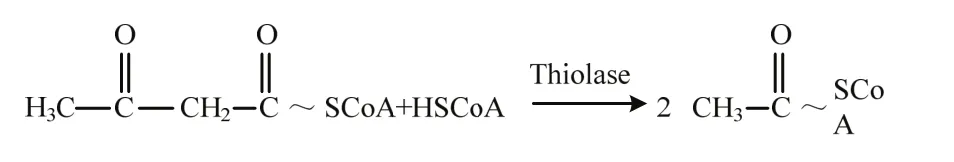
1.7.1 Hc-DAF-22蛋白最适温度及最适 pH的确定在相同条件下,取AcAc-CoA底物浓度为10 μmol·L-1的反应体系(50 mmol·L-1Tris-Cl pH8.1,20 mmol·L-1MgCl2,60 μmol·L-1CoA,10 μmol·L-1AcAc-CoA,加入约0.1 μg蛋白于室温起始反应),调节反应体系的反应温度,设置温度梯度为32.0、33.0、35.0、37.0、38.0、39.0、40.0℃。震荡反应30min,反应完成后,测定不同温度条件下反应体系的 OD303值。同理,在测得的最适温度条件下,调节反应体系的 pH,设置pH梯度为7.0、7.5、8.0、8.5、9.0、9.5和10.0,反应完成后测定不同pH条件下反应体系的OD303值。
1.7.2 Hc-DAF-22蛋白 Km与 Vmax的确定 在最适 pH和最适温度条件下,在其他反应体系一致的情况下,AcAc-CoA浓度分别设置为 15、30、40、100、150 μmol·L-1的底物溶液中分别加入0.1 μg重组蛋白溶液,进行多次酶促反应。每隔1 min测定一次反应体系的OD303值。根据酶促反应数据计算出初始反应速率,进一步计算得到初始反应速率倒数1/v与底物浓度倒数1/[S],然后以1/[S]对1/v作图,根据直线斜率和截距得出米氏常数Km与Vmax[20]。
2 结果
2.1 Hc-daf-22基因的克隆及其鉴定
以捻转血矛线虫成虫mRNA逆转录的cDNA为模板,PCR扩增Hc-daf-22。1%琼脂糖凝胶电泳分析显示,在1 500 bp附近有单一明显的条带,大小与预期片段一致(图1-A),测序结果与NCBI已公布的H. contortus ZJ株Hc-daf-22基因序列比对基因相似度为99.9%。
选择pET-22b-Hc-daf22阳性克隆用EcoRⅠ和SalⅠ限制性内切酶双酶切鉴定。酶切后,获得约1 500 bp的片段与约 4 000 bp的片段,与预期结果相符(图1-B),证明Hc-daf22已正确转入pET-22b中。
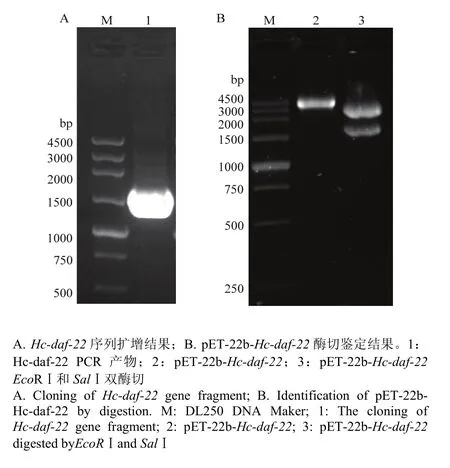
图1 Hc-daf-22序列扩增结果及pET-22b-Hc-daf-22酶切鉴定Fig. 1 Cloning of Hc-daf-22 gene fragment and identification of pET-22b-Hc-daf-22 by digestion
2.2 Hc-DAF-22蛋白的表达,纯化及其鉴定
2.2.1 Hc-DAF-22蛋白诱导表达 将带有Hc-daf-22-pET-22b重组质粒的E. coli BL21菌液扩大培养,经IPTG诱导表达4 h,离心菌液,50 mmol·L-1浓度的PBS溶液重悬菌体溶液,冰浴超声破碎后分别进行 SDSPAGE分析。根据Hc-daf-22-pET-22b质粒的载体图,利用 EditSeq软件预测融合表达蛋白分子量约为 59 kD,SDS-PAGE结果显示蛋白条带大小与软件预测的结果一致,在上清和沉淀中均有表达,呈部分可溶(图3)。
2.2.2 Hc-DAF-22蛋白分离纯化及鉴定 收集亲和色谱纯化后的目标蛋白,SDS-PAGE检测蛋白纯化情况。经纯化超滤的重组蛋白如图3-A,蛋白大小与预期一致为59 kD,且浓度较高无杂带。重组蛋白以抗His血清作为一抗Western Blot鉴定,结果显示蛋白大小与预期一致为59 kD(图3-B)。蛋白浓度测定按照蛋白浓度测定试剂盒进行,测得蛋白浓度为1.70 μg·μL-1。说明纯化的可溶性蛋白浓度较高,可用于后续酶活性测定。

图2 Hc-DAF-22重组蛋白在大肠杆菌BL21菌株中的诱导表达情况Fig. 2 Hc-DAF-22 protein expressed in E. coli strains BL21
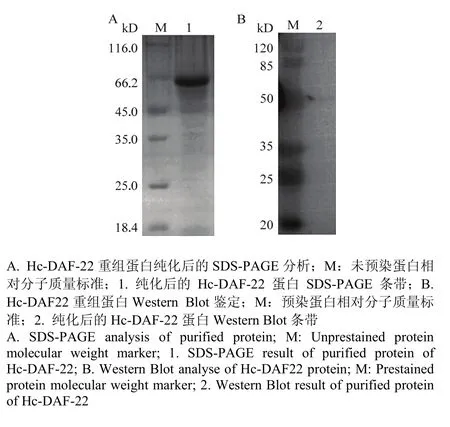
图 3 Hc-DAF-22重组蛋白纯化后的 SDS-PAGE分析及Western Blot鉴定Fig. 3 SDS-PAGE analysis of purified protein and Western blot analysis
2.3 Hc-DAF-22蛋白酶活性测定
2.3.1 乙酰乙酰辅酶a标准曲线的绘制 按照文献[19]所述,以底物乙酰乙酰辅酶 a为标准物,测定其不同浓度对应的吸光值,绘制浓度标准曲线。如图4-A所示,绘制的标准曲线R2=0.99289,满足试验要求。试验中可通过OD值的变化判断AcAc-CoA的反应量,进而推测Hc-DAF-22催化下的反应速率。
2.3.2 Hc-DAF-22蛋白酶活性反应最适温度确定
在反应体系与其他反应条件一致的情况下,如图 4-B所示,在37℃反应条件下,Hc-DAF-22蛋白活性最高,说明其最佳反应温度为37℃。并且在32—39℃温度区间,蛋白酶活性先升高后降低,且保持在80%以上;当温度达 40℃时,其蛋白活性仅剩 40%左右,说明40℃对蛋白酶活性有较大影响,该蛋白酶不耐高温。
2.3.3 Hc-DAF-22蛋白酶活性反应最适pH确定 在37℃反应温度下,不同 pH条件下测定酶活,数据如图4-C所示。可知,pH从中性到碱性的变化过程中,酶的活性先升高后降低,在 pH=8.0的弱碱性环境中达到最大活性。因此,说明Hc-DAF-22蛋白偏好在弱碱环境中发挥活性,当pH为8.0时,该蛋白酶活性最强;当pH继续升高时,该酶活性不断下降,在pH为10时,酶活性接近0,说明强碱对酶活性有抑制性作用。
2.3.4 不同底物浓度下,Hc-DAF-22酶活性测定 测定不同底物浓度下Hc-DAF-22酶反应速率,运用浓度速度双倒数做图,结果如图4-D所示。根据方程计算,可得Vmax=1 784 nmol·L-1·min-1,Km=33.765 μmol·L-1。
3 讨论
目前,关于寄生性线虫脂肪酸代谢通路研究较少,但已有研究在捻转血矛线虫发现与秀丽线虫硫解酶基(Ce-daf-22)具有高同源性的新基因Hc-daf-22,预测编码的氨基酸同源性为 83%[20]。因此,推测捻转血矛线虫存在与秀丽线虫相似的过氧化物酶体β-氧化过程。本试验成功克隆捻转血矛线虫Hc-daf-22,并在大肠杆菌原核表达系统中表达。选择pET-22b作为表达载体,在低温条件下诱导有利于融合蛋白的表达,在一定程度上可增加表达蛋白的可溶性[21],本研究获得 pET-22b-Hc-daf-22可溶性重组蛋白。
在模式生物C. elegans体内,Ce-DAF-22通过参与过氧化酶体长链脂肪酸代谢途径从而影响脂肪颗粒的体内积聚而改变虫体的发育方向[22-23]。分析发现Hc-DAF-22的N末端具有典型的参与长链脂肪酸代谢的I型脂肪酸硫解酶(即3-酮脂酰辅酶A硫解酶)功能域,在C末端具有典型的酰基辅酶A转移酶的保守功能域,具有类似于 Ce-DAF-22硫解酶活性的潜力[24]。由此推测在H. contortus体内同样存在与上述C. elegans相似的脂肪酸代谢途径,而 Hc-DAF-22具有长链脂肪酸硫解酶活性,参与线虫生活方式的某些剧变过程,参与决定虫体进入寄生阶段后的发育方向,而参与滞育形成只是其影响虫体生长发育的表现之一[25]。本试验参照C. elegans硫解酶测定方法[26]对Hc-daf-22硫解酶活性进行体外测定,了解Hc-DAF-22硫解酶活性及其他生化特性,并比较秀丽线虫与捻转血矛线虫DAF-22硫解酶活性差异。体外酶活测定试验结果显示,Hc-DAF-22 最佳反应pH为8.0,此结果与李志杰[27]研究秀丽线虫 Ce-DAF-22蛋白酶活所得结果一致,且哺乳动物同源蛋白酮脂酰辅酶A硫解酶最适反应pH为8.3[28],说明该硫解酶最适反应pH一致,均在弱碱环境下反应活性最高。本试验测得,Hc-DAF-22最佳酶活反应温度为37℃,在相同反应时间内,37℃蛋白可完全反应,其最佳反应温度与环境温度及宿主体温相比,与捻转血矛线虫所寄生宿主牛羊体温更为接近,说明该蛋白在寄生阶段酶活反应效率较高,推测捻转血矛线虫在寄生阶段因能量需求更大,脂肪酸代谢比自由生活阶段强烈[29]。另一方面已有研究表明在 Hc-daf-22基因在虫体滞育阶段差异表达,达脱鞘L3幼虫(ExL3)与L4阶段呈高丰度表达[21],因此推测与Hc-daf-22在寄生阶段参与H. contortus的滞育形成有关。
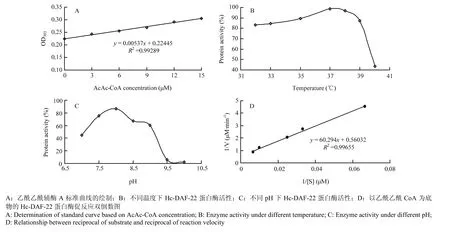
图4 Hc-DAF-22蛋白酶活测定相关数据Fig. 4 Enzyme activity deternimation of Hc-DAF-22
本试验采用了经典的硫解酶Mg2+测定法,首次测定得捻转血矛线虫 DAF-22蛋白硫解酶活性参数Vmax=1 784 nmol·L-1·min-1,Km=33.765 μmol·L-1。李志杰等[27]测得 Ce-DAF-22蛋白硫解酶活参数为 Vmax= 2 810 nmol·L-1·min-1,Km=13 μmol·L-1;JIA等[30]测得鼠过氧化物酶体3-酮脂酰辅酶A硫解酶硫解酶活参数为Vmax=30 000 nmol·L-1·min-1,Km=21 μmol·L-1。与这些同源蛋白相比,捻转血矛线虫DAF-22蛋白,酶活性与Ce-DAF-22接近但仍偏小;与鼠过氧化物酶体3-酮脂酰辅酶A硫解酶相比,酶活性为鼠硫解酶的十分之一左右。总体来说,捻转血矛线虫DAF-22蛋白酶活性相对较低,所需反应较长,其 Km较高,达最大反应速度时所需的底物浓度相对较高。
4 结论
捻转血矛线虫DAF-22蛋白是过氧化物酶体脂肪酸β氧化的关键酶之一,本研究在利用E. coli BL21对 HC-DAF-22进行了表达,经纯化、复性后,该重组蛋白能够对乙酰乙酰辅酶 A体现出一定的催化活性,Vmax和 Km值分别是 33.765 μmol·L-1和 1 784 nmol·L-1·min-1,其最适反应pH为8.0,最佳反应温度为37℃,结果表明Hc-DAF-22具有一定硫解酶活性,但与秀丽线虫同源蛋白相比硫解酶活性较低。
[1] WANG C R, QIU J H, ZHU X Q, HAN X H, NI H B, ZHAO J P, ZHOU Q M, ZHANG H W, LUN Z R. Survey of helminths in adult sheep in Heilongjiang Province, People's Republic of China. Veterinary Parasitology, 2006, 140: 378-382.
[2] 沈效平. 湖南山羊捻转血矛线虫感染调查及rDNA ITS遗传差异分析[D]. 长沙: 湖南农业大学, 2013.
SHEN X P. Investigating prevalence and researching genetic differences of rDNA ITS of Haemonchus contortus from goat in Hunan[D]. Changsha: Hunan Agricultural University, 2013. (in Chinese)
[3] 解晓钰, .博州地区羊消化道寄生虫感染调查及冬季驱虫试验研究[D]. 乌鲁木齐: 新疆农业大学, 2009.
XIE X Y. Investigation on the infection of digestive parasites in sheep in Bo-zhou area and winter expel parasites experiment study[D]. Wurumuqi: Xinjiang Agricultural University, 2009.(in Chinese)
[4] GETACHEW T, DORCHIES P, JACQUIET P. Trends and challenges in the effective and sustainable control of Haemonchus contortus infection in sheep. Review. Parasite-journal De La Societe Francaise De Parasitologie, 2007, 14: 3-14.
[5] KEARNEY P E, MURRAY P J, HOY J M, HOHENHAUS M, KOTZE A. The ‘Toolbox’ of strategies for managing Haemonchus contortus in goats: What’s in and what’s out. Veterinary Parasitology, 2016, 220: 93-107.
[6] CAMPBELL B E, BOAG P R, HOFMANN A, CANTACESSI C, WANG C K, TAYLOR P, HU M, SINDHU Z U, LOUKAS A, STERNBERG P W, GASSER R B. Atypical (RIO) protein kinases from Haemonchus contortus--promise as new targets for nematocidal drugs. Biotechnology Advance, 2011, 29(3): 338-350.
[7] ALBARQI M M, STOLTZFUS J D, PILGRIM A A, NOLAN T J, WANG Z, KLIEWER S A, MANGELSDORF D J, LOK J B. Regulation of life cycle checkpoints and developmental activation of infective larvae in Strongyloides stercoralis by dafachronic acid. PLoS Pathogens, 2016, 35: 570-574.
[8] LI N C, FAN J, PAPADOPOULOS V. Sterol carrier protein-2, a nonspecific lipid-transfer protein, in intracellular cholesterol trafficking in testicular leydig cells. PLoS One, 2016, 11: e0149728.
[9] REUSS S H V, BOSE N, SRINIVASAN J, YIM J J, JUDKINS J C, STERNBERG P W, SCHROEDER F C. Comparative metabolomics reveals biogenesis of ascarosides, a modular library of small-molecule signals in C. elegans. Journal of the American Chemical Society, 2012, 134: 1817-1824.
[10] LUDEWIG A H, SCHROEDER F C. Ascaroside signaling in C. elegans. Wormbook the Online Review of C. elegans Biology, 2013, 18: 1-22.
[11] JOO H J, YIM Y H, JEONG P Y, JIN Y X, LEE J E, KIM H, JEONG S K, CHITWOOD D J, PAIK Y K. Caenorhabditis elegans utilizes dauer pheromone biosynthesis to dispose of toxic peroxisomal fatty acids for cellular homoeostasis. Biochemical Journal, 2009, 422: 61-71.
[12] JOO H J, KIM K Y, YIM Y H, JIN Y X, KIM H, KIM M Y, PAIK Y K. Contribution of the peroxisomal acox gene to the dynamic balance of daumone production in Caenorhabditis elegans. Journal of Biological Chemistry, 2010, 285: 29319-29325.
[13] ZHANG S O, BOX A C, XU N Y, MEN J L, YU J, GUO F, TRIMBLE R, MAK H Y. Genetic and dietary regulation of lipid droplet expansion in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107: 4640-4645.
[14] WANG R, KNIAZEVA M, HAN M. Peroxisome protein transportation affects metabolism of branched-chain fatty acids that critically impact growth and development of C. elegans. PLoS One, 2013, 8(8):e76270.
[15] SRINIVASAN J, VON REUSS S H, BOSE N, ZASLAVER A, MAHANTI P, HO M C, O’DOHERTY O G, EDISON A S, STERNBERG P W, SCHROEDER F C. A modular library of small molecule signals regulates social behaviors in Caenorhabditis elegans. PLoS Biology, 2012, 10:e1001237-e1001237.
[16] JEONG P Y, KWON M S, JOO H J, PAIKY K. Molecular time-course and the metabolic basis of entry into dauer in Caenorhabditis elegans. PLoS One , 2009, 4:e4162.
[17] LI F, LOK J B, GASSER R B, KORHONEN P K., SANDEMAN M R, SHI D, ZHOU R, LI X, ZHOU Y, ZHAO J. Hc-daf-2 encodes an insulin-like receptor kinase in the barber’s pole worm, Haemonchus contortus , and restores partial dauer regulation. International Journal for Parasitology, 2014, 44: 485-496.
[18] PENKOV S, KAPTAN D, ERKUT C, SAROV M, MENDE F, KURZCHALIA T V. Integration of carbohydrate metabolism and redox state controls dauer larva formation in Caenorhabditis elegans. Nature Communications, 2015, 6: 8060.
[19] MADERN D, CAI X, ABRAHAMSEN M S, GUAN Z. Evolution of Cryptosporidium parvum lactate dehydrogenase from malate dehydrogenase by a very recent event of gene duplication. Journal of Medical Molecular Biology, 2006, 21: 489-497.
[20] 张红丽. 捻转血矛线虫滞育相关基因daf-22和hsp70全基因的获得及其功能的研究[D]. 杭州: 浙江大学, 2012.
ZHANG H L. Acquiring and function study of Haemonchus contortus arrested development related genes daf-22 and hsp70[D]. Hangzhou: Zhejiang University, 2012. (in Chinese)
[21] LIU J, NING B, LIU M, SUN Y, SUN Z, ZHANG Y, FAN X, ZHOU Z, GAO Z. Construction of ribosome display library based on lipocalin scaffold and screening anticalins with specificity for estradiol. Analyst, 2012, 137: 2470-2479.
[22] MCCORMICK M A, DELANEY J R, TSUCHIYA M, TSUCHIYAMA S, SHEMORRY A, SIM S, CHOU C Z, AHMED U, CARR D, MURAKAMI C J. A Comprehensive analysis of replicative lifespan in 4,698 single-gene deletion strains uncovers conserved mechanisms of aging. Cell Metabolism, 2015, 22: 895-906.
[23] CUI Y F, LI Z L, ZHAO E P, JIA Y F, LI D H, JU Z, CUI N Q. Overexpression of sterol carrier protein-2 in patients with hereditary cholesterol gallstones. BioMed Central Gastroenterology, 2011, 11: 784-788.
[24] GALLEGOS A M, ATSHAVES B P, STOREY S M, STARODUB O, PETRESCU A D, HUANG H, MCINTOSH AL, MARTIN G G, CHAO H, KIER A B. Gene structure, intracellular localization, and functional roles of sterol carrier protein-2. Progress in Lipid Research, 2001, 40: 498-563.
[25] LANGROVÁ I, MAKOVCOVÁ K, VADLEJCH J, JANKOVSKÁ I, PETRTÝL M, FECHTNER J, KEIL P, LYTVYNETS A, BORKOVCOVÁ M. Arrested development of sheep strongyles: onset and resumption under field conditions of Central Europe. Parasitology Research, 2008, 103: 387-392.
[26] LENITAV, MATTS N, EKLUND D M, ALM C, ERIKSSON A K, TUUF J, SALMINEN T A, MATTJUS P, EDQVIST J. Characterization of SCP-2 from Euphorbia lagascae reveals that a single Leu/Met exchange enhances sterol transfer activity. Febs Journal, 2006, 273: 5641–5655.
[27] 李志杰. 线虫线粒体极长链脂酰CoA脱氢酶、烯脂酰CoA水合酶和硫解酶的结构生物学研究[D]. 天津: 南开大学, 2010.
LI Z J. Research on the structure and function of Caenorhabditis elegans mitochondrial very long chain acyl-CoA dehydrogenase enoyl-CoA hydratase and thiolase[D]. Tianjin: Nankai University, 2010.(in Chinese)
[28] RADEK J T, DYER D H, LAN Q. Effects of mutations in Aedes aegypti sterol carrier protein-2 on the biological function of the protein. Biochemistry, 2010, 49: 7532-7541.
[29] YAN B, GUO X, ZHOU Q, YI Y, CHEN X, SUN W, DU A. Hc-fau, a novel gene regulating diapause in the nematode parasite Haemonchus contortus. International Journal for Parasitology, 2014, 44: 775-786.
[30] JIA Z, DING L. Expression and purification of His-tagged rat mitochondrial 3-ketoacyl-CoA thiolase wild-type and His352 mutant proteins. Protein Expression & Purification, 2004, 35: 320-326.
(责任编辑 林鉴非)
Characteristics of Hc-daf-22 Gene from Haemonchus contortus: Crokaryotic Expression and Its Enzymatic Activity
ZHENG XiuPing1, DING HaoJie1, GUO XiaoLu1, YANG Yi1, HUANG Yan1, CHEN XueQiu1, ZHOU QianJin2, DU AiFang1
(1Institute of Preventive Veterinary Medicine, Zhejiang University, Hangzhou 310029;2School of Marine Science, Ningbo University, Ningbo 315211 Zhejiang)
【Objective】 Haemonchus contortus is one of the major gastrointestinal nematodes infecting millions of ruminants, the disease (haemonchosis) is nationally epidemic in China. In order to analyze the biochemical properties of Hc-DAF-22 in Haemonchus contortus, the enzyme activity of renatured Hc-DAF-22 was measured in this study. By the results of enzyme activity assay, the role of Hc-DAF-22 protein will be understood in peroxisomal β-oxidation. 【Method】 First, the full-length of open reading frame of Hc-daf-22 was amplified by PCR from total cDNA of adult H. contortus ZJ Strain (GenBank:HQ738470.1). A recombinant pET-22b-Hc-daf-22 was constructed and transformed into E. coli BL21 strain; and its prokaryotic expression was induced for four hours by IPTG (0.1 mmol·L-1). Then the bacterial liquid was centrifuged and the cells were resuspended in PBS solution (50 mmol·L-1). After verification by SDS-PAGE and Western blot, the prokaryotic Hc-DAF-22 was purified by Ni-chelating affinity chromatography and concentrated by ultrafiltration tube. The concentration of protein was measured according to the protein concentration assay kit. Acetoacetylat natural state of CoA can occur keto - enol tautomerase and then enol compound is formed. Using this property, taking acetoacetyl coenzyme A as the substrate, the enzyme activity of renatured Hc-DAF-22 was measured in the reaction system (50 mmol·L-1Tris-Cl pH8.1, 20 mmol·L-1MgCl2,60 μmol·L-1CoA, 10 μmol·L-1AcAc-CoA, 0.1 μg protein). Different temperatures and pH were set in order to determine the optimum reaction conditions. 【Result】 The results showed that Hc-daf-22 gene was successfully cloned and gene similarity was 99.9% compared with H. contortus ZJ strain. Recombinant Hc-daf-22 could be expressed in E. coli BL21 and it could be detected both in the lysate supernate and precipitates, and molecular weight of the fusion protein was about 59 kD. The enzyme assay indicated that it could catalyze the substrate acetoacetyl coenzyme A, suggesting the activity of thiolase. And the optimal pH of this reaction was 8 and the optimal temperature was 37ºC. Under the optimal reaction conditions, the Michaelis constant Kmand the maximum reaction velocity Vmaxwere 33.765 μmol·L-1and 1 784 nmol·L-1·min-1, respectively. 【Conclusion】 H. contortus DAF-22 protein is a key enzyme of peroxisome β-oxidation, this experiment is successfully determined the Hc-DAF-22 protein activity using in vitro activity test. It was proved that Hc-DAF-22 has a certain thiolase activity, but is low compared with the Caenorhabditis elegans homolog protein.
Haemonchus contortus; Hc-daf-22; prokaryotic expression; enzyme activity assay; β-oxidation
2016-07-01;接受日期:2017-01-22
国家重点基础研究发展计划(“973”计划)(2015CB150300)、浙江省自然科学基金(LY14C180002)
联系方式:郑秀平,Tel:13738144872;E-mail:13738144872@163.com。通信作者杜爱芳,Tel:0571-88982583;E-mail:afdu@zju.edu.cn

