鼠冠状病毒核衣壳蛋白的抗体制备与抗原决定簇分析
郭佳慧,文荣,王玉燕,张浩旸,刘红,徐娅佳,叶荣
复旦大学基础医学院病原生物学系,上海 200032
·论著·
鼠冠状病毒核衣壳蛋白的抗体制备与抗原决定簇分析
郭佳慧,文荣,王玉燕,张浩旸,刘红,徐娅佳,叶荣
复旦大学基础医学院病原生物学系,上海 200032
核衣壳(nucleocapsid,N)蛋白有稳定病毒基因组、调控病毒复制及细胞状态的特殊作用。鼠肝炎病毒(murine hepatitis virus,MHV)为乙型冠状病毒属的原型病毒,是研究冠状病毒N蛋白功能的经典模型。本研究用去污剂处理鼠冠状病毒粒子暴露N蛋白,另用原核表达纯化的重组N蛋白分别免疫小鼠,制备多克隆及单克隆抗体。酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)和蛋白免疫印迹分析结果显示两类抗体均具有高灵敏度和特异度,与甲型冠状病毒猪传染性胃肠炎病毒(porcine transmissible gastroenteritis virus,TGEV)的N蛋白无交叉反应。原核表达缺失突变的N蛋白分析结果显示,多克隆抗体与单克隆抗体2E6识别的鼠冠状病毒N蛋白抗原决定簇完全一致,位于N端结构域(N-terminal domain,NTD)C端与SR之间的58个氨基酸残基内。此外,基于单克隆抗体2E6的ELISA及免疫荧光法能检测到感染细胞中和培养上清液中的N蛋白组分,且其含量与病毒复制的滴度一致。这些结果表明,鼠冠状病毒复制过程中粒子与细胞中的N蛋白可能维持相似的结构,使NTD与SR之间的部分氨基酸残基一直暴露在表面,从而形成了优势抗原决定簇。
鼠冠状病毒;核衣壳蛋白;抗体;抗原决定簇
冠状病毒(coronavirus,CoV)是一类有包膜的正链RNA病毒,属于套式病毒目(Nidovirales),其基因组是目前已知最大的mRNA分子,约30 kb[1]。早期认为冠状病毒主要引起家养动物和禽类肠道、呼吸道疾病,仅少数引起人类普通感冒[2]。近年来,因新型冠状病毒引起人类严重呼吸综合征如严重急性呼吸综合征(severe acute respiratory syndrome,SARS)和中东呼吸综合征(Middle East respiratory syndrome,MERS)暴发,导致许多来自人和野生动物(如蝙蝠)的冠状病毒种类被发现和鉴定[1-3]。目前,冠状病毒科(Coronaviridae)包括甲型、乙型、丙型和丁型4个属,新的冠状病毒主要集中在甲型冠状病毒属(Alphacoronavirus)和乙型冠状病毒属(Betacoronavirus)[4]。
鼠肝炎病毒(murine hepatitis virus,MHV)是乙型冠状病毒属的代表性成员,主要经口或呼吸道感染小鼠和大鼠,是实验动物的主要病原之一[5]。MHV是研究冠状病毒分子生物学和致病性的经典模型,有多个实验室分离株,其中MHV-A59能引起小鼠中枢神经系统和肝脏病变,是人类肝炎和肝脂肪变性及亚急性中枢神经系统病理的动物模型[6-8]。有学者将MHV-A59鼻内感染C57BL/6小鼠作为SARS-CoV和MERS-CoV所致急性呼吸综合征的替代模型[9]。冠状病毒RNA基因组通过转录产生一系列具有共同前导序列(leader sequence)和3′-UTR的亚基因组mRNA(subgenomic mRNA,sgmRNA)表达蛋白,其中表达复制酶的sgmRNA1与基因组RNA完全相同。开放读码框1(open reading frame 1,ORF1)占sgmRNA1 5′端2/3长度,翻译时发生核糖体移码,产生两个多聚蛋白pp1a和pp1ab,两者在木瓜样蛋白酶的作用下形成16个非结构蛋白(nsp1~nsp16)[1-2,10]。结构蛋白由各自的sgmRNA独立表达,主要有棘突(spike,S)蛋白、核衣壳(nucleocapsid,N)蛋白、膜(membrane,M)蛋白和小包膜(envelope,E)蛋白,部分冠状病毒还表达血凝素酯酶(hemagglutinin esterase,HE)蛋白[1-2,10]。其中N蛋白高度磷酸化,是构成病毒核衣壳的唯一蛋白,与基因组RNA结合形成螺旋状卷曲[1-2,10]。冠状病毒N蛋白具有调控病毒复制与细胞状态的功能,其磷酸化及其与RNA的结合,可调控病毒复制酶非连续-连续转录状态的转换,与基因组RNA的合成密切相关[11-15]。N蛋白自身可发生同源聚合,通过C端也能与病毒M蛋白相互作用,参与病毒粒子的选择性装配[16-18]。此外,冠状病毒N蛋白还能通过抑制RNase L活性、激发信号通路等拮抗干扰素(interferon,IFN)的抗病毒作用[19-20]。
本研究用去污剂处理的鼠冠状病毒粒子作为N蛋白抗原免疫小鼠,比较以原核表达N蛋白作为抗原所获得的抗体特性,发现多克隆与单克隆抗体均具有高度的特异性,且识别的N蛋白抗原表位明显一致。单克隆抗体能很好地识别细胞培养上清液中和胞内的N蛋白,提示鼠冠状病毒N蛋白在生物合成与装配过程中保持相对稳定的结构,暴露的残基形成优势抗原决定簇。本研究所制备的高亲和力单克隆抗体不但能用于N蛋白的检测,还能为进一步解析N蛋白的结构与功能奠定基础。
1 材料与方法
1.1 细胞、病毒、菌株和质粒
小鼠脑神经瘤细胞(Neuro-2a)、小鼠骨髓瘤细胞(P3/X63-Ag8.653)、小鼠巨噬细胞(Raw264.7)、犬肾细胞(A72)源自美国标准生物品收藏中心(American Type Culture Collection,ATCC),由本实验室保存;MHV-A59和质粒pMH54来自Dr. Paul Masters实验室[21],由本实验室保存;猪传染性胃肠炎病毒(porcine transmissible gastroenteritis virus,TGEV) Purdue源自ATCC,由本实验室保存;Novagen pET28a(Merck Millipore)由本实验室保存;DH5α、Top10、BL21感受态细胞购自天根生化科技(北京)有限公司。BALB/c小鼠由复旦大学动物实验中心提供。
1.2 细胞培养与病毒感染
Neuro-2a、Raw264.7、A72细胞培养基为含10%胎牛血清(Gibco-Life Technologies)的DMEM(Gibco-Life Technologies),P3/X63-Ag8.653细胞培养基为含10%胎牛血清的RPMI 1640(Gibco-Life Technologies),培养条件37 ℃,5% CO2。MHV-A59用Neuro-2a细胞扩增,TGEV用A72细胞扩增,感染复数(multiplicity of infection,MOI)为 0.1~1.0,感染时间为1~2 h。
1.3 冠状病毒N蛋白的原核表达与纯化
分子克隆按常规方法进行[22],试剂购自NEB和TaKaRa公司。MHV N蛋白基因来自质粒pMH54[21],TGEV Purdue N蛋白基因来自病毒感染细胞[23]。反转录-聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)扩增基因片段,经NdeⅠ和HindⅢ或EcoRⅠ位点插入原核表达载体pET28a His 6-tag(21个残基)的下游,获得野生型N蛋白表达载体(pET28a-mN和pET28a-tN)。在pET28a-mN基础上,利用酶切和融合PCR进一步构建不同区域缺失的N蛋白表达载体mN-A (Δ114~222 aa )、mN-B(Δ163~454 aa)、mN-C(Δ221~381 aa)和mN-D(Δ318~454 aa)。
重组质粒测序鉴定后,转化大肠埃希菌BL21感受态细胞,用1 mmol/L异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)诱导6 h,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)及蛋白免疫印迹法鉴定重组蛋白表达量和分布。菌体用超声破碎后,含重组N蛋白可溶性组分经Ni柱(Pharmcia-GE Healthcare)亲和层析,再用不同浓度咪唑(Sigma)洗脱,合并高纯度组分,用磷酸盐缓冲液(phosphate buffered saline,PBS)4 ℃透析3次,收集纯化后的重组 N蛋白,分装,-80 ℃保存。
1.4 病毒粒子N蛋白的制备
鼠冠状病毒粒子纯化按密度梯度离心法[24]中的聚乙二醇(polyethylene glycol,PEG)沉淀浓缩步骤进行。用5 mL MHV感染Neuro-2a细胞(或TGEV感染A72细胞)2 h,无血清 DMEM补齐至25 mL(T75)。培养至约80%细胞出现细胞病变效应(cytopathic effect,CPE)(MHV,24 h;TGEV,48 h)时,收集培养上清液,离心去除细胞碎片;4 ℃向病毒上清液中缓慢滴加1/3体积的30% PEG 8000(Sigma)(用0.85% NaCl配制),4 ℃继续搅拌2 h,离心沉淀后,用适量PBS悬浮和溶解;再用1/3体积的30% PEG 8000沉淀1次,用适量PBS悬浮和溶解,离心去除不溶物;分装后,置-80 ℃保存。在初步纯化的病毒粒子中加入SDS至终浓度为5%,37 ℃孵育15 min,灭活并破坏病毒粒子表面结构,暴露N蛋白。
1.5 小鼠免疫和N蛋白抗血清的制备
将纯化的原核表达N蛋白(mN和tN)或处理的病毒粒子(MHV和TGEV)与等体积福氏完全佐剂(Sigma)用注射器反复抽吸至完全乳化,腹腔免疫BALB/c小鼠(250~400 μL/只)。初次免疫后,间隔2周进行加强免疫(除乳化使用福氏不完全佐剂外,剂量与方法相同)。2~3次加强免疫后,眼眶后眦静脉取血或放血,分离血清。
1.6 单克隆抗体的制备与纯化
单克隆抗体制备采用标准杂交瘤技术,参照文献进行[25]。全部试剂购自Sigma,培养基购自Gibco-Life Technologies。基本流程如下:①0.5 mL石蜡油腹腔注射致敏小鼠1周,颈椎脱臼处死小鼠后,立即用HAT选择培养液洗脱腹腔巨噬细胞,96孔板培养24~48 h。②眼球放血处死免疫小鼠后取脾脏,通过吸管反复碾压及200目滤网过滤,再用无血清RPMI 1640洗3次。③P3/X63-Ag8.653在含10%胎牛血清的RPMI 1640培养基中培养48 h,收集并用无血清RPMI 1640洗2次。④将骨髓瘤细胞与脾细胞按约1∶10的比例混合,37 ℃水浴条件下50% PEG 4000诱导融合1~3 min,用37 ℃预热的无血清RPMI 1640缓慢稀释去除PEG,HAT选择培养液重悬,稀释,铺至含饲养细胞的培养板。⑤培养10~15 d后,用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测培养上清液中的抗体,阳性孔用有限稀释法进行单克隆化2次。⑥待稳定分泌抗体的细胞株复苏后,用低血清RPMI 1640培养,将细胞接种至BALB/c小鼠腹腔,1~2周后收集腹腔积液。培养上清液用适量PBS稀释,过亲和层析HiTrap Protein G柱(GE Healthcare)纯化。为减少样本体积及去除白蛋白,也可先用等体积饱和硫酸铵沉淀,溶解后经Sephadex G25M柱(Pharmacia Fine Chemical)脱盐,再用G蛋白柱纯化。
1.7 ELISA
ELISA所用试剂、材料与流程参照文献进行[25]。细胞上清液经等体积30% PEG 8000(Sigma)沉淀后,用碱性包被液稀释至原体积。单层感染细胞用1×IPP Buffer制备裂解液,碱性包被液稀释后进行包被;抗血清或单克隆抗体用PBS进行倍比稀释,4 ℃孵育过夜;二抗辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗小鼠IgG(GE)37 ℃孵育 1h,用邻苯二胺(o-phenylenediamine,OPD)/H2O2显色及硫酸终止,检测OD492值。
1.8 SDS-PAGE和蛋白免疫印迹法检测
蛋白电泳及转印采用Bio-Rad mini装置完成,缓冲液主要试剂(Tris/Glysine/SDS)购自Calbiochem公司。细胞裂解液样品加等体积2×样品缓冲液,100 ℃ 5 min变性处理;配制5%浓缩胶和10%分离胶的丙烯酰胺(Amresco)凝胶,恒流(15 mA)电泳。电泳后,用考马斯亮蓝R250(Amresco)染色并观察,或将胶内蛋白转移至聚偏氟乙烯(polyvinylidenefluoride,PVDF)膜(Bio-Rad)上,一抗4 ℃孵育过夜,二抗羊抗小鼠IgG-HRP 37 ℃孵育1 h,行增强化学发光法(enhanced chemiluminescence,ECL)(Bio-Rad)检测,X线片显影。
1.9 共聚焦显微镜观察
将细胞稀释后,铺至特制玻璃底一次性小型细胞培养皿(In Vitro Scientific),培养24~48 h,至约60%细胞融合。用1.0 MOI的病毒感染不同时间后取出,收集培养液。单层细胞用冷PBS洗3次,4% 多聚甲醛(Sigma)室温固定30 min,5%牛血清白蛋白(bovine serum albumin,BSA)封闭1 h,4 ℃保存。与抗MHV N蛋白单克隆抗体(2E6)4 ℃孵育过夜,二抗羊抗小鼠四甲基异硫氰酸罗丹明(tetramethyl rhodamine isothiocynate,TRITC)标记IgG(JIR)37 ℃孵育2 h,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)(JIR)孵育30 min,封片。用Leica TCS SP8激光共聚焦显微镜观察MHV N蛋白的表达与分布。
2 结果
2.1 鼠冠状病毒 N蛋白的序列分析
鼠冠状病毒N蛋白由454~455个氨基酸残基组成,富含碱性氨基酸(R和K)和丝氨酸(S)。通过比较不同毒株序列,发现两个20多个残基的间隔区(spacer A和spacer B)将3个结构域(domain)隔开(图1A)。domainⅠ(1~139位氨基酸)和domainⅡ(163~380位氨基酸)主要与病毒基因组RNA结合,domain Ⅲ(406~454位氨基酸)参与其他结构蛋白的相互作用[26]。根据RNA结合功能将domainⅠ和domainⅡ重新分为N1a(43~194位氨基酸)和N2b(257~379位氨基酸)结构域,现称为N端结构域(N-terminal domain,NTD)和C端结构域(C-terminal domain,CTD)(图1A)。NTD中碱性氨基酸在RNA结合作用中起关键作用[27]。此外,N蛋白的NTD区富含SGR,NTD与CTD之间区域富含SR,与N蛋白磷酸化有关[13,15]。
冠状病毒N蛋白的氨基酸序列在属内高度保守,在不同属之间差异明显。通过Vector NTI软件将乙型冠状病毒MHV-A59与甲型冠状病毒TGEV Purdue和丙型冠状病毒鸡传染性支气管炎病毒(avian infectious bronchitis virus,IBV)Beaudette的N蛋白氨基酸序列进行比对,发现三者序列仅12.1%一致(图1B),且54.3%保守序列集中在NTD和SR区,在CTD区相对较少。NTD和SR的一些关键碱性氨基酸参与RNA结合(图1B)。鼠冠状病毒5个分离株(MHV-A59、 MHV-JHM、MHV1、MHV2和MHV3)之间核苷酸序列同源性超过92%,氨基酸序列同源性超过94%[26]。
2.2 冠状病毒N蛋白抗体制备及特异性
为制备能识别天然冠状病毒N蛋白的抗体,用去污剂快速处理浓集的病毒(MHV和TGEV),暴露N蛋白作为抗原。同时,用纯化的原核表达N蛋白(mN和tN)作为对照抗原(图2A),免疫小鼠获得相应多克隆抗体(pAb-MHV、pAb-mN、pAb-TGEV、pAb-tN)及针对MHV的单克隆抗体(mAb-MHV)。ELISA结果显示,原核表达蛋白制备的多克隆抗体无明显背景反应,两者之间交叉反应也不明显(图2B)。蛋白免疫印迹结果显示,鼠冠状病毒N蛋白多克隆抗体(图2C)及单克隆抗体(图2E)均能与病毒感染的细胞(Neuro-2a)裂解液中N蛋白和原核(大肠埃希菌)表达的重组蛋白mN产生特异性反应,但不与猪冠状病毒(TGEV)感染细胞(A72)裂解液中N蛋白和原核(大肠埃希菌)表达的重组蛋白tN产生反应。同样,猪冠状病毒多克隆抗体也只与同源病毒的N蛋白产生反应(图2D),两者之间无交叉反应。
MHV在感染Neuro-2a细胞过程中,产生的N蛋白形成迁移率不同(相对分子质量40 000~55 000)的多条反应带,而原核表达的重组蛋白mN只有单一条带,相对分子质量略大(N端多His-tag序列的21个残基)(图2C、2E)。猪冠状病毒(TGEV)感染A72细胞产生的N蛋白与重组蛋白tN形成反应条带与抗体有关,pAb-tN多条带,而pAb-TGEV单一条带,相对分子质量比鼠冠状病毒N蛋白小;原核表达的tN也略大于TGEV感染产生的N蛋白(N端同样多His-tag序列的21个残基)(图2B)。
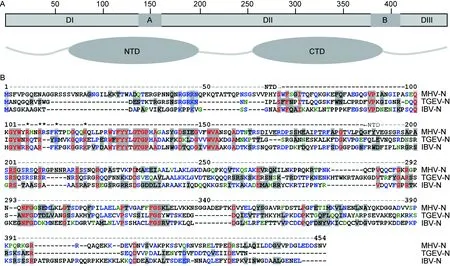
A: The functional domains of murine coronaviruse (MHV-A59). Three structural domain (DI, DII, and DIII) and two spacer sequences (A and B) are shown with rectangles (top); a N-terminal domain (NTD) and a C-terminal domain (CTD) of N proteins are shown with a cartoon (bottom). Numbers represent the position of amino acid residues. B: Alignment of anino acid sequences of N proteins from three genera of coronaviruses.Betacoronavirusmurine hepatitis virus (MHV-A59; sequence accession No. AY700211),Alphacoronavirus1 member porcine transmissible gastroenteritis virus (TGEV Purdue; sequence accession No. AJ271965) andGammacoronavirusavian infectious bronchitis virus (IBV Beaudette; sequence accession No. AJ311317) were used. NTD of MHV-A59 is marked. Asterisked residues play a key role in RNA binding of N protein and underlined residues are the potential antigenic determinants.
图1 鼠冠状病毒N蛋白的结构域及与其他冠状病毒N蛋白序列的比较
Fig.1 Domains of murine coronavirus N protein and comparison of the anino acid sequence from three genera of coronaviruses
2.3 鼠冠状病毒N蛋白优势抗原决定簇分析
在抗体制备过程中获得一株MHV N蛋白高亲和力单克隆抗体2E6(图2C),为确定其识别区域,在pET28a-mN的基础上通过缺失突变构建了4个含MHV N蛋白不同结构域的重组表达质粒(图3A),IPTG诱导后均能很好地表达,相对分子质量也与ExPASy软件预测值一致(图3B左)。蛋白免疫印迹结果显示,MHV N多克隆抗体(图3B中)与单克隆抗体(图3B右)对4个片段的反应几乎一致,均不能识别A和B片段,但能识别C和D片段及全长N蛋白(mN)。多克隆抗体还能与全长N蛋白(mN)的相对分子质量为35 000的降解片段反应(图3B中)。上述结果表明,多克隆抗体主要识别序列与单克隆抗体2E6一致,为domainⅡ的N端58个残基(163~220位氨基酸),覆盖NTD C端与SR富含区,是优势抗原决定簇。
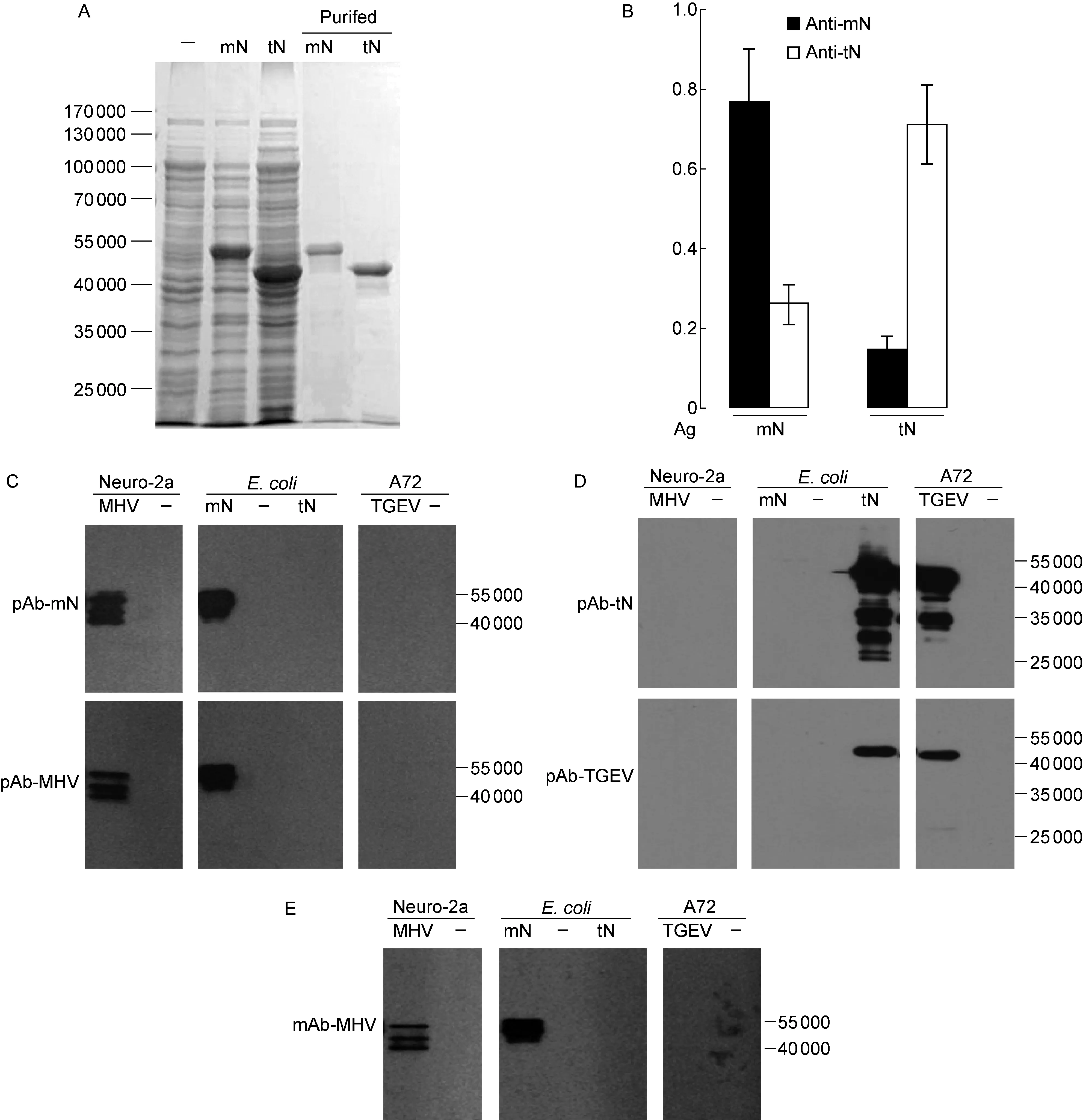
A: SDS-PAGE of MHV N (mN) and TGEV N (tN) fusion protein. Minus (-) represents pET28a vector control. B: ELISA of murine anti-mN and anti-tN antibodies. ELISA plates were coated with purified mN or tN and incubated with diluted antibodies.OD492values were from triple tests. C: Reactivity of MHV polyclonal antibodies. Lysates of murine Neuro-2a cells infected with MHV-A59, canine A72 cells infected with TGEV Purdue, andE.colicells expressing wild-type MHV-A59 N protein (mN) or TGEV Purdue N protein (tN) were analyzed by Western blotting with the polyclonal antibodies to treated MHV-A59 particles (pAb-MHV) or to mN (pAb-mN). D: Reactivity of TGEV polyclonal antibodies. Lysates as (C) were analyzed by Western blotting with the polyclonal antibodies to treated TGEV Purdue particles (pAb-TGEV) or to tN (pAb-tN). E: Reactivity of MHV monoclonal antibody. Lysates as (C) were analyzed by Western blotting with the monoclonal antibody (2E6) to treated MHV-A59 particles (mAb-MHV).
图2 抗体制备及与原核或真核细胞表达的两种冠状病毒N蛋白的反应性
Fig.2 Preparation and reactivity of antibodies to two N proteins expressed in prokaryotic and eukaryotic cells

A: Construction and expression strategy of murine coronavirus N protein in prokaryotic plasmid (pET28a). A diagram showed the residue number and position of three domains of MHV-A59 N protein (referring to Fig.1). A extensive His6-tag (21 aa) was added to the N-terminus of wild-type (mN) and four truncated or deleted mutants (A, B, C, and D) of N protein. The putative molecular weight was shown on the right side of these constructs. B: Expression and Western blotting of mN mutants inE.coli.E.colilysates expressing recombiant N protein were analyzed by SDS-PAGE and Coomassie staining (left panel) or blotted onto PVDF membranes and detected with mouse polyclonal antibody (central panel, pAb-MHV) and monoclonal antibody 2E6 (right panel, mAb-MHV) to murine coronavirus N protein.
图3 鼠冠状病毒N蛋白抗原决定簇分析
Fig.3 Analysis of the antigenic determinants of murine coronavirus N protein
2.4 单克隆抗体2E6识别不同类型的鼠冠状病毒 N蛋白
以上所获MHV N蛋白单克隆抗体2E6识别NTD C端与SR富含区,该区域的正电荷残基具有亲水性,也包括N蛋白主要磷酸化位点[13,15]。在MHV感染过程中,N蛋白具有自我装配及与其他结构蛋白相互作用的功能[2]。为验证该决定簇在细胞内生物合成过程中的空间稳定性,于感染鼠源Neuro-2a和Raw264.7细胞后的不同时间收集培养上清液与细胞裂解液中的N蛋白,在碱性条件下(pH 9.6)包被至ELISA微孔板,用单克隆抗体2E6进行检测。结果显示,MHV感染后培养上清液和细胞裂解液中N蛋白水平均在感染后16~24 h达到峰值,与病毒滴度比较一致(图4A)。单克隆抗体2E6与培养上清液中N蛋白反应良好,OD492值较高,而与细胞裂解液中N蛋白反应的OD492值较低(图4A),可能与N蛋白收集方法和稀释度有关。前者主要来自病毒,也包括未装配的N蛋白。通过免疫荧光技术检测细胞内MHV N蛋白表达与分布,发现感染后4 h即可见N蛋白表达,8~12 h后荧光信号明显(图4B)。此外,不同种类的鼠源细胞N蛋白合成时间与表达水平不同,分布也有差异。在Neuro-2a细胞呈细胞质分布,很少见核定位现象。在Raw264.7细胞不但呈细胞质分布,还可见少量核定位现象(图4B)。这些结果表明,本研究制备的MHV N蛋白抗体既能与完全变性的N蛋白反应,也能识别聚合的或在细胞内合成的构象相对稳定的N蛋白。

A: Time-course changes of viral titres in culture media (●), N protein in culture media (■), and N protein in cellular lysates (▲) after infection with murine coronavirus. Viral titre is shown as log10plaque forming unit (PFU) per mL of medium supernatant. Amount of N protein in media or lysates is shown asOD492of ELISA substrate. Tests were repeated triplicately. B: Expression of N protein in cells at the early stage of virus replication. N protein in infected Neuro-2a (top panel) and Raw264.7 (bottom panel) cells was detected by immunofluorescence with the mouse monoclonal antibody (2E6) to N protein of murine coronavirus. Scale bar, 25 μm.
图4 培养细胞中N蛋白的表达与病毒复制的相关性
Fig.4 Relationship between the expression of N protein and the replication of murine coronavirus in cultured Neuro-2a and Raw264.7 cells
3 讨论
冠状病毒N蛋白作为结构蛋白,主要与病毒基因组RNA结合后构成病毒核心。冠状病毒N蛋白不仅参与调节病毒RNA的复制,同时能作为RNA分子伴侣促进sgmRNA的转录[11-15]。鼠冠状病毒N蛋白的NTD和CTD均能与病毒RNA结合,前者作用较强[16]。两个结构域之间有一个在不同冠状病毒属之间相对保守的富含丝氨酸和精氨酸残基的SRXX重复区(也称N2a),通过与复制转录复合体(replication-transcription complex,RTC)中病毒的非结构蛋白nsp3结合,在病毒感染早期发挥关键作用[17-18]。此外,带有下游SR区的MHV N蛋白的NTD不但能特异性地结合自身转录调节序列(transcriptional regulatory sequence,TRS)RNA,还能结合SARS-CoV TRS RNA[28]。
以去污剂处理纯化后的鼠冠状病毒粒子为抗原制备的抗-MHV N蛋白多克隆抗体和单克隆抗体2E6,能特异性识别变性的N蛋白,不与猪冠状病毒(TGEV)的N蛋白产生交叉反应。多克隆抗体与单克隆抗体2E6识别MHV N蛋白的序列一致,抗原表位存在于domainⅡ的58个氨基酸内(163~220位氨基酸)。本研究所获的其他杂交瘤细胞株分泌的抗体识别序列也与2E6相同,表明去除鼠冠状病毒包膜后,N蛋白暴露区域是主要抗原决定簇。本研究制备的抗体能识别变性和非变性的N蛋白抗原决定簇,可能具有通过干扰N蛋白与RNA结合而降低病毒RNA合成与转录的作用,有待进一步证实。
冠状病毒N蛋白参与病毒核心形成,其表达水平在一定程度上决定了病毒增殖水平。为分析两者之间的关系,本研究采用ELISA和免疫荧光技术对细胞内和培养上清液中N蛋白进行检测,并与培养上清液中成熟病毒的滴度进行比较。ELISA结果显示,培养上清液与细胞裂解液中N蛋白含量与病毒滴度基本一致,均在病毒感染后12 h开始升高,16~24 h达到高峰,然后开始降低。虽然病毒感染后8 h培养上清液和细胞裂解液中N蛋白升高不明显,但免疫荧光可见细胞中有明显的N蛋白,Raw264.7细胞于感染后4 h即可见N蛋白表达。结果表明,单克隆抗体2E6对变性的N蛋白具有很好的识别能力,ELISA可用于细胞培养上清液中病毒的检测,而病毒在培养细胞内的复制水平用免疫荧光检测N蛋白更为灵敏。
一些研究发现,冠状病毒N蛋白能定位于细胞核的核仁,并调节细胞周期[29-30]。理论预测MHV N蛋白的核定位信号(nuclear localization signal,NLS)为domain Ⅲ中的一个富含碱性氨基酸的Pat 7序列[29]。冠状病毒基因组RNA指导的蛋白合成主要在细胞质内进行。本研究也注意到,MHV感染鼠源Neuro-2a和Raw264.7细胞后可见N蛋白的细胞核分布(数据未列),提示N蛋白可能参与干扰宿主细胞功能从而促进病毒自身复制。N蛋白对宿主细胞生理功能的影响有待深入研究。
[1] de Groot RJ, Cowley JA, Enjuanes L, Faaberg KS, Perlman S, Rottier PJM, Snijder EJ, Ziebuhr J, Gorbalenya AE. Nidovirales [M]. In: King AMQ, Adams MJ, Carstens EB, Lefkowitz EJ. eds. Virus taxonomy classification and nomenclature of viruses—nighth report of the International Committee on Taxonomy of Viruses. San Diego: Elsevier Academic Press, 2012: 785-795.
[2] Masters PS, Perlman S. Coronaviridae [M]. In: Knipe DM, Howley PM, Cohen JI, Griffin DE, Lamb RA, Martin MA, Racaniello VR, Roizman B. eds. Fields virology. 6th ed. Philadelphia: Lippincott Williams & Wilkins, 2013: 825-858.
[3] Ge XY, Li JL, Yang XL, Chmura AA, Zhu G, Epstein JH, Mazet JK, Hu B, Zhang W, Peng C, Zhang YJ, Luo CM, Tan B, Wang N, Zhu Y, Crameri G, Zhang SY, Wang LF, Daszak P, Shi ZL. Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor [J]. Nature, 2013, 503(7477): 535-538.
[4] ICTV. Virus taxonomy: 2014 release [EB/OL]. http://www.ictvonline.org/virusTaxonomy.asp?taxnode_id=20140886.
[5] Stohlman SA, Bergmann CC, Perlman S. Mouse hepatitis virus [M]. In: Ahmed R, Chen I. eds. Persistent viral infection. New York: John Wiley and Sons Ltd, 1998: 537-557.
[6] 覃小敏, 张江国, 苏凯, 杨超, 严伟明, 宁琴. 慢性病毒性肝炎小鼠动物模型的建立及其特征分析 [J]. 中国病毒学, 2006, 21(5): 417-420.
[7] Bender SJ, Weiss SR. Pathogenesis of murine coronavirus in the central nervous system [J]. J Neuroimmune Pharmacol, 2010, 5(3): 336-354.
[8] 甘露, 张哲, 郭进强, 谢茜, 蒙子君, 万为人, 罗炳德. 小鼠慢性病毒性肝炎诱发肝脂肪变性模型的构建 [J]. 南方医科大学学报, 2012, 32(12): 1722-1726.
[9] Yang Z, Du J, Chen G, Zhao J, Yang X, Su L, Cheng G, Tang H. Coronavirus MHV-A59 infects the lung and causes severe pneumonia in C57BL/6 mice [J]. Virol Sin, 2014, 29(6): 393-402.
[10] Weiss SR, Leibowitz JL. Coronavirus pathogenesis [J]. Adv Virus Res, 2011, 81: 85-164. doi: 10.1016/B978-0-12-385885-6.00009-2.
[11] Thiel V, Herold J, Schelle B, Siddell SG. Viral replicase gene products suffice for coronavirus discontinuous transcription [J]. J Virol, 2001,75(14): 6676-6681.
[12] Schelle B, Karl N, Ludewig B, Siddell SG, Thiel V. Selective replication of coronavirus genomes that express nucleocapsid protein [J]. J Virol, 2005, 79(11): 6620-6630.
[13] Wu CH, Yeh SH, Tsay YG, Shieh YH, Kao CL, Chen YS, Wang SH, Kuo TJ, Chen DS, Chen PJ. Glycogen synthase kinase-3 regulates the phosphorylation of severe acute respiratory syndrome coronavirus nucleocapsid protein and viral replication [J]. J Biol Chem, 2009, 284(8): 5229-5239.
[15] Wu CH, Chen PJ, Yeh SH. Nucleocapsid phosphorylation and RNA helicase DDX1 recruitment enables coronavirus transition from discontinuous to continuous transcription [J]. Cell Host Microbe, 2014, 16(4): 462-472.
[16] Hurst KR, Koetzner CA, Masters PS. Identification of in vivo-interacting domains of the murine coronavirus nucleocapsid protein [J]. J Virol, 2009, 83(14): 7221-7234.
[17] Hurst KR, Ye R, Goebel SJ, Jayaraman P, Masters PS. An interaction between the nucleocapsid protein and a component of the replicase-transcriptase complex is crucial for the infectivity of coronavirus genomic RNA [J]. J Virol, 2010, 84(19): 10276-10288.
[18] Hurst KR, Koetzner CA, Masters PS. Characterization of a critical interaction between the coronavirus nucleocapsid protein and nonstructural protein 3 of the viral replicase-transcriptase complex [J]. J Virol, 2013, 87(16): 9159-9172.
[19] Ye Y, Hauns K, Langland JO, Jacobs BL, Hogue BG. Mouse hepatitis coronavirus A59 nucleocapsid protein is a type I interferon antagonist [J]. J Virol, 2007, 81(6): 2554-2563.
[20] Lu X, Pan J, Tao J, Guo D. SARS-CoV nucleocapsid protein antagonizes IFN-β response by targeting initial step of IFN-β induction pathway, and its C-terminal region is critical for the antagonism [J]. Virus Genes, 2011, 42(1): 37-45.
[21] Kuo L, Godeke GJ, Raamsman MJ, Masters PS, Rottier PJ. Retargeting of coronavirus by substitution of the spike glycoprotein ectodomain: crossing the host cell species barrier [J]. J Virol, 2000, 74(3): 1393-1406.
[22] Green MR, Sambrook J. Molecular cloning: a laboratory manual. 4th ed [M]. New York: Cold Spring Harbor Laboratory Press, 2012.
[23] 王玉燕,吕钧,刘红,叶荣. 甲型冠状病毒属三个病毒株对不同宿主来源细胞的感染性比较 [J/OL]. 中国科技论文在线. http://www.paper.edu.cn/releasepaper/content/201301-1114.
[24] Ye R, Montalto-Morrison C, Masters PS. Genetic analysis of determinants for spike glycoprotein assembly into murine coronavirus virions: distinct roles for charge-rich and cysteine-rich regions of the endodomain [J]. J Virol, 2004, 78(18): 9904-9917.
[25] Howard GC, Kaser MR. Making and using antibodies: a practical handbook [M]. New York: CRC Press (Taylor and Francis Group),2013.
[26] Parker MM, Masters PS. Sequence comparison of the N genes of five strains of the coronavirus mouse hepatitis virus suggests a three domain structure for the nucleocapsid protein [J]. Virology, 1990, 179(1): 463-468.
[27] Saikatendu KS, Joseph JS, Subramanian V, Neuman BW, Buchmeier MJ, Stevens RC, Kuhn P. Ribonucleocapsid formation of severe acute respiratory syndrome coronavirus through molecular action of the N-terminal domain of N protein [J]. J Virol, 2007, 81(8): 3913-3921.
[28] Grossoehme NE, Li L, Keane SC, Liu P, Dann CE 3rd, Leibowitz JL, Giedroc DP. Coronavirus N protein N-terminal domain (NTD) specifically binds the transcriptional regulatory sequence (TRS) and melts TRS-cTRS RNA duplexes [J]. J Mol Biol, 2009, 394(3): 544-557.
[29] Wurm T, Chen H, Hodgson T, Britton P, Brooks G, Hiscox JA. Localization to the nucleolus is a common feature of coronavirus nucleoproteins, and the protein may disrupt host cell division [J]. J Virol, 2001, 75(19): 9345-9356.
[30] Reed ML, Dove BK, Jackson RM, Collins R, Brooks G, Hiscox JA. Delineation and modelling of a nucleolar retention signal in the coronavirus nucleocapsid protein [J]. Traffic, 2006, 7(7): 833-848.
. YE Rong, E-mail: yerong24@fudan.edu.cn
Preparation and characterization of antibodies against murine coronavirus nucleocapsid protein
GUO Jiahui, WEN Rong, WANG Yuyan, ZHANG Haoyang, LIU Hong, XU Yajia, YE Rong
DepartmentofMicrobiologyandParasitology,SchoolofBasicMedicalSciences,FudanUniversity,Shanghai200032,China
Nucleocapsid (N) protein of virus plays special roles in stabilization of viral genome, regulation of viral replication and adapting cellular circumstance. Murine hepatitis virus (MHV), the prototype ofBetacoronavirus, is a classic model for the exploration of coronavirus N protein functions. Viral N proteins from detergent-treated virions and recombinant N proteins expressed in prokaryotic cells were prepared and used to immunize BALB/c mice for the preparation of polyclonal and monoclonal antibodies respectively. Antibodies with high sensitivity and specificity against the antigens were selected and subjected an assay for antigenic determinants. The results indicated that both polyclonal antiserum and mAb 2E6 recognized a region covering 58 residues motif. An enzyme-linked immunosorbent assay (ELISA) with mAb 2E6 was established for N proteins in medium supernatants and cellular lysates. The signal could be detected at 4 h after infection and the readings were consistent to viral titers.
Murine coronavirus; Nucleocapsid protein; Antibody; Antigenic determinant
国家自然科学基金(31170786、31100116)
叶荣
2016-12-26)

