家蚕二分浓核病毒ns1基因序列的改造、表达和鉴定
徐 五, 周 倩, 胡朝阳, 李国辉, 姚 勤
(江苏大学 生命科学研究院, 江苏 镇江 212013)
家蚕二分浓核病毒ns1基因序列的改造、表达和鉴定
徐 五, 周 倩, 胡朝阳, 李国辉, 姚 勤*
(江苏大学 生命科学研究院, 江苏 镇江 212013)
探讨翻译起始区(TIR)部分密码子发生同义突变后,对家蚕二分浓核病毒(BmBDV)ns1基因表达的影响,以及对BmBDV NS1蛋白毒性进行鉴定,设计特异性上游引物,对BmBDVns1基因中第3、4、9和10个密码子进行同义突变,利用原核表达系统对野生型和改造后的ns1序列进行表达,通过SDS-PAGE电泳对这两种序列的表达产量进行分析。利用ProteinIsoTMGST Resin从超声破碎的菌液上清中纯化融合有GST的NS1蛋白,进而对纯化的靶蛋白在细胞水平和家蚕体内进行毒性分析。结果表明:TIR突变后的BmBDVns1 序列,其与野生型序列的表达产量之间没有明显差异;BmBDV NS1蛋白具有抑制细胞增殖和诱导家蚕致死的生化活性。
翻译起始区;家蚕二分浓核病毒;NS1蛋白;表达;鉴定;毒性
家蚕二分浓核病毒(BmBDV)是一种单链DNA病毒,含有两个线性的单链基因组片段VD1(6 543 nt)和VD2(6 022 nt),分别被包装入不同的核衣壳中[1-2]。该病毒特异性地感染家蚕中肠柱状上皮细胞,并在家蚕群体间进行交叉感染,导致家蚕群体爆发浓核病症,给蚕桑养殖户带来较大的经济损失[3]。家蚕二分浓核病毒编码一个以蛋白质为引物的B家族 DNA 聚合酶(pPolB),与腺病毒、φ29 DNA聚合酶同源,同属于以蛋白为引物的DNA聚合酶B家族,Peter and Max 曾推测BmBDV采用类似腺病毒的DNA复制方式[4-5],但BmBDV感染和增殖的具体分子机制尚不清楚;另外,Li等[3]曾报道BmBDV编码的非结构蛋白NS1具有解旋酶、ATPase酶及特定DNA序列结合的活性,与病毒DNA复制、基因转录以及与宿主间的相互作用等生化活动密切相关。因此,对BmBDV编码的一些非结构蛋白功能进行深入研究,有助于揭示BmBDV增殖的分子机制及宿主与该病毒之间的相互作用。BmBDVns1基因序列全长951 bp,其对应的氨基酸序列长度为316 aa,理论分子量为36.5 kD、等电点为 8.70。研究表明:BmBDV NS1蛋白是一个磷酸化蛋白,其磷酸化修饰可用来调控该蛋白的生化活性,进而对病毒DNA的复制、基因表达调控以及与宿主间的相互作用进行调控[6-7]。已有文献报道:细小病毒非结构蛋白 NS1可激活宿主Caspase蛋白的活性,使细胞周期停滞在 G1、S或 G2 期,从而导致细胞 DNA损伤和细胞凋亡等病理现象[8-9]。使用频率较低的密码子进行同义突变,利用原核表达系统对野生型以及改造后的序列进行表达,进而分析翻译起始区内的突变对蛋白表达产量的影响。另外,利用亲和层析对超声破碎后的菌体上清中的靶蛋白进行纯化,将纯化后的BmBDV NS1蛋白添加到昆虫细胞培养基中或皮下注射到家蚕血液中,观察细胞形态变化和家蚕的表型变化,进而来分析BmBDV NS1蛋白对细胞及家蚕生长的影响。
1 材料与方法
1.1 材料
1.1.1 菌种、质粒和家蚕 表达质粒pGEX-5X-3 购自GE公司;大肠埃希菌 DH5α和宿主表达菌 BL21( DE3)购自 Novagen;BmBDVns1基因由本实验室保存;306品系家蚕由本实验室进行孵化和饲养。
1.1.2 试剂Taq酶、限制性核酸内切酶EcoR I和XhoI、T4DNA ligase、pMD18-T载体以及250 bp DNA Ladder Marker购自TaKaRa公司;质粒提取和胶回收试剂盒购自Omega公司;丙烯酰胺和N, N-亚甲基双丙烯酰胺购自上海生物工程有限公司;蛋白质预染Marker购自Fermentas 公司;碱性磷酸酶标记的马抗小鼠IgG购自北京中杉金桥生物技术有限公司,BCIP/NBT碱性磷酸酯酶显色试剂盒购自海门碧云天生物技术有限公司;氨卞青霉素(Amp)和IPTG均购自上海朝瑞生物公司。
1.2 方法
1.2.1 引物设计 通过在线软件www.gcua.de对家蚕二分浓核病毒(BmBDV)ns1基因中各密码子在大肠埃希菌E.coli中的使用频率进行预测,结果发现ns1基因中第3(TCG/Ser)、4(AAG/Lys)、8(ATA/Ile)和第9(CTA/Leu)个密码子的使用频率在55%以下,在不改变氨基酸编码的情况下,分别将它们突变为(TCA/Ser)、(AAA/Lys)、(ATC/Ile)和(CTG/Leu)。为获得BmBDVns1的突变序列,通过Primer Premier 5 软件,设计2条特异性引物,NS1M-F: 5′-CGGAATTCCATGGAATCAAAATCAAATTTCCGTATCCTGTCA-3′ (Eco-R I)和NS1-R:5′-CCCTCGAGCTACCCATAATATTTATTATATACGTTTACAAAATT-3′(XhoI)。另外,针对BmBDVns1野生型序列设计一条上游引物,NS1W-F:5′-CGGAATTCCATGGAATCGAAGTCAA-ATTTCCGTATACTATCA-3′(EcoR I)。
1.2.2 重组表达载体的构建 分别以NS1M-F/NS1-R、NS1W-F/NS1-R为引物对,以BmBDV病毒基因组为模板,进行PCR扩增,将扩增的BmBDVns1突变型序列片段和野生型序列片段进行纯化,将纯化后的目的片段分别与pMD18-T载体进行连接,将连接产物转化感受态细胞DH5α、并将转化产物均匀涂抹在添加有氨苄青霉素抗性的平板,次日挑取平板上的克隆进行培养,并对其进行PCR、酶切鉴定以及序列测定,将鉴定正确的重组子分别命名为pMD18-T-NS1M和pMD18-T-NS1W。分别提取重组质粒pMD18-T-NS1M和pMD18-T-NS1W,对其分别进行EcoR I 和XhoI双酶切,对酶切后的目的片段进行纯化,将纯化后的DNA片段NS1M与NS1W分别与EcoR I /XhoI双酶切后的pGEX-5X-3载体进行连接,将连接产物分别转化感受态细胞DH5α,将转化产物涂抹在氨苄抗性的平板上,次日对平板上的克隆进行培养和鉴定,将鉴定后的重组子命名为pGEX-5X-3-NS1M和pGEX-5X-3-NS1W。
1.2.3 重组子的诱导表达及分析 将重组质粒pGEX-5X-3-NS1M和pGEX-5X-3-NS1W分别转化宿主表达菌BL21(DE3),将转化产物分别涂抹在氨苄平板上37 ℃过夜培养,次日挑取平板上的克隆在LB液体培养基中进行振荡培养。分别将培养后的菌液转接到100 mL LB液体培养基中,当培养的菌液OD600值至0.6时,分别添加IPTG至终浓度为0.8 mmol/L,在20 ℃低温中继续振荡培养8~12 h,对诱导后的菌液进行离心,收集后的菌体进行超声破碎,破碎后的菌液通过离心收集上清溶液,利用ProteinIsoTMGST Resin柱子,从超声破碎菌液上清中特异性地纯化出融合GST的NS1蛋白,对纯化的BmBDV NS1蛋白进行SDS-PAGE和Western blot分析,将SDS-PAGE胶上的蛋白点抠出,对其进行质谱鉴定。
1.2.4BmBDV NS1蛋白对BmN细胞增殖和家蚕生长的影响 将(1×105)BmN细胞接种在6孔细胞培养板中,每个孔中添加2 mL新鲜培养基,同时将纯化的BmBDV NS1蛋白添加到BmN细胞培养液中,其添加的蛋白量为32 g,分别以添加空白对照菌的洗脱液、小牛血清白蛋白和不加任何外源蛋白处理的细胞为对照,待培养72 h后,对培养的BmN细胞进行显微观察并拍照。另外,将纯化的BmBDV NS1蛋白(32 g)皮下注射30只5龄家蚕,以空白对照菌的洗脱液皮下注射30只家蚕作为阴性对照,另外,以小牛血清白蛋白(32 g)皮下注射30只家蚕作另一阴性对照,将注射后的家蚕在27 ℃中进行饲养观察,将这些经过处理的家蚕与未经任何处理的健康家蚕进行比较。
2 结果与分析
2.1BmBDVns1序列分析
BmBDVns1基因全长951 bp,编码一个序列为316个氨基酸的蛋白,其理论分子量为36.5 kD(图1)。利用在线软件Netphos 2.0 software (http://www.expasy.ch)对该蛋白序列进行磷酸化预测,结果表明BmBDV NS1氨基酸序列上有多个磷酸化修饰位点。利用在线软件SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)对BmBDV NS1氨基酸序列进行入核信号肽预测,结果表明该序列中没有典型的入核信号,通过Editseq软件对BmBDV NS1前100个氨基酸进行分析,发现该区域富含碱性氨基酸,其等电点为9.97,推测与该蛋白入核活性有关。

图1 BmBDV ns1基因序列及其对应的氨基酸序列Fig.1 The sequence of BmBDV ns1 and the deduced amino acid sequence
通过在线软件www.gcua.de对BmBDVns1序列在大肠埃希菌中的密码子使用频率进行分析,结果(图2A)表明:BmBDVns1基因序列中第3个密码子TCG、第4个密码子AAG、第9个密码子ATA和第10个密码子CTA在大肠埃希菌中的使用频率分别为55%、41%、45%和16%,如果将这4个密码子分别进行同义突变,突变后的密码子为TCA、AAA、ATC和CTG,在大肠埃希菌中的使用频率分别变为90%、100%、66%和100%(图2B)。
2.2BmBDVns1基因的原核表达和产物鉴定
如图3所示,对重组质粒pMD18-T-ns1(M)和pMD18-T-ns1(W)分别进行EcoR I/XhoI双酶切,结果表明:野生型BmBDVns1(W)和翻译起始区发生突变的BmBDVns1(M)都与pMD18-T连接;对重组质粒pGEX-5X-3-ns1(M)和pGEX-5X-3-ns1(W) 分别进行EcoR I/XhoI双酶切,结果表明:野生型BmBDVns1(W)和翻译起始区发生突变的BmBDVns1(M)都与pGEX-5X-3载体连接。
分别对含有pGEX-5X-3-NS1M和pGEX-5X-3-NS1W重组质粒的菌液进行IPTG诱导,对诱导后的菌体上清和菌体沉淀分别进行SDS-PAGE和Western blot分析,结果表明:BmBDV NS1蛋白成功获得表达,主要以可溶形式存在上清溶液中(图3C lane 2和lane 4),其中泳道2中的靶蛋白量与泳道4中靶蛋白量相近,说明BmBDVns1基因翻译起始区突变后,未见显著提高其在宿主菌中的表达量。Western blot结果(图3D)进一步证明:图3C lane 2和lane 4中60 kD位置的蛋白为靶蛋白。
2.3BmBDV NS1蛋白纯化和质谱鉴定
将表达菌进行超声破碎,利用GST柱子从裂解液上清中纯化BmBDV NS1蛋白,通过含不同浓度的还原型谷胱甘肽缓冲液对富集靶蛋白的柱子进行洗脱,收集系列BmBDV NS1蛋白流出液,通过SDS-PAGE电泳对这些流出液成分进行分析,结果表明(图4A):泳道1和泳道2分别为宿主表达菌总蛋白和与柱子结合后的蛋白流出液,而泳道3~7中分别为收集的靶蛋白,其大小与靶蛋白理论大小相一致。将泳道3中的蛋白条带抠出,对其进行质谱分析,结果表明:有五个肽段被检测到,它们都是BmBDV NS1序列中的肽段,表明纯化的蛋白为BmBDV NS1。
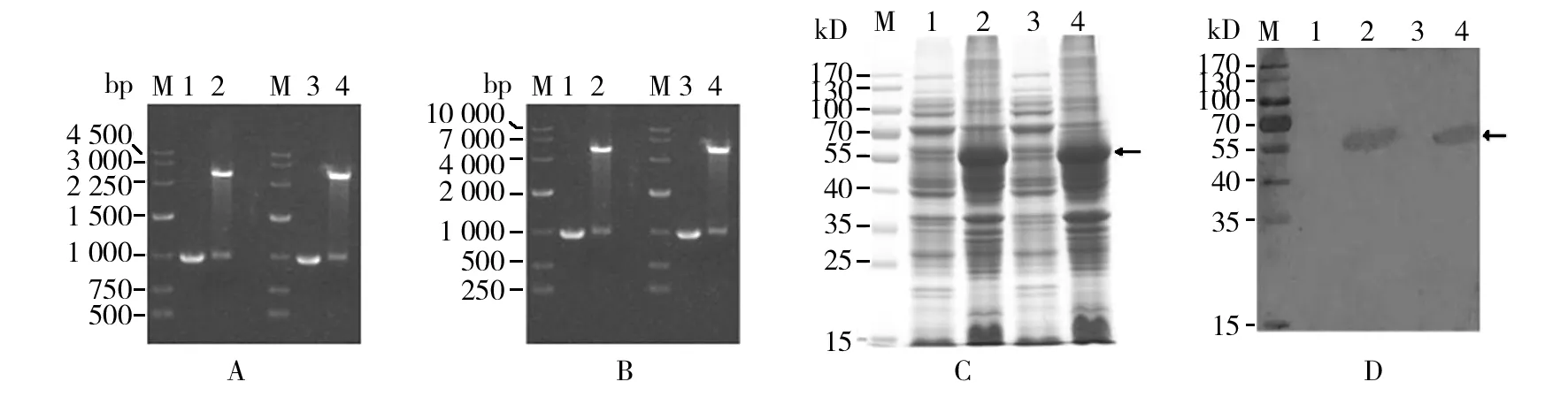
图3 BmBDV ns1表达载体的构建和靶蛋白的表达分析Fig.3 Construction of expression vector pGEX-5X-3-ns1, SDS-PAGE analysis of target protein expressed in E.coli and confirmed by Western blot analysisA:重组质粒pMD18-T-ns1(W) 和 pMD18-T-ns1(M)的鉴定;M:DNA Marker;1:BmBDV ns1(W)片段的PCR扩增;2:pMD18-T- ns1(W)质粒EcoR I/Xho I的双酶切电泳图;3: BmBDV ns1(M)片段的PCR扩增;4:pMD18-T-ns1(M)质粒EcoR I/Xho I的双酶切电泳图B:重组质粒pGEX-5X-3 ns1(W) 和 pGEX-5X-3 ns1(M)的鉴定;M: DNA Marker;1:BmBDV ns1(W)片段的PCR扩增;2:pGEX-5X-3 ns1(W)质粒EcoR I/Xho I的双酶切电泳图;3:BmBDV ns1(M)片段的PCR扩增;4:pGEX-5X-3-ns1(M)质粒EcoR I/Xho I的双酶切电泳图C:靶蛋白原核表达的SDS-PAGE电泳图;1、3:空白对照菌总蛋白的SDS-PAGE电泳图;2、4:pGEX-5X-3-ns1(W) 及 pGEX-5X-3-ns1(M)质粒在大肠埃希菌中的诱导表达D: 目的蛋白的Western blot 分析;M:蛋白Marker;2、4;BmBDV NS1抗体对靶蛋白的检测A:Identification of recombinant plasmids pMD18-T-ns1(W) and pMD18-T-ns1(M); M:DNA Marker; 1: DNA fragment of amplified from BmBDV ns1(W); 2: pMD18-T- ns1(W) digested with EcoR I/Xho I; 3: DNA fragment of BmBDV ns1(M) 4: pMD18-T-ns1(M) digested with EcoR I/Xho I B:Identification of recombinant plasmids pGEX-5X-3 ns1(W) and pGEX-5X-3 ns1(M); M: DNA Marker; 1: PCR product of BmBDV ns1(W); 2: pGEX-5X-3 ns1(W) digested with EcoR I/Xho I; 3: PCR product of BmBDV ns1(M); 4: pGEX-5X-3-ns1(M) digested with EcoR I/XhoIC: SDS-PAGE analysis of target protein expressed in E.coli; 1, 3:The induced product of E.coli harboring blank vector; 2, 4: The induced product of E.coli harboring pGEX-5X-3-ns1(W) or pGEX-5X-3-ns1(M)D: Western blot analysis of target protein; M: Protein Marker; 2, 4: Target protein was examined using antibodies against BmBDV NS1

图4 纯化的BmBDV NS1蛋白SDS-PAGE和质谱分析Fig.4 SDS-PAGE analysis of purified fractions from the lysate of E.coli and purified protein subjected to MS analysisA: BmBDV NS1蛋白收集液的SDS-PAGE电泳分析;M:蛋白Marker;1:含有目的质粒大肠埃希菌裂解上清的总蛋白;2:从凝胶柱子中收集的上样流出液;3~7:从凝胶柱子中收集洗脱后的蛋白流出液;B:对纯化的靶蛋白的质谱分析,下划线所标示的肽段为BmBDV NS1中被检测到的肽段A:SDS-PAGE analysis of the collected fractions containing BmBDV NS1 protein; M:Protein Marker 1: Total protein form E.coli harboring target plasmid; 2:The effluent fraction from the affinity column; 3-7:Collected elution fractions from the affinity column;B: Analysis of the target protein by mass spectrometry. The detected peptides from the BmBDV NS1 are indicated with underline
2.4BmBDV NS1蛋白对BmN细胞和家蚕生长的影响
将纯化的BmBDV NS1蛋白添加到BmN细胞中,27 ℃连续培养3 d后,对其进行光学显微观察(图5A)。其结果表明:BmBDV NS1蛋白会影响BmN细胞的正常生长, BmN细胞的增殖明显受到抑制,培养孔中的细胞呈零星状态,细胞表面粗糙,而其他对照中的细胞都能正常增殖,其细胞状态都较好,细胞边缘光滑圆润,推测BmBDV NS1蛋白对BmN细胞增殖具有副作用。
为进一步测定BmBDV NS1蛋白对家蚕个体生长的影响,将纯化的靶蛋白通过皮下注射进入家蚕血液中,同时将空白对照菌的洗脱流出液和BSA蛋白分别注射入家蚕血液中用作阴性对照(图5B)。结果表明:24 h后,注射BmBDV NS1蛋白的家蚕全部死亡,其身体呈透明状,身体后半部分略显黄色;而注射不含靶蛋白的洗脱流出液的家蚕对照组中,其个体全都是活的,能正常取食桑叶;为排除家蚕死亡是因为血液中注射过量的异源蛋白,本研究中又对家蚕皮下注射等量的BSA蛋白,对其培养24 h后,发现这些家蚕与没有经过任何处理的健康家蚕无明显差异,其行动和取食仍能正常进行,说明BmBDV NS1蛋白对家蚕确实具有致死作用。
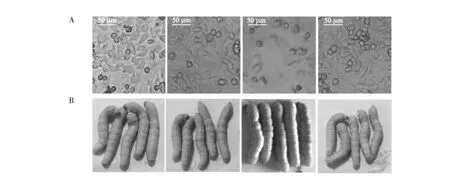
图5 BmBDV NS1对BmN细胞增殖和家蚕生长的影响Fig.5 Effect of BmBDV NS1on the growth of BmN cells and silkwormA:BmBDV NS1蛋白对BmN细胞增殖的影响;B:BmBDV NS1蛋白对家蚕生长发育的影响A:Effect of BmBDV NS1 on the proliferation of BmN cells; B:Effect of BmBDV NS1 on the growth of silkworm
3 讨 论
基因工程中常用的表达系统有酵母表达系统、杆状病毒-昆虫细胞表达系统、哺乳动物细胞表达系统和原核表达系统[10-12]。与真核表达系统相比,原核表达系统操作简单,所需费用相对低廉,周期短,尤其是外源基因在原核表达系统中的表达产量相对较高,因此在对外源基因进行表达时,科研人员往往首选原核表达系统,但鉴于部分表达产物是以包涵体形式存在,这种形式的产物没有生物活性、且缺乏翻译后修饰,在一定程度上限制了原核表达系统的进一步应用。然而到目前为止,还没有一种通用的策略能解决所面临的所有问题。科研人员为此也做了许多努力,对其进行改进,比如共表达分子伴侣、培养条件的优化、宿主菌的改变、新颖工程载体的构建以及选取合适的启动子强度等[13-15]。
研究表明[16-17]:靶基因翻译起始区(TIR)的二级结构和密码子的偏好性与靶基因的表达水平密切相关,其附近80个碱基所形成类似发夹等二级结构严重阻滞了翻译起始的顺利进行,直接影响了靶蛋白合成的起始速率,成为靶蛋白表达产量的一个重要影响因素。因此, 为提高靶基因的翻译起始效率, 本研究通过生物在线软件对BmBDVns1前15个密码子在大肠埃希菌中的使用频率进行分析, 在确保氨基酸序列一致的情况下, 使用大肠埃希菌偏好的密码子和降低mRNA二级结构的复杂程度为原则,对其基因序列进行改造,以期增强靶基因的翻译起始效率, 提高目的基因的表达产量。本研究尽管将BmBDVns1翻译起始区的部分密码子突变为大肠埃希菌中使用的高频密码子,但SDS-PAGE结果表明:其在大肠埃希菌中的表达产量与野生型序列的表达产量没有明显差异,推测其表达产量与BmBDV NS1蛋白的生化特性有关,当其表达产量达到一定的临界状态时,会显著地影响大肠埃希菌的生理活性,从而影响外源基因的表达产量。
越来越多的研究表明:细小病毒 NS1蛋白具有毒理效应,能够诱导细胞发生凋亡,激活胞内的Caspase蛋白酶,从而导致细胞凋亡或宿主发生病理效应。Hsu等[19]报道:在人细小病毒B19 感染的红细胞中,NS1蛋白招募线粒体中的Bax和Bad两种死亡蛋白,进而上调胞内caspase-3和caspase-9蛋白的活性,从而诱导细胞凋亡。鼠细小病毒(MVM) NS1蛋白毒力与其磷酸化修饰有关,T585 磷酸化位点的突变会降低其毒性,而S588磷酸化位点的突变却能增强NS1蛋白的细胞毒性[20];MVM NS1蛋白通过改变原肌球蛋白磷酸化的修饰位点,促使细胞骨架中的微丝和中间丝重排与解聚,从而导致细胞裂解,这种病理效应与CKII 基因有关,而缺失CKII 基因的A9成纤维细胞能逃逸NS1蛋白诱导的细胞病变[21-22]。在昆虫细胞中表达黑胸大蠊浓核病毒(Periplaneta fuliginosa densovirus,PfDNV) NS1 能抑制宿主细胞基因的表达,而NS1和PfDNV 的另外两种非结构蛋白的共表达能导致细胞坏死[23]。细小病毒H-1能诱导胸腺肿瘤细胞凋亡,该病变效应被报道与病毒编码的NS1蛋白及其磷酸化毒性直接相关,从而有望成为临床上抗肿瘤治疗的有效候选靶标[24]。
BmBDV NS1蛋白与细小病毒NS1蛋白高度同源,推测该蛋白具有类似细小病毒NS1蛋白的细胞毒性效应,为此,本研究将纯化的BmBDV NS1蛋白添加到细胞培养基中,结果发现:BmN细胞增殖明显受到抑制,细胞形态发生显著改变,BmBDV NS1蛋白能诱导家蚕致死,推测BmBDV NS1蛋白具有一定的细胞毒性,诱导BmN细胞发生了病变效应;然而,BmBDV NS1蛋白如何诱导BmN细胞和家蚕发生病理效应,其具体作用机制有待于进一步研究。
[1] Wang YJ, Yao Q, Chen KP, et al. Characterization of the genome structure ofBombyxmoridensovirus (China isolate)[J]. Virus Genes, 2007, 35(1):103-108.
[2] Li G, Sun C, Zhang J, et al. Characterization ofBombyxmoriparvo-like virus non-structural protein NS1[J]. Virus Genes, 2009, 39:396-402.
[3] 胡朝阳, 李国辉, 李光田, 等. 家蚕二分浓核病毒综述[J]. 科学通报,2013, 58(1):1-6.
[4] Hayakawa T, Kojima K, Nonaka K, et al. Analysis of proteins encoded in the bipartite genome of a new type of parvo-like virus isolated from silkworm-structural protein with DNA polymerase motif[J]. Virus Res, 2000, 66(1):101-108.
[5] Peter Tijssen, Max Bergoin. Densonucleosis viruses constitute an increasingly diversified subfamily among the parvoviruses[J]. seminars in VIROLOGY, 1995,6: 347-355.
[6] Li G, Li M, Wang P, et al. Characterization of recombinant expression ofBombyxmoribidensovirusns1 using a modified vector[J]. Acta Biochim Pol, 2014, 61(4):787-794.
[7] 李芒芒, 周倩, 王鹏, 等. 磷酸化病毒蛋白的生物学功能及形成机制[J]. 微生物学通报, 2015, 42(6): 1133-1140.
[8] Nüesch JP, Rommelaere J. NS1 interaction with CKII alpha: novel protein complex mediating parvovirus-induced cytotoxicity[J]. J Virol, 2006, 80(10):4729-4739.
[9] Poole BD, Zhou J, Grote A, et al. Apoptosis of liver-derived cells induced by parvovirus B19 nonstructural protein[J]. J Virol, 2006, 80(8):4114-4121.
[11]Belzhelarskaia SN. Baculovirus expression systems for recombinant protein production in insect and mammalian cells[J]. Mol Biol (Mosk), 2011,45(1):142-159.
[12]Looser V, Bruhlmann B, Bumbak F, et al. Cultivation strategies to enhance productivity of Pichia pastoris: A review[J]. Biotechnol Adv, 2015, 33(6 Pt 2):1177-1193.
[13]Peleg Y, Unger T. Resolving bottlenecks for recombinant protein expression inE.coli[J]. Methods Mol Biol, 2012, 800:173-186.
[14]Gopal GJ, Kumar A. Strategies for the production of recombinant protein inEscherichiacoli[J]. Protein J, 2013, 32(6):419-425.
[15]Arya R, Sabir JS, Bora RS, et al.Optimization of culture parameters and novel strategies to improve protein solubility[J]. Methods Mol Biol, 2015, 1258:45-63.
[16]Gualerzi CO, Pon CL. Initiation of mRNA translation in bacteria: structural and dynamic aspects[J]. Cell Mol Life Sci, 2015, 72(22):4341-4367.
[17]Simonetti A, Marzi S, Jenner L, et al. A structural view of translation initiation in bacteria[J]. Cell Mol Life Sci, 2009, 66(3):423-436.
[18]Wang S, Zhang R, Geng Y, et al. Improved expression and catalytic efficiency of (R)-carbonyl reductase inEscherichiacoliby secondary structure optimization of mRNA translation initiation region[J]. Sheng Wu Gong Cheng Xue Bao, 2009, 25(12):1907-1913.
[19]Hsu TC, Wu WJ, Chen MC, et al. Human parvovirus B19 non-structural protein (NS1) induces apoptosis through mitochondria cell death pathway in COS-7 cells[J]. Scand J Infect Dis, 2004, 36(8):570-577.
[21]Nüesch JP, Rommelaere J. A viral adaptor protein modulating casein kinase II activity induces cytopathic effects in permissive cells[J]. Proc Natl Acad Sci U S A, 2007, 104(30):12482-12487.
[22]Nüesch JP, Rommelaere J. NS1 interaction with CKII alpha: novel protein complex mediating parvovirus-induced cytotoxicity[J]. J Virol, 2006, 80(10):4729-4739.
[23]Yang B, Cai D, Yu P, et al. Non-structural proteins ofPeriplanetafuliginosadensovirus inhibit cellular gene expression and induce necrosis in Sf9 cell cultures[J]. Virus Genes, 2009, 38(3):478-486.
[24]Muharram G, Le Rhun E, Loison I, et al. Parvovirus H-1 induces cytopathic effects in breast carcinoma-derived cultures[J]. Breast Cancer Res Treat, 2010, 121(1):23-33.
Modification, Expression ofBombyxmoriBidensovirusns1 Gene and Characterization
XU Wu, ZHOU Qian, HU Zhao-yang, LI Guo-hui, YAO Qin
(Inst.ofLifeSci.,JiangsuUni.,Zhenjiang212013)
In order to investigate the effects of part of codons after happening synonymous mutation in the translational initiation region (TIR) ofBmBDV (Bombyxmoribidensovirus)ns1 gene on its expression, as well as to characterize the virulence ofBmBDV NS1 protein, specific upstream primer was specially designed, and carry out four synonymous mutations at 3rd, 4th, 9th and 10th codons of theBmBDVns1 gene; and express thens1 sequence using prokaryotic expression method on its wild type and the one after modification, then analyze the expression quantity of these two sequences with SDS-PAGE electrophoresis. NS1 protein merged with GST was purified from ultrasound-breaking cell broth usingProteinIsoTMGST Resin, and carried out virulence analysis on target protein at cell level and inB.moriinvivo. The results showed that there is no significant difference between expression quantity ofBmBDVns1 sequence after TIR mutation and sequence of wild type;BmBDV NS1 protein had biochemical activities of the inhibition against cell proliferation and silkworm death-inducing.
translational initiation region;Bombyxmoribidensovirus; NS1 protein; expression; characterization; virulence
国家自然科学基金项目(31270192, 31272507)
徐五 男,硕士研究生。研究方向为分子病毒学。E-mail:54the5@163.com
* 通讯作者。女,研究员,博士生导师。从事分子病毒学研究。Tel: 0511-88791702, E-mail:yaoqin@ujs.edu.cn
2016-03-30;
2016-06-07
Q78
A
1005-7021(2017)01-0028-08
10.3969/j.issn.1005-7021.2017.01.005

