海洋短小枯草芽胞杆菌的鉴定及抑菌活性分析
陈 香, 唐彤彤, 孙 星, 刘 勤*
(1.中国科学院 南京土壤研究所,江苏 南京 210008;2.中国科学院大学,北京 100049)
海洋短小枯草芽胞杆菌的鉴定及抑菌活性分析
陈 香1,2, 唐彤彤1,2, 孙 星1, 刘 勤1*
(1.中国科学院 南京土壤研究所,江苏 南京 210008;2.中国科学院大学,北京 100049)
对从连云港东西连岛海泥样品中分离得到的菌株BacilluspumilusHX2-2的分类地位、生长条件和抑菌活性进行了研究。经过形态特征、生理生化性质及16S rDNA序列分析鉴定,该菌属于短小芽胞杆菌。不同温度、盐度、pH培养条件下测定菌液吸光度OD600值,表明该菌是一株轻度嗜盐菌,最适温度、盐度、pH分别为30 ℃、3%、7.0~8.0。在不同病原真菌的平板抑菌活性试验中,该菌对草莓尖胞镰刀菌、马铃薯炭疽病菌和水稻立枯丝核菌表现出显著的抑菌作用。菌株B.pumilusHX2-2是一株短小芽胞杆菌,具有广谱抑菌活性,具有进一步研究的价值。
短小芽胞杆菌B.pumilusHX2-2;菌种鉴定;16S rDNA;抑菌活性
海洋微生物长期生活在高压、高盐、贫营养、低温等特殊的海洋环境中,因此具有独特的代谢途径,能够产生完全不同于陆地微生物的结构新颖、功能独特的生物活性物质[1-2]。海洋微生物能够分泌抗生素、胞外酶、胞外毒素等多种活性物质,这些物质具有抗菌、溶菌、抑藻和抗肿瘤等作用,因此分离鉴定具有生物活性物质的海洋微生物已成为国内外研究的热点[3-4]。海洋微生物是海洋活性物质的重要来源,芽胞杆菌是目前发现的具有开发应用前景的菌种之一,关于芽胞杆菌的研究报道表明,其产生的胞外活性物质对病原菌具有明显的拮抗作用,是研发利用生防菌剂防治植物病害的热点研究方向[5]。微生物生态平衡的破坏,病原菌的感染成为影响设施农业土传病害的主要原因之一。化学农药的施用不仅不能有效根治由致病菌引起的土传病害,而且造成化学农药的残留污染环境,甚至使病原菌产生抗药性,杀死有益微生物[6-7]。近年来,利用对病原菌具有拮抗活性的生防菌或其代谢产物进行生物防治成为一种绿色、有效的新手段[8]。研究表明,从海洋微生物中筛选根际促生菌的能力远高于陆地微生物,并且短小芽胞杆菌(Bacilluspumilus)产生的胞子抗逆性强,繁殖速度快[9-10];具有较宽的抑菌谱,对多种病原菌有抑制作用,常被用来制成菌剂防治植物病害[11-13]。Swarding等[14]发现了短小芽胞杆菌B.pumilusNClMB13374对草莓多种病原菌有抑制作用,是一种具有生物防治潜力的菌株 ;Akhtar等[15]报道了短小芽胞杆菌的生物制剂对鹰嘴豆根腐病有很好的防治效果;Xinqi等[5]通过绿色荧光蛋白标记等方法发现接种短小芽胞杆菌B.pumilusSOR-N43的发酵有机肥在黄瓜根部定殖能力较强,能够诱导立枯丝核菌RhizoctoniasolaniQ1 菌丝变形、细胞膨胀、细胞质泄露,是一种有效的拮抗菌剂。因此,可以看出短小芽胞杆菌对植物致病菌防治利用方面有很好的应用前景。从连云港东西连岛海域的海泥中筛选出一株具有抑菌活性的海洋细菌,通过对该菌的形态特征、生理生化特征、培养特征以及16S rDNA序列测定,表明该菌属于短小芽胞杆菌,初步研究了该菌对不同致病菌的平板抑菌效果,为进一步研究该菌及其对植物病害的防治提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 生防菌为短小芽胞杆菌B.pumilusHX2-2,从连云港东西连岛海域海泥中筛选得到,由本实验室保存。植物致病菌有黄瓜枯萎病菌(Fusariumoxysporumfsp.cucumerinumOwen)、草莓尖胞镰刀菌(Pestalotiopsisphotiniae)、马铃薯炭疽病菌(Colletotrichumcoccodes)、水稻立枯丝核菌(Fusariumgraminearum)、小麦禾谷镰刀菌(Rhizoctoniasolani)、板栗围小丛壳菌(Glomerellacingulate),由南京农业大学果树生物技术实验室提供。
1.1.2 培养基[16]2216E培养基用于海洋细菌的分离;PDA培养基用于培养真菌;用陈海水配置的NA培养基:蛋白胨5 g,酵母粉1 g,牛肉膏3 g,葡萄糖10 g,琼脂20 g,陈海水1 000 mL,pH 7.0~8.0,用于测定抑菌活性。
1.2 方法
1.2.1 菌株分离和纯化 采取连云港东西连岛海域海泥样品。将海泥用无菌生理盐水按1∶10(体积比)的比例稀释制成悬液,稀释10倍后备用。取100 μL稀释悬液,用涂布法在2216E培养基上分离,观察平板上不同菌落的形态特征和生长情况,挑取生长良好的乳黄色菌落在2216E培养基上划线纯化,30 ℃培养48~72 h。最后划线得到的单一菌落用试管保存法和甘油管保存法分别置于4 ℃和-20 ℃的冰箱保存。
1.2.2 菌株鉴定 ① 菌株形态观察: 将分离纯化的菌株在2216E培养基上划线,30 ℃培养48~72 h,观察菌落的颜色、大小、形状等特征,同时进行革兰染色观察。利用穿刺培养法,将菌株接种于半固体培养基中,30 ℃培养48 h,观察菌株的生长情况,确定菌株是否具有运动性。② 菌株理化鉴定: 参照《常见细菌系统鉴定手册》[17]和《伯杰氏细菌鉴定手册》(第9版)[18]所提供的方法对菌株B.pumilusHX2-2进行生理生化特性分析。③菌株16S rDNA序列测定和构建发育树: 菌株B.pumilusHX2-2基因组DNA提取采用OMEGA提供的Bacterial DNA kit(50) 试剂盒。PCR扩增引物:27 F (5′-AGAGTTTGATCCTGGCTCAG-3′),1492 R (5′-TACGGCTACCTTGTTACGACTT-3′)用于扩增16S rDNA基因。 PCR反应体系(100 μL):10×PCR缓冲液1 μL,dNTP(20 mmol/L)5 μL,MgCl2(25 mmol/L)8 μL,引物(20 μmol/L)各2 μL,DNA模板1 μL,Taq酶(175 U/μL)1 μL,双蒸水80 μL。扩增条件:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,循环30次,72 ℃后延伸5 min。扩增后吸取2 μL PCR反应液,于1%琼脂糖凝胶电泳中进行电泳分析结果,将PCR产物送华大基因公司测序。将测序得到的16S rDNA序列提交到GenBank进行BLASTN相似性对比,选择将相似性较高的序列采用Clustal X 2.1进行多序列比对,并用MEGA5.0软件采用邻接法(Neighbor-Joining)构建发育树。
1.2.3 菌株生长条件优化 ① 制备菌株种子液: 将试管保存的短小芽胞杆菌B.pumilusHX2-2转接到2216E培养基,30 ℃活化48 h。挑取活化好的菌株B.pumilusHX2-2的单菌落,接入装有2216E液体培养基的三角瓶中,30 ℃、180 r/min下培养24 h,菌液菌量为108cfu/mL。②不同温度、盐度、pH对菌株生长的影响:将制备好的菌株B.pumilusHX2-2的种子液,按1%(体积分数)的接种量接入装有50 mL 2216E培养液的250 mL三角瓶中,分别放置在不同温度(10、20、25、30、35、40、45 ℃)中,180 r/min培养24 h,测定不同培养温度下培养液的OD600值,各处理重复3次,以不接菌的2216E液体培养基作为空白对照。按1%(体积分数)接种量将菌株B.pumilusHX2-2的种子液,分别转接到不同盐度(1%、3%、5%、7%、10%、13%、15%,质量分数)的2216E培养液中,30 ℃、180 r/min震荡培养24 h,测定不同NaCl浓度下培养液OD600值,各处理重复3次,以不接菌的2216E液体培养基作为空白对照。将菌株B.pumilusHX2-2的种子液以1%(体积分数)接种量,转接到含最适NaCl浓度,pH值不同(4.0、5.0、6.0、7.0、8.0、9.0、10.0)的2216E液体培养基中,30 ℃、180 r/min震荡培养24 h,测定不同pH下培养液的OD600值,各处理重复3次,以不接菌的2216E液体培养基作为空白对照。
1.2.4 菌株抑菌活性测定 用平板对峙法[19]测定海洋短小芽胞杆菌B.pumilusHX2-2的抑菌活性,挑取短小芽胞杆菌B.pumilusHX2-2单菌落,接到2216E液体培养基,30 ℃、180 r/min震荡培养24 h,菌量为108cfu/mL。用陈海水配置NA琼脂培养基,培养基温度降至45 ℃时,吸取制备好的菌株发酵液按1∶20(体积比)的比例转接到NS琼脂培养基中,混匀后倒平板。然后用直径5 mm的打孔器,打取圆形的病原菌菌苔接种到涂有拮抗菌的PDA平板上,同时以不涂拮抗菌的病原菌平板为对照,各个处理做3次重复。放置于30 ℃恒温箱培养,直到对照组的病原菌长满平板时,用十字交叉法分别测量对照组平板和供试组平板的真菌菌落直径,计算抑菌率。供试菌抑菌率=(对照平板真菌直径-供试平板真菌直径)/(对照平板真菌直径)×100%。
2 结果与分析
2.1 菌株B.pumilusHX2-2的形态观察
从连云港东西连岛海域采集的海泥样品,采用平板稀释和涂布的方法分离出一株具有代表性的乳黄色的单菌落。菌株B.pumilusHX2-2在2216E培养基上为圆形、低凸、边缘整齐,菌落直径1~3 mm,表面光滑湿润;显微镜下呈杆状(图1),菌体长1.4~4.0 μm,宽0.4~0.5 μm,有鞭毛,能运动。

图1 菌株B. pumilus HX2-2在油镜下的形态
2.2 菌株生理生化特征
菌株B.pumilusHX2-2的生理生化特性结果如表1所示。菌株B.pumilusHX2-2为革兰阳性菌,能分解利用葡萄糖、乳糖、蔗糖、甘露醇,可以水解淀粉、纤维素,菌株的甲基红(M.R.)、乙酰甲基甲醇(V.P.)、柠檬酸盐反应呈阳性;菌株可以分解利用牛肉膏、酵母粉、蛋白胨作为唯一氮源,能分解明胶,产硫化氢,石蕊牛乳和硝酸盐还原反应呈阳性,吲哚反应为阴性;能够产生氧化酶、过氧化氢酶、苯丙氨酸脱氢酶。菌株B.pumilusHX2-2的理化指标反应特性与《常见细菌系统鉴定手册》[17]中描述的短小芽胞杆菌理化特性基本一致,因此被初步鉴定为短小芽胞杆菌。

表1 菌株B. pumilus HX2-2的生理生化特性分析

续表1
注:“+” 阳性;“-”阴性
2.3 菌株16S rDNA序列分析和构建发育树
菌株序列总长度1 422 bp(如图2),将菌株序列提交至GenBank获得登陆号KU948153。通过BLASTN比对分析,菌株B.pumilusHX2-2的16S rDNA序列和GenBank中公布的短小芽胞杆菌序列的相似性高于99%。构建的系统发育树结果表明(图3)短小芽胞杆菌B.pumilusHX2-2和Bacill-uspumilusL17、BacilluspumilusHB29和BacilluspumilusHNS70聚在一起,亲缘关系较近,并且Bootstrap检验值为100。综合菌株的形态特征、生理生化特性和16S rDNA序列分析结果,可以确定菌株B.pumilusHX2-2属于短小芽胞杆菌。

图2 菌株B. pumilus HX2-2的PCR产物电泳结果Fig.2 The electrophoretic result of PCR product of strain B. pumilus HX2-21:菌株B. pumilus HX2-2的基因组DNA;M:Marker1:genomic DNA of strain B.pumlius HX2-2;M:Marker

图3 菌株B. pumilus HX2-2的系统发育树
2.4 菌株生长条件测定
温度是影响菌株生长的重要因素,能够影响菌株的酶活性。如图4所示,菌株B.pumilusHX2-2能在20~45 ℃生长,最适生长温度30 ℃。当温度为10~30 ℃时,随着温度的上升,OD600值不断增加,菌株活菌数不断增加;高于30 ℃时,OD600值开始下降,活菌数开始减少;温度超过35 ℃,OD600值急剧下降。
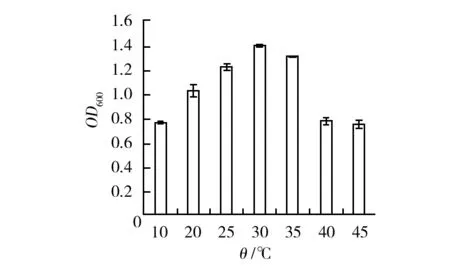
图4 不同温度对菌株B.pumilus HX2-2生长情况的影响Fig.4 Effects of different temperature on the biomass of strain B.pumilus HX2-2
图5为菌株B.pumilusHX2-2在不同NaCl质量分数下的生长曲线。由图5可以看出,NaCl质量分数为1%~3%时菌株生长最好,生物量最大;NaCl质量分数大于5%时,菌株OD600值急剧下降,生物量迅速减少;NaCl质量分数为10%~13%时,OD600值接近0,菌株几乎不生长。因此,菌株B.pumilusHX2-2是轻度嗜盐菌。

图5 不同NaCl质量分数对菌株B.pumilus HX2-2生长情况的影响Fig.5 Effects of different NaCl concentration on the biomass of strain B.pumilus HX2-2
由图6可以看出,pH为4.0~5.0,菌株几乎不生长,活菌量接近0;pH大于5.0,OD600值急剧上升,活菌数迅速增加;pH为6.0~8.0,菌株生长的最好;pH大于9.0,OD600值急剧下降,当pH为10.0,菌株还是能够生长的,说明菌株B.pumilusHX2-2耐碱不耐酸,对pH的适应范围较宽。

图6 不同pH对菌株B.pumilus HX2-2生长情况的影响Fig.6 Effects of different pH on the biomass of strain B.pumilus HX2-2
2.5 抑菌活性分析
菌株B.pumilusHX2-2对黄瓜枯萎病菌、草莓尖胞镰刀菌、马铃薯炭疽病菌、水稻立枯丝核菌、小麦禾谷镰刀菌、板栗围小丛壳菌这些植物病原指示菌的抑菌效果见表2。图7为植物病原菌在有拮抗菌液的平板和没有拮抗菌液的平板上的生长情况,可以看出菌株对不同植物病原菌表现出不同的抑菌活性,对草莓尖胞镰刀菌、马铃薯炭疽病菌、水稻立枯丝核菌有较为显著的抑活性,抑菌率超过70%;对黄瓜枯萎病菌和小麦禾谷镰刀菌的抑菌效果不太明显,抑菌率只有30%左右。

表2 菌株B.pumilus HX2-2对不同植物致病菌的抑菌活性
注:表中数据是通过SPSS16.0分析得到的,字母a、b、c、d表示在0.05水平上差异显著
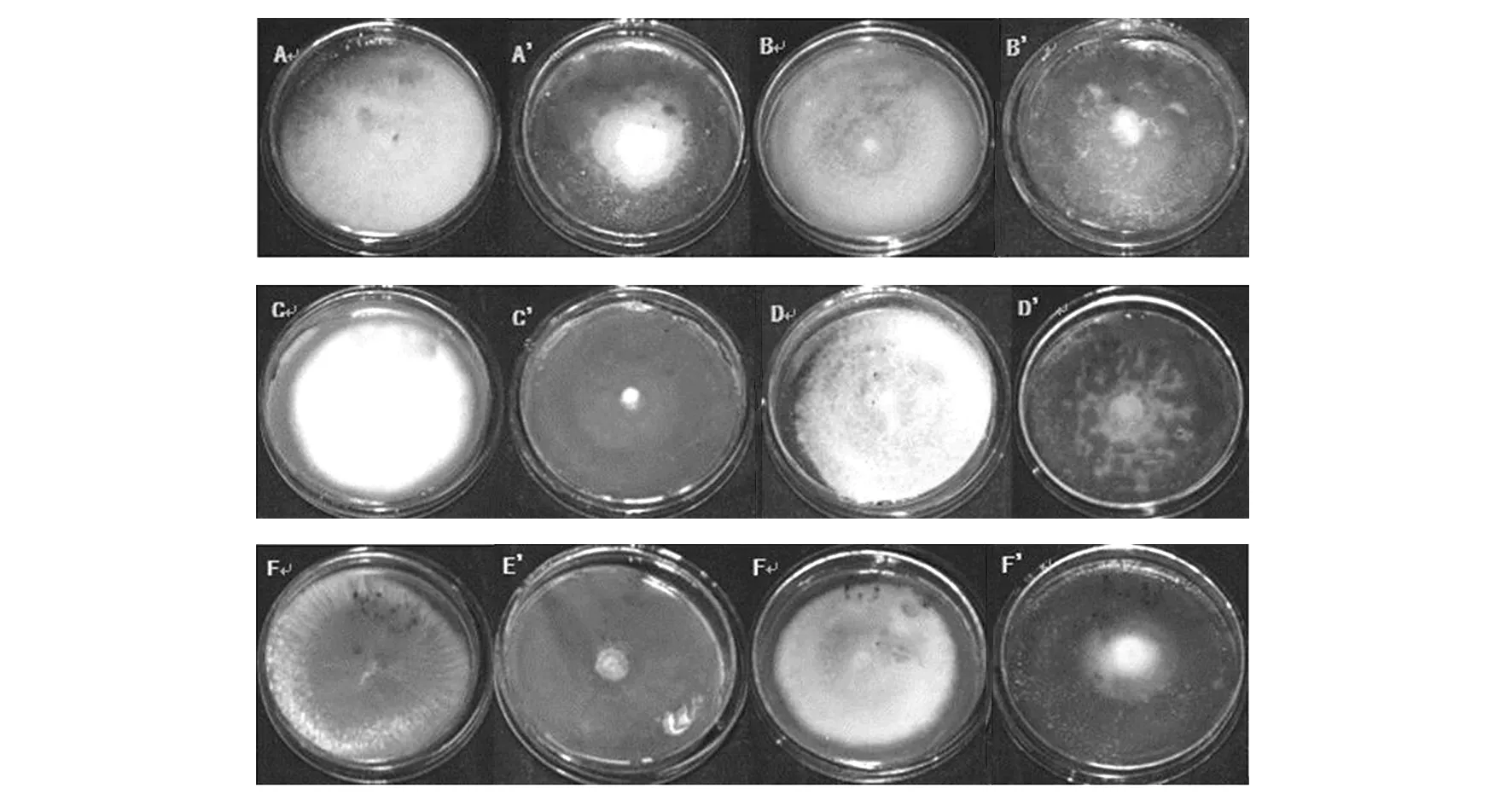
图7 菌株B.pumilus HX2-2对6种植物致病菌的抑菌效果Fig.7 Antimicrobial effects of strain B.pumilus HX2-2 against six plant pathogensA:黄瓜枯萎病原菌;B:草莓尖胞镰刀菌;C:马铃薯炭疽病菌;D:小麦禾谷镰刀菌;E:水稻立枯丝核菌;F:板栗围小丛壳菌;其中A、B、C、D、E、F为对照组;A′、B′、C′、D′、E′、F′为实验组A:Fusarium oxysporumf sp.cucumerinum;B:Pestalotiopsispho tiniae;C:Colletotrichum coccodes;D:Fusarium graminearum;E:Rhizoctonia solani;F:Glomerella cingulate;A,B,C,D,E,F are control groups; A′、B′、C′、D′、E′、F′are experimental groups
3 讨 论
目前所报道的芽胞杆菌主要是从土壤中筛选得到的,很少来自于海洋[20]。由于海洋的特殊环境,海洋微生物较陆地微生物有着特殊的代谢途径,能够产生结构新颖、种类丰富的抗菌活性物质,因此,从海洋中筛选具有抗菌活性的菌株已经成为微生物学研究的一个重要方向[21]。短小芽胞杆菌能够产生丰富的抗菌活性物质,在植物病害的防治和医学上具有潜在的应用价值。颜爱勤等[22]发现短小芽胞杆菌JK-SX001能够产生非蛋白类物质邻苯二甲酸二辛酯(DOP)对杨树溃疡病的3种病原真菌具有较强的拮抗作用;程丹丹等[23]从水稻植株样内分离出一株短小芽胞杆菌223所产生的蛋白类拮抗物质能有效抑制水稻纹枯病菌的生长。于婷等[24]提取的短小芽胞杆菌BSH-4的抗菌物质对蛋白酶较稳定,具有良好的热稳定性,并且对黄瓜蔓枯病菌、黄瓜立枯病菌和番茄早疫病菌有很好的抑菌活性。
本研究从连云港东西连岛筛选得到短小芽胞杆菌B.pumilusHX2-2,通过对其形态特征、生理生化性质鉴定表明菌株B.pumilusHX2-2和菌株鉴定手册中短小芽胞杆菌的描述较为接近。16S rDNA序列分析和系统发育树的构建揭示了菌株B.pumilusHX2-2和短小芽胞杆菌亲缘关系较近,因此,综合菌株的形态、生理生化和16S rDNA序列分析的结果,认为分离到的菌株B.pumilusHX2-2是一株短小芽胞杆菌。
分离得到的短小芽胞杆菌B.pumilusHX2-2的抑菌谱较广,对多种植物病原菌有抑菌活性。对主要的植物致病菌如草莓尖胞镰刀菌、马铃薯炭疽病菌和水稻立枯丝核菌表现出显著的抑菌活性,因此,菌株B.pumilusHX2-2在植物病原菌的生物防治方面具有潜在的开发利用价值。但是,当前的抑菌活性实验仅仅是在琼脂平板上的菌株B.pumilusHX2-2的体外抑制试验,菌株B.pumilusHX2-2抑菌物质的组成成分、理化性质及对病原菌的抑菌机理还需要进一步做更深入的研究。
[1] 林白雪,黄志强,谢联辉.海洋细菌活性物质的研究进展[J].微生物学报,2005,45(4):657-660.
[2] Habbu P,Warad V,Shastri R,et al.Antimicrobial metabolites from marine microorganisms[J].Chinese Journal of Natural Medicines,2016,14(2):101-116.
[3] 高伟,田黎,周俊英,等.海洋芽胞杆菌(Bacillusmarinus)B-9987菌株抑制病原真菌机理[J].微生物学报,2009,49(11):1494-1501.
[4] 王书锦,胡江春,薛德林,等.中国黄、渤海、辽宁近海地区海洋微生物资源的研究[J].锦州师范学院学报(自然科学版),2001,22(1):2-5.
[5] Xinqi Huang,Nan Zhang,Xiaoyu Yong,et al.Biocontrol of Rhizoctonia solani damping-off disease in cucumber withBacilluspumilusSQR-N43[J].Microbiogical Research,2012,167(3):135-143.
[6] Yi Sun,Li Tian,Yongfu Huang,et al.A new cyclotetrapeptide from marine fungus Trichodermareesei[J].Pharmazie,2006,61(9):809-810.
[7] 杨秀荣,刘水芳,孙淑琴,等.生防细菌防治土传病害的研究进展[J].天津农业科学,2008,14(4):38-42.
[8] Berrue F,Ibrahim A,Boland P,et al.Newly isolated marineBacilluspumilus(SP21)A source of novel lipoamides and other antimicrobial agents[J].International Union of Pure and Applied Chemistry,2009,81(6):1027-1031.
[9] 李学恭,雷晓凌.海洋短小芽胞杆菌ZH1-6菌株的鉴定及生物学特性[J].广东海洋大学学报,2009,29(3):82-85.
[10]孔高飞,金敏,朱莲莲,等.一种短小芽胞杆菌分离鉴定及培养条件研究[J].浙江理工大学学报(自然科学版),2014,31(4):468-473.
[11]Kapoor M,Nair L,Kuhad R.Cost-effective xylanase production from free and immobilizedBacilluspumilusstrain MK001 and its application in saccharification of Prosopisjuliflora[J].Biochemical Engineering Journal,2008,38(1):88-97.
[12]Hongzhen Zhang,Fengli Zhang,Zhiyong Li.Geneanalysis,optimized production and property of marine lipasefromBacilluspumilusB106 associated with South China Sea sponge Halichondria rugosa[J].World Journal of Microbiology and Biotechnology,2009,25(7):1267-1274.
[13]Mari M,Guizzardi M,Pratella G C.Biological control of gray mold in pears by antagonistic bacteria[J].Biological Control,1996,7(1):30-37.
[14]Swarding I P,Jeffries P.Antagonistic properties of two bacterial biocontrol agents of greymould disease[J].Biocontrol Science & Technology,1998,8(3):439-448.
[15]Akhtar M S,Siddiqui Z A,Glomus intraradices.Pseudomonas alcaligenes,andBacilluspumilus:effective agents for the control of root-rot disease complex of chickpea(Cicerarietinum L.)[J].Journal of General Plant Pathology,2007,74(1):53-60.
[16]聂亚峰,刘永峰,李德全,等. 海洋源拮抗细菌对水稻纹枯病的防治[J]. 江苏农业学报,2007,23(5):420-427.
[17]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:63-64,242-266,364-370.
[18]Holt J G,Krieg N R,Sneath P H A,et al.Bergey’s Manual of Determinative Bacteriology[M].Baltimore:William & Wilkins,1994:175-187.
[19]张立静,李术娜,朱宝成,等.高效纤维素降解菌短小芽胞杆菌(Bacilluspumilus)T-7的筛选、鉴定及降解能力研究[J].中国农学通报,2011,27(7):112-118.
[20]Catre B K.Biomedical potential of marine natural products[J].Bioscience,1996,46(4):271-286.
[21]李越中,陈琦.海洋微生物资源及其产生生物活性代谢产物的研究[J].生物工程进展,2000,20(5):28-31.
[22]颜爱勤,吴小芹,叶建人,等.短小芽胞杆菌JK-SX001非蛋白抗菌物质研究[J].南京林业大学学报(自然科学版),2012,36(3):13-16.
[23]程丹丹.水稻纹枯病生防潜力菌株短小芽胞杆菌223的初步研究[D].杭州:浙江大学,2008.
[24]于婷,尚玉珂,李艳芳,等.短小芽胞杆菌BSH-4抗菌物质的提取及其特性[J].植物保护学报,2009,36(1):65-69.
Identification of a MarineBacilluspumilusand Antimicrobial Activity Analysis
CHEN Xiang1, 2, TANG Tong-tong1, 2, SUN Xing1, LIU Qin1
(1.Inst.ofSoilSci.,ChineseAcad.ofSci.,JiangsuUni.,Nanjing210008; 2.Uni.ofChineseAcad.ofSci.,Beijing100049)
B.pumilusHX2-2 isolated from marine sediment samples collected in Is. Dongxi in Lianyungang was studied for its classification position, growth conditions, and microbial inhibition activity. On the basis of its morphological, physiological and biochemical characteristics and its 16S rDNA sequence analysis, the bacterium belonged toBacilluspumilus. The absorbance value ofOD600under different temperatures, salinity, pH, and growth conditions was tested, indicating that the strain was a slightly halophilic Bacillus strain, and its optimal temperature, salinity, and pH were at 30 ℃, 3%, and 7.0-8.0 respectively. The inhibition activities experiments on plate with different pathogen fungi, the strain showed significant inhibition against strawberry oxyspore Fusarium (Fusariumoxysporum), potato anthracnose pathogen (Colletotrichumcoccodes), and seeding blight of rice (Rhizoctoniasolani).B.pumilusHX2-2 possessed inhibition activities of broad spectrum, and have the value for further study.
BacilluspumilusHX2-2 strain; strain characterization; 16S rDNA; inhibition activity
国家自然科学基金项目(31400464)
陈香 女,硕士研究生。研究方向为生物多样性及其利用。E-mail:xchen@issas.ac.cn
2016-04-29;
2016-06-16
Q93-331
A
1005-7021(2017)01-0007-07
10.3969/j.issn.1005-7021.2017.01.002
* 通讯作者。男,研究员,博士生导师。主要从事农田土壤生态养分循环、污染物迁移及环境效应、农村景观生态环境建设等
研究工作。E-mail:qliu@issas.ac.cn

