川芎嗪通过抗炎作用减轻2型糖尿病大鼠心肌病变*
赵辛元, 徐 魁, 李彩容, 李 娟, 林凤平, 李彩艳, 孙家忠, 陈 晓
(1湖北科技学院临床医学院内分泌科, 2咸宁市中心医院内分泌科, 湖北 咸宁 437100; 3武汉大学中南医院内分泌科, 湖北 武汉 430071; 4湖北科技学院糖尿病心脑血管病变湖北省重点实验室, 湖北 咸宁 437100)
川芎嗪通过抗炎作用减轻2型糖尿病大鼠心肌病变*
赵辛元1, 徐 魁1, 李彩容1, 李 娟1, 林凤平2, 李彩艳2, 孙家忠3, 陈 晓4△
(1湖北科技学院临床医学院内分泌科,2咸宁市中心医院内分泌科, 湖北 咸宁 437100;3武汉大学中南医院内分泌科, 湖北 武汉 430071;4湖北科技学院糖尿病心脑血管病变湖北省重点实验室, 湖北 咸宁 437100)
目的: 观察川芎嗪对抗糖尿病引起的大鼠心肌细胞损伤的作用。方法: 雄性Wistar大鼠高糖高脂饲料喂养4周后空腹自尾静脉注射STZ制造2型糖尿病模型,观察不同给药剂量川芎嗪对糖尿病大鼠体重、血糖、心脏组织形态以及心肌组织中IL-1β、IL-6、TNF-α、IKKβ和NF-κB蛋白水平的影响。结果: 高剂量川芎嗪可缓解糖尿病大鼠的体重减轻和血糖升高,并且可以减少促炎因子 IL-1β、IL-6和TNF-α的表达,降低IKKβ和NF-κB的蛋白水平。结论: 川芎嗪通过拮抗炎症通路能减轻糖尿病引起的大鼠心肌细胞损伤。
川芎嗪; 心肌炎症; 2型糖尿病
糖尿病心肌病(diabetic cardiomyopathy,DCM)是一种常见的独立于其它发病因素的糖尿病(diabetes mellitus,DM)慢性并发症,也是导致糖尿病患者心血管疾病的一个重要的原因[1]。DCM的临床表现早期主要为左心室舒张功能障碍,晚期为收缩功能障碍,并且可以诱发心源性休克、心力衰竭和猝死等[2]。DCM的发病机制尚未完全阐明,但大多数学者认为是由糖、脂代谢紊乱导致的,其中氧化应激、炎症、线粒体损伤等在DCM的发病机制中具有重要地位,而氧化应激和炎症机制更受关注[3],因此有许多研究将DCM的治疗方向选在抗炎、抗氧化上[4-5]。川芎嗪是从伞形科藁本属植物川芎根中提取的生物碱,目前应用于临床的有川芎嗪片、川芎嗪注射剂等,具有广泛的药理活性[6]。诸多研究表明川芎嗪具有良好的对心脑血管的保护作用如防治脑缺血、抗血栓、抗肿瘤以及对心脏心肌细胞和冠状动脉的防治效果[7-8]。虽然近年来川芎嗪通过清除自由基,抗脂质过氧化的作用机制来产生药理活性的报道屡见报到,但文献多集中在肿瘤[9]、高血压[10]、脑中风[11]等方面,而对糖尿病引起病变的改善作用研究较少。即使川芎嗪在糖尿病人和动物水平上都具有治疗作用[12-15],但是甚少研究关注到其改善糖尿病所引起的心脏病变。本实验将从炎症因子方向来探讨川芎嗪对DCM的防治作用及可能机制,为其应用于临床提供实验及理论依据。
材 料 和 方 法
1 药物、试剂与仪器
川芎嗪(纯度98%,上海晶纯)、羧甲基纤维素钠和链脲佐菌素(streptozotocin,STZ)购自优宁维生物有限公司;抗IKKβ和NF-κB抗体(Abcam);抗β-actin抗体(武汉谷歌生物科技有限公司);检测IL-1β、IL-6和TNF-α炎症因子的ELISA试剂盒(武汉博士德生物有限公司);其余试剂均为国产分析纯。
血糖仪(深圳市三诺电子有限公司);电泳仪和电泳槽(北京六一公司);全波长多功能酶标仪(Bio-Tek);荧光扫描仪(奥德赛);3-18K高速冷冻离心机(Sigma);正置显微镜(Olympus)。
2 实验动物
雄性Wistar大鼠共50只,体重120~150 g,动物合格证为编号SYXK(鄂)2013-0071,伺养于SPF级动物房。维持正常的室温和光照12 h的昼夜节律。正常组给予普通饲料,常规饮水、进食。模型组和川芎嗪组给予高糖高脂喂养和常规饮水。
3 方法
3.1 糖尿病模型制备 用0.1 moL/L的枸橼酸缓冲液(pH 4.2)在冰浴中配制10 g/L的STZ溶液,现配现用。给禁食12 h 后的大鼠尾静脉注射STZ(25 mg/kg)。注射完7 d后测血糖,若餐后餐前血糖小于6.1 mmoL/L和2 h血糖大于11.2 mmoL/L,且有多饮、多食、多尿现象者,确定为糖尿病大鼠。
3.2 实验动物分组与处理 随机选择10只健康雄性Wistar大鼠为正常(normal, Nor)组,30 只造模成功的糖尿病大鼠随机分为3 组,分别为糖尿病模型组(DM组)、川芎嗪高剂量治疗组(High组)和低剂量治疗组(Low组)。川芎嗪用1% 的羧甲基纤维素钠助溶。各治疗组分别以50和100 mg·kg-1·d-1的剂量灌胃1次。空白组和模型组,每日以等体积1%的羧甲基纤维素钠灌胃1 次。于给药16 周末空腹12 h后测定空腹血糖和餐后血糖,每周进行体重监控。16周后,苯巴比妥钠麻醉,开胸取心脏,一部分用4% 多聚甲醛固定,用于HE 染色;另一部分冻存在-80 ℃冰箱,用于Western blot 检测和ELISA分析。
3.3 心肌组织结构的观察 4%多聚甲醛固定心肌组织24 h后,梯度乙醇脱水,二甲苯透明,石蜡包埋,制备4 μm 石蜡切片,常规HE 染色,中性树脂封片,光镜显微镜下观察分析心肌组织病理变化。
3.4 ELISA试剂盒检测心肌组织炎症因子IL-1β、IL-6和TNF-α的含量 剪取体积约100 mg的心肌组织,加入1 mL 生理盐水,匀浆器匀浆后,4 ℃、12 000 r/min离心10 min,取上清,按ELISA 试剂盒说明书操作,450 nm 波长下检测吸光度(A)值,绘制标准曲线,计算各组心肌组织IL-1β、IL-6和TNF-α炎症因子的含量。
3.5 Western blot 检测IKKβ和NF-κB蛋白表达 从-80 ℃冰箱取100 mg 冻存的心肌组织,称重,按照质量体积比1∶10加入1 mL RIPA 裂解液(含1 mmoL/L PMSF),冰上快速用剪刀剪碎成小团块,用超声波粉碎仪粉碎30 s,冰上静置30 s,重复3次后,静止30 min。4 ℃、12 000 r/min离心15 min,取上清于另一EP管中。用BCA 法进行蛋白含量测定,根据所需样品体积,加5×SDS 上样缓冲液, 沸水加热8 min,使蛋白变性。制作10%分离胶和5%的浓缩胶,取60 μg蛋白上样,进行SDS-PAGE分离蛋白,转至PVDF膜,5% BSA封闭1 h,加入适量比例的抗体,4 ℃过夜孵育,然后,孵育相应的荧光 II 抗1 h,同样TBST洗膜3次,荧光扫描得到目的条带。
4 统计学处理
采用GraphPad Prism 5统计软件进行分析。数据以均数±标准误(mean±SEM)表示,多组间的比较采用单因素方差分析,多重比较采用Tukey’s检验,以P<0.05为差异有统计学意义。
结 果
1 川芎嗪对大鼠体重和血糖的影响
与糖尿病大鼠相比,High组大鼠体重显著增加(P<0.05),并且与正常组的差异没有统计学显著性;糖尿病组与正常组比较,体重显著降低(P<0.01)。同样,在血糖水平上,与糖尿病组比较,高剂量川芎嗪组具有明显降低餐后血糖的作用(P<0.05),见图1。
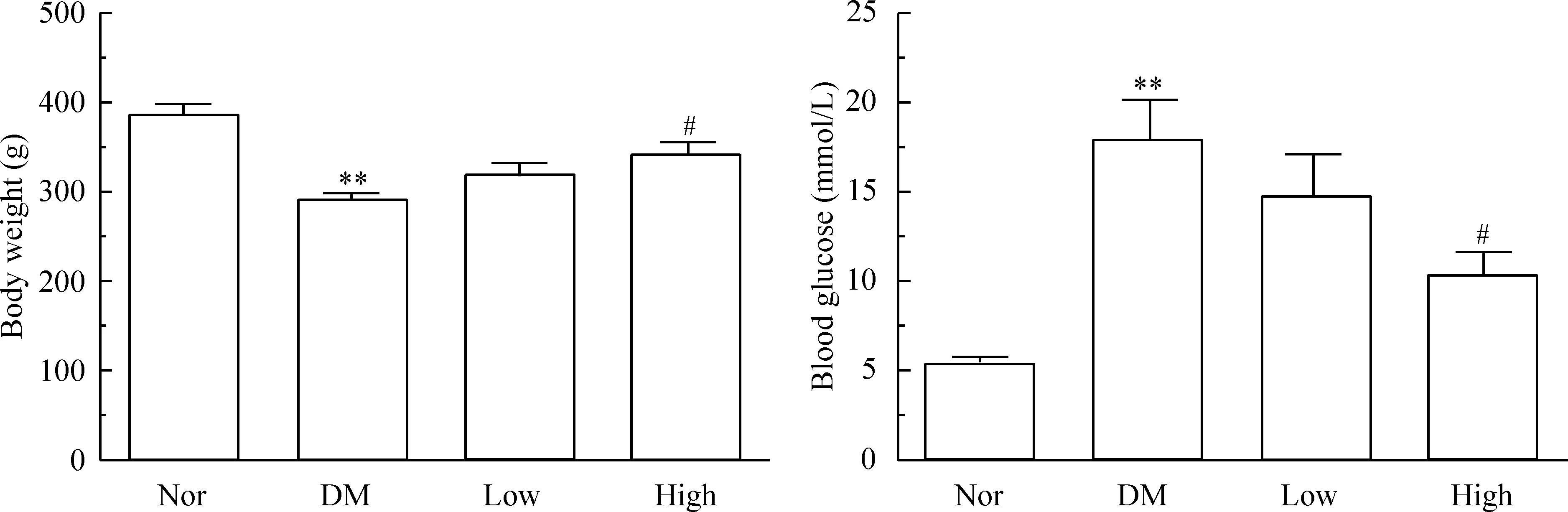
Figure 1.The body weight and blood glucose of the rats were detected. Mean±SEM.n=6.**P<0.01vsNor group;#P<0.05vsDM group.
图1 川芎嗪对糖尿病大鼠体重和血糖的影响
2 川芎嗪对糖尿病大鼠心脏形态学的影响
观察糖尿病大鼠心肌细胞组织HE染色切片,发现Nor组心肌细胞排列整齐,形态清晰可见;DM组心肌细胞形态上出现紊乱,结构模糊,细胞连接不紧密;随着药物剂量从低剂量到高剂量,细胞间隙逐渐减少,细胞排列较整齐,形态比较均一,见图2。
3 Western blot检测川芎嗪对IKKβ和NF-κB蛋白表达的影响
如图3所示,与正常组相比,糖尿病大鼠心脏组织中IKKβ和NF-κB蛋白表达水平显著增加(P<0.05);与DM组比较,川芎嗪组剂量依赖性地降低了IKKβ和NF-κB蛋白表达(P<0.05)。
4 川芎嗪对心脏炎症因子的影响
DM组IL-6和IL-1β的水平明显增加(P<0.01),而川芎嗪剂量依赖性地降低了IL-6和IL-1β的表达,高剂量组与糖尿病模型组比较差异具有统计学显著性(P<0.05);与正常组相比,糖尿病大鼠心脏中的TNF-α明显增加(P<0.01),而高剂量川芎嗪具有明显降低TNF-α表达的作用(P<0.05),见图4。

Figure 2.The changes of myocardial structure in different groups (HE staining, ×200).
图2 川芎嗪对糖尿病大鼠心脏组织形态学的影响

Figure 3.The modulation of ligustrazine on the expression of IKK and NF-κB in different groups. Mean±SEM.n=3.*P<0.05vsNor group;#P<0.05,##P<0.01vsDM group.
图3 川芎嗪对糖尿病大鼠心脏IKKβ和NF-κB的调控

Figure 4.Effect of ligustrazine on inflammatory cytokines in different groups. Mean±SEM.n=6.*P<0.05,**P<0.01vsNor group;#P<0.05vsDM group.
图4 川芎嗪对糖尿病大鼠心脏炎症因子的调控
讨 论
糖尿病业已成为一种继心脑血管、肿瘤之后严重威胁人类健康和生命安全的第三大杀手[16]。糖尿病引起的并发症在糖尿病的致死和致残过程中起到举足轻重的作用。越来越多由糖尿病引起的心肌病得到全世界科学家们的关注。据报道[17],长期的糖尿病状态具有提高心肌氧化应激和炎症的风险。同时,高糖刺激过多的ROS生成也引起多种炎症因子表达升高[18-19],如核转录因子NF-κB及炎症小体等,在胞浆中NF-κB通过与抑制蛋白IκB的结合,以无活性的形式存在。大部分NF-κB 的激活有赖于IκB的磷酸化和泛素化。IκB是首先被IKK(IκB激酶)所磷酸化,然后快速泛素化继而被26S蛋白酶体所降解。降解会解离出NF-κB,导致胞浆中NF-κB浓度升高。游离的NF-κB转运至细胞核内,启动靶基因转录,生成相应的mRNA和蛋白质[20]。本实验中糖尿病组IKK和NF-κB蛋白表达水平显著升高,涉及到NF-κB可能被激活。相反,在糖尿病状态下,川芎嗪可以剂量依赖地逆转激活反应。目前在糖尿病心肌病中发现的炎症小体很多,其中NLRs家族中的NLRP3尤为值得关注。研究发现其促进caspase-1的自我剪切,形成活性的caspase-1 p20/p10复合物,促进IL-1β的释放。后者在心肌细胞的凋亡过程中起到重要的作用。同时[21],高糖环境下的ROS也会促进IL-6和TNF-α的表达上调。在这过程中,核转录因子NF-κB具有间接的桥梁作用,通过转录促进炎症小体过度激活,导致心肌间质炎症反应、心肌细胞凋亡及心肌纤维化等发生。本实验中, DM组炎症因子IL-1、IL-6和TNF-α的释放均出现显著增加。这些表明在糖尿病状态下,炎症信号通路可能被激活。而川芎嗪显著降低了炎症因子的释放水平,特别是高剂量组,对糖尿病大鼠心肌细胞起到明显的保护作用。
大量研究已经表明川芎嗪对心血管系统的具有防治保护作用[22-23],可以抑制AngⅡ引起的心肌细胞凋亡,抑制糖尿病大鼠心肌细胞的外钙内流和肌浆网的內钙释放,来避免心肌细胞内钙超载,从而维持细胞内钙离子的水平,保护心肌的作用。但是对川芎嗪降低高血糖所导致的炎症方面的研究甚少。本课题试图从炎症因子相关途径来阐述川芎嗪对大鼠糖尿病的有益作用,结果发现川芎嗪不仅可以降低血糖、维持大鼠体重;组织形态上剂量依赖性地改善心肌细胞结构,恢复组织间隙,使细胞排列整齐,形态均一;还可以抑制心肌细胞中的炎症因子的含量,降低炎症信号通路中的IKKβ和转录因子NF-κB的表达,从而表现出对糖尿病心肌炎的治疗作用。
[1] 杨晓红, 崔 炜, 王雅依, 等. 阿托伐他汀对 2 型糖尿病大鼠心肌 NF-κB、TNF-α 表达的影响[J]. 解放军医学杂志, 2008, 33(3):282-285.
[2] 吕 冰. 参芍口服液对糖尿病大鼠心肌纤维化及炎性损伤的影响及机制的研究[D]. 石家庄:河北医科大学, 2015.
[3] Zhang Y, Ma X, Guo C, et al. Pretreatment with a combination of ligustrazine and berberine improves cardiac function in rats with coronary microembolization[J]. Acta Pharmacol Sin, 2016, 37(4):463-472.
[4] Chen W, Chen W, Zhu J, et al. Potent anti-inflammatory activity of tetramethylpyrazine is mediated through suppression of NF-κB[J]. Iran J Pharm Res, 2016, 15(1):197-204.
[5] 顾迎春, 于晓玲, 郭维军. 川芎嗪后处理对大鼠心肌缺血再灌注损伤的保护作用[J]. 国际心血管病杂志, 2009, 36(5):304-307.
[6] 陈 岩, 王拥军, 徐 浩, 等. 川芎嗪对白介素-1β 诱导退变的椎间盘终板软骨细胞的保护作用[J]. 中华中医药杂志, 2015, 30(5):1437-1442.
[7] Yin X, Wang X, Fan Z, et al. Hyperbaric oxygen preconditioning attenuates myocardium ischemia-reperfusion injury through upregulation of heme oxygenase 1 expression: PI3K/Akt/Nrf2 pathway involved.[J]. J Cardiovasc Pharmacol Ther, 2015, 20(4):428-438.
[8] 吴 宁, 胡德蓉, 齐洁琳, 等. 川芎嗪对急性放射损伤小鼠骨髓中LFA-1、ICAM-1表达影响的研究[J]. 中国病理生理杂志, 2008, 24(1):128-131.
[9] 牛 媛, 王 成, 张晓燕, 等. 川芎嗪对人肺腺癌 A549 细胞增殖, 迁移和侵袭的作用与机制[J]. 现代肿瘤医学, 2016, 24(10):1509-1512.
[10]郑世文, 郑仕成. 丹参川芎嗪与天麻素联用治疗急性脑梗死伴高血压的临床研究[J]. 中国医药指南, 2015, 13(16):30-31.
[11]黄 玲, 郑玲利, 蒋 婷, 等. 丹参川芎嗪注射液辅助治疗急性脑梗死的疗效与安全性评价[J]. 中国药业, 2015, 24(8):29-32.
[12]邓亚玲. 川芎嗪保守治疗 Ⅲ 期糖尿病视网膜病患者的可行性分析[J]. 医学理论与实践, 2015, 28(7):855-856.
[13]耿 坡. 盐酸川芎嗪注射液对糖尿病足患者神经运动传导速度和感觉传导速度的影响[J]. 中华保健医学杂志, 2016, 18(3):245-246.
[14]张晓莲. 丹参川芎嗪治疗糖尿病合并冠心病的临床疗效探究[J]. 糖尿病新世界, 2015, 35(3):16.
[15]张 宁, 汤碧娥, 张志琴, 等. 黄芪配伍川芎嗪对2型糖尿病大鼠大血管的保护作用[J]. 中国老年学杂志, 2016, 36(13):3138-3139.
[16]季 盛, 周 勇. 个体化治疗在 2 型糖尿病管理中的应用进展[J]. 上海医药, 2016, 37(8): 44-46.
[17]Falcão-Pires I, Leite-Moreira AF. Diabetic cardiomyopathy: understanding the molecular and cellular basis to progress in diagnosis and treatment[J]. Heart Fail Rev, 2012, 17(3):325-344.
[18]Park JH, Kang SS, Kim JY, et al. The antioxidantN-acetylcysteine inhibits inflammatory and apoptotic processes in human conjunctival epithelial cells in a high-glucose environment[J]. Invest Ophthalmol Vis Sci, 2015, 56(9):5614-5621.
[19]Lv J, Chen Q, Shao Y, et al. Cross-talk between angiotensin-II and toll-like receptor 4 triggers a synergetic inflammatory response in rat mesangial cells under high glucose conditions[J]. Biochem Biophys Res Commun, 2015, 459(2): 264-269.
[20]徐文明, 郭润民, 陈景福, 等. 硫化氢通过调控 NF-κB 通路抑制阿霉素引起的心肌细胞炎症与细胞毒性[J]. 中国病理生理杂志, 2013, 29(9): 1561-1566.
[21]Laiguillon MC, Courties A, Houard X, et al. Characte-rization of diabetic osteoarthritic cartilage and role of high glucose environment on chondrocyte activation: toward pathophysiological delineation of diabetes mellitus-related osteoarthritis[J]. Osteoarthritis Cartilage, 2015, 23(9):1513-1522.
[22]Deng L, Guo X, Li Z, et al. Ligustrazine derivatives. Part 4: design, synthesis, and biological evaluation of novel ligustrazine-based stilbene derivatives as potential cardiovascular agents[J]. Chem Biol Drug Design, 2012, 79(5):731-739.
[23]赵润英, 郝 伟, 孟祥军, 等. 阿魏酸川芎嗪对缺血再灌注大鼠心肌细胞凋亡及凋亡相关蛋白表达的影响[J]. 中国病理生理杂志, 2013, 29(12): 2139-2143.
(责任编辑: 陈妙玲, 罗 森)
Effect of ligustrazine on cardiac inflammation in rats with type 2 diabetes mellitus
ZHAO Xin-yuan1, XU Kui1, LI Cai-rong1, LI Juan1, LIN Feng-ping2, LI Cai-yan2, SUN Jia-zhong3, CHEN Xiao4
(1DepartmentofEndocrinology,HubeiUniversityofScienceandTechnologyClinicalMedicalCollege,2DepartmentofEndocrinology,CentralHospitalofXianningCity,Xianning437100,China;3DepartmentofEndocrinology,ZhongnanHospitalofWuhanUniversity,Wuhan430071,China;4HubeiProvincalKeyLaboratoryforDiabeticCardiovascularandCerebrovassularDiseases,HubeiUniversityofScienceandTechnology,Xianning437100,China.E-mail:gxzpwk69@126.com)
AIM: To study the effect of ligustrazine on the cardiacmyocyte lesion in rats with type 2 diabetes mellitus. METHODS: Male Wistar rats were injected with STZ via tail vein under high-glucose and high-fat feeding for 4 weeks to establish the animal model of type 2 diabetes mellitus. Ligustrazine at different doses was used to treat the diabetic rats. The body weight, blood glucose and the morphology of heart tissues were observed. The myocardial levels of IL-1β, IL-6 and TNF-α were detected by ELISA, and the protein expression of IKKβ and NF-κB in the myocardium was determined by Westeren blotting. RESULTS: Ligustrazine at high dose alleviated the body weight reduction and blood glucose elevation cause by diabetes, and reduced pro-inflammatory factors IL-1β, TNF-α and IL-6. Moreover, the protein expression of IKKβ and NF-κB was significant decreased by ligustrazine. CONCLUSION: Ligustrazine inhibits the myocardial inflammation caused by diabetes through anti-inflammatory pathway.
Ligustrazine; Myocardial inflammation; Type 2 diabetes mellitus
1000- 4718(2017)04- 0744- 05
2016- 10- 10
2016- 12- 19
湖北科技学院校级科研项目(No. KY14068)
R363; R587.1
A
10.3969/j.issn.1000- 4718.2017.04.028
△通讯作者 Tel: 0715-8236051; E-mail: gxzpwk69@126.com

