急性冠状动脉综合征合并糖尿病患者经皮冠状动脉介入术后替格瑞洛与氯吡格雷抗血小板疗效及预后研究
黄莉,王选琦,吴晓鹏
(陕西省第四人民医院心血管内科,西安 710043)
血小板聚集在急性冠状动脉综合征(acute coronary syndrome,ACS)的发生发展中起重要作用。糖尿病(diabetes mellitus,DM)是心血管系统疾病的独立危险因素,DM患者多伴有血小板功能紊乱,血小板反应性增强易出现不良心血管事件,ACS合并DM患者更应积极进行抗血小板治疗[1]。虽然ACS合并DM患者可在经皮冠状动脉介入(percutaneous coronary intervention,PCI)术后显著获益,但在双联抗血小板治疗下发生心血管事件的风险要远高于非DM患者。研究显示[2,3],合并DM的ACS患者抗血小板疗效较差,氯吡格雷抵抗发生率较高,PCI术后发生主要不良心血管事件(major adverse cardiovascular events,MACE)的风险较高。替格瑞洛是新型抗血小板药物,直接可逆性作用于P2Y12受体且无须经肝脏代谢激活,与氯吡格雷相比起效更快、作用更强、抑制血小板更稳定。PLATO试验证实[4],替格瑞洛较氯吡格雷显著降低ACS患者发生MACE的风险,且不增加大出血风险。但替格瑞洛在ACS合并DM患者中的抗血小板安全性和疗效仍缺乏足够的证据。本研究应用血栓弹力图评价替格瑞洛与氯吡格雷在ACS合并DM患者PCI后抗血小板治疗中的疗效和预后。
1 对象与方法
1.1 研究对象
入选2016年6月至2017年1月期间在陕西省第四人民医院心血管内科住院治疗的ACS合并DM患者100例。DM诊断按照2010年美国糖尿病学会糖尿病诊断标准[5]。ACS的诊断标准参照《急性冠脉综合征急诊快速诊疗指南》[6],首选桡动脉行冠状动脉造影和PCI治疗。入选标准:(1)有DM病史或新诊断的DM;(2)临床诊断为ACS,并成功行PCI;(3)签署知情同意书。排除标准:(1)严重肝肾功能不全;(2)严重心功能不全;(3)消化性溃疡或合并严重出血性疾病;(4)中、重度贫血或血小板计数<100×109/L;(5)对阿司匹林、氯吡格雷、替格瑞洛有禁忌证。采用前瞻性、随机对照的研究方法,按随机数字表随机分为两组:氯吡格雷组和替格瑞洛组,每组50例。本研究通过陕西省第四人民医院伦理委员会的批准。
1.2 方法
所有患者给予ACS常规药物治疗,包括降脂药物稳定斑块、调控血糖、改善心肌血供等药物治疗。患者入院时口服阿司匹林300 mg,之后口服100 mg,均1次/d。氯吡格雷组术前口服负荷剂量氯吡格雷(75 mg/片,赛诺菲)300 mg,之后口服维持剂量75 mg,均1次/d;替格瑞洛组术前口服负荷剂量替格瑞洛(90 mg/片,阿斯利康)180 mg,之后口服维持剂量90 mg,均2次/d。患者于PCI术后24~48 h抽取静脉血并在2 h内完成血栓弹力图检测,其中花生四烯酸(arachidonic acid,AA)抑制率<50%定义为阿司匹林抵抗,二磷酸腺苷(adenosine diphosphate,ADP)抑制率<30%定义为氯吡格雷或替格瑞洛抵抗。比较两组AA诱导的血小板抑制率和ADP诱导的血小板抑制率以及ADP激活血小板形成的最大血凝块幅度(maximum adenosine dipho-sphate,MAADP)。
术后6个月通过门诊和电话对患者进行随访,比较两组MACE、出血事件和呼吸困难发生率。MACE包括全因死亡、心肌梗死、再次血运重建、脑卒中和可疑或明确的支架内血栓等组成的复合终点。出血事件包括皮肤上消化道出血、颅内出血以及口腔、皮肤黏膜、齿龈出血等出血情况。
1.3 统计学处理

2 结 果
2.1 两组患者基线资料比较
两组患者基线资料相似,在年龄、性别、高血压、吸烟等冠心病危险因素方面差异无统计学意义(P>0.05),在空腹血糖、糖化血红蛋白、肌酐和左室射血分数(left ventricular ejection fraction,LVEF)方面差异亦无统计学意义(P>0.05;表1)。
2.2 两组患者血栓弹力图结果比较
与氯吡格雷组相比,替格瑞洛组AA抑制率和ADP抑制率均显著增高,MAADP幅度显著降低,差异具有统计学意义(P<0.05)。替格瑞洛组AA抑制率<50%和ADP抑制率<30%的患者数量显著低于氯吡格雷组(P<0.05;表2)。
2.3两组患者术后6个月MACE、出血事件和呼吸困难发生率比较
随访6个月,失访患者3例,其中氯吡格雷组2例,替格瑞洛组1例,替格瑞洛组MACE发生率显著低于氯吡格雷组,差异具有统计学意义(P<0.05)。氯吡格雷组出血患者2例:消化道出血1例;皮肤黏膜出血1例。替格瑞洛组出血患者6例:皮肤黏膜出血2例;口腔黏膜、齿龈出血2例;鼻出血1例;消化道出血1例。两组均为轻度出血,

表1 两组患者基线资料比较
MI: myocardial infarction; LVEF: left ventricular ejection fraction; SCr: serum creatinine
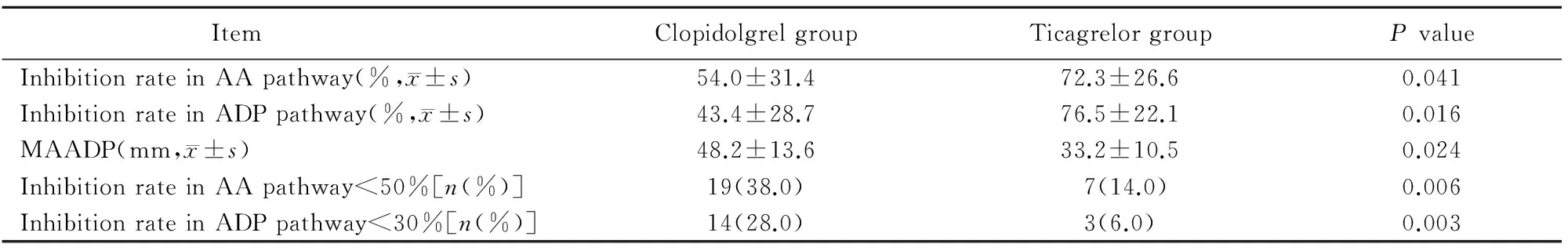
表2 两组患者血栓弹力图结果比较
AA: arachidonic acid; ADP: adenosine diphosphate; MAADP: maximum adenosine diphosphate
经对症治疗后缓解,均无消化道大出血和脑出血。替格瑞洛组呼吸困难3例,继续服药后症状逐渐缓解,无停药患者。替格瑞洛组出血事件和呼吸困难发生率有增加趋势,但差异无统计学意义(P>0.05;表3)。

表3 两组患者术后6个月各事件发生情况比较
MACE: major adverse cardiovascular events; MI: myocardial infarction
3 讨 论
ACS的病理机制是不稳定粥样斑块的破裂,继发急性血栓形成造成冠状动脉完全或不完全闭塞,从而导致心肌细胞坏死或严重缺血,血小板激活在ACS发病中扮演着极其重要的角色,因此抗血小板治疗在ACS治疗中具有重要的地位。PCI已成为ACS血运重建的主要治疗方式,但PCI会增加术后支架内血栓、心肌梗死等心血管缺血事件的风险,PCI联合抗血小板治疗能显著改善ACS患者的预后。双联抗血小板治疗成为ACS患者PCI术后经典的抗栓治疗方法,但即使规律、严格地应用双联抗血小板药物治疗(阿司匹林+氯吡格雷),仍有一部分患者会发生不良心血管事件[7],这是因为ACS患者在应用双联抗血小板治疗后血小板反应性仍然很高。
研究发现,氯吡格雷抗血小板疗效存在个体差异,部分患者存在氯吡格雷抵抗或低反应性[8,9]。氯吡格雷属噻吩吡啶类抗血小板药物,其活性代谢产物不可逆地抑制ADP与P2Y12受体结合,从而发挥抑制血小板聚集的作用。氯吡格雷抵抗的发生是多种机制造成的,研究表明,氯吡格雷抵抗的发生与患者年龄、性别、DM史、肥胖程度、血肌酐、尿酸水平、吸烟史、药物之间的相互作用及CYP2C19基因多态性等多因素有关[10,11]。ADP受体P2Y12基因多态性(CYP2C14、CYP3A4、CYP3A5)直接影响氯吡格雷的血小板抑制作用,药物之间的相互作用(比如与他汀类药物)也会竞争性抑制氯吡格雷的活化,从而降低氯吡格雷的抗血小板聚集作用,氯吡格雷负荷量不足和维持量不足也会造成氯吡格雷低反应性。DM患者冠状动脉病变多呈弥漫性病变及多支血管病变,往往合并胰岛素抵抗、炎症反应以及高脂血症等因素,这些因素易导致血小板高反应和过度活化,造成血小板功能紊乱,从而降低抗血小板药物的血小板抑制效率。Angiolillo等[12]研究发现,合并DM的ACS患者MACE的发生时间与氯吡格雷抵抗有很强的相关性,DM患者比正常人在应用氯吡格雷时血小板聚集率更高。因此,合并DM的ACS患者易出现氯吡格雷抵抗,PCI术后缺血事件的发生率也高于非DM患者。
DM患者血小板功能、血管内皮功能、凝血和纤溶途径异于正常人,导致其血小板黏附性、活性和聚集性增强,使得ACS合并DM患者PCI术后双联抗血小板药物(阿司匹林+氯吡格雷)治疗后效果不佳[13]。替格瑞洛是新型的口服抗血小板药物,具有强效、快速及持久的抗血小板作用,可改善心血管病患者的预后,降低缺血事件的发生。由于替格瑞洛不受肝脏CYP基因多态性的影响,抗血小板作用无个体差异性,药物抵抗的发生率较低。PLATO研究发现[14],DM患者MACE、全因死亡、主要出血事件的发生率均高于非DM患者,且糖化血红蛋白高者的MACE 和出血事件发生率更高,12个月随访结果显示,与氯吡格雷相比,替格瑞洛显著降低了全因死亡、心肌梗死及支架内血栓等终点事件,同时没有增加PLATO定义的致命性大出血。本研究纳入了ACS合并DM患者,应用血栓弹力图检测血小板对替格瑞洛与氯吡格雷的反应性,结果表明,与氯吡格雷组相比,替格瑞洛组的AA抑制率和ADP抑制率均显著增高,而MAADP幅度显著降低;术后6个月替格瑞洛组的MACE发生率也显著降低,且未增加出血事件和呼吸困难的发生率,提示替格瑞洛在ACS合并DM患者中有较好的安全性和较好的抗血小板疗效。
综上所述,对于ACS合并DM患者,PCI术后服用替格瑞洛比服用氯吡格雷可更加有效地抑制血小板活性,同时可降低术后6个月MACE发生率,且不增加发生出血事件和呼吸困难的风险。本研究为ACS合并DM患者PCI术后抗血小板治疗提供了优选策略,但由于样本量较小,尚需进一步大型临床研究证实。
【参考文献】
[1] Lv HH, Wu S, Liu X,etal. Comparison of VerifyNow P2Y12 and thrombelastography for assessing clopidogrel response in stroke patients in China[J]. Neurol Sci, 2015, 37(2): 277-282. DOI: 10.1007/s10072-015-2407-7.
[2] Schuette C, Steffens D, Witkowski M,etal. The effect of clopidogrel on platelet activity in patients with and without type-2 diabetes mellitus: a comparative study[J]. Cardiovasc Diabetol, 2015, 14: 15. DOI: 10.1186/s12933-015-0182-7.
[3] 赵红岩, 侯爱洁, 李占全. 分期冠状动脉介入治疗的间隔时间对老年患肾功能的影响[J]. 中华老年多器官疾病杂志, 2017, 16(7): 495-498. DOI: 10.11915/j.issn.1671-5403.2017.07.116.
Zhao HY, Hou AJ, Li ZQ. Impact of different time interval of staged percutaneous coronary intervention on renal function of elderly patients[J]. Chin J Mult Organ Dis Elderly, 2017, 16(7): 495-498. DOI: 10.11915/j.issn.1671-5403.2017.07.116.
[4] Hall HM, Banerjee S, Mcguire DK. Variability of clopidogrel response in patients with type 2 diabetes mellitus[J]. Diab Vasc Dis Res, 2011, 8(4): 245-253. DOI: 10.1177/1479164-111420890.
[5] Expert Committee on the Diagnosis and Clasification of Diabetes Mellitus. American Diabetes Association: clinical practice recommendations 2002[J]. Diabetes Care, 2002, 25(Suppl 1): S1-S147.
[6] 中国医师协会急诊医师分会,中华医学会心血管病学分会,中华医学会检验医学分会. 急性冠脉综合征急诊快速诊疗指南[J]. 中华急诊医学杂志, 2016, 25(4): 397-404. DOI: 10.3960/j.issn.1671-0282.2016.04.002.
Chinese Association of Emergency physicians, Chinese Society of Cardiology, Chinese Society of Laboratory Medicine. Emergency rapid diagnosis and treatment guidelines of acute coronary syndrome[J]. Chin J Emerg Med, 2016, 25(4): 397-404. DOI: 10.3960/j.issn.1671-0282.2016.04.002.
[7] Steg PG, Harrington RA, Emanuelsson H,etal. Stent thrombosis with ticagrelorversusclopidogrel in patients with acute coronary syndromes: an analysis from the prospective randomized PLATO trial[J]. Circulation, 2013, 128(10): 1055-1065. DOI: 10.1161/CIRCULATIONAHA.113.002589.
[8] Sambu N, Radhakrishnan A, Dent H,etal. Personalised antiplatelet therapy in stent thrombosis: observations from the Clopidogrel Resistance in Stent Thrombosis(CREST) registry[J]. Heart, 2012, 98(9): 706-711. DOI: 10.1136/heartjnl-2011-301164.
[9] Morneau KM, Reaves AB, Martin JB,etal. Analysis of gastrointestinal prophylaxis in patients receiving dual antiplatelet therapy with aspirin and clopidogrel[J]. J Manag Care Pharm, 2014, 20(2): 187-93. DOI: 10.18553/jmcp.2014.20.2.187.
[10] Verdoia M, Barbieri L, Schaffer A,etal. Impact of diabetes on uric acid and its relationship with the extent of coronary artery disease and platelet aggregation: a single-centre cohort study[J]. Metabolism, 2014, 63(5): 640-646. DOI: 10.1016/j.metabol.2014.01.010.
[11] Tresukosol D, Suktitipat B, Hunnangkul S,etal. Effects of cytochrome P450 2C19 and paraoxonase 1 polymorphisms on antiplatelet response to clopidogrel therapy in patients with coronary artery disease[J]. PLoS One, 2014, 9(10): e110188. DOI: 10.1371/journal.pone.0110188.
[12] Angiolillo DJ, Jakubowski JA, Ferreiro JL,etal. Impaired responsiveness to the platelet P2Y12 receptor antagonist clopidogrel in patients with type 2 diabetes and coronary artery disease[J]. J Am Coll Cardiol, 2014, 64(10): 1005-1014. DOI: 10.1016/j.jacc.2014.06.1170.
[13] Geisler T, Anders N, Paterok M,etal. Platelet response to clopidogrel is attenuated in diabetic patients undergoing coronary stent implantation[J]. Diabetes Care, 2007, 30(2): 372-374. DOI: 10.2337/dc06-1625.
[14] James S, Angiolillo DJ, Cornel JH,etal. Ticagrelorvsclopidogrel in patients with acute coronary syndromes and diabetes: a substudy from the PLATelet inhibition and patient Outcomes (PLATO) trial[J]. Eur Heart J, 2010, 31(24): 3006-3016. DOI: 10.1093/eurheartj/ehq325.

