蒙医不同针刺法对慢性应激抑郁大鼠额叶神经元形态及NO-cGMP信号通路的影响
赛音朝克图,赵贤芳,那顺,景泉凯,陈福玉,黄金刚
1.内蒙古自治区国际蒙医医院,内蒙古 呼和浩特 010065;2.内蒙古民族大学,内蒙古 通辽 028000;3.北京中医药大学针灸推拿学院,北京 100029
论著·实验研究
蒙医不同针刺法对慢性应激抑郁大鼠额叶神经元形态及NO-cGMP信号通路的影响
赛音朝克图1,赵贤芳2,那顺2,景泉凯3,陈福玉1,黄金刚1
1.内蒙古自治区国际蒙医医院,内蒙古 呼和浩特 010065;2.内蒙古民族大学,内蒙古 通辽 028000;3.北京中医药大学针灸推拿学院,北京 100029
目的 观察蒙医不同针刺法对抑郁模型大鼠额叶神经元及NO-cGMP信号通路的影响,探讨蒙医不同针刺法抗抑郁作用的生物学机制。方法雄性SD大鼠随机分为正常组、模型组、百忧解组、蒙医银针组、蒙医三根平衡针组、针药结合组,每组8只。除正常组外,其余各组大鼠孤养,不可预知的应激刺激前1 h,接受不同方式的治疗。28 d后观察大鼠行为学改变,断头取大鼠海马及额叶组织,不同染色观察额叶神经元形态改变,应用硝酸还原酶法和放射免疫法检测海马及额叶NO-cGMP含量。结果尼氏染色结果显示,模型组大鼠额叶神经元锥体细胞形态不完整、排列紊乱、数量明显减少,尼氏体变浅、大部分模糊不清;蒙医三根平衡针组、蒙医银针组大鼠额叶神经元形态尚可,尼氏体呈深蓝色。HE染色结果显示,模型组大鼠额叶神经元胞膜破裂、结构不清楚,部分细胞脱落而形成空泡;蒙医三根平衡针组、蒙医银针组大鼠额叶细胞排列较规则,细胞层次较丰富,神经元胞膜较完整。与正常组比较,模型组额叶及海马NO-cGMP含量明显升高,各治疗组均能不同程度逆转此变化。结论蒙医不同针刺法可能通过调控NO-cGMP的表达而达到治疗抑郁症的目的。
抑郁症;额叶;神经元;NO-cGMP信号通路;蒙医针刺;大鼠
抑郁症作为一种心境或情感障碍性疾病,严重损害人类躯体多种生理指标。目前对抑郁症发病机制尚认识不足,因此尚缺乏有效的治疗方法。蒙医文献记载和现代临床研究显示,蒙医针刺疗法在改善抑郁患者持续低落、兴趣缺乏、乐趣丧失等核心症状方面疗效确切[1-2]。NO-cGMP信号通路与抑郁发作密切相关[3],一氧化氮(NO)是调控血管舒张反应的关键因素,但它作为神经系统重要的信使分子和神经递质,参与学习、记忆在内的多种生理过程。可能在抑郁症的发病机制和病程中起重要作用[4-5]。环磷酸鸟苷(cGMP)是一种具有细胞内信息传递作用的第二信使,可被G蛋白偶联受体激活的蛋白激酶活化,进而将胞外信号转导至细胞核。在细胞凋亡、血管重塑、神经传递等方面发挥着重要的生理功能[6]。本实验通过建立慢性应激抑郁大鼠模型,探讨蒙医不同针刺法对抑郁模型大鼠神经元及不同脑区NO-cGMP信号通路的影响,为蒙医针刺治疗抑郁症提供实验和理论依据。
1 材料与方法
1.1 动物
SPF级成年雄性SD大鼠48只,体质量(200± 10)g,北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2012-0001。饲养于北京中医药大学实验动物中心,自由饮水摄食。
1.2 主要试剂与仪器
尼氏染色液(上海碧云天生物技术有限公司),湿转缓冲液和丽春红染色液(北京赛诺博公司),苏木精染液、伊红染液和 1%盐酸乙醇分化液(北京鼎国昌盛生物技术有限公司),NO试剂盒(南京建成生物工程研究所),cGMP试剂(Biovision cGMP Direct Immunoasssay kit)。蒙医RZ-I型电热银针治疗仪(内蒙古元阳中蒙科技开发有限公司),电动组织匀浆器(美国 Fluka公司),Fresco低温冷冻离心机(美国Thermo公司),MultiSkan3酶标仪(Thermo公司),可见分光光度计(上海光学仪器公司),37 ℃恒温水浴锅(廊坊市中仪国科器仪表有限公司)。
1.3 分组及造模
通过开野实验将水平运动次数加垂直运动次数不足30次或超过120次的大鼠剔除。选取符合条件的大鼠 48只,随机分为正常组、模型组、蒙医银针组、蒙医三根平衡针组、百忧解组和针药结合组,每组8只。参照文献[7-8]方法,造模大鼠全部孤养,随机接受28 d 7种不同的应激刺激(4 ℃游泳5 min,昼夜颠倒24 h,禁食24 h,禁水24 h,夹尾3 min,水平摇晃30 min,潮湿环境24 h),以上刺激每日1种,同种刺激不能连续出现,且每种刺激最少3次。
1.4 处理方法
正常组:每笼饲养4只,正常饮水摄食,不给任何刺激。模型组:孤养,并接受7种不可预知的应激刺激28 d。蒙医银针组:孤养,每日接受各种不同的应激刺激前1 h,进行蒙医银针(长度:3 cm、直径0.65 mm)刺激“巴达干穴”(位于第三胸椎下凹中)、“心穴”(位于第7胸椎下凹正中)和“黑白际穴(位于前正中线,两乳正中的心窝处)”。针刺方法:“巴达干穴”“心穴”针尖向上斜刺0.5~1 cm,“黑白际穴”针尖向下斜刺0.5~1 cm,每次留针20 min。蒙医三根平衡针组:孤养,针刺和选穴同上,每日选取1个穴位,针柄接蒙医RZ-I型电热银针治疗仪加温刺激,加热温度为(40±1)℃,每次加温时间20 min,防止灼伤针刺部位。第1日“巴达干穴”,第2日为“心穴”,第3日为“黑白际穴”,依次循环刺激。百忧解组:孤养,每日应激刺激前1 h,将百忧解以生理盐水配制成1 mg/mL,按照2 mg/kg体质量灌胃给药。针药结合组:孤养,每日应激刺激前1 h,行蒙医三根平衡针组同样方法刺激,刺激后将百忧解以生理盐水配制成1 mg/mL,按照2 mg/kg体质量灌胃给药。
1.5 标本制备
实验第29日,大鼠开胸暴露心脏,生理盐水灌流10 min,4%甲醛急灌10 min,慢灌20 min。断头取脑,去除颅骨,充分暴露脑组织,将两侧顶叶掀起,分离、剥离,取出海马,切下额叶。上述操作均在冰盘上3 min内完成,制作石蜡切片。
1.6 指标检测
1.6.1 尼氏染色 常规脱蜡,染色8 min,染色时温度为37~50 ℃,蒸馏水洗涤2次,95%乙醇约5 s,95%乙醇脱水2 min,换用新鲜95%乙醇再脱水2 min,二甲苯透明5 min,换用新鲜的二甲苯,再透明5 min,用中性树胶封片,显微镜下观察。
1.6.2 HE染色 常规烤片,切片脱蜡至水,苏木精液染色10 min,自来水洗1 min,1%盐酸乙醇分化数秒,自来水洗1 min,0.2%氨水返蓝30 s,自来水洗1 min,伊红染色3~5 min,自来水速洗,脱水,透明,中性树胶封固,显微镜下观察。
1.6.3 硝酸还原酶法测定海马及额叶皮层一氧化氮含量 按试剂盒说明书制备试剂,空白管放入双蒸水0.l mL,标准管放入100 μmo1/L标准应用液0.l mL,测定管放入样本0.1 mL。空白管、标准管及测定管各加入混合试剂0.2 mL,混匀,37 ℃水浴60 min。空白管、标准管及测定管各加入试剂0.2 mL,混匀,室温静置10 min,3500~4000 r/min离心10 min,取上清液显色。空白管、标准管及测定管各加入上清液0.5 mL,显色剂0.6 mL,混匀,室温静置10 min,蒸馏水调零,于550 nm波长处、0.5 cm光径下测定各管光密度(OD)值,计算NO含量[(测定管OD值-空白管OD值)÷(标准管OD值-空白管OD值)×标准品浓度÷待测样本蛋白浓度]。
1.6.4 放免法检测海马及额叶皮层cGMP含量 取适量额叶或海马,放入盛有2 mL预冷的50 mmol/L醋酸缓冲液(pH 4.75)试管中,用匀浆器将组织粉碎研磨,将悬浮液倒入离心管中。用2 mL无水乙醇冲洗匀浆器后倒入悬浮液中,混匀,静置5 min,3500 r/min离心15 min,收集上清液。再用75%乙醇2 mL清洗匀浆器1次,倒入同一离心管,3500 r/min离心15 min,合并上清液,于80 ℃烤箱中烘干后,4 ℃保存待测。cGMP含量测定操作按试剂盒说明进行。于酶标仪波长450 nm处测量各孔OD值。
1.7 统计学方法
采用SPSS17.0统计软件进行分析。实验数据以—x±s表示,多组间比较采用方差分析,两组间比较采用LSD检验,若方差不齐,组间用独立样本的非参数检验。P<0.05表示差异有统计学意义。
2 结果
2.1 蒙医不同针刺法对模型大鼠额叶神经元病理形态的影响
尼氏染色结果显示,与正常组比较,模型组大鼠额叶神经元锥体细胞形态不完整、排列紊乱、数量明显减少,尼氏体变浅、大部分模糊不清;与模型组比较,百忧解组、蒙医三根平衡针组、蒙医银针组大鼠额叶神经元形态细胞形态尚可,尼氏体呈深蓝色,数量较多,但与针药结合组比较还有部分尼氏体溶解。结果见图 1。HE染色结果显示,模型组大鼠额叶神经元胞膜破裂、结构不清楚,胞核变小,较多细胞核固缩,部分细胞脱落而形成空泡;蒙医三根平衡针组、蒙医银针组、百忧解组大鼠额叶细胞排列较规则,细胞层次较丰富,神经元胞膜较完整,但与正常组、针药结合组比较仍有部分细胞萎缩、胞核变小和核固缩。结果见图2。
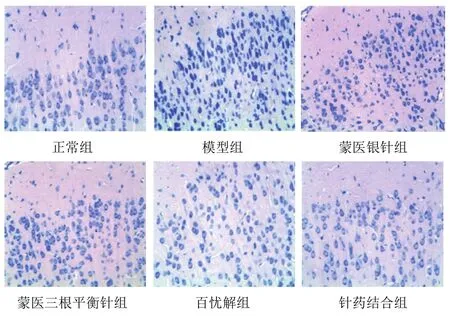
图1 各组大鼠额叶神经元病理形态(尼氏染色,×400)
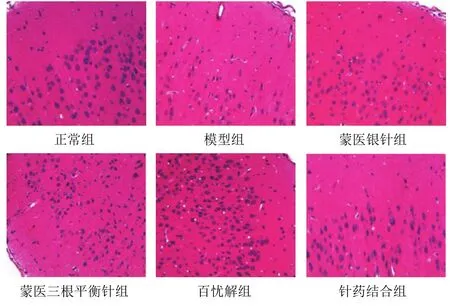
图2 各组大鼠额叶神经元病理形态(HE染色,×400)
2.2 蒙医不同针刺法对模型大鼠海马和额叶一氧化氮的影响
与正常组比较,模型组海马和额叶皮层NO含量明显增加(P<0.01)。与模型组比较,蒙医三根平衡针组、百忧解组、针药结合组海马NO含量明显降低(P<0.05),蒙医银针组NO含量降低,但差异无统计学意义;百忧解组和针药结合组额叶皮层NO含量明显降低(P<0.05),蒙医银针组、蒙医三根平衡针组NO含量降低,但差异无统计学意义。结果见表1。
表1 各组大鼠海马和额叶皮层NO含量比较(μmol/g)
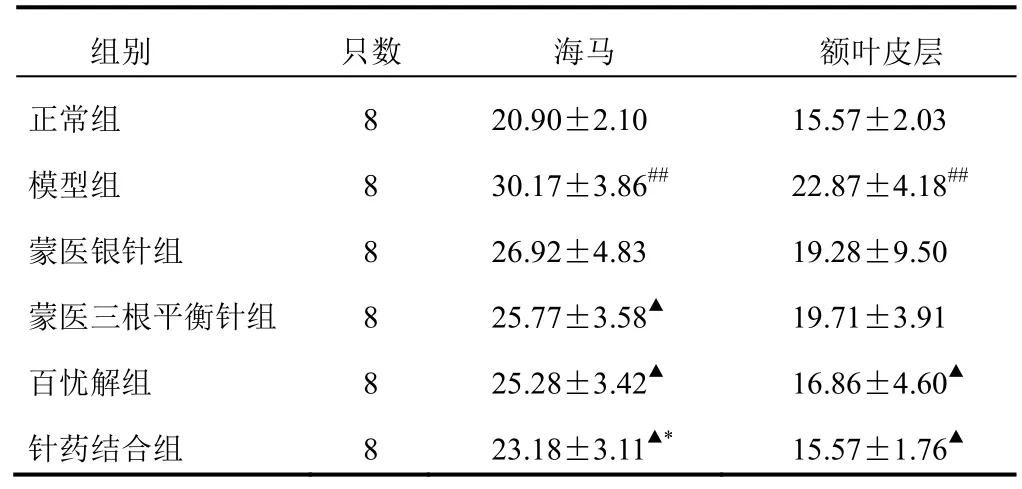
表1 各组大鼠海马和额叶皮层NO含量比较(μmol/g)
注:与正常组比较,##P<0.01;与模型组比较,▲P<0.05;与蒙医三根平衡针组比较,*P<0.05
组别 只数 海马 额叶皮层正常组 8 20.90±2.10 15.57±2.03模型组 8 30.17±3.86## 22.87±4.18##蒙医银针组 8 26.92±4.83 19.28±9.50蒙医三根平衡针组 8 25.77±3.58▲ 19.71±3.91百忧解组 8 25.28±3.42▲ 16.86±4.60▲针药结合组 8 23.18±3.11▲* 15.57±1.76▲
2.3 蒙医不同针刺法对模型大鼠海马和额叶环磷酸鸟苷的影响
与正常组比较,模型组大鼠海马和额叶皮层组织cGMP含量明显增加(P<0.01)。与模型组比较,蒙医银针组、蒙医三根平衡针组、百忧解组、针药结合组海马cGMP含量明显降低(P<0.05),百忧解组、蒙医银针组与蒙医三根平衡针组cGMP含量相当,针药结合组cGMP含量明显低于蒙医三根平针组(P<0.05);蒙医三根平衡针组、百忧解组、针药结合组额叶皮层cGMP含量明显降低(P<0.05),蒙医银针组cGMP含量降低,但差异无统计学意义。结果见表2。
表2 各组大鼠海马和额叶皮层cGMP含量比较(pmol/mg)
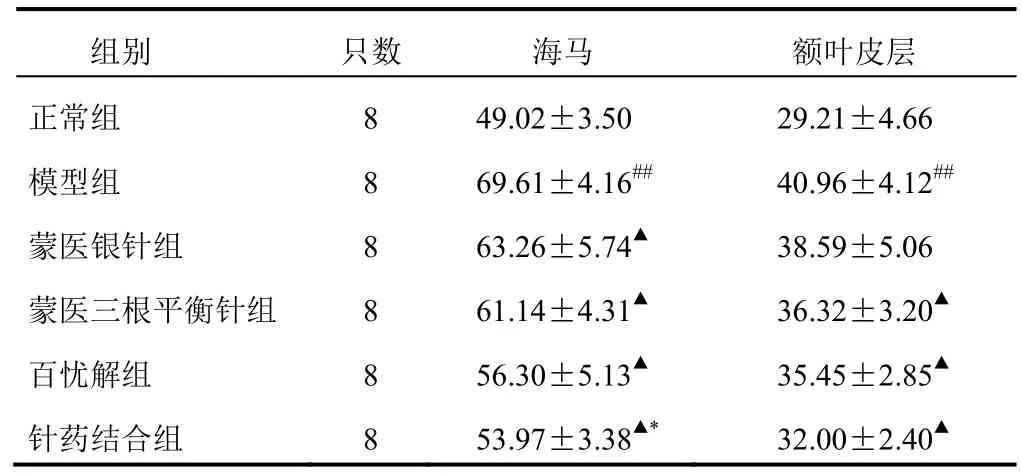
表2 各组大鼠海马和额叶皮层cGMP含量比较(pmol/mg)
注:与正常组比较,##P<0.01;与模型组比较,▲P<0.05;与蒙医三根平衡针组比较,*P<0.05
组别 只数 海马 额叶皮层正常组 8 49.02±3.50 29.21±4.66模型组 8 69.61±4.16## 40.96±4.12##蒙医银针组 8 63.26±5.74▲ 38.59±5.06蒙医三根平衡针组 8 61.14±4.31▲ 36.32±3.20▲百忧解组 8 56.30±5.13▲ 35.45±2.85▲针药结合组 8 53.97±3.38▲* 32.00±2.40▲
3 讨论
抑郁症是病因不明的情感障碍性疾病。目前,NO介导的N-甲基-D-天冬氨酸(NMDA)受体-NO-cGMP信号通路与抑郁症的发病机制假说很受关注。NO是一种非经典的新型递质和信息传递分子,与脑血管结构、血管通透性、微循环、神经突触可塑性、神经元兴奋及炎性损害有关,既可作为神经递质直接传递信息,也可作为神经调质影响其他神经递质的传递,或作为第二信使传递细胞信息。但过量的NO却会引起神经毒性作用[9]。研究发现,抑郁症患者血浆NO浓度与抑郁症状严重程度显著相关[10]。既往研究表明,NO-cGMP通路与抑郁发作的大致过程,除了NO直接参与学习、记忆在内的多种生理过程外,通过谷氨酸-NMDA受体-NOS-NO-cGMP通路诱发抑郁发作。即突触前部位释放的谷氨酸结合到NMDA受体,增加Ca2+内流和膜的去极化,激活NO合酶NOS,使NO合成增多,NO扩散到临近细胞与鸟苷酸环化酶(GC)中Fe的结合,改变酶结构,转化成cGMP,形成NO-cGMP通路,从而加大对神经元的毒性,导致抑郁发作[11-12]。另外,NO直接影响NMDA受体的激活[13]。NMDA受体过度激活,同样导致抑郁样行为发生[14]。慢性应激可能激活海马内谷氨酸-Ca2+-NMDA受体-NOS-NO-cGMP途径,生成过量的NO,对神经元产生毒性作用。
蒙医学“心思病”“悲伤狂”与现代医学抑郁症有共同之处。蒙医学认为,人体是由三根、七素、三秽构成。人体之所以能维持正常的生理活动,主要是体内具有三根,即赫依、希拉、巴达干。机体三根中,若赫依的功能失调,则人的思辨能力、精神、神志出现异常。临床上表现为情绪低落、精力减退、失眠健忘、疲乏、游离性疼痛等症状。当巴达干功能紊乱时,则出现记忆力减退、思维迟钝、意识模糊等症状。希拉功能失调,则出现口干、狂躁等症状。故蒙医学认为,抑郁症是体内三根中赫依偏盛,并与希拉、巴达干相搏侵袭心,从而心脑血行障碍,阻塞白脉之传导所致。蒙医学中白脉类似于神经系统,大脑是白脉之海,脊髓像树根一样向下延伸,分出司管脏器 19条白脉,其中1条赫依性白脉延伸到第7椎与心脏相连。因此,与心相连的赫依性白脉之传导受阻,心主神明的生理功能发生异常,则会出现抑郁样行为。因此,抑郁症的治疗以镇赫依、调理三根、宁心安神、促进白脉传导为主要治疗原则,根本在于调节体内三根的相对平衡状态。本实验选取的“巴达干穴”“心穴”“黑白际穴”具有调节三根、安神作用,蒙医银针、蒙医三根平衡针均有疏通白脉作用[15]。本研究尼氏染色显示,模型组大鼠额叶神经元与正常组比较,尼氏体变浅、大部分模糊不清;百忧解组、蒙医三根平衡针组、蒙医银针组大鼠额叶神经元形态较模型组细胞形态尚可,但与正常组和针药结合组比较还有部分尼氏体溶解。HE染色结果显示,模型组大鼠额叶神经元胞膜破裂、结构不清楚;百忧解组、蒙医三根平衡针组、蒙医银针组大鼠额叶细胞排列较规则,细胞层次较丰富,神经元胞膜较完整,但与正常组和针药结合组比较仍有部分细胞萎缩、胞核变小和核固缩。
慢性应激28 d后,额叶和海马NO-cGMP的含量明显增加,蒙医银针组、蒙医三根平衡针组、百忧解组和针药结合组均能逆转此变化,说明蒙医不同针刺疗法均有抗抑郁作用,但在海马组织,针药结合组cGMP含量明显低于蒙医银针组、蒙医三根平衡针组和百忧解组,说明针药结合治疗抑郁症疗效更好。与针刺联合盐酸帕罗西汀片治疗轻中度抑郁症临床研究结果相似[16]。另外,本研究发现,接受不同的针刺干预后NO-cGMP在海马和额叶的表达有所不同,海马中表达变化较额叶组织更明显,表明对针刺刺激海马神经元较额叶敏感。本实验结果显示,蒙医不同针刺法在对抑郁样行为干预过程中均能调控 NO-cGMP表达,这可能也是蒙医针刺治疗抑郁症的作用机制之一。另一方面,NO-cGMP表达各组间有明显的差异,说明蒙医不同针法对抑郁症的疗效有所不同。
[1] 胡斯楞,陈英松.抑郁症的蒙医学研究进展[J].中国民族民间医药,2016,25(4):11-12.
[2] 赛音朝克图,白淑英,朱海龙,等.蒙医三根平衡针对首发抑郁症的疗效观察[J].中国中医药科技,2013,20(2):170-171.
[3] 李欣,周虹,杨宝学,等.一氧化氮与抑郁症发生的相关性[J].国际神经病学神经外科学杂志,2010,37(4):352-356.
[4] 程素满,陈金峰,李志榕,等.气体信号分子CO和H2S与抑郁症之间的相关研究[J].生命科学研究,2014,18(5):407-410.
[5] MADHUSOODANAN K S, MURAD F. NO-cGMP signaling and regenerative medicine involving stem cells[J]. Neurochem Res,2007,32(4/5):681-694.
[6] WANG-ROSENKE Y, NEUMAYER H H, Peters H. NO signaling through cGMP in renal tissue fibrosis and beyond:key pathway and noveltherapeutic target[J]. Curr Med Chem,2008,15:1396-1406.
[7] KATZ R J, BALDRIGHI G. A further parametric study of imipra-mine in an animal model of depression[J]. Phamacol Bichem Behav,1982, 12(1):969-972.
[8] 许晶,李晓秋.慢性应激抑郁模型的建立及其评价[J].中国行为医学科学,2003,12(1):14-17.
[9] BANASR M, VALENTINE G W, LI X Y, et al. Chronic unpredictable stress decreases cell proliferation in the cerebral cortex of the adult rat[J]. Biol Psychiatry,2007,62(5):496-504.
[10] 张洪燕,陆蓉,瞿秋霜.神经源型一氧化氮合酶C276T基因多态性与抗抑郁疗效相关分析[J].四川精神卫生,2010,23(3):129-133.
[11] 王景霞,张建军,李伟,等.芍药苷抗抑郁作用与NO/c GMP通路相关性研究[J].中药与临床,2012,3(1):27-28,37.
[12] LEZA J C, SALAS E, SAWICKI G, et a1. The effects of stress on homeostasis in JCR-LA-cp rats:the role of nitric oxide[J]. Pharmacol Exp Ther,1998,286(3):1397-1403.
[13] GARTHWAITE J, CHARLES S L, CHESS-WILLIAMS R. Endotheliumderived relaxing factor release on activation of NMDA receptors suggests role as intercellular messenger in the brain[J]. Nature, 1988,336(6197):385-388.
[14] 吴帅,安书成,陈慧彬,等.慢性应激性抑郁发生中大鼠眶额叶多巴胺Dl受体对谷氨酸及其NMDA受体的调节[J].心理学报,2014,46(1):69-78.
[15] 策·苏荣扎布.蒙医临床学[M].呼和浩特:内蒙古人民出版社,1999:844-850.
[16] 陈海东,杨秀岩,马学红,等.针刺联合盐酸帕罗西汀片治疗轻中度抑郁症临床研究[J].中国中医药信息杂志,2014,21(8):35-38.
Effects of Different Mongolian Acupuncture Methods on Neurons Form in Frontal Lobe and NO-cGMP Signaling Pathways in Rats with Chronic Stress Depression
SAI Yinchaoketu1, ZHAO Xian-fang2, NA Shun2, JING Quan-kai3, CHEN Fu-yu1, HUANG Jin-gang1(1. Inner Mongolia International Mongolian Hospital, Hohhot 010065, China; 2. Inner Mongolia University for Nationalities, Tongliao 028000, China; 3. School of Acupuncture-moxibustion and Tuina, Beijing University of Chinese Medicine, Beijing 100029, China)
ObjectiveTo observe the effects of different Mongolian acupuncture methods on neurons form in frontal lobe and NO-cGMP signaling pathways in rats with chronic stress depression; To explore biological mechanism of different Mongolian acupuncture methods for depression.MethodsThe male SD rats were randomly divided into control group, model group, fluoxetine group, Mongolian silver acupuncture group, Mongolian acupuncture “three modulation methods” group, and the combination of acupuncture with fluoxetine group (8 rats in each group). Except for control group, other rats were kept alone. Rats receive different treatment 1 hour before stimulations. Behavior changes were observed after 28 days. Hippocampus and frontal lobe tissues were collected. Frontal lobe neurons form changes were observed through different dyeing methods. The content of NO-cGMP was detected by radioimmunoassay and nitrate reductase method.ResultsResults of Nissl′s staining showed that the neuronal pyramidal cells in the frontal lobe of model group rats arranged disorderedly, morphology was not intact and the number was obviously reduced. Nissl′s staining got shallow and the most were blurry. The form of the frontal lobeneurons in Mongolian acupuncture “three modulation methods” group and Mongolian acupuncture group were good, Nissl′s staining was dark blue. HE staining results showed that cytomembrane of frontal lobe neurons in model group rats ruptured, and structure was not clear. some cells fell off and formed into cavities. In Mongolian acupuncture“three modulation methods” group and Mongolian silver acupuncture group, the frontal lobe cells arranged regularly, cellular level was rich, and the nerve cell membrane was complete. The content of NO-cGMP in frontal lobe and hippocampus tissues was significantly elevated in model group. Mongolian acupuncture, Mongolian acupuncture "three modulation methods", fluoxetine, and the combination of acupuncture with fluoxetine treatments all could reverse the changes.ConclusionDifferent Mongolian acupuncture methods may treat depression through regulating and controlling the expression of NO-cGMP.
depression; frontal lobe; neurons; NO-cGMP signaling pathways; Mongolian acupuncture; rats
10.3969/j.issn.1005-5304.2017.04.011
R245
A
1005-5304(2017)04-0040-05
2016-08-10)
(
2016-08-27;编辑:华强)
国家自然科学基金(81360576);内蒙古自治区自然科学基金(2015MS08130)

