芫花醇提物对不同种属体系UGTs及UGT1A1活性的影响
郭嫦娥,苗培培,陈红影,陈宁,马鹏凯,李红品,朱虹宇,高兴,张玉杰
北京中医药大学中药学院,北京 100102
芫花醇提物对不同种属体系UGTs及UGT1A1活性的影响
郭嫦娥,苗培培,陈红影,陈宁,马鹏凯,李红品,朱虹宇,高兴,张玉杰
北京中医药大学中药学院,北京 100102
目的考察芫花醇提物对UGTs及UGT1A1活性的影响,为阐释芫花毒性机制提供依据。方法采用体外肝微粒体孵育模型,以4-硝基酚为底物检测UGTs活性,以β-雌二醇为底物检测UGT1A1活性,利用UV和HPLC测定底物及代谢物含量。结果芫花醇提物中3种黄酮类成分芹菜素、羟基芫花素、芫花素含量分别为6.34%、8.72%、6.06%,UV测得总二萜含量为31.40%。体外实验表明,在大鼠肝微粒体(RLM)和人肝微粒(HLM)孵育体系中,芫花醇提物均能显著抑制UGTs活性;对UGT1A1活性,在RLM、HLM和重组酶(rhUGT1A1)孵育体系中,芫花醇提物均表现为中等强度的抑制作用,以羟基芫花素计,半数抑制浓度分别为46.32、32.49、8.382 µmol/L,抑制类型分别为竞争性抑制作用、反竞争性抑制作用和竞争性抑制作用。结论 芫花醇提物对不同肝微粒体孵育体系中UGTs及UGT1A1活性均可产生抑制作用且存在种属差异性,这种抑制作用可能是芫花致肝损伤的机制之一。
芫花;醇提物;UGTs;UGT1A1;肝微粒体;毒性;抑制作用
芫花Genkwa Flos为瑞香科植物Daphne genkwa Sieb. et Zucc.的干燥花蕾,其性温,味苦、辛,归肺、脾、肾经[1],为传统峻下逐水药[2]。芫花含有黄酮类、香豆素类、木脂素类、二萜原酸酯类、挥发油类等多种化学成分[3],具有镇咳、祛痰、镇痛、抑菌、抗炎、抗惊厥、抗肿瘤等多种药理活性[4],但长期大剂量使用可致肝、肾、脑等器官出现严重损伤[5],并对皮肤及黏膜具有严重的刺激性[6]。研究表明,芫花醇提物是芫花的主要活性部位,具有良好的镇痛作用[7]、抗炎活性[8]、抗寄生虫活性[9],同时也具有明显的肝肠毒性作用[10]。UGTs催化的葡萄糖醛酸结合反应是体内重要的Ⅱ相代谢途径,可增加底物的亲水性,使其更有效地从尿或胆汁中排出体外,对调节机体与外环境间的相互作用和保持机体内环境的稳定具有重要意义[11-12]。UGT1A1是葡萄糖醛酸转移酶中重要的一员,是许多内源性激素、毒性代谢物(如胆红素)和外源物的结合酶[13],对维持体内平衡具有重要的作用。因此,研究基于UGTs介导的药物相互作用对解释中药配伍原理及指导临床用药具有重要意义。曾有报道芫花对细胞色素P450酶活性的影响[14],而其对Ⅱ相代谢酶UGTs活性的影响研究目前尚未见报道。本试验采用肝微粒体体外孵育方法,以 4-硝基酚(4-NP)和β-雌二醇为探针底物,利用UV和HPLC分别测定底物及代谢产物的含量变化,考察芫花醇提物对人和鼠肝微粒体孵育体系中UGTs及UGT1A1活性的影响,为芫花致肝损伤的可能机理、芫花的开发利用,以及预测临床可能的代谢性药物相互作用提供依据。
1 仪器与试药
岛津高效液相色谱仪(LC-20AT四元高压泵,SPD-20A UV-vis检测器,DGO-20A在线真空脱气机,SIL-20A自动进样器,GTO-10AS VP柱温箱及LC色谱工作站),T10 basic匀浆器(IKA,德国),TGL 20M台式高速冷冻离心机(长沙湘智离心机仪器有限公司),TU-1901紫外分光光度计(北京普析通用仪器有限责任公司),DKZ-450B型电热恒温振荡水槽(上海森信实验仪器有限公司),VOTEX GENIVS漩涡混匀仪(IKA),MTN-2800D型氮气吹干仪(天津奥特赛恩斯仪器有限公司)。
芫花(批号14010602),安徽本草国药有限公司,经北京中医药大学中药学院张贵君教授鉴定为瑞香科植物芫花 Daphne genkwa Sieb. et Zucc.的干燥花蕾;芫花素、芹菜素(批号分别为 111899-201202、111901-201102,纯度均≥98%)、氢溴酸右美沙芬(批号100201-201003,纯度≥98%),中国食品药品检定研究院;羟基芫花素(批号10540000,纯度≥98%),上海标准品生物技术有限责任公司;丙甲菌素,北京拜耳迪生物技术有限公司(J&K Scientific,中国大陆);尿苷-5′-二磷酸三钠盐(UDPGA)、D-葡萄糖二酸-1,4-内酯,Sigma-Aldrich;混合雄性大鼠肝微粒体(RLM)、男性混合人肝微粒体(HLM),汇智泰康生物技术(北京)有限公司;重组酶 UGT1A1(rhUGT1A1),BD公司(上海,中国);脱水穿心莲内酯(批号A0473,纯度≥98%),成都曼思特生物科技有限公司;β-雌二醇,TCI公司;β-雌二醇-3-葡糖醛酸苷(E-3-G),Toronto Research Chemicals Inc.;4-NP,上海江莱生物科技有限公司;乙腈、甲醇为色谱纯,美国Fisher公司;其余试剂均为国产分析纯。
2 方法
2.1 芫花醇提物的制备
称取芫花1 kg,用10倍量95%乙醇加热回流提取2 h,得提取液;残渣用50%乙醇继续加热回流提取2 h,合并提取液,减压浓缩,蒸干,得芫花醇提取物164.12 g。
2.2 芫花醇提物主要成分含量测定
2.2.1 HPLC测定3种黄酮成分 采用Agilent Zorbax Extend-C18色谱柱(150 mm×4.6 mm,5 µm),流动相A为0.2%甲酸水、B为乙腈,梯度洗脱(0~25 min,90%~80%A;25~60 min,80%~48%A;60~70 min,48%~10%A;70~80 min,10%~90%A),流速为1 mL/min,柱温40 ℃,检测波长280 nm[15]。3种黄酮成分分离良好,芫花素、羟基芫花素、芹菜素保留时间分别为54.25、48.68、41.78 min。色谱图见图1。
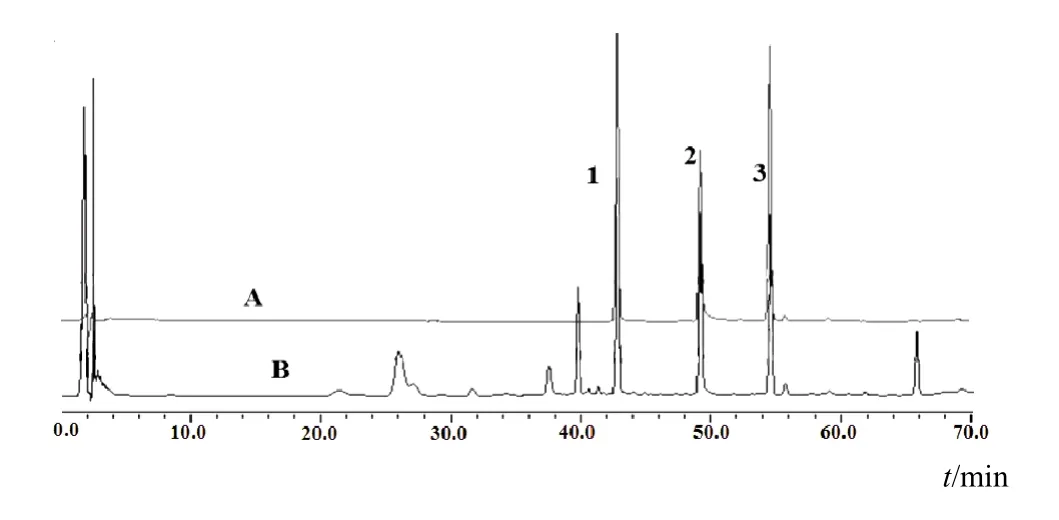
图1 芫花醇提物中3种黄酮成分HPLC图
2.2.2 比色法测定总二萜含量 选择与芫花中二萜类成分结构相似的脱水穿心莲内酯作为对照品,测定芫花醇提物中总二萜含量[16]。取脱水穿心莲内酯对照品及芫花醇提物溶液各2 mL,分别置于10 mL具塞试管中,水浴挥干溶剂,分别加入新鲜配制的 5%香草醛-冰乙酸溶液0.2 mL及高氯酸0.8 mL,混匀,密塞,置60 ℃水浴中反应15 min,取出,迅速冷却后精密加入冰乙酸5 mL,混匀,静置10 min,以空白试剂作为对照,于400~800 nm波长处测定吸收光谱,结果见图2、图3。选择410 nm为检测波长,测定芫花醇提物中总二萜含量。

图2 脱水穿心莲内酯对照品UV图

图3 芫花醇提物UV图
2.3 HPLC测定UGT1A1活性
采用Agilent Zorbax Extend-C18色谱柱(4.6 mm× 150 mm,5 µm),流动相A为0.2%甲酸水、B为乙腈,梯度洗脱(0~10 min,90%~75%A;10~30 min,75%~48%A;30~45 min,48%~10%A,45~60 min,10%~90%A),流速1 mL/min,柱温40 ℃,检测波长280 nm。结果UGT1A1底物β-雌二醇的代谢产物E-3-G与内标(氢溴酸右美沙芬)峰形良好,分离完全,无杂质峰干扰,空白肝微粒体及提取物成分对测定无干扰,专属性强。色谱图见图4。
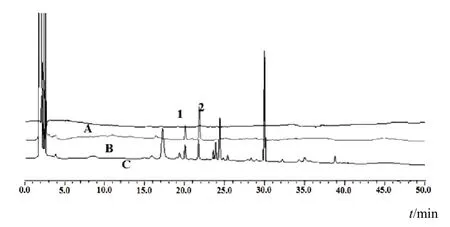
图4 RLM中E-3-G的HPLC图
2.4 温孵条件及样品处理
2.4.1 UGTs活性测定 参照文献[17-19]方法,以4-NP为底物,采用UV进行测定。200 µL温孵体系包括 0.2 g/L RLM 或 HLM、丙甲菌素(50 µg/mg protein)、3 mmol/L UDPGA、100 mmol/L Tris-HCl、5 mmol/L MgCl2、5 mmol/L D-葡萄糖二酸-1,4-内酯、1 mmol/L 4-NP及100 µmol/L芫花醇提物(以羟基芫花素计)。37 ℃预孵育5 min,加入UDPGA启动反应,孵育30 min,加入5%三氯乙酸2 mL终止反应,13 000×g离心15 min,取上清液1 mL,加入2 mol/L NaOH 0.25 mL,于405 nm波长处测定吸光度。
2.4.2 UGT1A1活性测定 参照苗培培等[18]方法,确定温孵时间为30 min,蛋白终浓度为0.5 g/L。
2.5 芫花醇提物对UGT1A1的半数抑制浓度测定
取UGT1A1的特异性底物β-雌二醇,测定不同浓度芫花醇提物作为抑制剂对其代谢的抑制作用,计算半数抑制浓度(IC50)。在孵育体系中,固定探针底物浓度不变(RLM:35 µmol/L;HLM和rhUGT1A1:30 µmol/L),芫花醇提物的浓度(以羟基芫花素计)为0~150 µmol/L,按“2.4.1”项下步骤反应,终止后,HPLC测定探针代谢产物 E-3-G的含量,采用GraphPad Prism 5处理数据,计算芫花醇提物对UGT1A1抑制作用的IC50值。
2.6 芫花醇提物对UGT1A1抑制类型的确定
对IC50<100 µmol/L的反应体系,进一步分析芫花醇提物对UGT1A1的抑制类型。配制3个不同浓度的探针底物溶液,在孵育体系中,分别加入不同浓度的探针药物和芫花醇提物反应一定时间后,终止反应,按“2.4.1”项下处理样品, HPLC分析代谢产物(E-3-G)的含量,根据Lineweaver-Burk和Dixon-Plot图,计算抑制常数Ki,判断抑制类型。
2.7 数据处理
采用 SPSS17.0统计软件进行分析。数据用—x±s表示。各组数据均进行线性回归分析,同时进行方差分析,方差不齐者采用非参数检验。P<0.05表示差异有统计学意义。
3 结果
3.1 芫花醇提物主要成分含量测定
1 kg芫花原材料所得芫花提取物为164.12 g。芫花醇提物中3种黄酮成分芹菜素、羟基芫花素、芫花素的含量分别为6.34%、8.72%、6.06%,即羟基芫花素>芹菜素>芫花素;总二萜含量为 31.40%。醇提物浓度以羟基芫花素计,浓度为80.51 µmol/L。
3.2 芫花醇提物对UGTs活性的影响
与空白组比较,芫花醇提物均可显著抑制RLM、HLM孵育体系中UGTs活性,结果见表1。

表1 芫花醇提物对肝微粒体UGTs活性的影响[—x±s,µmol/(mg•min),n=6]
3.3 芫花醇提物对UGT1A1活性的影响
芫花醇提物浓度依赖性地抑制UGT1A1的活性,以羟基芫花素计,IC50分别为46.32 µmol/L(RLM)、32.49 µmol/L(HLM)、8.382 µmol/L(rhUGT1A1),见图5A、图6A、图7A。Lineweaver-Burk和Dixon-plot图表明,芫花醇提物在 RLM、rhUGT1A1体系中对UGT1A1的抑制类型为竞争性抑制作用(见图5B、C,图7B、C),以Lineweaver-Burk斜率和芫花醇提物浓度作图计算出在RLM、rhUGT1A1体系中的抑制动力学参数Ki分别为32.31、5.59 µmol/L(见图5D、图7D);芫花醇提物在HLM体系中对UGT1A1的抑制类型为反竞争性抑制作用(见图6B、C),以Lineweaver-Burk斜率和芫花醇提物浓度作图计算出抑制动力学参数Ki为1.464 µmol/L(见图6D)。
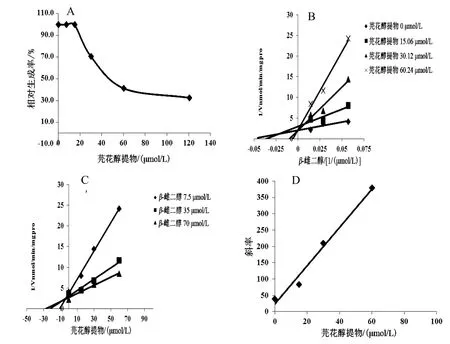
图5 芫花醇提物对RLM体系中UGT1A1活性的抑制作用(n=3)
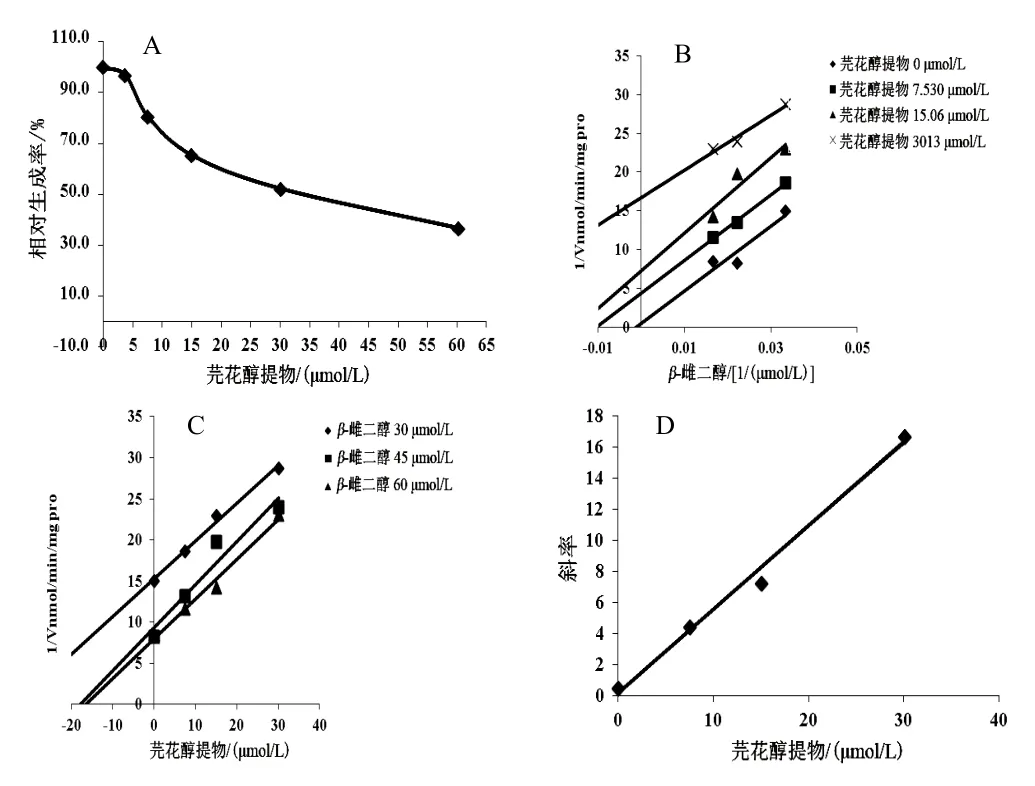
图6 芫花醇提物对HLM体系中UGT1A1活性的抑制作用(n=3)
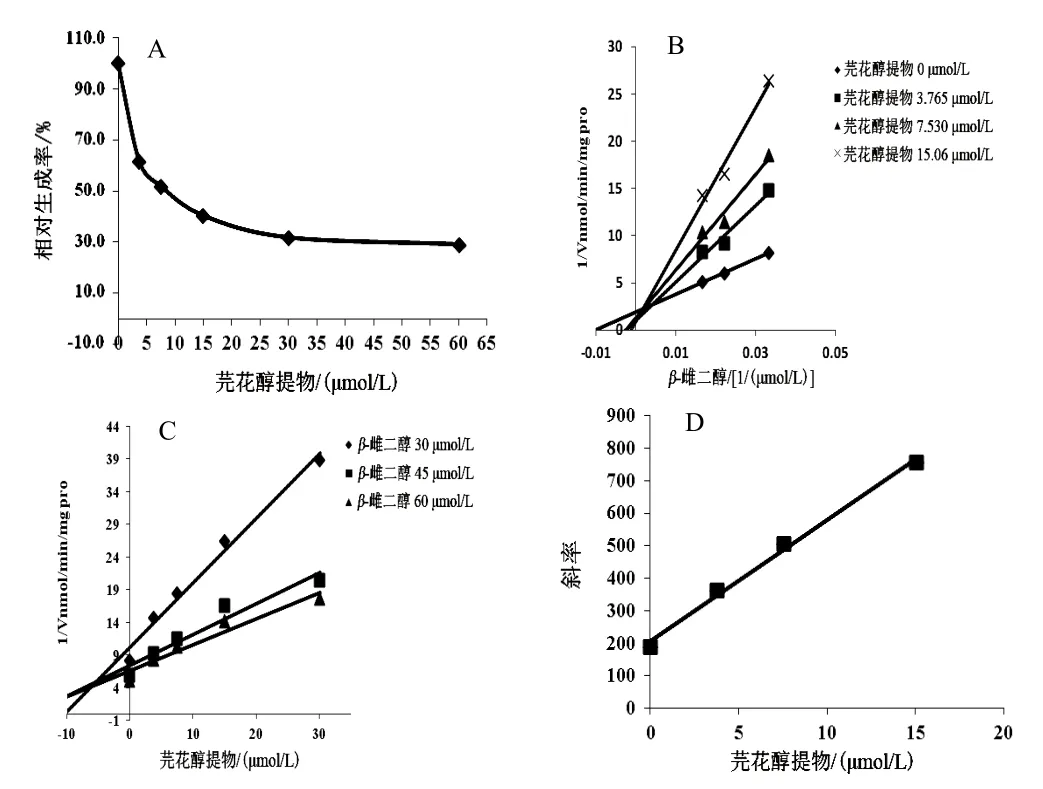
图7 芫花醇提物对rhUGT1A1体系中UGT1A1活性的抑制作用(n=3)
4 讨论
UGTs是体内最重要的Ⅱ相代谢酶,主要分布于肝脏、肠道、肾脏等器官。其功能是催化外源性药物、内源性物质发生葡萄糖醛酸化结合反应,转化为极性较强的结合物,增加底物的亲水性,使其能更有效地从尿或胆汁中排出体外,这是机体的一个重要解毒过程[20-21]。已有学者通过血清生化指标和组织病理学筛选出芫花醇提物的氯仿萃取部位是芫花致肝毒性部位,并鉴定该部分含有黄酮类成分(芫花素、芹菜素、羟基芫花素)、木脂素类及二萜原酸酯类等成分[10]。本研究测定芫花醇提物对不同种属肝微粒体中 UGTs和UGT1A1活性的影响发现,芫花醇提物对RLM和HLM孵育体系中UGTs均产生了显著的抑制作用,并且其抑制率均大于50%,这提示在芫花醇提物中存在某些成分可作为UGTs抑制剂,具有导致毒性发生的潜在可能性。
UGTs的数量和活性直接影响药物在体内的代谢消除,对维持机体的稳定及药物发生药效至关重要。对于RLM和rhUGT1A1体系,芫花醇提物对UGT1A1表现为中等强度的抑制作用,其抑制类型均为竞争性抑制作用(IC50分别为 46.32、8.382 µmol/L);对于HLM体系,芫花醇提物对UGT1A1表现为中等强度抑制作用,其抑制类型为反竞争性抑制作用(IC50为32.49 µmol/L)。由以上结果可知,芫花醇提物对不同种属中 UGT1A1的抑制程度不同,其抑制作用为rhUGT1A1>HLM>RLM;推测原因可能为,药物代谢酶存在种属差异,药物作用于不同种属 UGT1A1时呈现出不同的效果。
本研究结果提示,当芫花与UGT1A1底物药物联合使用,或长时间大剂量单独用药时,均可能发生药物代谢性相互作用或扰乱体内内源性物质的正常代谢。结合本实验室前期研究羟基芫花素对UGT酶的活性影响[18]及Chen Y等[22]和张亚洲等[23]报道的芹菜素和芫花酯戊在体内的代谢消除均需UGTs的参与,本研究通过芫花醇提物对UGTs和UGT1A1活性的抑制作用,推测Ⅱ相代谢作用可能造成芫花的毒性成分如芫花二萜成分[24]或次生毒性代谢物在体内的代谢转化受阻,导致其在体内滞留蓄积从而产生毒性,这可能为芫花致毒的机制之一,为芫花致肝损伤研究提供新思路、新方法,其具体作用机制还需进一步探讨。
[1] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:159.
[2] 李思蒙,侴桂新.芫花提取物及单体化合物体外抗肿瘤活性的初步筛选研究[C]//中国药学会中药和天然药专业委员会.中药与天然药高峰论坛暨第十二届全国中药和天然药物学术研讨会论文集.海口:中国药学会中药和天然药专业委员会,2012:3.
[3] 谈恒山,魏臻.药物相互作用的研究方法应用进展[J].药学与临床研究,2010,18(6):507-512.
[4] 李玲芝,宋少江,高品一.芫花的化学成分及药理作用研究进展[J].沈阳药科大学学报,2007,24(9):587-592.
[5] 夏丽英.现代中药毒理学[M].天津:天津科技翻译出版公司,2005, 209.
[6] 杨致礼,王佑之,吴成林,等.“十八反”中海藻、大戟、甘遂和芫花反甘草组的毒性试验[J].中国中药杂志,1989,14(2):48-50,64.
[7] 张英福,邱小青,田治锋.芫花对豚鼠膀胱逼尿肌收缩活动的影响[J].中药药理与临床,1999,15(5):36.
[8] 郑维发,王莉,石枫.芫花根乙醇提取物的抗炎活性[J].中草药,2004, 35(11):1262-1269.
[9] 莫建初,刘志茹,王海,等.芫花杀虫活性成分的结构鉴定[J].中南林学院学报,2001,21(4):5-10.
[10] 袁杨,耿璐璐,庄贺飞,等.芫花致肝毒性部位筛选及其肝毒性部位UPLC指纹图谱研究[J].中国中药杂志,2013,38(1):70-74.
[11] TUKEY R H, STRASSBURG C P. Human UDP-glucuronosyltransferases: metabolism, expression, and disease[J]. Annu Rev Pharmacol Toxicol,2000,40:581-616.
[12] JANCOVA P, ANZENBACHER P, ANZENBACHEROVA E. Phase Ⅱ drug metabolizing enzymes[J]. Biomed Pap,2010,154(2):103-116.
[13] ZHANG D, CHANDO T J, EVERETT D W, et al. In vitro Inhibition of UDP glucuronosylt transferases by at atazanavir and other HIV protease inhibitions and the relationship of this property to in vivo bilirubin glucuronidation[J]. Drug Metab Disp,2005,33(11):1729.
[14] 和凡,钟国平,赵立子,等.LC-MS/MS法研究黄酮类化合物对人肝微粒体细胞色素P450酶6种亚型的体外抑制作用[J].中国新药杂志,2009, 18(24):2340-2348.
[15] 李玲芝,彭缨,高品一,等.芫花的化学成分的LC-MS分析[C]//中国药学会.第九届全国中药和天然药物学术研讨会大会报告及论文集.南昌:中国药学会,2007:6.
[16] 李瑞海,冯琳,马欣悦,等.脂肪油和总二萜含量与柏子仁质量的相关性分析[J].中国实验方剂学杂志,2015,21(12):9-11.
[17] BOCK K W, BURCHELL B, DUTTON G J, et al. UDP-glucuronosyltransferase activities. Guidelines for consistent interim terminology and assay conditions[J]. Biochem Pharmacol,1983,32(6):953-955.
[18] 苗培培,赵园园,苗青,等.羟基芫花素对UGTs及UGT1A1活性抑制作用种属差异的体外研究[J].中国中药杂志,2016,41(3):504-508.
[19] 赵园园,苗培培,苗青,等.6种黄连生物碱对鼠肝微粒体 UGTs及UGT1A1活性影响的体内外研究[J].中国中药杂志,2016,41(2):309-313.
[20] RODEIRO I, JOSÉ G M, PEREZ G, et al. Mangifera indica L. extract and mangiferin modulate cytochrome P450 and UDP-glucuronosyltransferase enzymes in primary cultures of human hepatocytes[J]. Phytother Res,2013,27(5):745-752.
[21] FUJIWARA R, NAKAJIMA M, YAMANAKA H, et al. Effects of coexpression of UGT1A9 on enzymatic activities of human UGT1A isoforms[J]. Drug Metab Dispos,2007,35(5):747-757.
[22] CHEN Y, GUO J, TANG Y, et al. Pharmacokinetic profile and metabolite identification of yuanhuapine, a bioactive component in Daphne genkwa by ultra-high performance liquid chromatography coupled with tandem mass spectrometry[J]. J Pharm Biomed Anal, 2015,112:60-69.
[23] 张亚洲,王涛,邹树良,等.芹菜素在大鼠体内代谢产物的鉴定与分析[J].中国药房,2016,27(4):479-482.
[24] CHEN Y Y, GUO J M, QIAN Y F, et al. Toxicity of daphnane-type diterpenoids from Genkwa Flos and their pharmacokinetic profile in rat[J]. Phytomedicine,2013,21(1):82-89.
Effects of Genkwa Flos Ethanol Extracts on UGTs and UGT1A1 Activities in Different Systems
GUO Chang-e, MIAO Pei-pei, CHEN Hong-ying, CHEN Ning, MA Peng-kai, LI Hong-pin, ZHU Hong-yu, GAO Xing, ZHANG Yu-jie (School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100102, China)
ObjectiveTo investigate the inhibition of Genkwa Flos ethanol extracts on UGTs and UGT1A1 activities of different liver microsomes; To predict the toxicity mechanism of Genkwa Flos.MethodsBy adopting in vitro liver microsomes incubation model, 4-nitrophenol (4-NP) and β-estradiol were selected as substrates to determine activities of UGTs and UGT1A1 by UV and HPLC, respectively.ResultsContent determination results show that there were 6.34% of apigenin, 8.72% of hydroxygenkwanin and 6.06% of genkwanin in ethanol extracts, and total diterpene accounted for 31.40%. In vitro research showed that ethanol extracts significantly inhibited UGTs activity in rat and human liver microsome. UGT1A1 activity was inhibited by hydroxygenkwanin with IC50about 46.32, 32.49 and 8.382 µmol/L in rat liver microsome (RLM), human liver microsome (HLM) and recombinant UGT1A1 (rhUGT1A1), respectively. The inhibition types were competitive inhibition in RLM and rhUGT1A1, and uncompetitive inhibition in HLM.ConclusionEthanol extracts showed different inhibition of UGTs and UGT1A1 activities, and the inhibition may reveal one of the mechanisms of liver injury induced by Genkwa Flos.
Genkwa Flos; ethanol extracts; UGTs; UGT1A1; liver microsomes; toxicity; inhibition
10.3969/j.issn.1005-5304.2017.04.021
R285.5
A
1005-5304(2017)04-0083-05
2016-08-02)
(
2016-08-25;编辑:陈静)
国家自然科学基金(81274177、81073140);北京中医药大学自主选题项目(2016-JYB-XS048、2016-JYB-XS081、2016-JYB-XS058)
张玉杰,E-mail:zhyj227@126.com

