神经生长因子经鼻给药治疗有机溶剂中毒性脑病临床分析*
杨 东,樊新颖.第二军医大学南京临床医学院(南京军区南京总医院) 神经内科 (南京 20002);2.南京大学医学院附属金陵医院(南京军区南京总医院) 神经内科(南京 20002)
·论 著·
神经生长因子经鼻给药治疗有机溶剂中毒性脑病临床分析*
杨 东1,樊新颖2Δ
1.第二军医大学南京临床医学院(南京军区南京总医院) 神经内科 (南京 210002);2.南京大学医学院附属金陵医院(南京军区南京总医院) 神经内科(南京 210002)
目的 分析有机溶剂中毒性脑病的临床诊治特点,并探索神经生长因子经鼻给药方法的可行性和安全性。方法 回顾性分析15例经鼻给予神经生长因子治疗的有机溶剂中毒性脑病患者的临床特点,比较分析给药前后的实验室检验指标,同时记录不良事件。结果 有机溶剂中毒性脑病患者症状表现为头晕、乏力等非特异性症状,以及记忆力下降、计算力下降等认知障碍。15例患者经鼻给药平均时间为14(9~31)d,治疗后2例有鼻黏膜轻微不适,其余未见异常。给药前后实验室指标比较,差异无统计学意义(P>0.05)。结论 有机溶剂中毒性脑病的诊断主要依据暴露史、临床表现及影像学检查综合判断,经鼻给予神经生长因子治疗有机溶剂中毒性脑病是一种安全、可行的方法。
有机溶剂;中毒性脑病;经鼻给药
有机溶剂广泛应用于日常生活领域,暴露环境下进入人体,在脑组织内蓄积,引起功能障碍,称为中毒性脑病[1],临床表现主要有恶心、头痛、疲劳等非特异性症状,也会出现认知功能障碍[2-3]。神经生长因子(nerve growth factor,NGF)具有修复受损神经细胞的作用[4]。经鼻给药是一种新型给药方法,可以绕开血脑屏障,直接作用于中枢神经系统,具有无创、快捷的特点[5]。本研究分析15例经鼻给予NGF治疗的有机溶剂中毒性脑病患者的临床特点,现报道如下。
1 资料与方法
1.1 临床资料
选取2014年1月至2016年9月南京军区南京总医院神经内科收治的接受NGF经鼻给药的中毒性脑病患者共15例,诊断标准根据1985年WHO及1986年北卡罗纳州标准[6- 7]:1)确定的神经毒剂暴露史;2)临床表现和神经系统症状与神经毒剂相关联;3)临床症状和辅助检查中有客观的结果发现;4)排除其他疾病。
1.2 研究方法
15例患者均给予鼠NGF 20 μg(2 mL,武汉海特生)+2 mL生理盐水,稀释后滴鼻,20 μg/次,1次/d。给药采取滴鼻式,取仰卧位,经鼻滴管双侧鼻孔交替给药。分别记录给药前后实验室生物学指标(血常规、肝功、肾功、电解质、血脂水平、血凝等),同时观察记录不良事件。本研究患者给药方案均经我院医学伦理委员会批准。
1.3 统计学方法
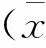
2 结果
2.1 基线资料
15例病例中,男9例,女6例,平均年龄(43±13)岁,平均发病时间(15±16)d,接触的有机溶剂种类分为:聚氯乙烯20.0%(3/15)、过氯乙烯13.3%(2/15)、二氯乙烷20%(3/15)、苯类13.3%(2/15)、一氧化碳20.0%(3/15)、沼气6.7%(1/15)及酒精6.7%(1/15)。根据接触时间长短,分为急性53.3%(8/15)和慢性46.7%(7/15)。NGF经鼻给药平均时间(20±16)d。
2.2 临床症状
临床症状主要表现为非特异性症状以及认知功能障碍。非特异性症状包括头晕20.0%(3/15)、肢体乏力20.0%(3/15)、言语不利13.3%(2/15)、癫痫6.7%(1/15)、味觉减退6.7%(1/15)、锥体外系症状13.3%(2/15)以及意识障碍33.3%(5/15)。认知功能障碍包括记忆力下降33.3%(5/15)、计算力下降26.7%(4/15)、注意力下降33.3%(5/15)及精细运动能力下降26.7%(4/15)。
2.3 检查结果
15例患者均行头颅MRI检查,73.3%(11/15)有异常表现。病变部位主要包括大脑半球33.3%(5/15)、小脑26.7%(4/15)、基底节区33.3%(5/15)、顶叶13.3%(2/15)及枕叶6.7%(1/15)。53.3%(8/15)病人有DWI高信号,46.7%(7/15)表现为长T1长T2,13.3%(2/15)表现为短T1长T2。病灶形态表现为小斑片状、片状、结节状至条状不等。其他检查异常包括异常脑电图40.0%(6/15)、体诱发电位异常20.0%(3/15)及视觉通路异常13.3%(2/15)。实验室检查中,33.3%(5/15)脑脊液异常,33.3%(5/15)白细胞数异常,13.3%(2/15)血糖升高,26.7%(4/15)肝功异常,20.0% (3/15) C反应蛋白升高, 20.0% (3/15)D-二聚体值异常(图1~2)。

图1 1例慢性有机溶剂中毒性脑病头颅MRI影像注:A.T1WI示双侧大脑半球皮层下白质对称稍长信号; B.T2WI示稍长信号; C.DWI示稍高信号
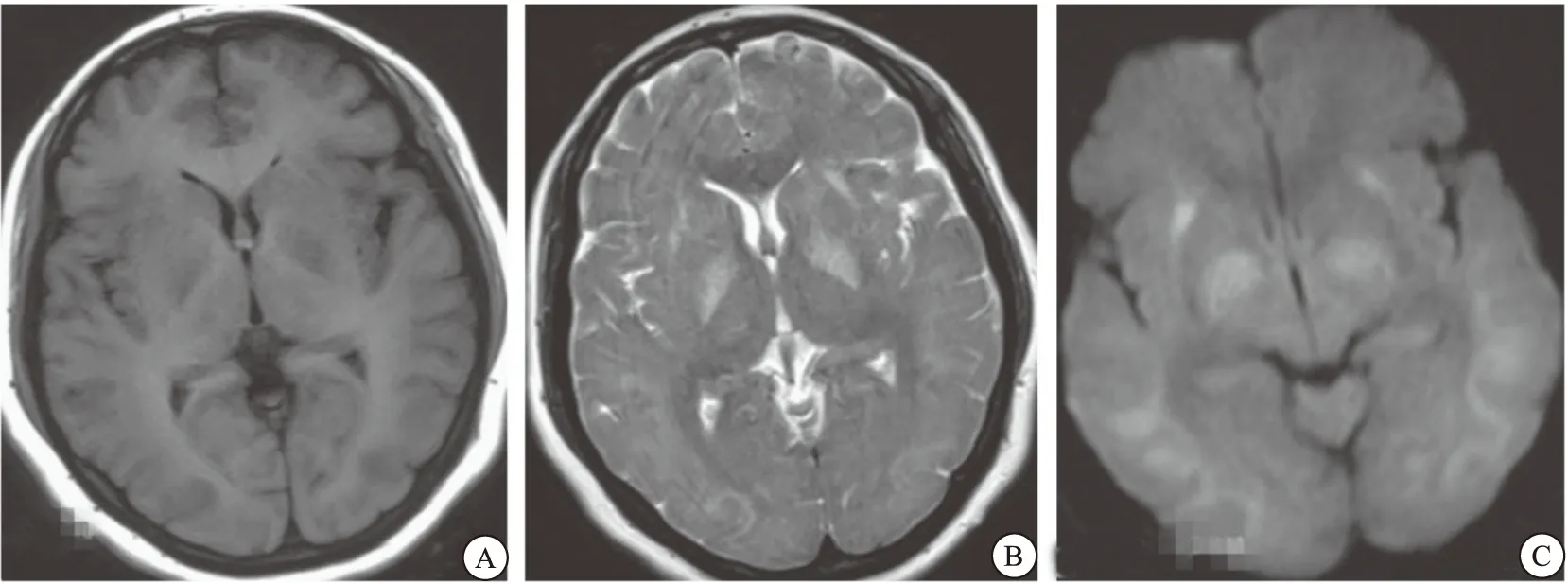
图2 1例急性有机溶剂中毒性脑病头颅MRI影像注:A.T1WI示双侧基底节区及脑灰质多发短T1;B.T2WI示长信号影;C.DWI示稍高信号
2.4 实验室检验指标治疗前后情况比较
15例患者NGF经鼻给药治疗前后实验室指标(血常规、肝肾功、电解质及血凝)比较,差异无统计学意义(P>0.05)(表3)。
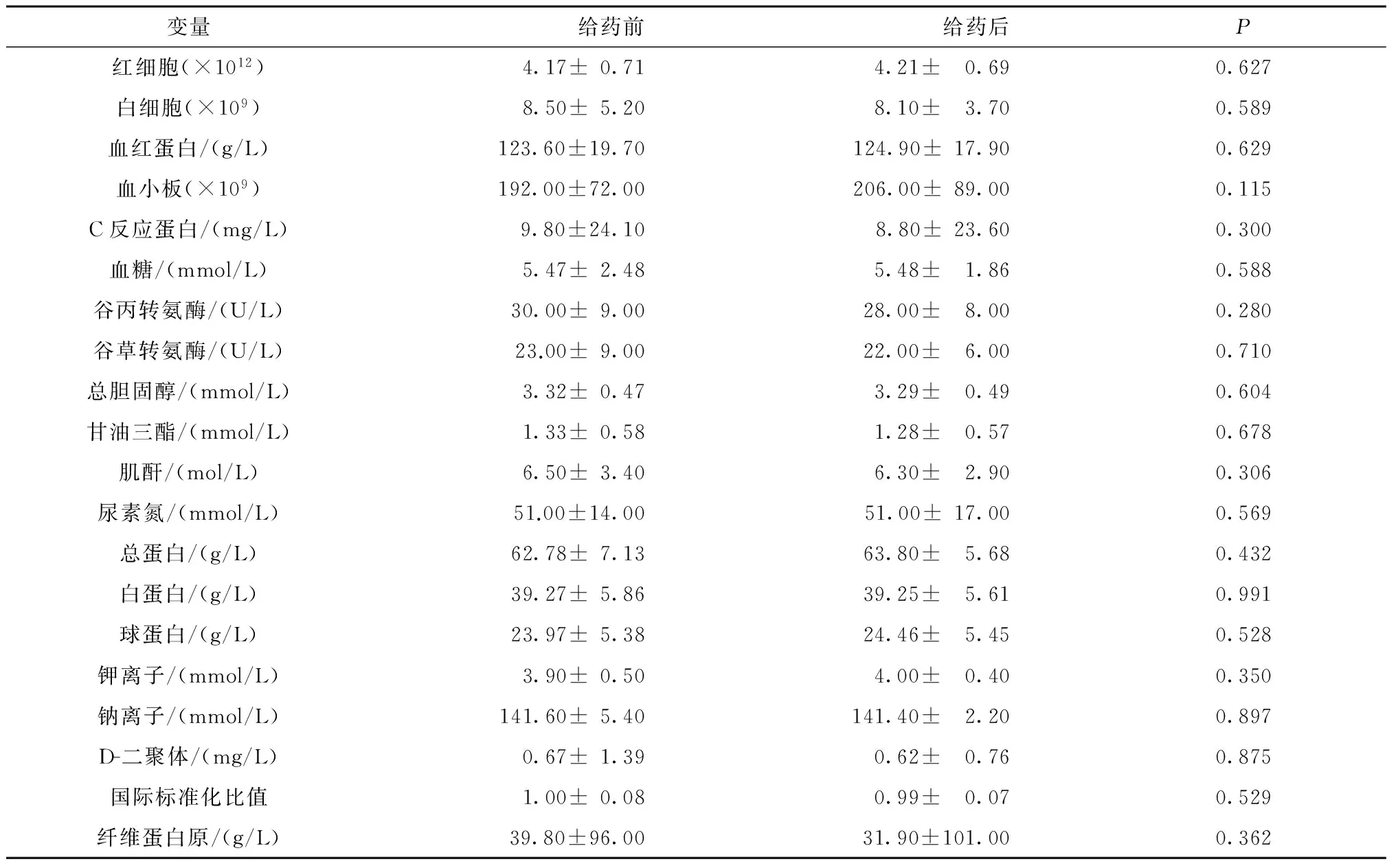
表3 实验室检验指标治疗前后情况比较(n=15)
2.5 治疗结果
2例(13.3%)患者诉鼻黏膜轻度不适,其余患者无不良反应。所有患者均分别给予对症支持治疗。随访时间为1~3月,2例(13.3%)患者完全恢复,12例(80.0%)患者症状缓解,1例(6.7%)患者症状无明显改变。
3 讨论
常用有机溶剂包括苯、三氯乙烯、全氯乙烯、甲醇、二硫化碳等[1, 8],主要通过呼吸道和皮肤接触进入人体,其化学结构高度亲脂,可顺利透过血脑屏障,蓄积在富含脂质的组织如脑、髓鞘等部位[9-11]。有机溶剂在代谢过程中,生成大量脂质过氧化物及自由基,破坏细胞膜稳定性,导致髓鞘变性及损伤,造成大脑白质甚至灰质的萎缩和损害[12-14]。根据暴露时间,有机溶剂中毒性脑病分为急性和慢性。急性通常为数天或数周,慢性通常累积或重复数月或数年[3]。临床症状包括非特异症状及认知障碍。非特异性症状包括恶心、头痛、疲劳、头晕,也可刺激眼、鼻、咽喉黏膜引发炎症。认知障碍包括记忆力注意力下降、反应迟钝和焦虑、抑郁、易怒等,此外还会出现小脑综合症、帕金森症、脑血管病等症状[15-17]。
有机溶剂中毒性脑病的症状主要根据有机溶剂暴露史、临床症状以及影像学表现,依据WHO和北卡罗来纳州标准[6-7]。暴露史对诊断至关重要,若同一场所其他人员也有发病,有助于诊断[3, 14]。本研究中,有3例聚氯乙烯中毒病人均在同一场所工作,均具有类似症状。认知障碍通过神经心理评估可以为诊断提供依据[18-19]。本组认知障碍表现有记忆力下降、计算力下降、注意力下降及精细运动能力下降,同国外报道[20]相似。
影像学检查是重要的诊断依据。典型表现为核磁共振成像(MRI)双侧脑白质对称的T2、T2Flair高信号,基底节及小脑少见,单侧表现亦有报道[2, 21],此外,急性期会出现弥漫性水肿[22]。本研究中,73.3%患者MRI表现为脑白质异常信号,病变部位包括大脑半球、小脑、基底节区、顶叶及枕叶。
本研究中,40.0%患者脑电图异常,20.0%诱发电位异常,13.3%视觉通路异常,但研究[3, 9,23]认为,这些检查的诊断作用有限。实验室检查对诊断亦无多大帮助[3],本研究中,33.3%患者脑脊液异常,脑脊液检查虽无特异性诊断作用,但能鉴别颅内感染等疾病,可以指导治疗。本研究中,部分患者生化检验白细胞值升高、C反应蛋白升高、肝功异常、血糖值及血凝指标异常,提示有机溶剂可能会对内环境带来广泛性损害。
治疗方式上没有特异性手段,原则在于尽快脱离暴露环境,及时对症治疗[3, 11]。NGF具有营养神经细胞、维持神经元存活分化作用,可以修复受损的中枢神经系统细胞组织[24-25]。既往研究[26]发现,NGF外周途径给药可以治疗神经系统疾病,但外周途径给药难以通过血脑屏障,实际作用效率不高。经鼻给药可以通过嗅神经、三叉神经及淋巴通路,绕过血脑屏障直接作用于中枢神经系统病变部位[5, 27]。樊新颖等[28-29]通过动物试验证明,NGF经鼻给药可以治疗中毒性脑损伤。经鼻给药在治疗认知障碍等中枢神经系统变性疾病方面已经取得一些临床成果[30-31],但目前尚无研究证实经鼻给药对中毒性脑病的作用。本研究中,回顾性分析15例中毒性脑病患者经鼻给予NGF治疗,2例(13.3%)患者出现轻微鼻黏膜不适,没有因不适中途停药,其余患者均无不适,且给药前后患者血象、肝肾功及血凝指标变化差异无统计学意义(P>0.05)。说明这种治疗方式是可行、安全的,但有效性尚不能确定。
本研究是一个回顾性研究,样本量较小,且没有设立对照组进行对比。患者除进行NGF经鼻给药治疗外,还进行其他对症处理,这些因素会对结果造成影响。安全性评估主要通过血液指标的对比,评估手段较单一,缺乏给药后影像学检查,故无法评估经鼻给药对影像学检查的影响;患者未进行认知功能量表的评估,还需设计随机对照试验进行完善。
综上所述,有机溶剂中毒性脑病应通过暴露史、临床表现及影像学等相关检查进行诊断。短期内经鼻给予NGF治疗是一种安全、可行的治疗方式,其有效性需要随机对照试验进一步论证。
[1]Filley C M. Occupation and the risk of chronic toxic leukoencephalopathy[J]. Handb Clin Neurol, 2015, 131: 73-91.
[2]Rimkus Cde M, Andrade C S, Leite Cda C,etal. Toxic leukoencephalopathies, including drug, medication, environmental, and radiation-induced encephalopathic syndromes [J]. Semin Ultrasound CT MR, 2014, 35(2): 97-117.
[3]Kim Y, Kim J W. Toxic encephalopathy[J]. Saf Health Work, 2012, 3(4): 243-256.
[4]Ip N Y, Yancopoulos G D. Neurotrophic factors and their receptors[J]. Ann Neurol, 1994, 35(Suppl): S13-S16.
[5]Jiang Y, Wei N, Zhu J,etal. A new approach with less damage: intranasal delivery of tetracycline-inducible replication-defective herpes simplex virus type-1 vector to brain[J]. Neuroscience, 2012, 201: 96-104.
[6]Grasso P.Neurotoxic and neurobehavioral effects of organic solvents on the nervous system[J].Occup Med,1988,3(3):525-539.
[7]Baker E L,Seppäläinen A M. Proceedings of the Workshop on Neurobehavioral Effects of Solvents. October 13-16, 1985, Raleigh, North Carolina, U.S.A[J]. Neurotoxicology, 1986, 7(4): 1-95.
[8]Dick F D. Solvent neurotoxicity[J]. Occup Environ Med, 2006, 63(3): 221-226.
[9]Sainio M A Sr. Neurotoxicity of solvents[J]. Handb Clin Neurol, 2015, 131: 93-110.
[10] Mi T, Han C, Wang Y,etal. Acute toxic leukoencephalopathy in migrant workers exposed to organic solvents in construction materials[J]. Occup Environ Med, 2013, 70(6): 435-436.
[11] White R F, Proctor S P. Solvents and neurotoxicity[J]. Lancet, 1997, 349(9060): 1239-1243.
[12] Dobbs M R. Toxic encephalopathy[J]. Semin Neurol, 2011, 31(2): 184-193.
[13] Filley C M, Halliday W, Kleinschmidt-DeMasters B K. The effects of toluene on the central nervous system[J]. J Neuropathol Exp Neurol, 2004, 63(1): 1-12.
[14] Feldman R G. Occupational neurology[J]. Yale J Biol Med, 1987, 60(2): 179-186.
[15] van Hout M, Hageman G, van Valen E. Pitfalls in clinical assessment of neurotoxic diseases: Negative effects of repeated diagnostic evaluation, illustrated by a clinical case[J]. NeuroToxicology, 2014, 45: 247-252.
[16] Visser I, Wekking E M, de Boer A G,etal. Prevalence of psychiatric disorders in patients with chronic solvent induced encephalopathy (CSE)[J]. Neurotoxicology, 2011, 32(6): 916-922.
[17] Filley C M, Kleinschmidt-DeMasters B K. Toxic leukoencephalopathy[J]. N Engl J Med, 2001, 345(6): 425-432.
[18] van der Laan G, Sainio M, van Valen E. Solvent-induced encephalopathy in the Netherlands and Finland[J]. Occup Med (Lond), 2015, 65(8): 609-611.
[19] Spee T, van Valen E, van Duivenbooden C,etal. A screening programme on chronic solvent-induced encephalopathy among Dutch painters[J]. Neurotoxicology, 2012, 33(4): 727-733.
[20] Verberk M M, van der Hoek J A, van Valen E,etal. Decision rules for assessment of chronic solvent-induced encephalopathy: Results in 2370 patients[J]. Neurotoxicology, 2012, 33(4): 742-752.
[21] Kao H W, Pare L, Kim R,etal. Toxic leukoencephalopathy with atypical MRI features following a lacquer thinner fire[J].J Clin Neurosci, 2014, 21(5): 878-880.
[22] Dietemann J L, Botelho C, Nogueira T,etal. Imaging in acute toxic encephalopathy[J]. J Neuroradiol, 2004, 31(4): 313-326.
[23] 刘力学, 樊双义, 夏学林. 60例一氧化碳中毒患者脑电图分析及对迟发性脑病的预测价值[J]. 成都医学院学报, 2015, 10(5): 567-570.
[24] Guégan C, Ceballos-Picot I, Chevalier E,etal. Reduction of ischemic damage in NGF-transgenic mice: correlation with enhancement of antioxidant enzyme activities[J]. Neurobiol Dis, 1999, 6(3): 180-189.
[25] Zassler B, Humpel C. Transplantation of NGF secreting primary monocytes counteracts NMDA-induced cell death of rat cholinergic neurons in vivo[J]. Exp Neurol, 2006, 198(2): 391-400.
[26] Zhao M, Li X Y, Xu C Y,etal. Efficacy and safety of nerve growth factor for the treatment of neurological diseases: a meta-analysis of 64 randomized controlled trials involving 6,297 patients[J]. Neural Regen Res, 2015, 10(5): 819-828.
[27] Lochhead J J, Wolak D J, Pizzo M E,etal. Rapid transport within cerebral perivascular spaces underlies widespread tracer distribution in the brain after intranasal administration[J]. J Cereb Blood Flow Metab, 2015, 35(3): 371-381.
[28] 樊新颖, 李芸, 马敏敏, 等. 神经生长因子鼻腔给药对有机磷酸酯类化合物中毒大鼠纹状体损伤的影响[J]. 中华医学杂志, 2012, 92(33): 2366-2369.
[29] 樊新颖, 朱武生, 杨龙, 等. 经鼻给予神经生长因子对沙林染毒大鼠梨状皮质神经元的影响[J]. 中华神经科杂志, 2007, 40(9): 634-636.
[30] Finger E C, MacKinley J, Blair M,etal. Oxytocin for frontotemporal dementia: a rando mized dose-finding study of safety and tolerability[J]. Neurology, 2015, 84(2): 174-181.
[31] Claxton A, Baker L D, Hanson A,etal. Long-acting intranasal insulin detemir improves cognition for adults with mild cognitive impairment or early-stage Alzheimer's disease dementia[J]. J Alzheimers Dis, 2015, 44(3): 897-906.
Clinical Analysis of Intranasal Administration with Nerve Growth Factor for Treating Solvent-induced Toxic Encephalopathy*
YangDong1,FanXinying2Δ.
1.DepartmentofNeurology,NanjingCollegeofClinicalMedicineofTheSecondMilitaryMedicalUniversity,Nanjing210002,China; 2.DepartmentofNeurology,JinlingHospitalofTheSecondMilitaryMedicalUniversity,Nanjing210002,China
Objective To study the clinical characteristics of diagnosis and treatment for solvent-induced toxic encephalopathy and explore the feasibility and safety of intranasal administration with nerve growth factor (NGF) for the treatment of toxic encephalopathy. Methods The retrospective analysis was performed to analyze the clinical characteristics of 15 patients diagnosed with solvent-induced toxic encephalopathy and treated with NGF by intranasal administration. Then the comparative analysis was made to compare the laboratory test indexes before and after treatment, and the adverse events were also recorded. Results The main clinical manifestation in the patients with solvent-induced toxic encephalopathy involved the non-specific symptoms such as headache and fatigue and the cognitive disorders such as the deterioration of memory and computing power. The mean time of intranasal administration with NGF was 14 days with the range of 9 to 31 days. Only two patients felt slight discomfort of nasal mucosa. No significant differences were found in the laboratory test indexes between before and after treatment (P>0.05). Conclusion The diagnosis of solvent-induced toxic encephalopathy was mainly based on the exposure history, clinical manifestation and comprehensive judgement of neuroimaging examination. The intranasal administration with NGF is feasible and safe in treating the patients with toxic encephalopathy.
Organic solvent; Toxic encephalopathy; Intranasal administration
*通信作者:国家自然科学基金(No: 81500939;No: 81471181)
http://kns.cnki.net/kcms/detail/51.1705.R.20170321.0925.024.html
10.3969/j.issn.1674-2257.2017.02.011
R749.6
A
△通信作者:樊新颖, E-mail: fxypyr@163.com

