糖基化改性对大豆蛋白抗原性及结构特性的影响
布冠好 朱婷伟 陈复生
(河南工业大学粮油食品学院,郑州 450001)
糖基化改性对大豆蛋白抗原性及结构特性的影响
布冠好 朱婷伟 陈复生
(河南工业大学粮油食品学院,郑州 450001)
以大豆分离蛋白和葡聚糖为原料,在干热条件下进行美拉德反应,制取不同时间下的糖基化复合物。以β-伴大豆球蛋白和大豆球蛋白抗原抑制率为指标,采用间接竞争ELISA方法测定糖基化产物的抗原性,在反应6 d时,糖基化产物中β-伴大豆球蛋白和大豆球蛋白的抗原性分别降低了36.90%和18.12%。糖基化产物颜色加深,且游离氨基含量降低,说明大豆蛋白与糖发生了不同程度的反应。红外光谱中糖链的引入,使蛋白质分子展开,β-转角和无规则卷曲结构含量降低,影响了β-伴大豆球蛋白α亚基的抗原表位,从而可能使大豆蛋白的抗原性降低。糖基化反应影响抗原性的关键作用在于蛋白与糖结合部位对蛋白质结构变化的影响。
大豆分离蛋白 葡聚糖 糖基化 抗原性 结构
大豆作为一种优质的植物蛋白来源,被广泛应用于食品以及饲料工业中。大豆中的蛋白质营养价值高且价格相对廉价,但大豆蛋白也是常见的8大食物蛋白过敏原之一。大豆分离蛋白(SPI)是一种蛋白质含量不低于90%的大豆产品,其主要成分包括大豆球蛋白与β-伴大豆球蛋白[1]。β-伴大豆球蛋白是7S的主要组成,是由3个亚基α(~67 ku)、α′(~71 ku)、β(~50 ku)组成的三聚体[2]。大豆球蛋白作为11S的主要组分,是一个六聚体蛋白质,每个亚基单位均含有一个酸性链和碱性链,并通过二硫键连接[3]。二者亦是大豆过敏原中两种主要的过敏原,与大豆蛋白的结构特性有密切的关系[4]。在降低蛋白质过敏性试验中,已有相关研究证实糖基化反应能有效降低蛋白质的抗原性。
本研究以大豆分离蛋白和葡聚糖为原料进行干法糖基化反应。分别以β-伴大豆球蛋白和大豆球蛋白抗原抑制率为指标,采用间接竞争ELISA方法测定糖基化复合物抗原性的变化。通过颜色测定、游离氨基含量的测定、SDS-PAGE电泳以及傅里叶红外光谱等方法测定糖基化反应程度和蛋白结构的变化。分析大豆蛋白糖基化产物的抗原性与结构之间的变化关系,为探究糖基化修饰对抗原性影响的作用机理、开发低敏性大豆蛋白制品提供参考。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白(SPI,蛋白质质量分数92.46%):山东谷神生物科技集团有限公司;葡聚糖:天津市科密欧化学试剂有限公司;β-伴大豆球蛋白(β-conglycinin,C5868)、大豆球蛋白(glycinin,G3171)、酶标二抗(HRP标记的羊抗兔IgG,A6154)、2,4,6-三硝基苯磺酸(P2297-10 mL):Sigma公司;兔抗βconglycinin血清、兔抗glycinin血清:实验室自制;牛血清蛋白(BSA)、TMB单组份显色液:北京索莱宝科技有限公司;低分子质量标准蛋白:中国科学院上海生物化学研究所。
TGJ-18型冷冻干燥机:北京四环科学仪器厂;LRH-150F型恒温生化培养箱:上海一恒科技有限公司;FC型酶标仪:赛默飞世尔仪器有限公司;电泳设备:北京六一实验设备有限公司;CR-400彩色色差计:Konica Minolta公司;WQF-510型傅里叶红外光谱:北京瑞丽分析仪器有限公司。
1.2 试验方法
1.2.1 大豆分离蛋白-葡聚糖复合物的制备
将大豆分离蛋白和葡聚糖按质量比3∶1溶解于蒸馏水中,使最终溶液浓度为6%,混合均匀后进行真空冷冻干燥。取冻干的样品置于铝盒内,并将其放入干燥器内,以饱和KBr溶液来保持79%的相对湿度,然后将干燥器置于恒温培养箱内,在60℃下制取不同反应时间的大豆分离蛋白-葡聚糖复合物。
1.2.2 糖基化产物抗原性测定
采用间接竞争ELISA方法来测定糖基化产物的抗原性,参考文献[5]。分别用0.3 μg/mLβ-conglycinin和0.025 μg/mLglycinin标准抗原包被96孔酶标板,每孔100 μL,同时分别将1∶3 200稀释度的抗β-conglycinin兔血清和抗glycinin兔血清与蛋白浓度为2 mg/mL的糖基化样品液等体积加入离心管中,混匀;4℃冰箱过夜。次日甩去孔内液体,PBST(10 mmol/L,pH 7.40的磷酸盐缓冲液PBS+0.05% Tween-20)洗涤4次,每次3 min,用吸水纸拍干;加100 μL/孔封闭液(PBS+1%BSA+0.1%Tween-20)进行封闭,37℃孵育1 h后,PBST洗涤4次,拍干;抗原抗体反应:将离心管中混合液加入酶标板孔内,每孔100 μL,在37℃孵育1 h后,PBST洗涤4次,拍干;加入1∶10 000稀释度的酶标二抗,每孔100 μL,在37℃孵育1 h后,PBST洗涤4次,拍干;然后加入TMB单组份显色液,每孔100 μL,37℃显色10 min后,每孔加入50 μL 2 mol/L H2SO4终止反应。利用酶标仪双波长测定各孔的OD值,实际OD值=OD450-OD620。
抗原性的大小用抑制率来表示,抑制率表示样品中抗原抑制兔抗血清与酶标板上包被的标准抗原结合能力的大小,可记为抗原抑制率;抑制率越低,则样品的抗原性越低,二者呈正比关系;计算公式如下:
抗原抑制率=(1-OD/OD0)×100%
式中:OD表示被测样品的吸光值;OD0为无竞争体系的吸光值。
1.2.3 糖基化产物颜色测定
用CR-400彩色色差计来测定不同时间下糖基化产物的颜色,以L,a,b 3个指标来表示糖基化产物的色泽。其中L(0~100,黑~白)表示明度;a(-a~+a,绿~红)和b(-b~+b,蓝~黄)为色品指数。
1.2.4 游离氨基含量测定
采用三硝基苯磺酸(TNBS)法[6]对糖基化产物中游离氨基含量进行测定。用1%SDS溶解糖基化产物,使复合物中蛋白质的质量浓度为5 mg/mL。取0.25 mL的样品液并加入2 mL磷酸缓冲溶液和2 mL 0.1%的TNBS溶液,混合均匀后在50℃下避光放置60 min,最后加入4 mL 0.1 mol/L的HCl终止反应。避光放置30 min后于420 nm下测其吸光值。
1.2.5 SDS-PAGE分析
糖基化产物用蒸馏水溶解,使最终蛋白质浓度为2 mg/mL,采用12%的分离胶,4%的浓缩胶进行不连续的凝胶电泳。其中上样量为10 μL,电泳全过程采用恒流,开始电泳时调节电流至25 mA,当溴酚蓝指示剂前沿进入到分离胶时将电流调至40 mA(约50 min)。电泳完成后(约2 h),将凝胶取出固定1 h,分别用考马斯亮蓝染色,最后脱色至蛋白质条带清晰。
1.2.6 红外光谱扫描
将糖基化样品与干燥的溴化钾以1∶100混合,用研钵均匀研成粉末,压成薄片后,用傅里叶红外分光光度计作全波段(4 000~400 cm-1)扫描,扫描32次。利用PeakFit V4.12软件分析蛋白质的二级结构的变化。
1.2.7 数据分析
所有试验测定重复3次,用SPSS 16.0软件进行显著性分析。利用Peak fit 4.20软件计算蛋白质二级结构含量。
2 结果与讨论
2.1 糖基化产物抗原性变化分析
抗原性的大小可用抗原抑制率来表示,不同时间下的大豆分离蛋白-葡聚糖复合物的抗原性变化如图1所示。
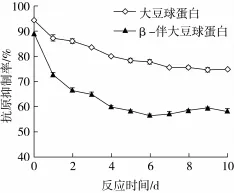
图1 不同时间下糖基化产物的抗原性变化
从图1可以看出,随糖基化反应时间的延长,糖基化产物的抗原性逐渐降低。反应6 d时,伴大豆球蛋白抗原抑制率和大豆球蛋白抗原抑制率分别为56.33%和77.42%;分别降低了36.90%和18.12%。说明糖基化处理能起到降低大豆蛋白抗原性的作用。引入糖链对抗原表位的掩蔽作用以及加热过程中蛋白结构的变化,二者可影响糖基化产物的抗原性变化[7]。糖基化反应过程中,蛋白-糖或蛋白-蛋白之间的相互作用影响蛋白质的空间结构,对抗原表位进行掩蔽,从而降低了大豆蛋白的抗原性[8]。另一方面,伴大豆球蛋白本身是一种糖蛋白,而大豆球蛋白是一种不含糖基的六聚体蛋白质,且热稳定性相对较高,当对大豆分离蛋白进行干热糖基化处理后,伴大豆球蛋白组分受到影响大,因此,糖基化产物中的伴大豆球蛋白抗原抑制率降低效果比较明显。有研究表明,美拉德反应所得到的产物中糖与蛋白结合形式稳定,遮掩抗原蛋白的抗原表位后经消化酶水解并没有再次暴露,糖基化反应确为一种有效去除大豆抗原蛋白免疫原性的方法[9]。
2.2 颜色测定结果分析
美拉德反应在进行过程中会产生很多具有特征亮色的物质,色泽变化明显,而且在一定的条件下,可以产生不同的特征颜色物质,如:橘黄色、黄色、蓝色以及红色产物等[10]。试验中不同时间下样品颜色的变化如表1所示。
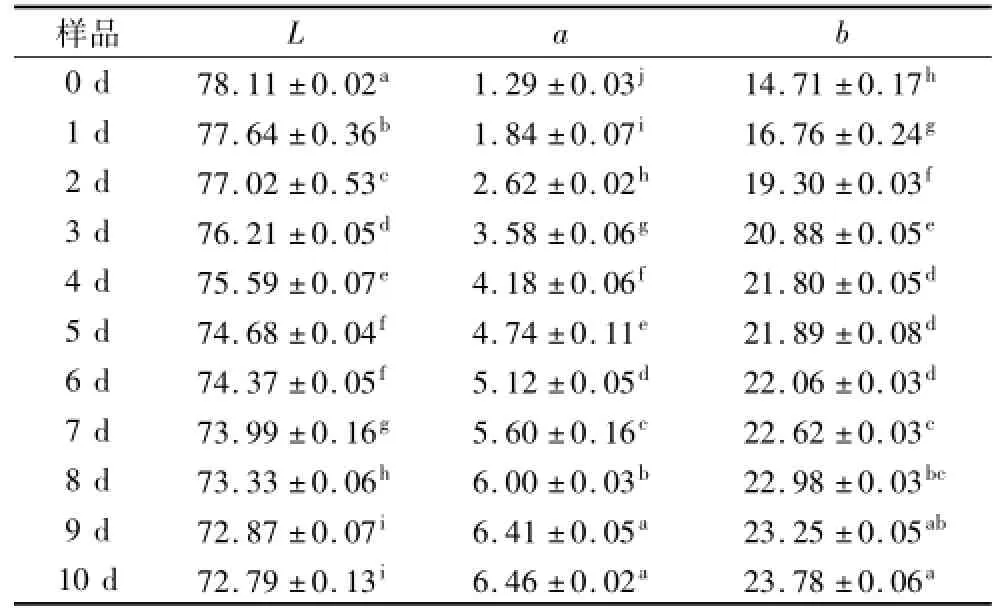
表1 糖基化产物的色差分析结果
从表1可以看到,随反应时间的增加,L值呈下降趋势,a值和b值均随反应时间的延长呈上升的趋势。a值代表红色,正值越大说明样品颜色偏红,b值增大,说明样品颜色偏黄。整体上产物的颜色开始由红黄色逐渐变为红褐色。产物颜色的变化情况间接反映美拉德反应的进程。类黑精等高分子物质的产生是颜色变化的主要原因[10-11],反应时间越长,褐变程度加深。
2.3 糖基化产物游离氨基含量分析
糖基化反应的进程也可以通过测定反应过程中游离氨基含量的变化来证实。
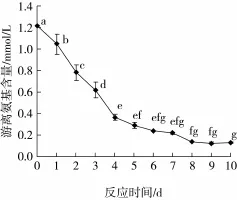
图2 不同反应时间下糖基化产物游离氨基含量的变化
由图2可以看出,反应时间的长短对大豆分离蛋白-葡聚糖复合物的影响显著(P<0.05)。随着糖基化反应时间的延长,游离氨基残留量逐渐减少,表明发生了糖基化反应。在糖基化反应过程中,蛋白质分子中氨基酸侧链的自由氨基与糖分子中的还原末端的羟基发生了羟胺反应,因此,蛋白质中的游离氨基含量会降低[12]。大豆分离蛋白-葡聚糖复合物在反应的前5 d,时间对反应进程的影响显著(P<0.05),游离氨基含量下降速度很快,表明在一定的温度、湿度下大豆蛋白与葡聚糖之间发生了交联,糖基化程度加深。
2.4 SDS-PAGE分析
大豆分离蛋白-葡聚糖糖基化产物的SDSPAGE电泳图谱如图3所示。
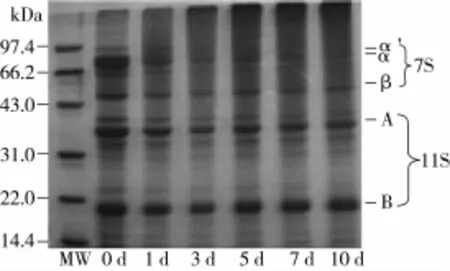
图3 不同反应时间下糖基化产物SDS-PAGE电泳图
图3显示,随着糖基化反应时间的延长,电泳图中分离胶的顶端,电泳条带的颜色加深,即有大分子的聚合物生成。糖链的引入使得与蛋白质发生交联,反应过程中形成异肽键或二硫键,生成了一些大分子物质[13]。其次,随反应时间的增加,电泳条带有轻微的上移,迁移速率变慢。可见,各个分子质量的蛋白质分子均参与了糖基化反应。此外,随反应时间的增加,7S各蛋白亚基条带减弱,可见大豆蛋白中7S组分的反应程度较高。糖基化产物抗原性变化测定发现,糖基化产物中伴大豆球蛋白抗原抑制率降低效果明显,说明糖基化反应对7S组分影响较大,通过电泳图印证了这一结果。
2.5 红外光谱分析
红外光谱是研究蛋白质-糖类体系很好的方法之一,因为在红外光谱中特殊辨别的区域中,蛋白质和碳水化合物不存在交叉重叠[14]。大豆蛋白糖基化产物的红外图谱如图4所示。
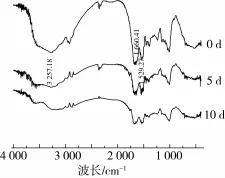
图4 糖基化复合物的红外扫描图谱
从图4可以看出,与大豆分离蛋白相比,当蛋白质共价结合糖分子后,蛋白质分子中的羟基增加,在红外图谱上表现为3 100~3 500 cm-1区间的吸收峰变宽,另外,共价交联形成新的N-H键导致吸收峰的强度增大,键长缩短,伸缩振动波数升高[15]。1 500 cm-1左右处的吸收峰变宽,此处的吸收峰属于C-N键的伸展,蛋白与多糖反应过程中,出现了新的共价键基团[14,16]。接着利用PeakFit软件对糖基化产物的酰胺Ⅰ带进行去卷积二阶导数拟合来计算蛋白二级结构含量的变化,糖基化样品的二级结构含量变化如表2所示。
从表2可得,经过糖基化改性后,复合物中蛋白质的α-螺旋、β-转角、无序结构含量减少,同时β-折叠结构含量增加。通常情况下,蛋白质二级结构中的β-折叠通常埋藏在多肽链的内部,而糖基化反应的发生,蛋白质中分子间氢键遭到破坏,减弱了蛋白质分子间的相互作用力,引起蛋白质分子结构改变[15];另一方面,糖链引入到蛋白质肽链中,而糖链的空间效应引起了β-折叠结构和无规则结构的变化,交联的糖蛋白导致蛋白质分子的变化,空间结构展开[17]。单晓红[18]对大豆蛋白序列的二级结构进行分析发现,β-转角和无规则卷曲结构在蛋白质序列中的前段有较高频率的出现,而推测出β-伴大豆球蛋白的α亚基的抗原表位集中在蛋白质序列的前段,β-转角是凸出结构而且大都出现在蛋白抗原的表面,与抗体结合后很可能形成抗原表位。通过红外光谱分析发现糖基化产物中β-转角和无规则卷曲结构含量降低。由此推断,由于糖链的引入,使蛋白质分子展开,空间结构产生变化,β-转角结构和无规则卷曲结构的含量下降,从而使大豆蛋白的抗原性降低。可见糖与蛋白的结合部位对蛋白质结构变化的影响使蛋白质抗原性发生改变。
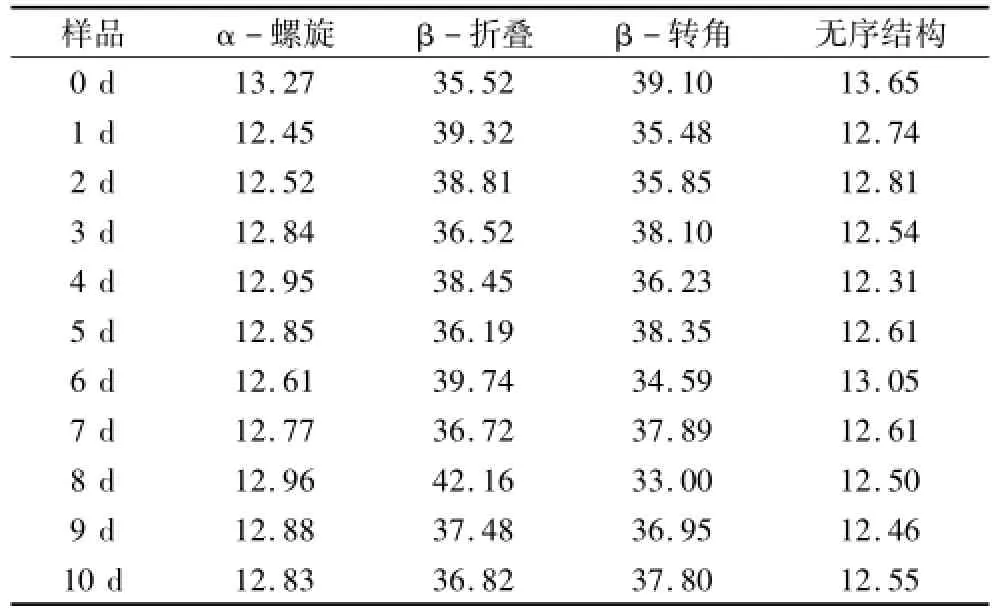
表2 糖基化产物中蛋白质的二级结构/%
3 结论
大豆分离蛋白-葡聚糖复合物抗原性随反应时间的增加而整体上呈降低的趋势。在反应6 d时,糖基化产物中β-伴大豆球蛋白和大豆球蛋白的抗原性分别降低了36.90%和18.12%。反应过程中,伴大豆球蛋白受影响较大,抗原抑制率降低效果明显。随着反应时间的增加,糖基化产物颜色变化明显,且游离氨基含量逐渐降低。SDS-PAGE图中电泳条带的变化说明大分子物质的生成以及7S组分反应程度较高。红外光谱扫描发现,糖链的引入使蛋白质分子展开,结构中β-转角和无规则卷曲结构含量降低,影响了大豆蛋白中β-伴大豆球蛋白的α亚基的抗原表位,从而使大豆蛋白的抗原性降低。糖基化反应对抗原性影响的关键作用在于糖与蛋白的结合部位对蛋白质结构变化的影响。
[1]Moriyama T,Kishimoto K,Nagai K,et al.Soybean betaconglycinin dietsuppressesserum triglyceridelevelsin normal and genetically obese mice by induction of beta-oxidation,downregulation of fatty acid synthase,and inhibitionof triglyceride absorption[J].Bioscience,Biotechnology,and Biochemistry,2004,68(2):352-359
[2]Maruyama N,Katsube T,Wada Y,et al.The roles of the N -linked glycans and extension regions of soybean β-conglycinin in folding,assembly and structural features[J].European Journal of Biochemistry,1998,258:854-862
[3]Prak K,Nakatani K,Katsube-Tanaka T,et al.Structurefunction relationships of soybean proglycinins at subunit levels[J].Journal of Agricultural and Food Chemistry,2005,53:3650-3657
[4]林化成,姬洪波.大豆抗原蛋白的致敏作用及其缓解机制的研究进展[J].中国畜牧兽医,2011,38(7):38-42 Lin H C,Ji H B.Research advances of mechanism of soybean antigen protein induced allergic reaction and attenuation[J].China Animal Husbandry&Veterinary Medicine,2011,38(7):38-42
[5]布冠好,郑喆,郑海,等.牛乳过敏原β-乳球蛋白间接竞争ELISA检测方法的建立[J].中国农业大学学报,2008,13(6):71-76 Bu G H,Zheng Z,Zheng H,et al.A method for detecting β -lactoglobulin in cow milk allergens by indirect competit ive enzyme-linked immunosorbent assay[J].Journal of China Agricultural University,2008,13(6):71-76
[6]Nissen J.N.Determination of the degree of hydrolysis of food protein hydrolysates by trinitribenzenesulfonic acid[J]. Journal of Agricultural and Food Chemistry,1979,27(6):1256-1263
[7]李铮,罗永康,冯力更,等.乳清蛋白-低聚异麦芽糖的制备及其抗原性研究[J].中国农业大学学报,2011,16(2):133-137 Li Z,Luo Y K,Feng L G,et al.Study on preparat ion and antigenicity of WPI-isomalto-oligosaccharide conjugate[J].Journal of China Agricultural University,2011,16(2):133-137
[8]Bielikowicz K,Kostyra H,Kostyra E,et al.The influence of non-enzymatic glycosylation on physicochemical and biological properties of pea globulin 7S[J].Food Research International,2012,48(2):831-838
[9]谭振.胃肠消化对糖基化大豆抗原蛋白免疫原性的影响[D].长春:吉林农业大学,2014 Tan Z.Effects of gastrointestinal digestion on immunoreactivity of glycosylation soybean antigen proteins[D].Changchun:Jilin Agricultural University,2014
[10]于彭伟.Maillard反应产物抗氧化性能、有害成分分析及其对猪肉保鲜效果的研究[D].南京:南京农业大学,2011 Yu P W.Antioxidant properties,analysis of harmful ingredients of maillard reaction products and study on the freshkeeping effects of products to pork[D].Nanjing:Nanjing Agricultural University,2011
[11]Adams A,Borreli R,Flogiano V,et al.Thermal degradation studies of foods melanoidins[J].Journal of Agricultural and Food Chemistry,2005,53:4136-4142
[12]Xue F,Li C,Zhu X W,et al.Comparative studies on the physicochemical properties of soy protein isolate-maltodextrin and soy protein isolate-gum acacia conjugate prepared through Maillard reaction[J].Food Research International,2013,51(2):490-495
[13]齐军茹,杨晓泉,彭志英.利用Maillard反应制备大豆蛋白-葡聚糖共价复合物[J].无锡轻工大学学报,2004,23(5):21-25 Qi J R,Yang X Q,Peng Z Y.Preparation of soy proteindextran conjugate through the Maillard reaction[J].Journal of Wuxi University of Light Industry,2004,23(5):21-25
[14]Gu F L,Kim J M,Abbas S,et al.Structure and antioxidant activity of high molecular weight Maillard reaction products from casein-glucose[J].Food Chemistry,2010,120:505-511
[15]穆丽霞.大豆蛋白-糖接枝改性及其结构与功能特性研究[D].广州:华南理工大学,2010 Mu L X.The research of conformation and functional properties of soy protein-saccharide conjugates[D].Guangzhou:South China University of Technology,2010
[16]齐军茹,杨晓泉,廖劲松.液相体系制备大豆酸沉蛋白-葡聚糖共价复合物及其反应机制(Ⅱ)反应机制的理论分析[J].食品化学,2008,29(2):142-144 Qi J R,Yang X Q,Liao J S.Preparation and theoretical analysis of soy acid protein-polysaccharide conjugates obtained in liquid system(Ⅱ)forming mechanism of soy acid protein-polysaccharide conjugates[J].Food Science,2008,29(2):142-144
[17]Liu J H,Ru Q M,Ding Y T.Glycation a promising method for food protein modification:Physicochemical properties and structure,a review[J].Food Research International,2012,49:170-183
[18]单晓红.大豆和牛奶致敏原表位预测及加工对其抗原性和结构的影响[D].无锡:江南大学,2013 Shan X H.Prediction of soybean and milk allergen peptide and effects of processing treatment on their antigenicity and conformational structure[D].Wuxi:Jiangnan University,2013.
Effects of Glycation Modification on Soybean Protein Antigenicity and Structural Properties
Bu Guanhao Zhu Tingwei Chen Fusheng
(College of Food Science and Technology,Henan University of Technology,Zhengzhou 450001)
Soy protein isolate(SPI)and dextran were used as raw materials and SPI-dextran conjugate were prepared under dry-heated at different times through Maillard reaction in this paper.The antigen inhibition rate of β-conglycinin and glycinin in SPI-dextran conjugate were tested with indirect competitive ELISA method.The antigenicity of β-conglycinin and glycinin decreased 36.90%and 18.12%respectively when the reaction processed at 6 d.Meanwhile,the color deepened and the free amino group content reduced which indicated that different degrees of reaction occurred between soy protein isolate with dextran.FTIR indicated that the protein structure of glycated samples unfolded as the introduced sugar chains.The reduced β-corner and random coil structure content impacted the epitope of β-conglycinin antigen in soybean protein,and then reduced the antigenicity of soybean protein.These showed that the key effect relies on the structure changes caused by the binding site between protein and saccharide.
soybean protein isolate,dextran,glycation,antigenicity,structures
TS21
A
1003-0174(2017)01-0034-06
863计划(2013AA102208-5),河南省教育厅科学技术研究重点项目(14B550013),国家自然科学基金(31201293)
2015-06-25
布冠好,女,1980年出生,副教授,食品蛋白质资源开发与利用
陈复生,男,1963年出生,教授,食品蛋白质资源开发与利用

