ClC-3的表达峰度与胶质瘤细胞增殖的关系
张广宇,贾世峰,张晓炜,曹旭华,焦保华
(1.河北医科大学第二医院神经外科,河北 石家庄 050000;2.华北理工大学附属医院肿瘤科,河北 唐山 063000)
ClC-3的表达峰度与胶质瘤细胞增殖的关系
张广宇1,贾世峰2,张晓炜1,曹旭华1,焦保华1
(1.河北医科大学第二医院神经外科,河北 石家庄 050000;2.华北理工大学附属医院肿瘤科,河北 唐山 063000)
目的 研究氯离子通道-3(ClC-3)的表达峰度与胶质瘤细胞增殖的关系。方法选取2015年5月至2016年5月河北医科大学第二医院神经外科收治的20例胶质瘤患者作为观察组,另选同期20例行颅内减压术治疗的脑创伤患者作为对照组,比较两组患者不同ClC-3表达峰度下胶质瘤细胞增殖差异。结果观察组患者的CIC-3mRNA、细胞周期素D1(Cyclin D1)、细胞周期素E(Cyclin E)、Ki-67、增殖细胞核抗原(PCNA)、基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)表达水平分别为(0.78±0.14)%、(81.85±21.45)%、(85.48±21.32)%、(81.25±21.34)%、(73.46±22.24)%、(0.77±0.21)%、(1.21±0.15)%,与对照组的(0.25±0.15)%、(62.31±11.55)%、(48.33± 11.10)%、(48.10±11.10)%、(23.12±11.28)%、(0.45±0.17)%、(0.77±0.18)%相比较,差异均有统计学意义(P<0.05);观察组内ClC-3中低表达峰度患者CIC-3 mRNA、Cyclin D1、Cyclin E、Ki-67、PCNA、MMP-2、MMP-9表达水平为(0.59±0.20)%、(64.33±1.57)%、(59.74±2.71)%、(62.33±1.25)%、(54.64±2.21)%、(0.62±0.18)%、(0.87±0.12)%,与高表达峰度患者的(0.91±0.12)%、(96.32±1.15)%、(96.48±1.20)%、(94.28±1.37)%、(85.66±2.34)%、(0.89±0.24)%、(1.33± 0.20)%相比较,差异均有统计学意义(P<0.05)。结论ClC-3的表达峰度与胶质瘤细胞增殖关系密切,ClC-3的表达峰度越高,胶质瘤细胞增殖越显著,可将其作为防治胶质瘤的新靶点。
氯离子通道-3;表达;峰度;胶质瘤;细胞增殖
胶质瘤为神经胶质瘤的简称,是指发生于神经外胚层的肿瘤,为目前临床较为常见的颅内恶性肿瘤,不仅严重威胁患者生命安全,同时给临床诊疗工作造成一定阻碍,已经引起了临床的高度关注[1]。近些年来随着医学研究的不断深入开展,胶质瘤细胞增殖的影响因素研究取得了阶段性的成果,其中氯离子通道-3(Chloride channel-3,ClC-3)表达峰度与胶质瘤的发生与发展存在密切的关联性,日益引起临床的重视[2]。本研究进一步围绕ClC-3的表达峰度与胶质瘤细胞增殖的关系展开深入研究,现报道如下:
1 资料与方法
1.1 一般资料 选取2015年5月至2016年5月河北医科大学第二医院神经外科收治的20例胶质瘤患者作为观察组,其中男性14例、女性6例;年龄25~62岁,平均(43.25±1.38)岁;病程6个月~1.5年,平均(1.00±0.15)年;Kernohan分级:Ⅱ级4例、Ⅲ级10例、Ⅳ级6例;临床表现:头痛5例、视力减退7例、精神症状8例;ClC-3表达峰度:低表达峰度9例、中表达峰度5例、高表达峰度6例。纳入标准:①经临床综合诊断确诊为胶质瘤者;②无其他全身严重器质性疾病者;③临床依从性好者;④无免疫系统疾病或缺陷者。排除标准:①血液系统疾病或凝血功能障碍者;②妊娠期、哺乳期患者。另选同期20例行颅内减压术治疗的脑创伤患者作为对照组,其中男性12例,女性8例;年龄28~60岁,平均(43.18±1.45)岁;致病原因:交通事故15例、高空坠落5例;临床表现:头痛6例、单侧或双侧瞳孔散大7例、精神症状7例。两组患者的性别、年龄、临床表现等一般资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 诊断标准 所有胶质瘤诊断符合美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)编撰的《胶质瘤临床指引(2006)》中的以下内容:①脑脊液穿刺检查提示脑脊液蛋白量显著增加,白细胞计数同样增加;②脑电图检查提示肿瘤部位脑电波频率计波幅较周围正常组织显著改变,如:局限性δ波、棘波或尖波等;③放射性同位素扫描显示血脑屏障通透性提高、同位素吸收率高;④头颅平片扫描提示颅内压增高征,肿瘤钙化及松果体钙化移位等[3]。
1.3 研究方法
1.3.1 胶质瘤增殖试验方法 将入组胶质瘤患者胶质瘤细胞以2×105/mL密度接种于96孔板,按照操作说明,加入10 uL(购自于美国Santa Cruz公司) CLC-3抗体,置于5%CO2培养箱中孵育2 h,将其置入美国BioTek公司生产的ELx800酶联免疫检测仪中于波长450 nm处测定光密度值[4]。
1.3.2 免疫组化 将两组患者脑组织样本实施石蜡固定并置于烘箱之中以67℃烘片2.5 h,促使石蜡切片脱蜡至水,随后采用pH7.4的磷酸缓冲盐溶液(phosphate buffer saline,PBS)反复洗片3次。另取定量pH6.0柠檬酸盐缓冲液加热至沸腾后将切片置于其中,放入微波盒中微波处理15 min后自然冷却[5]。利用无菌蒸馏水反复冲洗3次,每次持续时间3 min,室温下孵育15 min,去除磷酸缓冲盐溶液后加入聚合物增强剂,孵育25 min,磷酸缓冲盐溶液反复冲洗3次,每次5 min,再次去除该溶液并加入酶标抗鼠/兔聚合物,孵育0.5 h,继续经上述步骤处理,加入配置的二氨基联苯胺溶液(diaminobenzidine,DAB),苏木素复染,蓝化,切片经梯度酒精脱水干燥后于显微镜下观察[6]。
1.3.3 ClC-3表达峰度结果判定 将间质瘤细胞胞膜或者是胞浆内出现棕黄色染色定义为阳性细胞,连续取20个视野计算平均值,并以阳性细胞数<10%作为低表达、阳性细胞数10%~30%为中表达、阳性细胞数>30%为高表达[7]。
1.4 观察指标 观察不同组别CIC-3mRNA、细胞周期素D1(Cyclin D1)、细胞周期素E(Cyclin E)、Ki-67、增殖细胞核抗原(Proliferating Cell Nuclear Antigen,PCNA)、基质金属蛋白酶-2(matrix metalloproteinase 2,MMP-2)、基质金属蛋白酶-9(matrix metalloproteinase 9,MMP-9)表达水平。
2 结果
2.1 两组患者的胶质瘤细胞增殖指标比较 对照组CIC-3蛋白阴性表达及观察组的阳性表达见图1、图2;观察组患者的CIC-3mRNA、Cyclin D1、Cyclin E、Ki-67、PCNA、MMP-2、MMP-9表达水平与对照组相比较,差异有统计学意义(P<0.05),见表1。
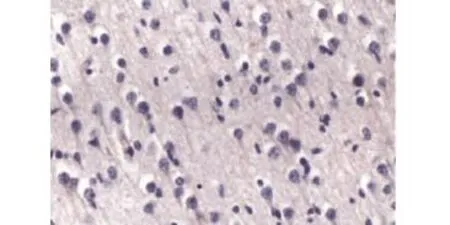
图1 CIC-3蛋白在对照组的阴性表达(×400)
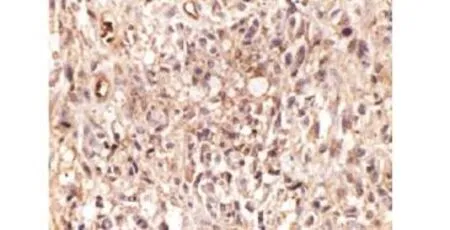
图2 CIC-3蛋白在观察组的阳性表达(×400)
表1 两组患者的胶质瘤细胞增殖指标比较(±s,%)
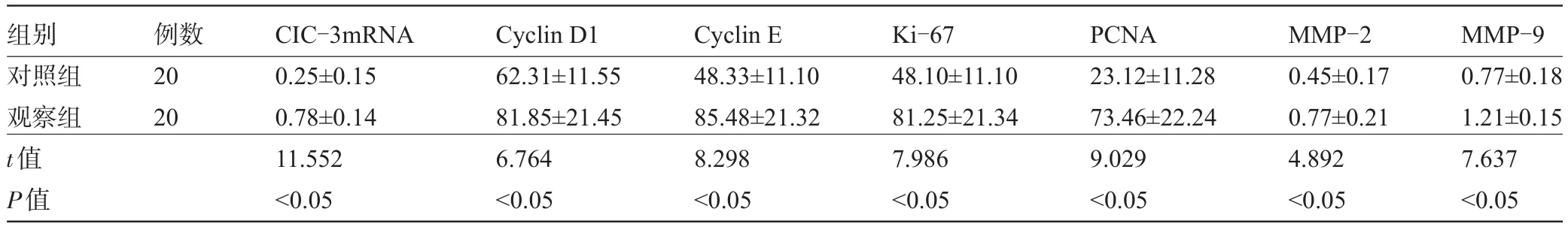
表1 两组患者的胶质瘤细胞增殖指标比较(±s,%)
组别对照组观察组t值P值例数20 20 CIC-3mRNA 0.25±0.15 0.78±0.14 11.552<0.05 Cyclin D1 62.31±11.55 81.85±21.45 6.764<0.05 Cyclin E 48.33±11.10 85.48±21.32 8.298<0.05 Ki-67 48.10±11.10 81.25±21.34 7.986<0.05 PCNA 23.12±11.28 73.46±22.24 9.029<0.05 MMP-2 0.45±0.17 0.77±0.21 4.892<0.05 MMP-9 0.77±0.18 1.21±0.15 7.637<0.05
2.2 观察组内不同ClC-3表达峰度患者胶质瘤细胞增殖指标比较 观察组内中低表达峰度患者与高表达峰度患者胶质瘤细胞增殖指标表达水平相比较差异均有统计学意义(P<0.05),见表2。
表2 观察组内胶质瘤细胞增殖指标比较(±s,%)
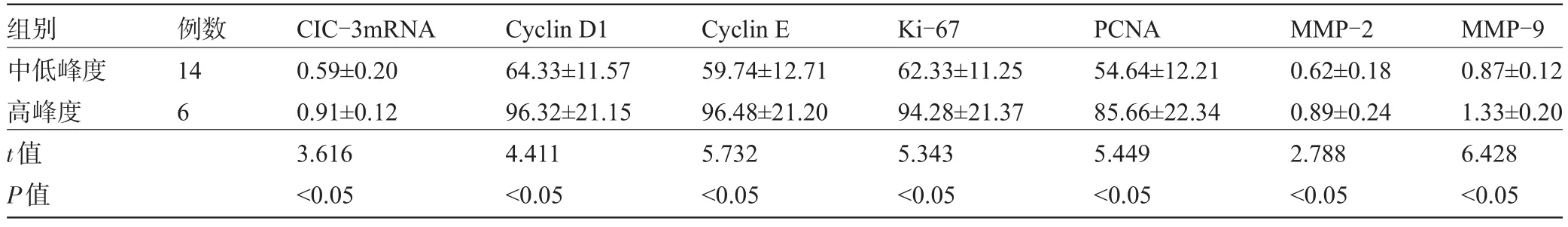
表2 观察组内胶质瘤细胞增殖指标比较(±s,%)
组别中低峰度高峰度t值P值例数14 6 CIC-3mRNA 0.59±0.20 0.91±0.12 3.616<0.05 Cyclin D1 64.33±11.57 96.32±21.15 4.411<0.05 Cyclin E 59.74±12.71 96.48±21.20 5.732<0.05 Ki-67 62.33±11.25 94.28±21.37 5.343<0.05 PCNA 54.64±12.21 85.66±22.34 5.449<0.05 MMP-2 0.62±0.18 0.89±0.24 2.788<0.05 MMP-9 0.87±0.12 1.33±0.20 6.428<0.05
3 讨论
近年来,大量临床研究证实胶质瘤具有较高的特异性,侵袭能力显著,并且对于放化疗的抵抗能力较强,所以该肿瘤已经成为了中枢神经系统致死率最高的恶性肿瘤之一[8]。目前该病治疗的难点集中于胶质瘤细胞增殖以及组织浸润广泛,所以寻求能够阻断胶质瘤细胞恶性增殖与浸润的分子靶点成为医学界研究的热门议题。
随着临床研究的不断深入开展,细胞内离子通道在调控肿瘤细胞生长周期方面发挥了重要的作用,尤其是肿瘤细胞在摄取到充足的营养物质后内部渗透压随之升高,促使细胞外的水分子进入到细胞内,使得细胞容积大幅增加,激活氯离子(Cl-)通道,导致自身的氯离子外流[9]。容积调节性氯通道(volume regulated chloride channel,VRCC)全程参与到了肿瘤细胞的增殖过程,对其展开研究将有助于探寻更加有效的诊疗方案[10]。本次研究证实,观察组CIC-3mRNA、Cyclin D1、Cyclin E、Ki-67、PCNA、MMP-2、MMP-9表达水平均显著高于正常对照组,而观察组内中低表达峰度的胶质瘤患者CIC-3mRNA、Cyclin D1、Cyclin E、Ki-67、PCNA、MMP-2、MMP-9表达水平低于高表达峰度患者。由此结果可知,ClC-3的表达峰度与胶质瘤细胞增殖呈现出密切相关,而此种关联性对于阻断胶质瘤细胞的增殖具有重要意义。
综上所述,ClC-3的表达峰度与胶质瘤细胞增殖密切相关,ClC-3的表达峰度越高,胶质瘤细胞增殖越显著,可将其作为防治胶质瘤的新靶点。
[1]林嘉麟,施静雯,刘学强,等.耐药肿瘤细胞中ClC-3、P-gp的表达变化及相关性[J].山东医药,2016,56(21):13-15.
[2]徐彬,林嘉麟,施静雯,等.慢病毒介导的干扰ClC-3肝癌稳定细胞株的建立及其侵袭和迁移能力的改变[J].中国药理学通报,2015, 31(8):1101-1107.
[3]Viswanath P,Ronen SM.Metabolic reprogramming of pyruvate dehydrogenase is essential for the proliferation of glioma cells expressing mutant IDH1[J].Mol Cell Oncol,2016,3(2):e1077922.
[4]吴慧,李红枝,毛建文.ClC-3氯通道蛋白调控细胞增殖机制的研究进展[J].临床与病理杂志,2014,34(5):630-635.
[5]王施思,杨清松,施静雯,等.稳定表达ClC-3对宫颈癌细胞顺铂敏感性的影响及其机制[J].肿瘤,2014,34(10):888-893,907.
[6]杨清松,张守盼,林卓华,等.ClC-3荧光真核表达载体的构建及表达[J].中国当代医药,2013,20(29):4-5,8.
[7]赵维,白金锡,韩振国,等.三苯氧胺(TAM)及靶向CLC-3反义核苷酸对MCF-7(ER+)增殖的影响[J].中国实验诊断学,2012,16(10): 1774-1776.
[8]于春艳,韩命龙,钟加滕,等.抑制ClC-3表达对顺铂诱导人卵巢癌SKOV3/DDP细胞凋亡的促进作用[J].吉林大学学报(医学版), 2012,38(6):1106-1109.
[9]向晖,刘健民,杨小兰,等.脑胶质瘤患者血清中基质金属蛋白酶-2含量的动态研究[J].实用临床医学,2011,12(8):14-16.
[10]周玉叶,杨元生,陈垦,等.电压门控氯通道生物学功能与疾病的关系[J].国际病理科学与临床杂志,2013,33(4):338-342.
Relationship between ClC-3 expression kurtosis and glioma cell proliferation.
ZHANG Guang-yu1,JIA Shi-feng2, ZHANG Xiao-wei1,CAO Xu-hua1,JIAO Bao-hua1.1.Department of Neurosurgery,the Second Hospital of Hebei Medical University,Shijiazhuang 050000,Hebei,CHINA;2.Department of Oncology,the Affiliated Hospital of North China University of Science&technology,Tangshan 063000,Hebei,CHINA
ObjectiveTo study the relationship of chloride channel-3(ClC-3)expression with glioma cell proliferation.MethodsFrom May 2015 to May 2016,20 patients with glioma in the Second Hospital of Hebei Medical University were enrolled as the observation group,and 20 patients with traumatic brain injury undergoing intracranial decompression were selected as the control group.Glioma cell proliferation under different ClC-3 expression kurtosis was compared between the two groups.ResultsCIC-3 mRNA,Cyclin D1,Cyclin E,Ki-67,proliferating cell nuclear antigen(PCNA),MMP-2 and MMP-9 expression levels in the observation group were(0.78±0.14)%,(81.85±21.45)%, (85.48±21.32)%,(81.25±21.34)%,(73.46±22.24)%,(0.77±0.21)%,(1.21±0.15)%,as compared with(0.25±0.15)%, (62.31±11.55)%,(48.33±11.10)%,(48.10±11.10)%,(23.12±11.28)%,(0.45±0.17)%,(0.77±0.18)%in the control group (P<0.05).In the observation group,CIC-3 mRNA,Cyclin D1,Cyclin E,Ki-67,PCNA,MMP-2,MMP-9 in patients with low expression kurtosis were(0.59±0.20)%,(64.33±11.57)%,(59.74±12.71)%,(62.33±11.25)%,(54.64±12.21)%, (0.62±0.18)%,(0.87±0.12)%,as compared with(0.91±0.12)%,(96.32±21.15)%,(96.48±21.20)%,(94.28±21.37)%, (85.66±22.34)%,(0.89±0.24)%,(1.33±0.20)%in patients with high expression kurtosis,(P<0.05).ConclusionClC-3 expression kurtosis is positively correlated with glioma cell proliferation,which may be used as a new target for the prevention and treatment of glioma.
Chloride channel-3(ClC-3);Expression;Kurtosis;Glioma;Cell proliferation
R730.264
A
1003—6350(2017)06—0877—03
10.3969/j.issn.1003-6350.2017.06.005
2016-09-30)
焦保华。E-mail:13932193056@163.com

