高效液相色谱法测定柴胡配方颗粒中柴胡皂苷a含量
缪希红,李晓燕,高君文,苏平菊
(1.河北省承德市中心医院,河北 承德 067000; 2.河北以岭医药研究院,河北 石家庄 050035)
·检验检测·
高效液相色谱法测定柴胡配方颗粒中柴胡皂苷a含量
缪希红1,李晓燕2,高君文2,苏平菊2
(1.河北省承德市中心医院,河北 承德 067000; 2.河北以岭医药研究院,河北 石家庄 050035)
目的建立测定柴胡配方颗粒中柴胡皂苷a含量的高效液相色谱(HPLC)法。方法色谱柱采用Welch Ultimate XB-C18柱(250mm× 4.6mm,5 m),以乙腈-甲醇-0.1%磷酸溶液为流动相进行梯度洗脱,检测波长为210 nm。结果柴胡皂苷a进样量在0.660 4~6.604 0 g范围内与峰面积线性关系良好,回归方程为 Y=288.216X-6.057,r=0.999 97,柴胡皂苷a的平均回收率为101.99%,RSD为1.91%(n=9)。结论该方法简便、准确,重复性好,可用于柴胡配方颗粒的质量控制。
高效液相色谱法;柴胡配方颗粒;柴胡皂苷a
柴胡配方颗粒是由中药材柴胡经提取、浓缩、分离、干燥、制粒及包装等加工工艺制成的颗粒剂,具有疏散退热、疏肝解郁、升举阳气的功效[1],用于和解退热、疏肝解郁、升举阳气、升散除湿等[2]。服用方便,剂量准确,高效迅速,质量稳定,近年来,其销量逐年上升,深得消费者青睐[3]。柴胡配方颗粒中的主要药味柴胡为历版《中国药典》收载药材,应用广泛,其主要化学成分为三萜皂苷类成分,包括柴胡皂苷a、柴胡皂苷b2、柴胡皂苷b3、柴胡皂苷c、柴胡皂苷d等[4-5],均有很强的药理活性,其中柴胡皂苷a和柴胡皂苷d含量较高,是柴胡重要的质量评价指标[6-8]。为了更好地控制柴胡配方颗粒的质量,本研究中采用高效液相色谱(HPLC)法对柴胡皂苷a进行了含量测定,现报道如下。
1 仪器与试药
1.1 仪器
Agilent1100型高效液相色谱仪,包括VWD紫外检测器(美国安捷伦公司);KQ-250B型超声波清洗器(昆山市超声仪器有限公司);AT201型电子天平(瑞士Mettler-Toledo公司)。
1.2 试药
柴胡皂苷a对照品(中国食品药品检定研究院,批号为110777-200406);柴胡配方颗粒(石家庄以岭药业股份有限公司,批号为150101);乙腈、甲醇为色谱纯,其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:WelchUltimateXB-C18柱(250mm×4.6mm,5μm);流动相:乙腈为流动相 A,甲醇为流动相 B,0.1%磷酸溶液为流动相C,梯度洗脱,见表1;流速:1 mL/min;柱温:26℃;检测波长:210 nm。理论板数按柴胡皂苷a峰计算应不低于5 000。
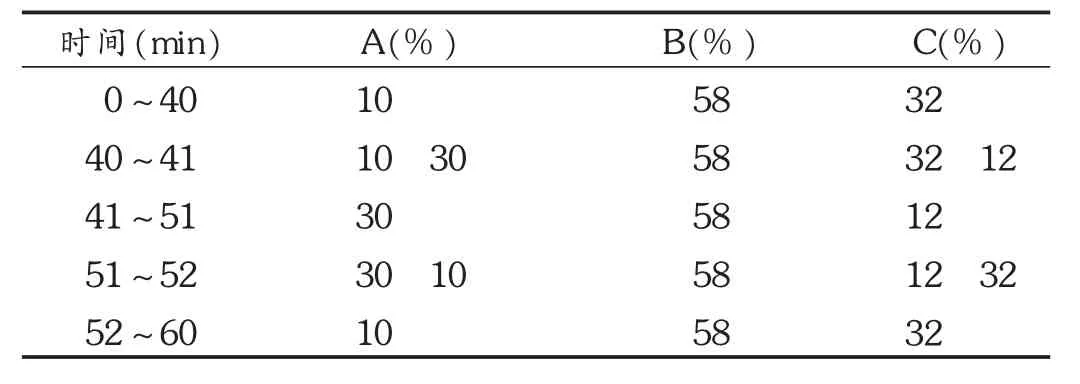
表1 流动相梯度洗脱程序
2.2 溶液制备
对照品溶液:取柴胡皂苷a对照品适量,精密称定,加甲醇制成每1mL含柴胡皂苷a0.2mg的溶液,即得。
供试品溶液:取本品,研细,取1.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇25m L,密塞,称定质量,超声处理(功率250W,频率40 kHz)20min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
阴性对照品溶液:因本制剂为单味药材且制剂时未添加辅料,取制备供试品溶液用的甲醇。
2.3 方法学考察
阴性干扰试验:取2.2项下3种溶液各10μL,分别注入高效液相色谱仪,记录色谱图。供试品溶液色谱中,在与对照品溶液相应位置上有相同保留时间色谱峰,阴性对照无干扰,见图1。

图1 高效液相色谱图
线性关系考察:精密吸取质量浓度为 0.066 04,0.132 08,0.198 12,0.330 2,0.660 4 g/L的柴胡皂苷a对照品溶液各10μL,分别注入液相色谱仪,测定峰面积,以峰面积积分值(Y)为纵坐标、进样量(X)为横坐标绘制标准曲线,得回归方程 Y=288.216X-6.057,r=0.999 97。结果表明,柴胡皂苷a进样量在0.660 4~6.604 0μg范围内与峰面积呈良好线性关系。
精密度试验:精密吸取对照品溶液10μL,在拟订色谱条件下连续进样5次,测定峰面积。结果对照品的平均峰面积为569.391,RSD为0.69%(n=5),表明仪器精密度良好。
稳定性试验:精密吸取供试品溶液 10μL,分别于 0,2,4,6,8,10,12,24 h时进样,测定峰面积。结果的 RSD为1.82%(n=8),表明供试品溶液在24 h内稳定。
重复性试验:取同一批样品9份,分别取高、中、低3个剂量,依法制备供试品溶液,测定含量。结果见表2。
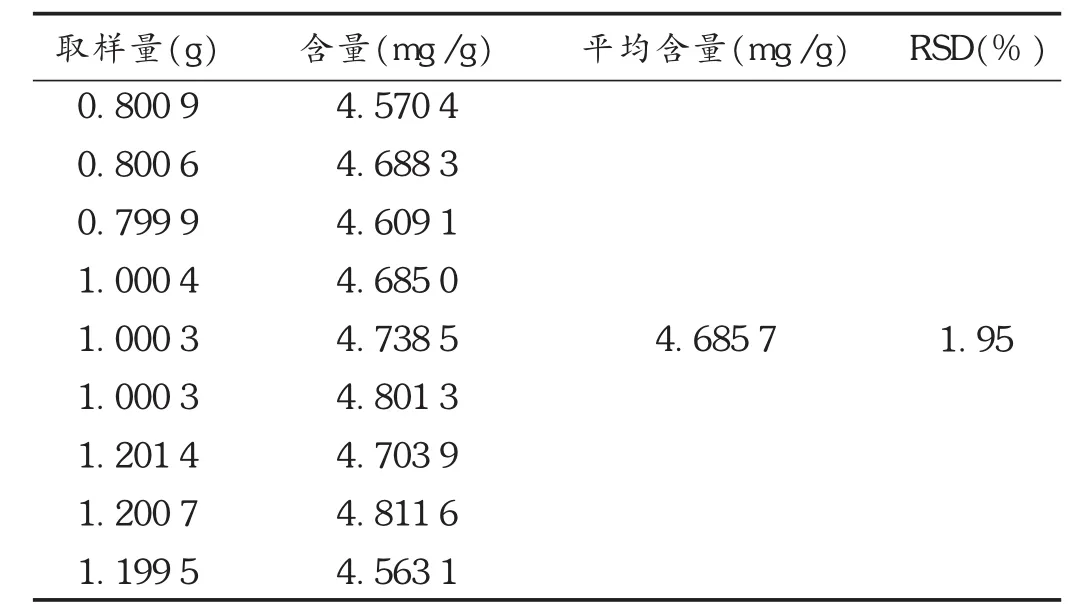
表2 柴胡皂苷a重复性试验结果(n=9)
加样回收试验:取同一批样品9份,分为3组,分别精密加入25m L高、中、低3种质量不同浓度的柴胡皂苷a对照品溶液,进行超声提取,测定含量,计算回收率。结果见表3。
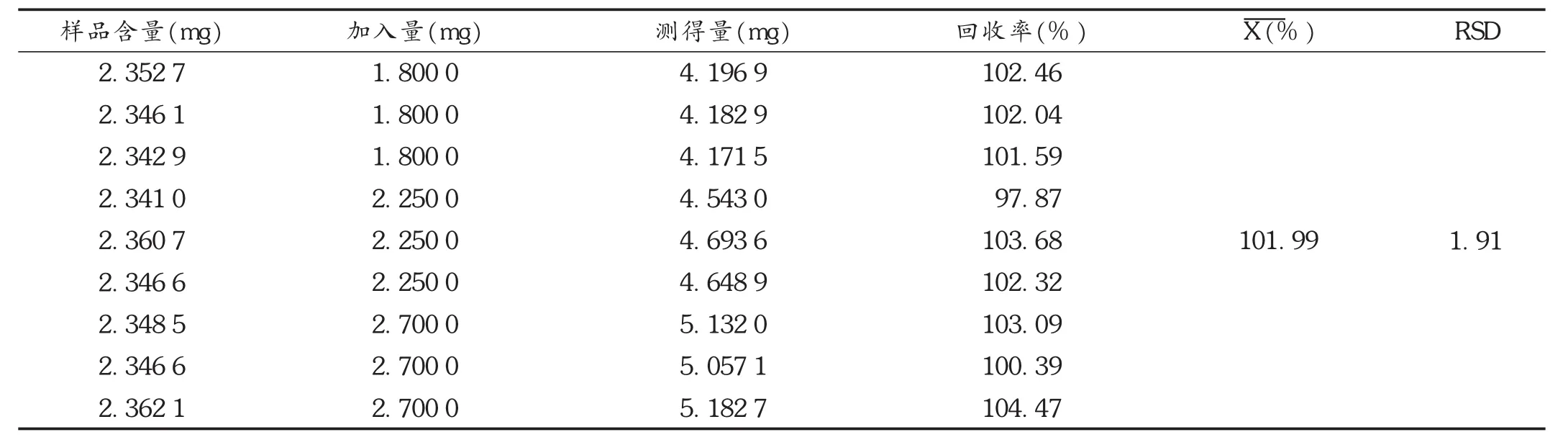
表3 柴胡皂苷a加样回收试验结果(n=9)
耐用性试验:取同一批样品,分别在不同测定波长、不同柱温及不同色谱条件下检测柴胡皂苷a的含量。结果在210,208,212 nm波长下,柴胡皂苷 a的 RSD为1.70%(n=3);在24,26,28,30℃柱温下,柴胡皂苷a的 RSD为1.54%(n=4);3种不同色谱柱对样品的分离无影响,柴胡皂苷a的 RSD为1.68%(n=3)。可见,测定条件的微小变动对检测结果无影响。
2.4 样品含量测定
用所建立的含量测定方法,测定3批柴胡配方颗粒柴胡皂苷a的含量,结果批号为150101,150102,150103的3批样品中柴胡皂苷a的含量分别为4.6641,3.7038,3.708 8mg/g。
3 讨论
3.1 色谱条件选择
柴胡中的主要成分柴胡皂苷a和柴胡皂苷d在紫外区仅有末端吸收,该区域成分较多,不易进行定量测定,检测时易受到试剂的干扰[9]。另外,皂苷类成分样品处理较复杂,故对其定量测定不多。目前,柴胡制剂中柴胡皂苷a和柴胡皂苷d的测定方法主要为HPLC法,检测器有ELSD检测器和VWD紫外检测器[10-14],流动相为甲醇-乙腈-水 (25∶45∶30)、乙腈-水(28∶72)及乙腈-水进行梯度洗脱。本研究中曾采用2010年版《中国药典(一部)》柴胡项下含量测定的流动相[1],对乙腈-水进行梯度洗脱,但该流动相柴胡皂苷a分离不好,且峰形不对称,经反复调整流动相比例,并在流动相中添加甲醇和磷酸,使柴胡皂苷a获得良好分离,峰形对称,基线平稳,梯度洗脱可缩短分析时间,降低检测成本。
3.2 样品处理筛选
柴胡皂苷测定的样品处理方法有采用甲醇超声提取,大孔吸附树脂除杂[10],采用5%浓氨试液的甲醇溶液提取后用正丁醇萃取的方法[11-13],以及采用甲醇提取、正丁醇萃取、碱洗的处理方法[13]等,但处理过程烦琐,操作复杂,不利于大批量生产的产品控制。本研究中采用甲醇超声提取,取续滤液即可,方法简单,易操作,特别适用于大批量生产的产品质量控制。
3.3 提取溶剂选择
本研究曾对70%甲醇、甲醇及含5%浓氨试液的甲醇溶液提取的样品进行柴胡皂苷a检测,结果3种溶剂测定的柴胡皂苷a含量差异不明显,色谱峰也无差异,为简化操作,选择用甲醇做提取溶剂;为保证柴胡皂苷a提取充分,对提取溶剂用量及超声处理时间进行考察,结果提取溶剂选择25m L与50m L时柴胡皂苷a含量无差异,超声处理时间20~40 min对柴胡皂苷a含量影响不大。
3.4 不足
柴胡在煎煮过程中皂苷类成分存在结构性转变[15-16],柴胡配方颗粒中柴胡在提取过程中成分发生变化,导致柴胡皂苷d的含量过低,无法进行定量测定,因此本研究中仅对柴胡皂苷a进行了含量测定。
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:263-264.
[2]王 斌,张腾霄,马松艳,等.柴胡的临床应用及配伍规律研究[J].时珍国医国药,2012,23(1):225-227.
[3]孙源源,施 萍.借助中药配方颗粒推进中药国际化的对策研究[J].中草药,2013,44(8):929-934.
[4]杨 柳,王雪莹,刘 畅,等.北柴胡化学成分与药理作用的研究进展[J].中医药信息,2012,29(3):143-145.
[5]刘永春,丛培臣.柴胡的化学成分及药理作用研究概况[J].黑龙江医药,2006,19(3):216-218.
[6]卫 昊,刘 清,卫伟光,等.HPLC法测定秦岭柴胡及其不同提取物中柴胡皂苷a和柴胡皂苷d[J].中成药,2013,35(2):342-345.
[7]鲁湘鄂,郭海福,汪洪武,等.HPLC法测定柴胡中柴胡皂苷a,d的含量[J].肇庆学院学报,2006,27(2):43-46.
[8]李 竞,高 英,李海龙,等 .太行山区柴胡中总皂苷及柴胡皂苷 a、d的含量测定[J].中国医药导报,2013,10(8):124-126.
[9]曹邦静,苏 娟,叶 霁.蒸发光散射检测器在中药分析中的应用[J].药学实践杂志,2015,33(1):13-16.
[10]谭雄斯.HPLC-UV-ELSD法测定益肝乐颗粒中槲皮素、山柰素、柴胡皂苷a和柴胡皂苷d[J].中成药,2014,36(3):531-535.
[11]苟小军,黄 强.HPLC法测定柴胡疏肝胶囊中柴胡皂苷a、d的含量[J].现代中药研究与实践,2014,8(5):65-67.
[12]刘香玉,田民强,冯丽莉,等.复方解郁颗粒的质量标准研究[J].中国药师,2014,17(5):763-766.
[13]黄有带,熊艺花,景运条,等.复肝宁片质量标准的研究[J].广东药学院学报,2014,30(5):604-607.
[14]杜天信,王秀真,杜志谦,等.加味益气丸定性鉴别与含量测定[J].中国实验方剂学杂志,2013,19(5):129-132.
[15]李 军,姜 华,尹卫平.柴胡及其煎剂中皂苷类成分的高效液相指纹图谱研究[J].时珍国医国药,2009,20(9):2205-2206.
[16]李 军,姜 华,张延萍,等.柴胡汤剂中次生柴胡皂苷结构研究[J].中国中药杂志,2012,37(20):3078-3082.
Content Determ ination of Saikosaponin A in Chaihu Dispensing G ranules by HPLC
Miao Xihong1,Li Xiaoyan2,Gao Junwen2,Su Pingju2
(1.Chengde Central Hospital,Chengde,Hebei,China 067000; 2.Hebei Yiling Medicine Institute,Shijiazhuang,Hebei,China 050035)
Ob jective To establish an HPLC method for the content determination of saikosaponin a in Chaihu Dispensing Granules.M ethods HPLC analysis was performed on an Welch Ultimate XB-C18column(250 mm×4.6 mm,5 μm)with acetonitrilemethanol-0.1% phosphoric acid solution as mobile phase for gradient elution.The detection wavelength was at 210 nm.Results The calibration curve of saikosaponin a showed a good linearity within the range of 0.660 4-6.604 0μg,and the regression equation was Y=288.216 X-6.057(r=0.999 97).The average recovery was 101.99% and RSD was 1.91%(n=9).Conclusion The method is convenient,accurate and reproducible to operate and is suitable for the quality control of Chaihu Dispensing Granules.
HPLC;Chaihu Dispensing Granules;saikosaponin a
R284.1;R286.0
A
1006-4931(2017)03-0033-03
2016-06-22;
2016-10-20)
10.3969/j.issn.1006-4931.2017.03.011
缪希红(1974-),女,满族,副主任中医师,研究方向为中医临床及制剂开发,(电子信箱)944359932@qq.com。
李晓燕(1974-),女,满族,正高级工程师,研究方向为中药新药开发及质量标准,(电话)0311-66703013(电子信箱)sjzyllxy@163.com。

