IL-1β 作用下功能化自组装多肽纳米纤维水凝胶对大鼠髓核细胞蛋白多糖和 II 型胶原代谢影响的实验研究
郭子明 阮狄克 何王德利 李威 李小川 林凌瀚 陈佳海
IL-1β 作用下功能化自组装多肽纳米纤维水凝胶对大鼠髓核细胞蛋白多糖和 II 型胶原代谢影响的实验研究
目的观察修饰有骨形态发生蛋白质 7 ( bone morphogenetic protein 7,BMP-7 ) 功能片段的功能化自组装多肽纳米纤维水凝胶 RADKPS 在低浓度炎症因子白介素-1β ( inter leukin-1β,IL-1β ) ( 10 pg / ml )持续作用下对大鼠髓核细胞蛋白多糖和 II 型胶原代谢的影响。方法 体外分离培养 SD 大鼠髓核细胞 ( nucleus pulposus cells,NPCs ),取第 3 代 NPCs 分别在无 BMP-7 功能片段的 RADA16-I 或修饰有 BMP-7 功能片段的RADKPS 中培养,试验共分 4 组:A 组 ( 无 IL-1β 干预的 RADA16-I 组 )、B 组 ( 有 IL-1β 干预的 RADA16-I组 )、C 组 ( 有 IL-1β 干预的 RADKPS 组 ) 和 D 组 ( 无 IL-1β 干预的 RADKPS 组 )。分别在培养的第 3 天、第6 天及第 9 天通过 RT-PCR 和 ELISA 检测髓核细胞蛋白多糖和 II 型胶原在 RNA 和蛋白水平的表达量。结果RT-PCR 和 ELISA 结果表明在第 3 天和第 6 天时 C 组蛋白多糖和 II 型胶原的表达水平均明显高于 A 组,差异均有统计学意义 ( P<0.05 ),但到第 9 天时两组之间的差异无统计学意义 ( P>0.05 );B 组蛋白多糖和 II 型胶原的表达水平在第 3 天、第 6 天及第 9 天时均低于 A 组,但差异均无统计学意义 ( P>0.05 );在第 3 天时C 组蛋白多糖和 II 型胶原的表达水平低于 D 组,差异无统计学意义 ( P>0.05 ),在第 6 天和第 9 天时,C 组中两者的表达量均明显低于 D 组,且差异均有统计学意义 ( P<0.05 )。结论 髓核细胞经 BMP-7 功能片段刺激后对 IL-1β 抑制其蛋白多糖和 II 型胶原合成的作用更为敏感,但低浓度 IL-1β ( 10 pg / ml ) 不能完全抵消功能化自组装多肽纳米纤维水凝 RADKPS 中 BMP-7 功能片段对大鼠 NPCs 蛋白多糖和 II 型胶原合成的促进作用。本研究表明 RADKPS 在体外条件下有一定的抗 IL-1β 作用,所以即使在炎症因子 IL-1β 的存在下,RADKPS仍能促进髓核细胞蛋白多糖和 II 型胶原的合成。
组织工程;骨形态发生蛋白质;白细胞介素;水凝胶;大鼠;髓核细胞
下腰痛是当今临床常见病之一,它不仅严重影响患者的生活质量和劳动能力,同时还给社会造成严重的经济负担[1]。研究表明椎间盘退变 ( intervertebral disc degeneration,IDD ) 是造成下腰痛的主要原因之一[2]。髓核细胞外基质蛋白多糖和 II 型胶原含量的降低在 IDD 的发生及发展中扮演着重要角色,因此提高退变椎间盘中细胞外基质蛋白多糖和 II 型胶原的含量将是修复退变椎间盘的一个有效途径[3-5]。
骨形态发生蛋白质 7 ( bone morphogenetic protein 7,BMP-7 ) 又名成骨蛋白-1 ( osteogenic protein-1,OP-1 ),是转化生长因子 β ( transforming growth factor-β,TGF-β ) 超家族中的一员,体外及体内试验均表明 BMP-7 可促进犬、兔及人髓核细胞中蛋白多糖和 II 型胶原的合成,同时体内实验表明 BMP-7 注射后还可提高新西兰大白兔椎间盘内的含水量及增加椎间盘高度,进而达到修复退变椎间盘的作用[6-8]。
RADA16-I ( AcN-RADARADARADARADA-CNH )是一种新型自组装多肽纳米纤维支架材料,通过在其C 端末端复合短的具有不同功能的生物活性多肽片段提高其生物学活性,从而达到与组织细胞特异性作用的目的,并将这种经过修饰后的 RADA16-I 材料称之为“功能化自组装纳米纤维支架”[9]。本研究前期将短的具有 BMP-7 功能的多肽片段 ( KPSSAPTQLN )通过化学键方式结合在 RADA16-I 的 C 端从而构建出功能化自组装多肽纳米纤维水凝胶支架材料RADA-KPSS,再把 RADA-KPSS 与 RADA16-I 以1∶1 比例混合形成新型功能化自组装多肽纳米纤维水凝胶支架材料 RADKPS,研究表明,RADKPS 在体外可明显促进人退变髓核细胞中蛋白多糖和 II 型胶原的合成,且后续的研究进一步展现了 RADKPS 应用于修复退变椎间盘的良好潜力[10-13]。
研究证实退变椎间盘组织中 IL-1β 的含量明显升高,且其通过抑制髓核细胞外基质的合成和加速细胞外基质的降解进而加速椎间盘的退变,所以IL-1β 可能影响 RADKPS 应用于修复退变椎间盘的远期体内实验[14-16]。关于 RADKPS 在 IL-1β 持续作用下对髓核细胞外基质蛋白多糖和 II 型胶原的代谢的影响,目前尚未有文献报道,本研究拟在体外观察修饰有 BMP-7 功能片段的 RADKPS 在低浓度 IL-1β 的持续作用下对大鼠髓核细胞蛋白多糖和II 型胶原代谢的影响,为 RADKPS 进一步应用于体内修复退变椎间盘提供指导。
材料与方法
一、试验动物
清洁级健康雄性 SD 大鼠,5 只 ( 3 个月龄,体质量 330~370 g ),均由解放军海军总医院动物试验中心提供,动物处理方案经过海军总医院伦理委员会批准。
二、主要材料、仪器及试剂
RADA16-I [ 氨基酸序列:ACN- ( RADA ) 4-CONH2 ]与 RADA-KPSS [ 氨基酸序列列:ACN-( RADA ) 4GGKPSSAPTQLN-CONH ]多肽粉末各100 mg ( 利用固相合成法合成,纯度>90%;上海生工生物工程有限公司;RADA16-I,P10325;RADA-KPSS,P10324 );胎牛血清 FBS ( Gibco,美国,16000-044 );LG-DMEM 培养基 ( Solarbio,中国,31600-500 );PBS 缓冲液 ( Hyclone,美国,SH30256.01 );II 型胶原酶 ( Sigma,美国,C6885 );胰酶 ( Gibco,美国,25300-054 );Trizol ( Invitrogen,美国,15596026 ) IL-1β ( Peprotech,美国,200-01B );RT-PCR 试剂盒 ( Takara,日本,RR820A );RT-PCR 仪 ( Thermo Fisher,美国,TCR0096 );ELISA 检测试剂盒 ( Blue Gene,中国;大鼠蛋白多糖,E02P0161;大鼠 II 型胶原,E02C0779 );RevertAidTM First Strand cDNA Synthesis试剂盒 ( Takara,日本,RR036A )。Millicell cell culture insert ( 孔径 0.4 μm,直径 12 mm,Merck,美国,PICM01250 );培养瓶 ( Corning,美国,431464U );培养板 ( Corning,美国,NY14831 )。细胞培养箱 ( Thermo,美国,HERACell 150i );倒置相差显微镜 ( Olympus,日本,703516 );超声破碎仪( Ameritech,中国,UC-5832 )。
三、试验步骤
1. 髓核细胞的分离、培养及传代:经腹腔注射 10% 水合氯醛处死 SD 大鼠,置于 75% 乙醇中浸泡 10 min 后转入经紫外照射处理过的无菌动物手术台,常规消毒术区、铺巾,沿背部正中入路切开皮肤,轻柔剥离脊柱周围附着的肌肉及软组织结构,于无菌操作下取出 SD 大鼠腰段脊柱,无菌 PBS 缓冲液清洗后立即转入超净台,利用尖刀片在解剖显微镜下切开椎间盘外层纤维环,显露并分离中央胶冻样髓核组织,眼科镊夹取后置入装有 PBS 缓冲液 ( 含 0.1% 双抗的 ) 的 15 ml 离心管内清洗 3 次( 3 min / 次 ),并以 1200 r / min 离心 5 min 后收集组织块沉淀,随后转移至 6 孔板中,用眼科剪将 6 孔板中的组织块剪碎至约 1 mm × 1 mm× 1 mm 大小后完全浸于 0.25% II 型胶原酶溶液,在 37 ℃ 及 5% CO2的恒温培养箱进行消化,每隔 30 min 用吸管轻柔吹打数次。4 h 后用等体积的完全培养基 ( 含 10% FBS 的 LG-DMEM ) 终止消化,用 200 目无菌筛网过滤后收集细胞沉淀,PBS 漂洗 2 次 ( 3 min / 次 ),1000 r / min 离心 5 min,弃上清,加入完全培养基重悬并用吸管轻柔吹打混匀细胞,随后将细胞以1×105个 / ml 接种于 25 cm2的无菌培养瓶内,置于5% CO2、37 ℃ 饱和湿度细胞培养箱中培养,每 3 天换液 1 次。在倒置相差显微镜下观察髓核细胞生长状况,待细胞融合至 80%~90% 时,用 0.25% 胰酶( 含 0.01% EDTA ) 消化后按 1∶3 进行传代培养,取第 3 代髓核细胞用于后续试验。
2. 多肽水凝胶的制备:用无菌超纯水将RADA16-I 和 RADA-KPSS 多肽粉末溶解后分别配制成浓度为 1% ( m / v ) 的多肽溶液,4 ℃ 条件下使用超声破碎仪探针超声 30 min 使多肽粉末充分溶解;将 1% RADA16-I 溶液与 1% RADA-KPSS 溶液等体积混合形成 1% RADKPS;置于 4 ℃ 保存以用于后续试验 ( 图1 )。
3. 细胞 / 多肽水凝胶支架材料的制备:将 transwell 小室轻置于 24 孔培养板内,然后用 10% ( m / v )的蔗糖溶液重悬收集到的第 3 代髓核细胞并制备成浓度为 2.5×106个 / ml 的细胞悬液,取 20 μl 细胞悬液 ( 含有 5×104个髓核细胞 ) 分别与 100 μl 的 1% RADA16-I 和 1% RADKPS 的多肽溶液迅速混匀。随后立即将细胞 / 多肽水凝胶支架材料混悬液移入transwell 小室,用移液枪在 24 孔板底面轻缓的加入100 μl 完全培养基,随后置入 5% CO2、37 ℃ 培养箱内孵育 10 min 以成胶,成胶后移除 24 孔板底面的完全培养基,轻缓地在 24 孔板培养孔内和水凝胶表面加入完全培养基共 1 ml,再次置入 5% CO2、37 ℃ 培养箱内孵育 30 min,之后每 30 min 更换 1 次培养孔内及凝胶表面的完全培养基,至少更换 2 次以平衡水凝胶的 pH 值 ( 图2 )。
4. 试验分组及 IL-1β 干预:试验共分为四组:A组,无 IL-1β 干预的 RADA16-I 组;B 组,有 IL-1β ( 10 pg / ml ) 干预的 RADA16-I 组;C 组:有 IL-1β ( 10 pg / ml ) 干预的 RADKPS 组;D 组:无 IL-1β 干预的 RADKPS 组。细胞 / 多肽水凝胶支架材料制备成功后在 A 组和 D 组培养孔内和水凝胶表面轻缓加入完全培养基共 1 ml,B 组和 C 组在加入 1 ml 完全培养基的同时加入 IL-1β ( 10 pg / ml )。此后每天换液 1 次,每次换液时在 B 组和 C 组均加入 IL-1β ( 10 pg / ml )。
5. 蛋白多糖和 II 型胶原的 mRNA 检测:实时荧光定量 PCR ( RT-PCR ):( 1 ) RNA 的提取:使用 Trizol 分别提取各组第 3 天、第 6 天及第 9 天时的髓核细胞的总 RNA;( 2 ) cDNA 合成:采用RevertAidTM First Strand cDNA Synthesis 试剂盒,按照说明书配制逆转录反应体系。反转录反应,37 ℃,15 min;反转录酶失活反应,85 ℃,5 s,得到 RT 反应液;( 3 ) SYBR Green RT-PCR 反应体系:采用 SYBRPremixEx TaqTM II ( Tli RNaseHPlus ) RT-PCR 试剂盒,按照说明书配制扩增反应体系,95 ℃ 预变性 30 s,进行 40 个循环,95 ℃ 变性 3 s,60 ℃ 退火延伸 30 s,以 SD 大鼠的 β-actin 作为内参基因,检测各组蛋白多糖及 II 型胶原的 mRNA 相对表达量,以上引物均由北京生工有限公司合成。

图1 功能化自组装多肽纳米纤维水凝胶的大体照 a~b:RADA16-I;c~d:RADKPSFig.1 General observation of the functional self-assembling peptide nanof i ber hydrogel scaffold a - b: RADA16-I; c - d: RADKPS

图2 髓核细胞与 RADA16-I 或 RADKPS 混合后放在 transwell小室内培养Fig.2 NPCs / RADA16-I mixtureor NPCs / RADKPS mixture was cultured in transwell
6. 蛋白多糖和 II 型胶原的 ELISA 定量检测:在第 3 天、第 6 天及第 9 天时用 RIPA 蛋白裂解液分别提取各组的总蛋白,暂存于 -80 ℃ 以用于后续试验。用 BCA 法测定每组的总蛋白浓度,根据 ELISA试剂盒说明书对各组蛋白多糖和 II 型胶原进行定量检测。
四、统计学处理
采用 SPSS 20.0 软件对数据进行统计学分析,计量资料表示为±s。将各组数据进行方差齐性检验后,再采用单因素方差分析的检验方法进行组间比较,每次试验重复 3 次。P<0.05 表示组间差异有统计学意义。
结 果
一、RT-PCR 检测各组细胞中蛋白多糖和 II 型胶原的 mRNA 表达水平
在第 3 天和第 6 天时 C 组蛋白多糖和 II 型胶原的 mRNA 表达水平均明显高于 A 组,且差异均有统计学意义 ( P<0.05 ),在第 9 天时两者差异无统计学意义 ( P>0.05 );在第 3 天、第 6 天及第 9 天时B 组蛋白多糖和 II 型胶原的 mRNA 表达水平均低于A 组,但差异均无统计学意义 ( P>0.05 );在第 3 天时 C 组蛋白多糖和 II 型胶原 mRNA 的表达水平均低于 D 组,差异无统计学意义 ( P>0.05 ),而在第6 天和第 9 天时两者的表达水平均明显低于 D 组,且差异均有统计学意义 ( P<0.05 ),( 图3 )。
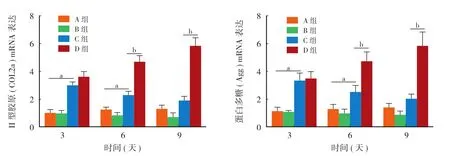
图3 蛋白多糖和 II 型胶原 mRNA 的相对表达量 (aP < 0.05,A 组与 C 组对比;bP < 0.05,C 组与 D 组对比;A 组:RADA16-I,B 组:RADA16-I + IL-1β,C 组:RADKPS + IL-1β;D 组:RADKPS )Fig.3 Relative expression of Agg and COL2a mRNA (aP < 0.05, group A vs. group C;bP < 0.05, group C vs. group D; Group A: RADA16-I, Group B: RADA16-I + IL-1β, Group C: RADKPS + IL-1β, Group D: RADKPS )
二、ELISA 定量检测各组中蛋白多糖和 II 型胶原的含量
蛋白多糖和 II 型胶原的 ELISA 定量检测结果表明,在第 3 天和第 6 天时 C 组蛋白多糖和 II 型胶原的含量均明显高于 A 组,且差异均有统计学意义( P<0.05 ),但在第 9 天时两组差异无统计学意义( P>0.05 );B 组蛋白多糖和 II 型胶原在第 3 天、第6 天及第 9 天时的含量均低于 A 组,两组之间的差异均无统计学意义 ( P>0.05 );C 组蛋白多糖和 II 型胶原在第 3 天时的含量低于 D 组,差异无统计学意义 ( P>0.05 ),但在第 6 天和第 9 天时两者的含量均明显低于 D 组,且差异有统计学意义 ( P<0.05 ),( 图4 )。
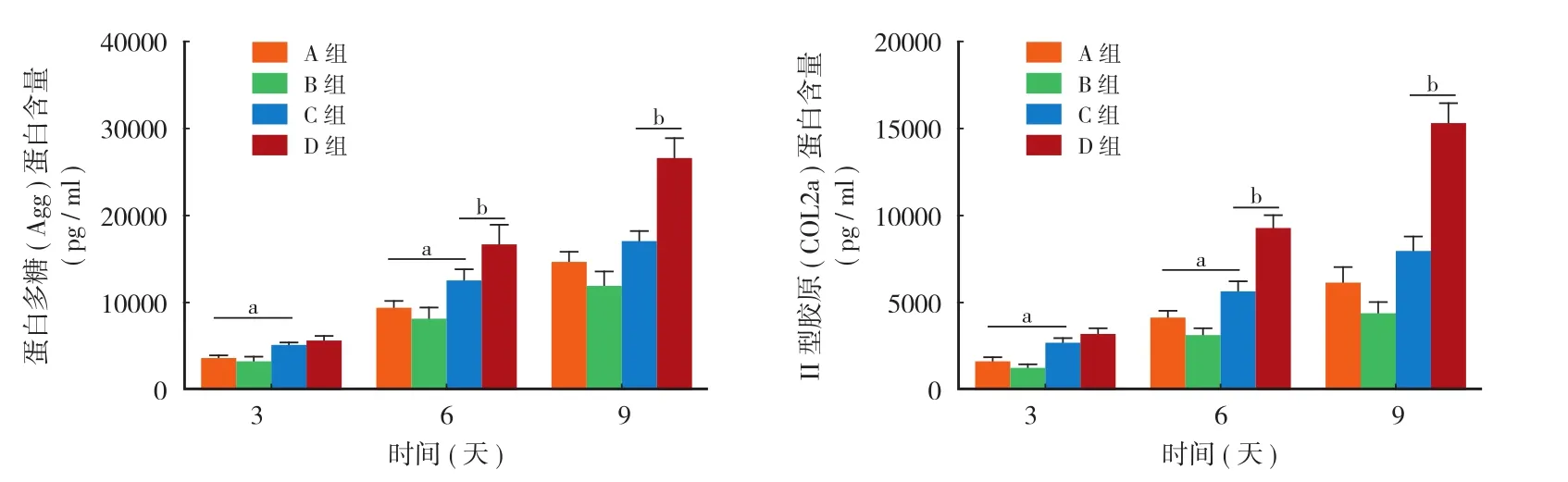
图4 通过 ELISA 检测到的蛋白多糖和 II 型胶原的含量 (aP < 0.05,A 组与 C 组对比;bP < 0.05,C 组与 D 组对比;A 组:RADA16-I,B 组:RADA16-I + IL-1β,C 组:RADKPS + IL-1β;D 组:RADKPS )Fig.4 The production of Agg and COL2a were determined by ELISA (aP < 0.05, group A vs. group C;bP < 0.05, group C vs. group D; Group A: RADA16-I, Group B: RADA16-I + IL-1β, Group C: RADKPS + IL-1β, Group D: RADKPS )
讨 论
组织工程应用于修复退变的椎间盘被认为是一种很有前景的方式[17-18],理想的组织工程材料不仅要提供利于髓核细胞生长的微环境,而且还要能促进髓核细胞外基质的分泌,本试验前期研究已证明修饰有 BMP-7 功能片段的功能化自组装多肽纳米纤维水凝胶 RADKPS 不仅能明显促进髓核细胞外基质蛋白多糖和 II 型胶原的合成,而且还具有理想的生物相容性、促进种子细胞增殖及分化等作用[10-13],这些研究表明 RADKPS 在将来应用于体内修复退变椎间盘方面具有良好的潜力。但在退变的椎间盘中炎症因子的含量是明显升高的,尤其是 IL-1β,IL-1β 的存在也许会影响 RADKPS 对退变椎间盘的修复作用[14,19]。本实验研究表明在低浓度 IL-1β ( 10 pg / ml ) 持续作用下会在一定程度上弱化,但不能完全抵消 RADKPS 对髓核细胞外基质蛋白多糖和II 型胶原合成的促进作用。
关于 IL-1β 作用浓度的选择,Huch 等[20]早期研究表明在 IL-1β 的作用浓度为 10 pg / ml 时,BMP-7 ( 50 ng / ml ) 对人膝关节软骨细胞外基质蛋白多糖的合成仍有积极促进作用,随后 Zhang 等[19]报道 BMP-7 ( 100 ng / ml ) 可完全抵消 IL-1α ( 0.1 ng / ml ) 对牛髓核细胞外基质蛋白多糖合成的抑制作用。基于以上研究,本实验选用浓度为 10 pg / ml 的 IL-1β 作为后续的试验研究。
RT-PCR 及 ELISA 结果表明,在第 3 天和第6 天时 C 组蛋白多糖和 II 型胶原的表达水平均明显高于 A 组,且差异有统计学意义,到第 9 天时C 组中两者的表达量仍高于 A 组,但差异无统计学意义。因此,以上实验结果表明在低浓度 IL-1β 持续作用 9 天下,IL-1β 不能完全抵消 RADKPS 中 BMP-7 功能片段对大鼠髓核细胞外基质蛋白多糖和II 型胶原合成的促进作用。
此外 C 组蛋白多糖和 II 型胶原的表达量在第3 天时均低于 D 组,但差异均无统计学意义,在第6 天和第 9 天时均明显低于 D 组,且差异均有统计学意义;同时在第 3、6 及 9 天时 B 组蛋白多糖和II 型胶原的表达水平均低于 A 组,但差异均无统计学意义。Zhang 等[19]在之前的研究中也得出了类似的试验结果即在无 BMP-7 刺激后低浓度的 IL-1α ( 0.1 ng / ml ) 对牛髓核细胞外基质蛋白多糖的合成有微弱的抑制作用,而同浓度的 IL-1α 对经 BMP-7 刺激后的牛髓核细胞中蛋白多糖的合成有明显的抑制作用,出现这种结果的原因可能是经 BMP-7 刺激后的髓核细胞对低浓度 IL-1 的负性调节作用更敏感。同时,Zhang 等[19]研究表明无 BMP-7 存在时低浓度的 IL-1α ( 0.1 ng / ml ) 不仅不抑制牛纤维环细胞外基质蛋白多糖的合成,反而对其合成起到一定的促进作用;还有研究表明低浓度的 IL-1β ( 10 pg / ml ) 对人膝关节软骨细胞外基质蛋白多糖的合成反而有一定的促进作用[20]。
所以虽然修饰有 BMP-7 功能片段的 RADKPS能显著促进髓核细胞外基质蛋白多糖和 II 型胶原的合成,但本试验结果表明退变椎间盘中 IL-1β 的存在也许会在一定程度上弱化其对于退变椎间盘的修复作用。为了使 RADKPS 对退变椎间盘的修复达到更理想的效果,可以考虑通过抑制 IL-1β 的负面效应而达到。最近研究表明 IL-1β 受体拮抗剂阿那白滞素已用于临床上治疗类风湿关节炎和骨关节炎,且取得了良好的临床疗效[21-22]。目前体外及动物试验已证实 IL-1β 受体拮抗剂可明显减轻 IL-1β 对椎间盘组织所产生的致退变作用[23-25],以上研究表明联合使用 IL-1β 受体拮抗剂,也许会使 RADKPS 对退变椎间盘的修复达到更理想的效果。但目前关于IL-1β 受体拮抗剂应用于修复退变椎间盘的研究主要局限于体外或者动物试验,需进行进一步的临床试验以验证其在修复退变椎间盘方面的应用价值。
综上所述,本实验通过用 IL-1β 在一定程度上模拟退变椎间盘周围的炎性环境以观察 RADKPS 对大鼠髓核细胞外基质蛋白多糖和 II 型胶原代谢的影响,更加完善了功能化自组装多肽纳米纤维水凝胶RADKPS 在修复退变椎间盘方面的作用,为其远期的体内试验提供了一定的指导意义。
[1]Pellisé F, Balagué F, Rajmil L, et al. Prevalence of low back pain and its effect on health-related quality of life in adolescents[J]. Arch Pediatr Adolesc Med, 2009, 163(1):65-71.
[2]Freimark D, Czermak P. Cell-based regeneration of intervertebral disc defects: review and concepts[J]. Int J Artif Organs, 2009, 32(4):197-203.
[3]Antoniou J, Steffen T, Nelson F, et al. The human lumbar intervertebral disc: evidence for changes in the biosynthesis and denaturation of the extracellular matrix with growth, maturation, ageing, and degeneration[J]. J Clin Invest, 1996, 98(4):996-1003.
[4]Buckwalter JA. Aging and degeneration of the human intervertebral disc[J]. Spine, 1995, 20(11):1307-1314.
[5]Liu GZ, Ishihara H, Osada R, et al. Nitric oxide mediates the change of proteoglycan synthesis in the human lumbar intervertebral disc in response to hydrostatic pressure[J]. Spine, 2001, 26(2):134-141.
[6]Wang C, Ruan DK, Zhang C, et al. Effects of adeno-associated virus-2-mediated human BMP-7 gene transfection on the phenotype of nucleus pulposus cells[J]. J Orthop Res, 2011, 29(6):838-845.
[7]Imai Y, Miyamoto K, An HS, et al. Recombinant human osteogenic protein-1 upregulates proteoglycan metabolism of human anulus fibrosus and nucleus pulposus cells[J]. Spine, 2007, 32(12):1303-1309.
[8]An HS, Takegami K, Kamada H, et al. Intradiscal administration of osteogenic protein-1 increases intervertebral disc height and proteoglycan content in the nucleus pulposus in normal adolescent rabbits[J]. Spine, 2005, 30(1):25-31.
[9]Bradshaw M, Ho D, Fear MW, et al. Designer self-assembling hydrogel scaffolds can impact skin cell proliferation and migration[J]. Sci Rep, 2014, 4:6903.
[10]Tao H, Zhang Y, Wang CF, et al. Biological evaluation of human degenerated nucleus pulposus cells in functionalized self-assembling peptide nanof i ber hydrogel scaffold[J]. Tissue Engineering Part A, 2014, 20(11-12):1621-1631.
[11]刘龙刚, 伍耀宏, 陶晖, 等. 修饰有 BMP-7 功能片段的功能化自组装多肽纳米纤维水凝胶 RADKPS 制备及其生物相容性研究[J]. 中国修复重建外科杂志, 2016, (4):491-498.
[12]Wu Y, Jia Z, Liu L, et al. Functional self-assembled peptide nanofibers for bone marrow mesenchymal stem cell encapsulation and regeneration in nucleus pulposus[J]. Artif Organs, 2016, 40(6):E112-119.
[13]Li XC, Wu YH, Bai XD, et al. BMP7-based functionalized self-assembling peptides protect nucleus pulposus-derived stem cells from apoptosis in vitro[J]. Tissue Eng Part A, 2016, 22(19-20):1218-1228.
[14]Yang W, Yu XH, Wang C, et al. Interleukin-1beta in intervertebral disk degeneration[J]. Clin Chim Acta, 2015, 450:262-272.
[15]Hu J, Deng G, Tian Y, et al. An in vitro investigation into the role of bone marrowderived mesenchymal stem cells in the control of disc degeneration[J]. Mol Med Rep, 2015, 12(4):5701-5708.
[16]Shen B, Melrose J, Ghosh P, et al. Induction of matrix metalloproteinase-2 and -3 activity in ovine nucleus pulposus cells grown in three-dimensional agarose gel culture by interleukin-1beta: a potential pathway of disc degeneration[J]. European Spine Journal, 2003, 12(1):66-75.
[17]Sakai D. Future perspectives of cell-based therapy for intervertebral disc disease[J]. Eur Spine J, 2008, 17(Suppl 4): S452-458.
[18]Vadalà G, Russo F, Martino AD, et al. Intervertebral disc regeneration: from the degenerative cascade to molecular therapy and tissue engineering[J]. J Tissue Eng Regen Med, 2013, 9(6):679-690.
[19]Zhang Y, An HS, Toofanfard M, et al. Low-dose interleukin-1 partially counteracts osteogenic protein-1-induced proteoglycan synthesis by adult bovine intervertebral disk cells[J]. Am J Phys Med Rehabil, 2005, 84(5):322-329.
[20]Huch K, Wilbrink B, Flechtenmacher J, et al. Effects of recombinant human osteogenic protein 1 on the production of proteoglycan, prostaglandin E2, and interleukin-1 receptor antagonist by human articular chondrocytes cultured in the presence of interleukin-1beta[J]. Arthritis Rheum, 1997, 40(12): 2157-2161.
[21]Chevalier X, Giraudeau B, Conrozier T, et al. Safety study of intraarticular injection of interleukin 1 receptor antagonist in patients with painful knee osteoarthritis: a multicenter study[J]. J Rheumatol, 2005, 32(7):1317-1323.
[22]Kary S, Burmester GR. Anakinra: the first interleukin-1 inhibitor in the treatment of rheumatoid arthritis[J]. Int J Clin Pract, 2003, 57(3):231-234.
[23]Genevay S, Finckh A, Mezin F, et al. Influence of cytokine inhibitors on concentration and activity of MMP-1 and MMP-3 in disc herniation[J]. Arthritis Res Ther, 2009, 11(6):R169.
[24]Gorth DJ, Mauck RL, Chiaro JA, et al. IL-1ra delivered from poly(lactic-co-glycolic acid) microspheres attenuates IL-1βmediated degradation of nucleus pulposus in vitro[J]. Arthritis Res Ther, 2012, 14(4):R179.
[25]Gorth DJ, Martin JT, Dodge GR, et al. In vivo retention and bioactivity of IL-1ra microspheres in the rat intervertebral disc: a preliminary investigation[J]. J Exp Orthop, 2014, 1(1):15.
( 本文编辑:李慧文 )
Effect of functionalized self-assembling peptide nanof i ber hydrogel on the metabolism of aggrecan and type II collagen of rat nucleus pulposus cells with the effect of IL-1β
GUO Zi-ming, RUAN Di-ke, HE Qing, WANG De-li,LI Wei, LI Xiao-chuan, LIN Ling-han, CHEN Jia-hai. Naval Clinical College of Anhui Medical University, Hefei, Anhui, 230032, China
RUAN Di-ke, Email: ruandikengh@163.com
ObjectiveTo observe the effect of RADKPS which is modif i ed with BMP-7 functional fragments on the metabolism of aggrecan and type II collagen of nucleus pulposus cells of rats when a low concentration of interleukin-1 beta ( IL-1β, 10 pg / ml ) is existent. Methods Nucleus pulposus cells ( NPCs ) were isolated from Sprague-Dawley rats and cultured to the 3rd passage in vitro. NPCs were cultured in the presence of RADA16-I which was without BMP-7 functional fragment or RADKPS which was combined with BMP-7 functional fragments. Experiments were divided into 4 groups: group A ( RADA16-I without IL-1β ), group B ( RADA16-I with IL-1β ), group C ( RADKPS with IL-1β ) and group D ( RADKPS without IL-1β ). Real-time PCR ( RT-PCR ) and enzymelinked immunosorbent assay ( ELISA ) were performed to determine the RNA and protein expressions of aggrecan and type II collagen of each group on the 3rd day, the 6th day and the 9th day. Results The results of RT-PCR and ELISA showed that the expression level of aggrecan and type II collagen of group C was signif i cantly higher than that of group A on the 3rd day and the 6th day and the difference was statistically signif i cant ( P < 0.05 ), but the differencebetween the 2 groups was not statistically signif i cant on the 9th day ( P > 0.05 ); the expression level of aggrecan and type II collagen of group B was lower than that of group A at the 3rd day, the 6th day and the 9th day, but the difference between the 2 groups was not statistically signif i cant at the 3 time points ( P > 0.05 ); the expression level of aggrecan and type II collagen of group C was lower than that of group D on the 3rd day and there was no statistical signif i cance ( P > 0.05 ). But the expression level of aggrecan and type II collagen of group C was signif i cantly lower than that of group D on the 6th day and the 9th day, and the difference between the 2 groups was statistically signif i cant ( P <0.05 ). Conclusions After being stimulated by BMP-7 functional fragments, nucleus pulposus cells are more sensitive to the inhibition of IL-1β on the synthesis of aggrecan and type II collagen. However, IL-1β ( 10 pg / ml ) could not completely counteract the positive effect of BMP-7 functional fragments which are compounded in the functionalized self-assembled peptide nanof i ber hydrogel RADKPS on the synthesis of aggrecan and type II collagen of NPCs. The present study shows that RADKPS has a certain anti-IL-1β effect in vitro. Therefore, RADKPS can still promote the synthesis of aggrecan and type II collagen of NPCs when proinf l ammatory cytokine IL-1β is present.
Tissue engineering; Bone morphogenetic protein 7; Interleukin-1 beta; Hydrogel; Rats; Nucleus pulposus cells
10.3969/j.issn.2095-252X.2017.03.009
R318
国家自然科学基金面上项目 ( 81472121 )
230032 合肥,安徽医科大学海军临床学院 ( 郭子明、阮狄克 );100048 北京,海军总医院骨科 ( 何、王德利、李威、李小川、林凌瀚、陈佳海 )
阮狄克,Email:ruandikengh@163.com
2016-12-20 )

