Pellet 培养与纤维蛋白凝胶支架体外成软骨能力的比较
黄亮节 翁土军 张春丽 刘彦 钱隆 侯树勋
Pellet 培养与纤维蛋白凝胶支架体外成软骨能力的比较
黄亮节 翁土军 张春丽 刘彦 钱隆 侯树勋
目的比较 Pellet 培养和纤维蛋白凝胶支架两种培养方式诱导脂肪干细胞向软骨细胞分化及合成细胞外基质的差异。方法 人脂肪组织酶消化分离脂肪干细胞,培养基为 DMEM 含 10% 胎牛血清,利用Pellet 培养和纤维蛋白凝胶支架两种培养体系将 P3 代脂肪干细胞诱导成软骨后 21 天取材进行苏木精-伊红染色,番红 O 染色,DMMB 法测定胞外基质中 GAG 含量,荧光定量 PCR 测定 II 型胶原基因表达。结果 苏木精-伊红染色与番红-O 染色显示,纤维蛋白凝胶实验组软骨细胞外基质大量分泌,并融合成片,说明纤维蛋白凝胶支架可更好促进干细胞成软骨分化、维持软骨细胞表型。GAG / DNA 结果显示,纤维蛋白凝胶组促GAG 分泌的能力优于其余各组 ( P<0.05 ),其 II 型胶原 mRNA 表达的能力也最强 ( P<0.05 )。结论 利用纤维蛋白凝胶支架诱导人脂肪干细胞成软骨分化的能力优于无支架的 Pellet 三维培养体系。
纤维蛋白;干细胞;组织工程;软骨;Pellet 培养;脂肪源干细胞
关节软骨自身修复能力差,如何治疗软骨缺损一直是关节外科医生所面临的难题。传统软骨缺损修复的方法有软骨下骨微骨折术、镶嵌式成形术及同种异体骨软骨移植等[1-3]。近年来又出现了自体软骨细胞移植等新技术[4]。但以上方法常受到供体数量不足、免疫排斥反应的限制,远期疗效并不理想[5]。新兴的组织工程技术利用支架材料联合干细胞与诱导因子,在体外或体内构建组织和器官,为软骨再生提供了新的思路。脂肪干细胞来源广泛、数量丰富、获取便捷,且具有成软骨分化潜能,在适宜条件下可向软骨分化,相比骨髓间充质干细胞具有明显优势,是软骨组织工程中种子细胞的理想选择[6]。
软骨组织工程中种子细胞诱导分化为软骨细胞一直是研究的热点。转化生长因子 β ( TGF-β ) 家族因其具有良好的促干细胞成软骨分化能力,常作为软骨组织工程中的诱导因子[7-8],且 TGF-β3 相较于传统的 TGF-β1,促进人间充质干细胞成软骨分化能力更强[9]。合适的诱导培养体系还包括培养模式、支架材料等,在脂肪干细胞的诱导分化中也起到关键作用。Pellet 培养体系作为无支架培养的代表,在长期培养中软骨细胞仍可保持较好生物学活性,同时特异性细胞外基质分泌增加,操作简单,产量较高[10]。近年来基于支架的组织工程技术也发展迅速,可注射式细胞支架因其创伤较小、可塑性强、操作方便等优势,成为软骨组织工程的研究热点[11]。纤维蛋白凝胶具有来源广泛、价格低廉、生物相容性好,在凝血酶作用下可形成三维立体多孔细胞支架,为种子细胞的均匀分布提供足够的空间,促进种子细胞的黏附、生长、增殖、分化[12],在软骨再生领域具有良好的应用前景。
本实验以人脂肪干细胞作为种子细胞,在培养体系中加入 TGF-β3 细胞因子,比较无支架的 Pellet培养和纤维蛋白凝胶支架两种培养方式成软骨效果的差异,探索诱导效果更好的软骨诱导培养体系,为下一步临床利用脂肪干细胞修复软骨损伤奠定基础。
材料与方法
本实验于 2016 年 3 月至 2016 年 9 月在解放军总医院第一附属医院全军骨科研究所完成。
材料:脂肪来自解放军总医院第一附属医院膝关节置换术患者,所有患者均签署知情同意书。
一、实验步骤
1. 实验相关试剂的配制:凝血酶溶液及纤维蛋白原溶液:凝血酶溶于氯化钙,获得浓度 5 U / ml 溶液 ( A 液 ),用来重悬细胞;纤维蛋白原溶于氯化钠溶液使浓度为 100 mg / ml,并含抑酞酶 10000 KIU / ml ( B 液 ),A 液和 B 液混合即可形成纤维蛋白凝胶。DMMB 染色液:1.6 mg DMMB 粉末溶于 100 ml 缓存液中,缓冲液含 3.04 g / L 甘氨酸、2.37 g / L 氯化钠及 0.01 mmol / L 盐酸 ( 表1 )。

表1 试验主要试剂及仪器Tab.1 The main reagent and apparatus
2. 人脂肪干细胞原代培养:收集手术患者髌骨下脂肪组织 20 ml,PBS 冲洗 3 次,将脂肪剪碎转移到 15 ml 离心管内,加入等体积 0.1% I 型胶原酶,37 ℃ 水浴消化 1.5 h,2000 r / min 离心 5 min;弃上清,PBS 重悬,200 目细胞筛过滤悬液至新离心管中,再次 2000 r / min 离心 5 min;弃上清,加入含10% FBS、1% 双抗的 DMEM / F12 培养基重悬,将细胞打匀后接种于 10 cm 培养皿,于 37 ℃、5% CO2培养箱中培养后 48 h 首次换液,换液后 7 天形成细胞克隆并 80% 融合传代。
3. 三维培养细胞微球的制备:收集 P3 代脂肪干细胞,重悬计数,在每个 15 ml 离心管中加入5×105个细胞,300 g 离心 5 min,倾弃上清,加入2 ml 不完全软骨诱导培养基。其成分为:高糖DMEM 加入 100 U / ml 青、链霉素、10% FBS、10-7mol / L 地塞米松、ITS+( 含 10 mg / L 胰岛素,5 μg / L 硒,5.5 mg / L 转铁蛋白,4.7 mg / L 亚油酸,0.5 g / L BSA )、110 mg / L 丙酮酸钠溶液、50 mg / L左旋抗坏血酸-2、40 mg / L 脯氨酸。24 h 后细胞聚集成球,实验组换用添加 10 ng / ml TGF-β3 的完全培养基,对照组继续不完全培养基培养。每隔 2 天全量换液,实验组新鲜加入 TGF-β3,第 21 天收获细胞。
4. 纤维蛋白凝胶复合脂肪干细胞体外培养:收集 P3 代脂肪干细胞,计数,在干净 1.5 ml EP 管中加入 5×105个细胞,弃上清,取 A 液 30 μl 重悬细胞,加入内径 4 mm 的塑料模具内,再取 B 液 30 μl加入,摇晃混匀,37 ℃ 反应 40 min 后混合液凝固成凝胶,将凝胶取出放入 6 孔板内,实验组加入含TGF-β3 的完全培养基 2 ml,对照组加入不完全培养基 2 ml。每隔 2 天全量换液,第 21 天收获细胞。
5. 相关指标的检测:
( 1 ) 组织学评价:成软骨诱导 21 天,取各组的细胞微球及纤维蛋白凝胶,PBS 洗 1 次,4% 多聚甲醛 4 ℃ 固定过夜,20%、30% 蔗糖多聚甲醛溶液依次沉底,OTC 胶包埋,行冰冻切片和相应染色。
苏木精-伊红染色:无水乙醇固定切片数秒,轻柔水洗 1 次,苏木精染色 10 min,水洗,1% 盐酸乙醇分化,返蓝液返蓝,伊红染色 20 min 后用双蒸水洗去多余燃料。脱水、透明、封固。观察组织结构及胞外基质的变化。
番红-O 染色:无水乙醇固定切片数秒,轻柔水洗 1 次,0.1% 番红 O 染色 3 min,水洗 3 次,0.1%醋酸分化 1 s,双蒸水洗 1 min。脱水、透明、封固。酸性黏蛋白、蛋白聚糖均会被染成红色。
( 2 ) 细胞微球及水凝胶 DNA 含量检测:第21 天,各组细胞微球及凝胶以 125 μg / ml 木瓜蛋白酶消化,65 ℃ 水浴 18 h,所得组织消化液一半用于GAG 含量检测,另一半用于 DNA 提取:组织消化液中加入 200 μg / ml 蛋白酶 K 继续消化,55 ℃ 水浴过夜,饱和氯化钠 / tris 酚 / 氯仿 / 乙醇提取 DNA,Nanodrop2000 检测 DNA 浓度。
( 3 ) 细胞微球及水凝胶糖胺聚糖 ( GAG ) 含量检测:每组留存的组织消化液 50 μl 加入 96 孔板,加入 200 μl 预先配置好的 DMMB 染色液。另外取0.1 mg / ml 硫酸软骨素标准储存液用双蒸水稀释成不同浓度 0.02 mg / ml、0.04 mg / ml、0.06 mg / ml、0.08 mg / ml、0.1 mg / ml 制作标准曲线。室温静置2 min,525 nm 波长下测量各孔吸光值。根据标准曲线算出 GAG 浓度。
( 4 ) 实时定量 PCR 检测 II 型胶原的表达:利用Trizol 法提取微球及水凝胶中总 RNA。根据试剂盒说明书进行反转录及 q-PCR 反应,反转录试剂盒为Biotool 公司 All-in-One cDNA Synthesis SuperMix,货号 B24403;定量 PCR 试剂盒为康维世纪公司UltraSYBR Mixture ( Low ROX ),货号 CW2601S。定量 PCR 所用的仪器为 Thermo Fisher 公司 QuanStudio5型 PCR 仪,反应条件:95 ℃、10 min,95 ℃、15 s,57 ℃、1 min,40 个循环,57 ℃ 延伸 1 min。检测目的基因为 II 型胶原,以 GAPDH 为内参基因,各引物序列见表2。采用 ΔΔCt 法计算各组基因相对表达量。

表2 PCR 引物序列Tab.2 Primer sequence of each gene
二、统计学处理
采用 SPSS 19.0 统计软件进行分析。组间数据比较采用 t 检验,P<0.05 为差异有统计学意义。
结 果
一、细胞微球和纤维蛋白凝胶苏木精-伊红染色情况
为描述方便,将无 TGFβ3 的 Pellet 组、添加TGFβ3 诱导的 Pellet 组、无 TGFβ3 的纤维蛋白凝胶组及添加 TGFβ3 诱导的纤维蛋白凝胶组分别以I 组、II 组、III 组、IV 组表示,下同。培养 21 天,III 组、IV 组仍可见凝胶支架。II 组和 IV 组软骨细胞外基质表达较 I 组和 III 组明显增多,融合成片。III 组、IV 组与 I 组、II 组比较,其结构更加均一,有软骨陷窝样结构形成,IV 组较其余各组组胞外基质表达更多 ( 图1 )。
二、细胞微球和纤维蛋白凝胶番红-O 染色情况
成软骨诱导 21 天,添加 TGFβ3 诱导的 II 组、IV 组番红 O 染色呈阳性,证实有大量蛋白聚糖表达。未添加诱导因子的 I 组、III 组,蛋白聚糖表达较弱。IV 组较 II 组异染性着色更强 ( 图2 )。
三、细胞微球和纤维蛋白凝胶 DNA、GAG 含量检测
培养 21 天,各组间 DNA 总量差异无统计学意义 ( P>0.05 ),( 图3a )。添加 TGFβ3 诱导后,II 组、IV 组 GAG 的表达量显著高于对应的 I 组、III 组,其差异有统计学意义 ( P<0.05 ) ( 图3b )。采用 GAG 含量与 DNA 含量的比值衡量 GAG 分泌能力的相对大小,并将未添加诱导的 I 组数值作为 1,其余各组的数值为相对 I 组的倍数大小。添加了诱导因子 TGFβ3 后,II 组、IV 组 GAG 的分泌能力均高于 I 组、III 组,其差异有统计学意义 ( P<0.05 ),II 组、III 组 GAG 分泌能力差异无统计学意义 ( P>0.05 ),IV 组 GAG 的分泌能力显著高于其余各组 ( P<0.05 ) ( 图3c )。
四、细胞微球和纤维蛋白凝胶成软骨特异性分子基因表达检测
培养 21 天,II 组 II 型胶原相对表达量高于I 组,差异有统计学意义 ( P<0.05 ) ( 图4a )。IV 组II 型胶原相对表达量亦高于 III 组,差异有统计学意义 ( P<0.05 ) ( 图4b )。比较各组间 II 型胶原相对表达量的高低,将 I 组数值作为 1,可见凝胶组添加诱导因子 TGFβ3 后 ( IV 组 ),其 II 型胶原相对表达量高于其余各组,差异有统计学意义 ( P<0.05 ),II 组、III 组 II 型胶原相对表达量差异无统计学意义( P>0.05 ) ( 图4c )。

图1 细胞微球和纤维蛋白凝胶苏木精 -伊红染色情况 ( × 400 ) a:为未添加TGFβ3 诱导的 Pellet 组;b:为添加了TGFβ3 诱导的 Pellet 组;c:为未添加TGFβ3 诱导的纤维蛋白凝胶组;d:为添加了 TGFβ3 诱导的纤维蛋白凝胶组。标尺 = 25 μm图2 细胞微球和纤维蛋白凝胶番红 - O染色情况 ( × 400 ) a:为未添加 TGFβ3诱导的 Pellet 组;b:为添加了 TGFβ3 诱导的 Pellet 组;c:为未添加 TGFβ3 诱导的纤维蛋白凝胶组;d:为添加了 TGFβ3 诱导的纤维蛋白凝胶组。标尺 = 25 μmFig.1 Cell microspheres and fi brin gel HE staining ( × 400 ) a: Pellet without TGFβ3 induction; b: Pellet with TGFβ3 induction; c: Fibrin gel without TGFβ3 induction; d: Fibrin gel with TGFβ3 induction. Bar = 25 μmFig.2 Cell microspheres and fi brin gel red-O staining ( × 400 ) a: Pellet without TGFβ3 induction; b: Pellet with TGFβ3 induction; c: Fibrin gel without TGFβ3 induction; d: Fibrin gel with TGFβ3 induction. Bar = 25 μm
讨 论
软骨组织工程利用三维立体支架材料结合种子细胞体外构建有功能的软骨,修复缺损,给软骨损伤的治疗带来了曙光。多项研究已表明,TGF-β 结合特定的培养条件,可在体外诱导胚胎干细胞、骨髓间充质干细胞及脂肪源干细胞成软骨分化[13]。脂肪干细胞可从全身多处部位提取,来源丰富。与其它来源干细胞相比,还具有增殖快、数量众多、免疫源性低、不易造成损伤等优点。研究表明,利用琼脂糖凝胶支架,搭载脂肪源干细胞与搭载骨髓间充质干细胞,两者形成的软骨组织在力学性能上差异无统计学意义[14],而单位体积脂肪组织内的干细胞数目是同体积骨髓中骨髓间充质干细胞数目的40 倍[15]。脂肪干细胞作为一种优秀的种子细胞,具有良好的应用前景。
有报道表明,软骨细胞采用二维培养容易发生去分化,软骨相关细胞外基质的合成减少[16]。一个可供细胞黏附、增殖与分化的三维结构是体外诱导干细胞成软骨所必需的。既往研究表明,细胞通过 Pellet 培养无需支架即可形成类软骨组织[17]。Pellet 培养能较好地模拟体内微环境,高密度细胞聚集又可增强细胞间相互作用,促进细胞因子的诱导效应。纤维蛋白凝胶由机体自身产生,种属间差异小,免疫源性低,在临床上应用广泛,常作为止血剂和密封剂[18],在组织工程领域也被广泛应用。其多孔的网状微观结构,是种子细胞的良好载体。有研究也将纤维蛋白作为药物的缓释系统[19],进行药物投递。Homminga 等[20]利用纤维蛋白凝胶体外结合兔软骨细胞,体外培养 7 天,发现软骨细胞可保持良好的形态与增殖能力并分泌软骨细胞外基质。通常认为,软骨细胞胞外基质成熟需要 6 周,而纤维蛋白凝胶在体内 2~3 周已降解完全。王九现等[21]研究表明,在纤维蛋白凝胶中加入少量抑酞酶可抑制其降解。朱立新等[22]利用兔软骨细胞复合加入抑酞酶、氨甲环酸改良的纤维蛋白凝胶支架,植入兔关节软骨损伤处,植入后 12 周取材发现纤维蛋白凝胶降解速度明显减缓。改良后的纤维蛋白凝胶,已日益成为软骨组织工程支架的首选。

图3 细胞微球和纤维蛋白凝胶 DNA、GAG 含量检测 a:各组 DNA 含量情况;b:各组 GAG 含量情况;c:各组 GAG / DNA 比值的大小情况Fig.3 Cell microspheres and fi brin gel DNA, GAG content detection a: The DNA content of each group; b: The content of GAG in each group; c: The size of each group GAG / DNA ratio
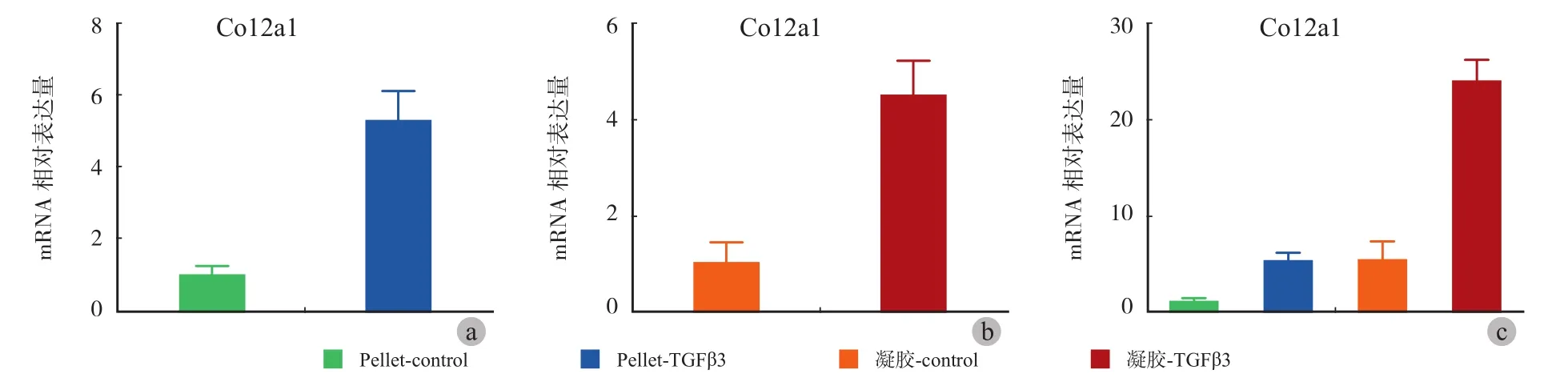
图4 细胞微球和纤维蛋白凝胶成软骨特异性分子基因表达检测 a:示细胞微球组 II 型胶原相对表达量;b:示纤维蛋白凝胶组 II 型胶原相对表达量;c:示各组间 II 型胶原相对表达量的大小情况Fig.4 Cell microspheres and fi brin gel cartilage-specif i c molecular gene expression detection a: The relative expression of type II collagen in cell microspheres group; b: The relative expression of type II collagen in fi brin gel group; c: The relative amount of type II collagen of each group
本研究结果表明,在改良的纤维蛋白凝胶中,添加 TGF-β3 诱导因子,可成功诱导人脂肪干细胞向软骨分化,构建软骨样组织。苏木精-伊红染色显示,添加诱导的凝胶支架组中细胞已具有软骨细胞的典型形态,即圆形或椭圆形的软骨细胞,番红-O 染色显示,添加诱导的凝胶支架组软骨细胞外基质大量分泌,并融合成片,表明纤维蛋白凝胶支架联合诱导因子能够更好地促进干细胞成软骨分化、维持软骨细胞表型。糖胺聚糖 ( glycosaminoglycan,GAG ) 是关节软骨基质中的特征性物质,具有黏滞性,常覆盖在关节面上,具有润滑和保护作用。本研究通过 DMMB 染色法测定各组中 GAG的含量。研究结果显示,添加 TGF-β3 诱导后,纤维蛋白凝胶组和细胞微球组 GAG 表达均升高,而GAG / DNA 结果显示,纤维蛋白凝胶组促 GAG 分泌的能力相对更强,从而合成的组织工程软骨在功能上更接近原生软骨组织。II 型胶原是软骨基质中最重要的标志物,丝状的胶原蛋白纤维与弹性蛋白及多糖蛋白相互交织形成网状结构,产生一定的机械强度,维持关节软骨的弹性与韧性。本研究通过实时定量 PCR 观察 II 型胶原 ( Col2a1 ) 基因的表达,结果显示,添加 TGFβ3 的纤维蛋白凝胶组诱导 II 型胶原 mRNA 表达的能力最强。纤维蛋白凝胶组 Col2a1 mRNA 及 GAG 的表达均显著高于 Pellet 组,这可能是由于纤维蛋白凝胶具有三维微观孔隙结构,表面积 / 体积比较大,细胞间交互作用更强[23];且纤维蛋白凝胶自身亦可释放血小板生成因子 PDGF 及TGF-β[24],进一步促进细胞增殖和软骨基质的合成。未添加 TGFβ3 的凝胶支架组,其 GAG 水平及II 型胶原基因表达与添加了 TGFβ3 诱导的 Pellet 组几乎一致,这可能是由于基础培养基中的 ITS+及地塞米松具有一定的诱导成软骨效应[25-26],在纤维凝胶多孔支架中能较好地发挥成软骨诱导效应。
本研究表明利用纤维蛋白凝胶支架诱导人脂肪干细胞成软骨分化的能力优于无支架的单纯 Pellet培养,所形成的软骨组织在功能与结构上更接近天然软骨,说明利用纤维蛋白支架诱导成软骨效率更高。这为今后利用纤维蛋白凝胶复合自体脂肪干细胞再生组织工程软骨提供了实验依据,并为软骨损伤的临床治疗提供了新的思路。
[1]Aichroth PM, Patel DV, Moyes ST. A prospective review of arthroscopic debridement for degenerative joint disease of the knee[J]. Int Orthop, 1991, 15(4):351-355.
[2]Aubin PP, Cheah HK, Davis AM, et al. Long-term follow up of fresh femoral osteochondral allografts for posttraumatic knee defects[J]. Clin Orthop Relat Res, 2001, (391 Suppl):S318-327.
[3]Ghazavi MT, Pritzker KP, Davis AM, et al. Fresh osteochondral allografts for post-traumatic osteochondral defects of the knee[J]. J Bone Joint Surg Br, 1997, 79(6):1008-1013.
[4]Knutsen G, Drogset JO, Engebretsen L, et al. A randomized multicenter trial comparing autologous chondrocyte implantation with microfracture: long-term follow-up at 14 to 15 years[J]. J Bone Joint Surg Am, 2016, 98(16):1332-1339.
[5]Zhu H, Yang F, Tang B, et al. Mesenchymal stem cells attenuated PLGA-induced in fl ammatory responses by inhibiting host DC maturation and function[J]. Biomaterials, 2015, 53:688-698.
[6]Ringe J, Sittinger M. Tissue engineering in the rheumatic diseases[J]. Arthritis Res Ther, 2009, 11(1):211.
[8]Mehlhorn AT, Niemeyer P, Kaschte K, et al. Differential effects of BMP-2 and TGF-beta1 on chondrogenic differentiation of adipose derived stem cells[J]. Cell Prolif, 2007, 40(6):809-823.
[9]Eslaminejad MB, Karimi N, Shahhoseini M. Chondrogenic differentiation of human bone marrow-derived mesenchymal stem cells treated by GSK-3 inhibitors[J]. Histochem Cell Biol, 2013, 140(6):623-633.
[10]An HS, Thonar EJ, Masuda K. Biological repair of intervertebral disc[J]. Spine, 2003, 28(15 Suppl):S86-92.
[11]曹谊林. 组织工程学研究进展[J]. 上海交通大学学报医学版, 2008, 28(7):763-766.
[12]Dare EV, Griffith M, Poitras P, et al. Fibrin sealants from fresh or fresh/frozen plasma as scaffolds for in vitro articular cartilage regeneration[J]. Tissue Eng Part A, 2009, 15(8): 2285-2297.
[13]Lieb E, Milz S, Vogel T, et al. Effects of transforming growth factor beta1 on bonelike tissue formation in three-dimensional cell culture. I. Culture conditions and tissue formation[J]. Tissue Eng, 2004, 10(9-10):1399-1413.
[14]Vinardell T, Buckley CT, Thorpe SD, et al. Compositionfunction relations of cartilaginous tissues engineered from chondrocytes and mesenchymal stem cells isolated from bone marrow and infrapatellar fat pad[J]. J Tissue Eng Regen Med, 2011, 5(9):673-683.
[15]Zhu Y, Liu T, Song K, et al. Adipose-derived stem cell: a better stem cell than BMSC[J]. Cell Biochem Funct, 2008, 26(6): 664-675.
[16]Cancedda R, Dozin B, Giannoni P, et al. Tissue engineering and cell therapy of cartilage and bone[J]. Matrix Biol, 2003, 22(1):81-91.
[17]Ishihara K, Nakayama K, Akieda S, et al. Simultaneous regeneration of full-thickness cartilage and subchondral bone defects in vivo using a three-dimensional scaffold-free autologous construct derived from high-density bone marrowderived mesenchymal stem cells[J]. J Orthop Surg Res, 2014, 9:98.
[18]Spicer PP, Mikos AG. Fibrin glue as a drug delivery system[J]. J Control Release, 2010, 148(1):49-55.
[19]Ahearne M, Buckley CT, Kelly DJ. A growth factor delivery system for chondrogenic induction of infrapatellar fat padderived stem cells in fibrin hydrogels[J]. Biotechnol Appl Biochem, 2011, 58(5):345-352.
[20]Homminga GN, Buma P, Koot HW, et al. Chondrocyte behavior in fibrin glue in vitro[J]. Acta Orthop Scand, 1993, 64(4):441-445.
[21]王九现, 朱立新, 靳安民, 等. 抑肽酶/氨甲环酸改良可注射性纤维蛋白凝胶的体外实验[J]. 中国组织工程研究, 2008, 12(49):9703-9708.
[22]朱立新, 李奇, 林荔军, 等. 改良纤维蛋白胶软骨膜块在模拟微重力培养下修复关节软骨缺损[J]. 中国骨与关节损伤杂志, 2008, 23(9):741-744.
[23]Sheehy EJ, Mesallati T, Vinardell T, et al. Engineering cartilage or endochondral bone: a comparison of different naturally derived hydrogels[J]. Acta Biomaterialia, 2014, 13:245-253.
[24]Sims CD, Butler PE, Cao YL, et al. Tissue engineered neocartilage using plasma derived polymer substrates and chondrocytes[J]. Plastic Reconstr Surg, 1998, 101(6): 1580-1585.
[25]Liu X, Liu J, Kang N, et al. Role of insulin-transferrin-selenium in auricular chondrocyte proliferation and engineered cartilage formation in vitro[J]. Int J Mol Sci, 2014, 15(1):1525-1537.
[26]Sher L, Oquendo MA, Burke AK, et al. Combined dexamethasone suppression-corticotrophin-releasing hormone stimulation test in medication-free major depression and healthy volunteers[J]. J Affect Disord, 2013, 151(3):1108-1112.
( 本文编辑:李贵存 )
Comparison of in vitro chondrogenic ability between two culture modes: pellet culture system and fi brin gel scaffold
HUANG Liang-jie, WENG Tu-jun, ZHANG Chun-li, LIU Yan, QIAN Long, HOU Shu-xun. Xijing Hospital,the fourth Military Medical University, Xi’an, Shanxi, 710032, China
HOU Shu-xun, Email: hsxortho@hotmail.com
ObjectiveTo compare the effects of 2 different culture modes: pellet culture system and fi brin gel scaffold on the chondrocytic differentiation of adipose-derived stem cells ( ADSCs ) and the synthesis of cartilage extracellular matrix. Methods Adipose tissues were used to isolate human ADSCs and grown in Dulbecco’s modif i ed Eagle’s medium ( DMEM ) containing 10% fetal bovine serum ( FBS ). After the human ADSCs were cultured to the 3rd generation, they were induced into cartilage by 2 kinds of culture modes respectively. At the 21st day, the cells were observed by hematoxylin-eosin ( HE ) staining and safranine-O staining. The glycosaminoglycan ( GAG ) content in extracellular matrix was determined by content dimeth-ylmethylene blue ( DMMB ) method. The expression of type II collagen gene was assessed by real-time polymerase chain reaction ( PCR ). Results HE staining and safranine-O staining showed that the extracellular matrix of chondrocytes was strongly secreted in the fi brin gel scaffold group with transforming growth factor β3 ( TGFβ3 ) and fused into a sheet. It’s indicated that the fi brin gel scaffold could better promote cartilage differentiation of stem cells and maintain chondrocyte type. The results of GAG / deoxyribonucleic acid ( DNA ) showed that the ability to secrete GAG in the fi brin gel scaffold group with TGFβ3 was better than that of the other group ( P < 0.05 ), and the expression of type II collagen messenger ribonucleic acid ( mRNA ) was the strongest ( P < 0.05 ). Conclusions The ability of fi brin gel scaffold to differentiate ADSCs into cartilage is better than that of scaffold-free pellet culture system.
Fibrin; Stem cells; Tissue engineering; Cartilage; Pellet culture; Adipose-derived stem cell
10.3969/j.issn.2095-252X.2017.03.008
Q254, R318
710032 西安,第四军医大学西京医院 ( 黄亮节 );100048 北京,解放军总医院第一附属医院骨科、北京市骨科植入医疗器械工程技术研究中心 ( 翁土军、张春丽、刘彦、钱隆、侯树勋 )
侯树勋,Email: hsxortho@hotmail.com
2016-10-11 )

