胫骨近端肿瘤假体置换术后伸膝装置重建病例报道并文献复习
黄俊琪 毕文志 韩纲 贾金鹏 许猛 王威
胫骨近端肿瘤假体置换术后伸膝装置重建病例报道并文献复习
黄俊琪 毕文志 韩纲 贾金鹏 许猛 王威
目的比较胫骨近端肿瘤假体置换术后不同方法重建伸膝装置的疗效。方法 回顾性分析2012 年 1 月至 2014 年 1 月,在我院行胫骨近端肿瘤扩大切除、人工假体置换、伸膝装置重建术的患者,评估术后膝关节功能和并发症情况。检索 PubMed,Springer,Ovid,LWW,EMBASE 数据库,关键词为胫骨、肿瘤、关节成形术。将相关文献纳入一并讨论。结果 本组伸膝装置重建患者 32 例,均采用假体重建方式。术后随访中出现伸膝迟滞 5 例,感染 2 例。共检索到 9 篇文献,其中骨肉瘤 362 例,软骨肉瘤 26 例,尤文肉瘤 21 例,骨巨细胞瘤 21 例,软组织肉瘤 25 例。经典假体重建 272 例,自体移植物重建 2 例,生物重建24 例。所有膝关节重建术后发生伸膝迟滞 29 例、感染 39 例、韧带断裂 24 例、肿瘤复发 25 例、假体重建失败 133 例。结论 伸膝装置重建能有效恢复患者膝关节功能,但术后存在并发症较多。比较不同重建方式,没有哪一种技术表现出明显的优越所在。现今手术更趋于生物性重建来改善功能。
骨肿瘤;关节成形术,置换,膝;胫骨;髌韧带
保肢手术被认为是多数骨或软组织肉瘤治疗的有效方式[1-2]。与截肢相比,保肢术能获得更好的围手术期和远期的运动功能[3]。在遵循扩大切除的原则下,保肢术手术难度较大,手术时间较长。基于不同的重建方法,保肢术并发症的发生风险较高。如感染、伤口不愈、软组织缺损、假体周围骨折、假体松动、移植物-宿主交界处的不连、移植物骨折、肢体不等长[4]。因此,保肢的前提需满足:( 1 )其对肿瘤的控制及远期生存不差于截肢术;( 2 ) 能提供更好的功能;( 3 ) 并发症的发生率较低。
胫骨近端肿瘤手术涉及肿瘤完整切除,软组织覆盖,髌韧带再连接,神经血管损伤问题。重建不仅需要提供完全伸直的机械基础,还需承受膝关节本身持续的张力和轴向的负载。瘤段切除时常需要一起切除部分髌韧带[5-6]。因此为了维持术后关节功能活动和稳定性,伸膝装置的恢复尤为重要[7]。虽然对伸膝装置重建方法的报道层出不穷,但对于膝关节伸膝装置重建方法的比较研究较少。本研究回顾性分析近期伸膝装置重建患者术后疗效,并结合文献报道进行各重建方法的评估。
临床资料
一、一般资料
2012 年 1 月至 2014 年 1 月,共 32 例患者在我院行胫骨近端肿瘤扩大切除、人工假体置换、伸膝装置重建术。平均年龄 18 岁。其中骨肉瘤患者28 例,骨巨细胞瘤患者 3 例,尤文肉瘤患者 1 例。术前评估,所纳入患者均未发现远处转移。
二、治疗情况
骨肉瘤和尤文肉瘤患者术前接受新辅助化疗。通过术前 X 线片、MRI 测量肿瘤累及范围和手术切缘,评估术中所需假体大小和长度。常规采用前正中切口、髌旁入路显露术野,对瘤段行 en-block 切除。肿瘤未侵犯髌骨结节的患者,术中保留髌韧带止点处骨瓣,直接固定于假体上。肿瘤侵犯髌骨结节患者,在髌韧带止点近端 2 cm 切断,通过缝线或钢丝固定 ( 图1 )。扩大切除后髌韧带长度不足或假体周围没有足够软组织覆盖,采用人工韧带或腓肠肌内侧头转位进行重建 ( 图2 )。术后 3 周开始指导患者功能锻炼。
三、随访情况
术后 6 个月采用 MSTS 93 评估患肢功能,平均 22 分。伸膝迟滞的患者平均为 10°,包括 2 例髌韧带直接固定、2 例腓肠肌内侧头重建、1 例 LARS韧带重建。2 例感染的患者术中髌韧带均为直接固定。其中 1 例行清创后二期假体置换术,术后随访功能良好;另 1 例行截肢术。
文献资料
所用检索工具为 Pubmed,Springer,Ovid, LWW,EMBASE。检索关键词包括胫骨 ( tibia ),关节置换 ( arthroplasty ),骨肿瘤 ( bone neoplasm )。
纳入标准:各类型重建方式的直接研究报道,评述。排除标准:非肿瘤性关节置换后重建报道,综述。所涉及文献仅限于英文。通过 GRADE system 对纳入文章证据级别分类以评估其临床价值。共 9 篇文献 ( 表1 ) 报道了因肿瘤性切除后膝关节重建共455 例,其中骨肉瘤 362 例,软骨肉瘤 26 例,尤文肉瘤 21 例,骨巨细胞瘤 21 例,软组织肉瘤 25 例;非肿瘤因素重建的患者共 23 814 例 ( 表2 )。结合本组病例,采用不同方式重建伸膝装置共 298 例,经典假体重建 272 例,自体移植物重建 2 例,生物重建24 例 ( 表1 )。
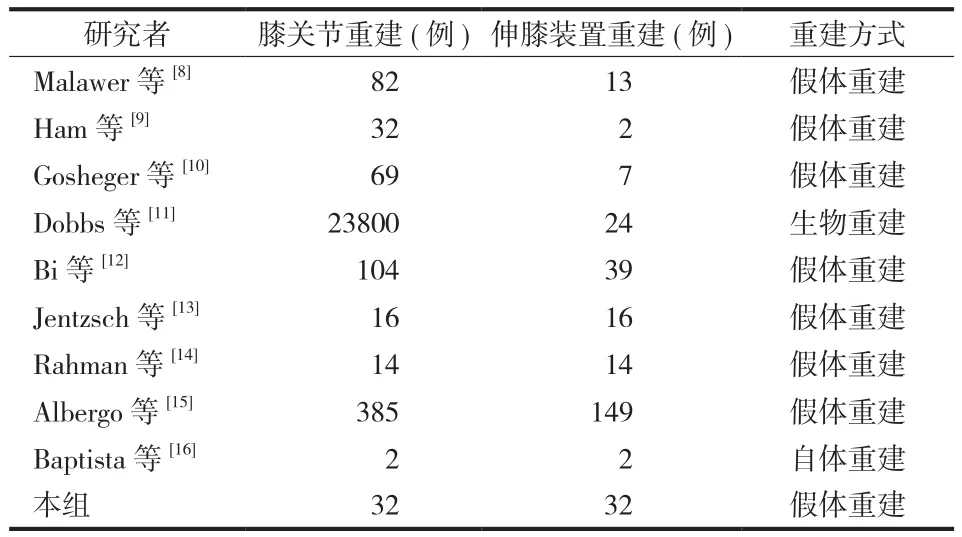
表1 纳入本研究相关文献报道情况Tab.1 Correlated literature reports included in this study
术后伸膝迟滞 29 例 ( 9.7% )、感染 39 例( 8.6% )、韧带断裂 24 例 ( 8.1% )、肿瘤复发 25 例( 5.5% ) ( 表3 )。感染患者一期假体取出,放置抗生素占位器,控制炎症后行二期翻修术;假体重建失败的患者均给予积极手术翻修;肿瘤复发的患者选择再次扩大切除或截肢术,根据资料统计 5 年保肢率为 50%~70%。
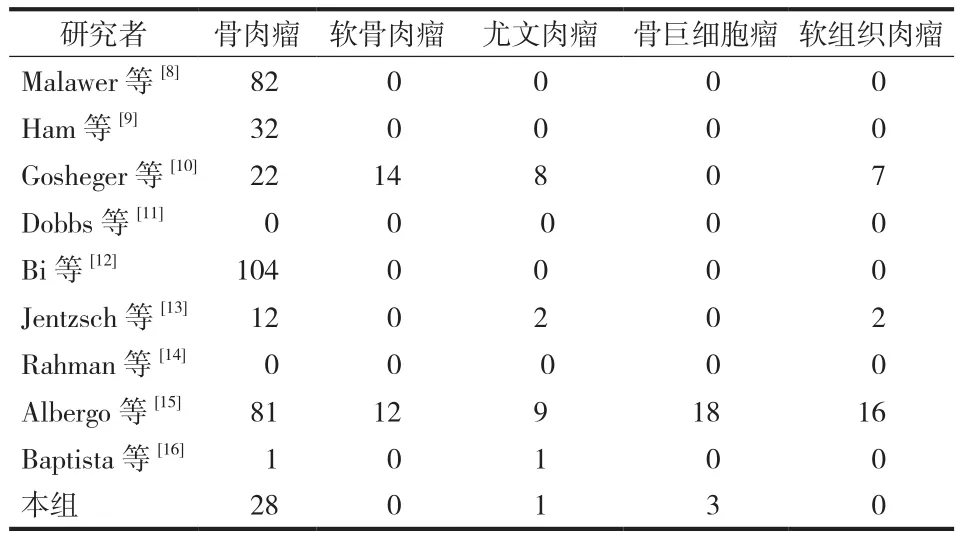
表2 纳入研究患者肿瘤类型Tab.2 Tumor types in enrolled patients
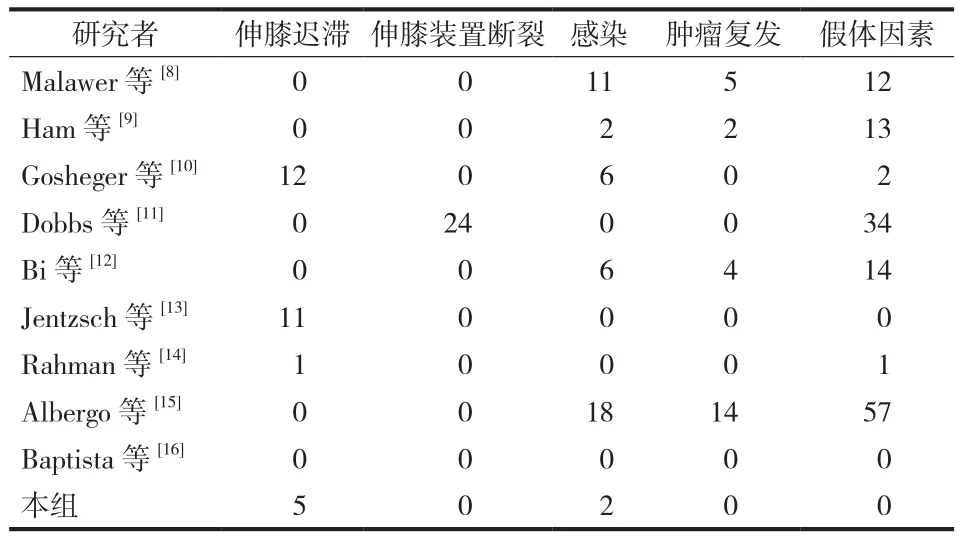
表3 膝关节重建术后并发症Tab.3 Complications after knee joint reconstruction
各种重建选择中并没有证据显示在患者满意度方面明显优于其它术式的重建方法[17]。但伸膝装置的完整重建已是共识。这对于年轻患者或者运动要求较高的患者获得较好功能,改善他们生活质量尤为重要[18-19]。常使用的胫骨近端重建的方法:骨关节异体移植物,假体-异体移植物重建,肿瘤假体重建,腓肠肌内侧头皮瓣覆盖等[20-21]。
讨 论
膝关节周围组织的解剖给恶性或良性肿瘤切除后的重建带来挑战。股骨远端肌肉附着不多,血管和神经位于骨后方的软组织内,股骨远端的切除常不涉及其区间。切除后重建也较易。股骨远端病变的切除更不涉及伸膝装置。不同于股骨远端,胫骨近端解剖对重建存在明显限制。窝内神经血管束紧邻胫骨近端,外侧还有腓总神经走形。相对缺乏软组织覆盖,影响伸膝装置重建。窝远端缺乏像肌的天然屏障阻碍肿瘤的侵袭,使得病变更易于进入小腿的间室内。
对于胫骨近端肿瘤,保肢术仍然是治疗首选方案。由于其解剖结构的特殊性,解剖功能的重建面临各方面影响因素。在保证肿瘤扩大切除的前提下,尽量保留患肢功能成为关键。所检索的文献中并无证据级别高的随机对照研究。各种类型重建方案各有利弊。报道所偏向的术式也有相应证据支持。好的术后功能,低的失败率和截肢率是主要评估指标。肿瘤的累及、手术切除程度、骨重建的选择都是影响修复方法的关键因素。伸膝装置软组织的重建修复包括肌瓣转位 ( 最常见腓肠肌内侧头 ),自体肌腱移植物 ( 缝匠肌,股二头肌 ),腓骨肌转位,直接将髌韧带固定于假体或移植物上。近期报道更强调生物性重建。其具有假体材料的持久性,低的近期失败率和感染率。但在这些文献回顾中发现并没有随机对照试验,大多数为回顾性研究,病例报道或对复杂重建术所存在问题的分析。
一、经典假体重建
肿瘤假体置换最为普遍,常作为优先考虑方式。具有材质较易获得,术后可早期承重等优点。伸膝装置重建的问题在于应用假体时如何将韧带固定于其金属面上。固定的方法包括:应用螺钉或缝线直接固定在假体上;合成材料;应用周围组织转位形成生物重建。许多胫骨假体表面设计有凹槽或套在骨-假体面,以利于骨长入增强机械力。
大量回顾性研究报道直接假体重建的长期使用寿命和保肢率。Ham 等[9]回顾所在中心 32 例假体置换患者的使用情况和保肢率。10 年假体仍可使用的病例占到 50%~60%,而保肢率能达到80%~90%。Malawer 等[8]报道的 10 年假体 67% 仍可使用,保肢率在 89%。但行广泛关节外胫骨近端肿瘤切除后全膝关节置换术,重建的髌韧带易发生冠状面的撕裂[22]。尤其在用螺钉直接将韧带固定在胫骨假体前方多空衬垫上的时候。虽然部分患者功能评估时仍具有主动伸膝的作用力,但多数会出现伸膝延迟的现象。X 线上显示韧带完好的患者多能获得满意的功能。常见的并发症主要是伤口感染。对患者而言,这种灾难性的并发症需要二期清创处理,带血管肌瓣转位或膝上截肢。无菌性松动和假体本身的失败常需要二期翻修。虽然数据呈现良好的假体情况和保肢手术的有效性,但高的翻修率也同样显著。近期研究显示定制假体在使用方面有了明显改善[14,23]。通过术前 X 线片和核磁设计手术切除范围及假体大小,使定制假体与宿主关节高度匹配[12]。
纺织材料如聚乙烯对酞酸酯的使用起到连接髌韧带与假体间空隙的作用,为伸膝装置提供稳定的机械固定[10]。Hobusch 等[24]报道 LARS 韧带应用于肿瘤切除后伸膝装置的替代。术后平均屈曲度为103°。研究并未发现使用 LARS 韧带会增加术后感染的风险。但在失败病例中发现韧带与假体之间并未达到愈合指标,仅有瘢痕形成。这往往是导致最后断裂的原因。Gosheger 等[10]介绍一种人工关节囊将肌肉软组织与假体连接在一起,保护伸膝装置避免脱位的发生。
为了克服愈合不良的问题,Bickels 等[25]和Malawer 等[26]提出了生物性模式固定。应用 Dacron tape 连接髌韧带与假体,提供直接的机械固定。Malawer 同时还结合了腓肠肌内侧头转位。Bickels使用了两种生物固定方式:自体骨移植于髌韧带-假体表面;带蒂腓肠肌内侧头转位覆盖。术中将腓肠肌内侧头从肌肉-肌腱处分离旋转,覆盖在胫骨近端,用缝线固定在髌韧带和股四头肌之间。这种连接方式能提供:( 1 ) 直接机械固定;( 2 ) 伸膝装置的生物加固;( 3 ) 带血管组织降低感染风险,促进愈合。Thorsten 等[13]直接将腓肠肌内侧头转位进行重建。研究选用 Blackburne-Peel 对结果进行评价[27]。研究发现髌韧带的增长能反映髌骨高度的增加,这多发生在术后 2 年内。但不影响关节的稳定;髌骨高度增加后 MSTS 评分会降低;髌骨高度与主动伸膝延迟相关。Pendegrass 等[28]使用自体移植物在髌韧带-假体交界面,术后 12 周出现类似正常韧带长入。生物性重建强调功能性韧带置入表面以获得稳定的机械固定。在平均超过 6 年随访过程中大部分患者表现出不错的功能。本组患者伸膝延迟对日常活动无明显限制。随后也有相关研究报道良好长期假体生存和功能[29]。
Coombs 等将髌韧带与带血管蒂的腓骨相连,作为胫骨近端骨肉瘤切除后重建[30]。下肢利用腓骨的重建一直受到骨重建或关节融合的限制。带血管的腓骨能提供良好生物重建,再联合带血管的肌瓣覆盖假体。术中将腓血管供应的腓骨转到胫骨中段,在近端钻孔,用不可吸收线缝合韧带。术后随访未发现伸膝延迟。Petschnig 等[31]比较腓骨转位联合髌韧带缝合于股二头肌腱与腓肠肌转位。带血管腓骨瓣利于韧带长入愈合,在假体上形成坚强的锚定作用。假体起到关节主要稳定作用,而腓骨转位作为假体与伸膝装置的桥接,改善膝关节功能。
胫骨近端肿瘤假体均设计有固定韧带的地方,但其髌韧带-金属连接较薄弱,易导致韧带的断裂。这与重建的失败率成相关性。进一步研究显示许多患者留有明显伸膝延迟。直接固定伸膝装置的患者 9%~33% 有超过 20° 的延迟。
二、自体移植物-假体重建
自体移植物-假体有利于改善使用寿命和关节稳定性[16]。但其应用的报道并不广泛,远期随访观察也不尽人意,自体移植物和伸膝结构失败率较高[32]。比较性研究更支持单一假体的重建,其失败率比自体移植物-假体重建要低。骨折,部分溶解,感染最后都使得伸膝结构的失败。其中感染是限制该技术应用的主要因素[15]。
三、生物重建
与其它方法相比,骨关节或自体移植物重建具有其优势。肿瘤切除后重建组织直接对接宿主韧带,关节囊,提供良好关节稳定。宿主髌韧带固定在胫骨近端移植物上更趋于解剖重建。肌瓣转位起到增强修复作用,能覆盖在移植物表面,降低感染风险,利于愈合。最常用的肌瓣为腓肠肌内侧头。Muscolo 等[33-34]使用自体移植物重建伸膝结构,术后影像显示无不愈合情况。超过 20 年随访功能分析,患者对治疗疗效满意,走路并不受到限制。没有患者因骨不连而需二次手术截骨。部分患者在术后发生移植物的骨折,采用髓内钉固定。随访过程中未发现有感染的病例。但另一些文献认为使用自体移植物具有高并发症风险[35]。例如感染,骨不连,骨折,移植物不稳等。一些并发症可能导致移植的失败,二期手术取出[36]。骨关节移植还面临关节软骨退化的问题[37]。长期关节磨损,骨性关节炎影响患者功能活动。虽然生物重建被认为能提供长期满意的疗效,但在报道中表明移植物的使用并不能完全解决肿瘤切除后骨缺损的问题。同时其高骨折,感染风险使患者不得不面临移植物取出再植入或者截肢的选择。
重建术后发生伸膝装置断裂,也可选用生物性的重建二期进行补救。伸膝装置的断裂虽然相对少见,一旦发生对于全膝置换是灾难性并发症。髌韧带断裂较股四头肌腱常见。这不仅影响术后患者满意度,还增加再断裂的风险[11]。直接缝合修复往往是不可靠的,腓肠肌内侧头或部分跟腱转位缝合作为替代物以获得稳定功能[38]。
总结这些重建方法,并没有哪一种技术表现出明显的优越所在,还有待进一步研究确认。同时患者病情的复杂性,也给重建带来不同程度的影响。
[1]Malawer M. Surgical technique and results of limb sparing surgery for high grade bone sarcomas of the knee and shoulder[J]. Orthopedics, 1985, 8(5):597-607.
[2]Ene R, Sinescu RD, Ene P, et al. Proximal tibial osteosarcoma in young patients: early diagnosis, modular reconstruction[J]. Rom J Morphol Embryol, 2015, 56(2):413-417.
[3]Lindner NJ, Ramm O, Hillmann A, et al. Limb salvage and outcome of osteosarcoma. The University of Muenster experience[J]. Clin Orthop Relat Res, 1999, (358):83-89.
[4]Niimi R, Matsumine A, Hamaguchi T, et al. Prosthetic limb salvage surgery for bone and soft tissue tumors around the knee[J]. Oncology Reports, 2012, 28(6):1984-1990.
[5]Capanna R, Scoccianti G, Campanacci DA, et al. Surgical technique: extraarticular knee resection with prosthesisproximal tibia-extensor apparatus allograft for tumors invading the knee[J]. Clin Orthop Relat Res, 2011, 469(10):2905-2914.
[6]Holzapfel BM, Pilge H, Toepfer A, et al. Proximal tibial replacement and alloplastic reconstruction of the extensor mechanism after bone tumor resection in German[J]. Oper Orthop Traumatol, 2012, 24(3):247-262.
[7]Mavrogenis AF, Angelini A, Pala E, et al. Reconstruction of the extensor mechanism after major knee resection[J]. Orthopedics, 2012, 35(5):672-680.
[8]Malawer MM, Chou LB. Prosthetic survival and clinical results with use of large-segment replacements in the treatment of high-grade bone sarcomas[J]. J Bone Joint Surg Am, 1995, 77(8):1154-1165.
[9]Ham SJ, Schraffordt Koops H, Veth RP, et al. Limb salvage surgery for primary bone sarcoma of the lower extremities: long-term consequences of endoprosthetic reconstructions[J]. Ann Surg Oncol, 1998, 5(5):423-436.
[10]Gosheger G, Hillmann A, Lindner N, et al. Soft tissue reconstruction of megaprostheses using a trevira tube[J]. Clin Orthop Relat Res, 2001, 393(1):264-271.
[11]Dobbs RE, Hanssen AD, Lewallen DG, et al. Quadriceps tendon rupture after total knee arthroplasty. Prevalence, complications, and outcomes[J]. J Bone Joint Surg Am, 2005, 87(1):37.
[12]Wenzhi Bi, Wei Wang, Gang Han, et al. Osteosarcoma Around the Knee Treated With Neoadjuvant Chemotherapy and a Customdesigned Prosthesis[J]. Orthopedics, 2013, 36(4):444-450.
[13]Jentzsch T, Erschbamer M, Seeli F, et al. Extensor function after medial gastrocnemius fl ap reconstruction of the proximal tibia[J]. Clin Orthop Relat Res, 2013, 471(7):2333-2339.
[14]Rahman J, Hanna SA, Kayani B, et al. Custom rotating hinge total knee arthroplasty in patients with poliomyelitis affected limbs[J]. Int Orthop, 2015, 39(5):833-838.
[15]Albergo JI, Gaston CL, Aponte-Tinao LA, et al. Proximal Tibia Reconstruction After Bone Tumor Resection: Are Survivorship and Outcomes of Endoprosthetic Replacement and Osteoarticular Allograft Similar[J]? Clin Orthop Relat Res, 2016, 475(3):676-682.
[16]Baptista PP, Bannwart CL, Batista FA, et al. Proximal tibial reconstruction with auto transplantation of the fi bular growth plate: two case reports, describing the surgical technique[J]. Springerplus, 2016, 20(5):490.
[17]Jeon DG, Kawai A, Boland P, et al. Algorithm for the surgical treatment of malignant lesions of the proximal tibia[J]. Clin Orthop Relat Res, 1999, (358):15-26.
[18]Aksnes LH, Bauer HC, Jebsen NL, et al. Limb-sparing surgery preserves more function than amputation: a Scandinavian sarcoma group study of 118 patients[J]. J Bone Joint Surg Br, 2008, 90(6):786-794.
[19]Rougrav BT, Simon MA, Kneisl JS, et al. Limb salvage compared with amputation for osteosarcoma of the distal end of the femur[J]. J Bone Joint Surg, 1994, 76(5):649-655.
[20]Louer CR, Garcia RM, Earle SA, et al. Free fl ap reconstruction of the knee: an outcome study of 34 cases[J]. Ann Plast Surg, 2015, 74(1):57-63.
[21]Ayerza MA, Aponte-Tinao LA, Abalo E, et al. Continuity and function of patellar tendon host-donor suture in tibial allograft[J]. Clin Orthop Relat Res, 2006, (450):33-38.
[22]Capanna R, Scoccianti G, Campanacci DA, et al. Surgical technique: extraarticular knee resection with prosthesisproximal tibia-extensor apparatus allograft for tumors invading the knee[J]. Clin Orthop Relat Res, 2011, 469(10):2905-2914.
[23]Groundland JS, Ambler SB, Houskamp LD, et al. Surgical and Functional Outcomes After Limb-Preservation Surgery for Tumor in Pediatric Patients: A Systematic Review[J]. JBJS Rev, 2016, 4(2).
[24]Hobusch GM, Funovics PT, Hourscht C, et al. LARS® band and tube for extensor mechanism reconstructions in proximal tibial modular endoprostheses after bone tumors[J]. Knee, 2016, 23(5):905-910.
[25]Bickels J, Wittig JC, Kollender Y, et al. Distal femur resection with endoprosthetic reconstruction: a long-term followup study[J]. Clin Orthop Relat Res, 2002, (400):225-235.
[26]Malawer MM, Price WM. Gastrocnemius transposition Xap in conjunction with limb-sparing surgery for primary bone sarcomas around the knee[J]. Plast Reconstr Surg, 1984, 73: 741-750.
[27]Blackburne JS, Peel TE. A new method of measuring patellar height[J]. J Bone Joint Surg Br, 1977, 59(2):241-242.
[28]Pendegrass CJ, Oddy MJ, Cannon SR, et al. A histomorphological study of tendon reconstruction to a hydroxyapatitecoated implant: regeneration of a neo-enthesis in vivo[J]. J Orthop Res, 2004, 22(6):1316-1324.
[29]Anract P, Missenard G, Jeanrot C, et al. Knee reconstruction with prosthesis and muscle fl ap after total arthrectomy[J]. Clin Orthop, 2001, (384):208-216.
[30]Kotz R, Engel A. Cement-free design of a tumor prosthesis for osteosarcoma of the distal femur and proximal tibia with a new fi xation technique for the ligamentum patellae. In: Chao E, Ivins J (eds) Tumor prostheses for bone and joint reconstruction[M]. Thieme- Stratton Incl, New York. 1983: 399-408.
[31]Petschnig R, Baron R, Kotz R, et al. Muscle function after endoprosthetic replacement of the proximal tibia Different techniques for extensor reconstruction in 17 tumor patients[J]. Acta Orthop Scand, 1995, 66(3):266-270.
[32]Dennis DA. The structural allograft composite in revision total knee arthroplasty[J]. J Arthroplasty, 2002, 17(4 Suppl 1): S90-93.
[33]Muscolo DL, Ayerza MA, Aponte-Tinao LA, et al. Use of distal femoral osteoarticular allografts in limb salvage surgery. Surgical technique[J]. J Bone Joint Surg Am, 2006, 88(Suppl 1 Pt2):305-321.
[34]Muscolo DL, Petracchi LJ, Ayerza MA, et al. Massive femoral allografts followed for 22 to 36 years. Report of six cases[J]. J Bone Joint Surg Br, 1992, 74(6):887-892.
[35]Peel T, May D, Buising K, et al. Infective complications following tumour endoprosthesis surgery for bone and soft tissue tumours[J]. EJSO, 2014, 40(9):1087-1094.
[36]Mankin HJ, Doppelt SH, Sullivan TR, et al. Osteoarticular and intercalary allograft transplantation in the management of malignant tumors of bone[J]. Cancer, 1982, 50(4):613-630.
[37]Muscolo DL, Ayerza MA, Aponte-Tinao LA, et al. Use of distal femoral osteoarticular allografts in limb salvage surgery[J]. J Bone Joint Surg Am, 2005, 87(11):2449-2455.
[38]Jaureguito JW, Dubois CM, Smith SR, et al. Medial gastrocnemius transposition fl ap for the treatment of disruption of the extensor mechanism after total knee arthroplasty[J]. J Bone Joint Surg Am, 1997, 79(6):866.
( 本文编辑:裴艳宏 )
Cases report and literature review of extensor mechanism reconstruction after proximal tibia prosthesis arthroplasty
HUANG Jun-qi, BI Wen-zhi, HAN Gang, JIA Jin-peng, XU Meng, WANG Wei. Department of Orthopaedics, Chinese PLA General Hospital, Beijing, 100853, China
BI Wen-zhi, Email: biwenzhi@sina.com
ObjectiveTo compare the clinical results of different extensor mechanism reconstruction techniques after proximal tibia prosthesis replacement. Methods From January 2012 to January 2014, the patients who received proximal tibia tumor resection, prosthesis replacement and extensor mechanism reconstruction were enrolled. Joint function and complications were assessed after the surgery. Associated manuscripts were searched in PubMed, Springer, Ovid, LWW and EMBASE, with the tibia, neoplasm and arthroplasty as the key words. Relevant articles were included and discussed. Results A total of 32 patients met the requirements, who all received prosthesis replacement. Extensor lag was noticed in 5 patients and infection in 2 patients during the follow-up. Nine articles were in accordance with the criteria, including 362 cases with osteosarcoma, 26 cases with chondrosarcoma, 21 cases with Ewing sarcoma, 21 cases with giant cell tumor of bone and 25 cases with soft tissue sarcoma. There were 272 cases receiving traditional prosthesis replacement, 2 cases receiving autograft replacement and 24 cases receiving biological reconstruction. After the surgery, extensor lag was found in 29 cases, infection in 39 cases, ligament rupture in 24 cases, relapse in 25 cases and prosthesis failure in 133 cases. Conclusions With extensor mechanism reconstruction, joint function can be restored but with a lot of postoperative complications. Through the comparison of different reconstruction techniques, no obvious advantages can be found in a single one. Nowadays, biological reconstruction is gaining more and more attention and can be used to improve the function.
Bone neoplasm; Arthroplasty, replacement, knee; Tibia; Patellar ligament
10.3969/j.issn.2095-252X.2017.03.010
R738.1, R687.3
100853 北京,解放军总医院骨科
毕文志,Email: biwenzhi@sina.com
2016-08-25 )

