玉米穗下节间长的杂种优势位点解析
李慧敏,李卫华,郭海平,刘坤,张向歌,张晓祥,谢惠玲,汤继华,丁冬
(河南农业大学农学院/省部共建小麦玉米作物学国家重点实验室,郑州450002)
玉米穗下节间长的杂种优势位点解析
李慧敏,李卫华,郭海平,刘坤,张向歌,张晓祥,谢惠玲,汤继华,丁冬
(河南农业大学农学院/省部共建小麦玉米作物学国家重点实验室,郑州450002)
【目的】穗下节间长决定着玉米的株高和穗位高 2个重要的农艺性状,并与产量、抗倒性等性状密切相关。前期研究发现玉米穗下第7、8、9节间长对穗位高具有决定作用,并表现出较强的杂种优势。文章拟解析玉米穗下节间长,尤其是穗下第7、8、9节间长杂种优势的决定因子,为全面了解和应用杂种优势奠定基础。【方法】利用以lx9801为遗传背景的昌7-2染色体单片段代换系(single segment substitution lines, SSSL)为基础材料,分别与优良自交系郑58和浚9058构建了两套测交群体,通过两年两点试验对玉米第7、8、9节间长进行杂种优势位点分析。【结果】利用SSSL×郑58测交群体和SSSL×浚9058测交群体通过两年两点试验发现,2012年在浚县的第7、8、9节间长的中亲优势值分别为57.25%和78.16%、68.30%和75.04%、59.48%和62.85%;2012年在长葛的第7、8、9节间长的中亲优势值分别为48.27%和63.02%、43.36%和54.80%、37.26%和42.62%;2013年在浚县的第7、8、9节间长的中亲优势值分别为23.01%和37.00%、22.69%和35.65%、22.20%和34.74%;2013年在长葛的第7、8、9节间长的中亲优势值分别为21.86%和33.19%、20.99%和35.57%、27.55%和42.19%;共定位了18个和18个第7节间长杂种优势位点,20个和23个第8节间长杂种优势位点,17个和19个第9节间长杂种优势位点。2个测交群体第7、8、9节间长相同的HL分别有3个、3个和1个,共有7个HL相同,分别占2个总测交群体中HL数的12.7%和11.6%。【结论】在SSSL×郑58群体定位的第7、8、9节间长HL与SSSL×浚9058群体的定位结果相比仅有7个(6%)相同位点,说明不同群体之间的杂种优势位点差别较大,几乎没有相同的杂种优势位点,推测在不同遗传背景下控制同一性状的杂种优势位点并不相同,据此推论,在单基因水平上,杂种优势位点表现出杂交组合(遗传背景)特异的特征。
玉米;单片段代换系;穗下第7、8、9节间长;杂种优势
0 引言
【研究意义】迄今为止,对杂种优势形成的遗传机理仍处于假说阶段,究其原因,一方面因为杂种优势这种相对复杂的遗传现象是受很多因素制约的;另一方面,与其亲本相比,杂交种在诸多方面均表现出杂种优势,从而消除不同性状之间的相互影响是很难的。因此,只有不同性状间的相互影响加以消除,精确度量单一性状杂种优势的表型数据,才能从根本上解析杂种优势形成的分子机理,为农作物遗传改良和新品种选育提供重要的理论支撑[1]。育种实践证明,不同穗下节间长表现出显著的杂种优势,因此,解析玉米穗下不同节间长杂种优势的遗传机理,可以为抗倒伏玉米新品种的选育提供理论依据。【前人研究进展】杂种优势是一个复杂的生物学现象,有多种决定因素[2]。科学家们通过数量遗传学、分子遗传学、基因组学以及生理生化方面等不同手段来研究杂种优势机理,先后提出并被大家广泛认可的几种假说:显性假说[3-4]、超显性假说(又叫等位基因异质结合假说)[5-6]、上位性假说[7-8]。杂种优势是生物界一种重要的遗传现象,在提高农作物产量和品质中得到了广泛应用,已广泛应用于玉米[9-11]、水稻[12-14]、油菜[15]等大田作物以及部分蔬菜作物[16]中,并取得了重大成功,如杂交水稻和杂交玉米的应用[17-19]。尽管杂种优势的利用已经取得了非常显著的成效,然而,对于杂种优势产生的生理生化基础和遗传学机理,迄今为止还并不十分清楚[20]。由于不同性状之间杂种优势可能存在不同的遗传机制,因此,针对不同性状剖析杂种优势对全面解析杂种优势的遗传机理具有重要意义。赵鹏等[1]对 3个优良玉米杂交种郑单958(郑58×昌7-2)、豫玉22(综3×豫87-1)和浚单20(浚9058×浚928)不同穗下节间长的杂种优势分析可以看出,不同穗下节间长的杂种优势存在显著差异,穗下第7、8、9节间长具有较强的杂种优势,其中,第9节间的杂种优势大于第8节间,第7节间的杂种优势最小。王玉民等[21]将单片段代换系(single segment substitution lines,SSSL)定义为高级作图群体,即通过多代回交且进一步自交并结合分子标记辅助选择的方法,筛选到与受体亲本在遗传背景上只有一个代换片段的差异的品系。具体步骤是将供体亲本与受体亲本杂交获得F1。以受体亲本作为轮回亲本,经过多代回交并进一步自交获得BCnFn,从BCnFn中鉴定单片段代换系。尚爱兰[22]构建了以郑58为背景的昌7-2的SSSL,其中有5个SSSL具有穗行数的超亲优势,2个SSSL具有百粒重超亲劣势,1个SSSL同时具有穗行数的超亲优势和百粒重超亲劣势。【本研究切入点】玉米的穗下节间长对抗倒伏与产量具有很大的影响,穗位以下节间长的缩短,可以增强玉米的抗倒伏能力[23]。目前,对玉米株高、穗位高等农艺性状的相关报道较多[24-27],但对穗下节间长的研究很少,而穗下第7、8、9节间长度的增加有利于雌穗分化,进而发育成大穗而增加粒重[28]。前期育种实践证明,玉米第7、8、9节间是玉米穗下节间长度变异最大的节间[29],对玉米穗位高影响最为明显,而穗位高又与玉米的抗倒伏性密切相关。因此,了解玉米第7、8、9节间的生长发育机制及其杂种优势形成的遗传机理对玉米育种实践具有重要意义。【拟解决的关键问题】本研究利用以lx9801背景的昌7-2染色体单片段代换系以及其与郑58、浚9058构建的测交群体,通过两年两点的田间试验对玉米穗下不同节间长在不同遗传背景下的杂种优势形成的遗传机理进行研究。
1 材料与方法
1.1 研究材料
以lx9801为轮回亲本,昌7-2为供体亲本构建的单片段代换系为基础材料。该群体是以昌7-2为供体亲本、lx9801为受体亲本,通过多代回交及自交,并结合200对亲本间差异性SSR分子标记辅助筛选构建而成,覆盖玉米全基因组约35%,其中包含2012年76份及2013年184份纯合的单片段代换系,分别与自交系郑58和浚9058杂交构建成相应的测交群体。
1.2 田间试验设计
2012年、2013年分别于河南省长葛市试验田和鹤壁市农业科学院试验田(河南浚县)种植 SSSL群体、SSSL×郑58测交群体、SSSL×浚9058测交群体及亲本(lx9801、昌7-2、郑58、浚9058)和对照(lx9801×郑58、lx9801×浚9058),田间试验材料按照随机区组设计,每个试验地点3个重复,单行区,行长3 m,行距0.6 m,株距0.25 m,田间常规管理。
1.3 性状调查
在玉米的不同生长季节分别于5叶期、10叶期对所有试验材料进行叶片标记,在玉米灌浆末期每一行选取10株正常生长的植株调查第7、8、9节间长。第7、8、9节间长为从玉米植株基部向上数的第7、8、9节间的长度。
1.4 数据处理与分析
采用SPSS18.0统计软件,对两年两点试验材料的第7、8、9节间长进行统计。加性效应值[30]=(SSSL表型值-lx9801表型值)/2,表型变异[31]=加性效应值/lx9801表型值×100%。SSSL测交群体分别以各试验点lx9801×郑58(浚9058)的观测值作为对照,通过方差分析和t测验对应比较SSSL×郑58(浚9058)与相应对照之间的差异,在P≤0.05的显著水平下认为存在一个相关性状的杂种优势位点(heterotic loci,HL)。用超标优势表示杂种优势效应,超标优势[32]={SSSL×郑58(浚9058)表型值-对照lx9801×郑58(浚9058)表型值)}/对照lx9801×郑58(浚9058)表型值。
杂种优势位点命名则以hi(i=1、2,分别表示SSSL与郑58、浚9058测交群体)+性状英文缩写+染色体序号+位点序号(如a,b,c…),如果一条染色体上仅有一个杂种优势位点则表示为:h+性状英文缩写+染色体序号。
2 结果
2.1 玉米SSSL测交群体的穗下第7、8、9节间长及其杂种优势的表型分析
构建SSSL群体的受体亲本lx9801株高较高,叶片细长,雄穗主轴较长而分枝数少;供体亲本昌 7-2配合力高、株型紧凑、叶片短而宽大、叶夹角较小呈扇形、雄穗主轴较短而分支数多。如图1所示,在4个试验环境中,亲本lx9801的第7、8、9节间长明显大于亲本昌7-2。

图1 lx9801和昌7-2第7、8、9节间长的植株表型Fig. 1 The plant performance of the 7th, 8th, and 9th internode length of lx9801and chang7-2
同一环境条件下SSSL测交群体第7、8、9节间长均表现出一定的变异(表1),测交群体的平均值与对照的表型值基本一致,如 2013年长葛点 SSSL ×郑58群体第7、8、9节间长的变异范围分别是6.28—10.5 cm、9.07—13.16 cm和11.39—15.96 cm,群体平均值和对照lx9801×郑58表型值分别为8.78和8.94 cm、11.01和10.91 cm及13.75和13.66 cm。自交系郑58、浚9058的第7、8、9节间长田间表现不同,如2012年浚县点郑58和浚9058的第7、8、9节间长分别为4.89和4.77 cm、7.41和7.19 cm、8.29和8.42 cm。
比较lx9801、郑58、浚9058及田间观测值,可以看到lx9801×郑58和lx9801×浚9058均表现出显著的杂种优势,如2013年长葛点2个杂交种穗下第7节间长的中亲优势值分别为23.65%和35.02%,第8
节间长的中亲优势值分别为19.66%和35.40%,第9节间长的中亲优势值分别为 26.87%和 40.00%(表1)。同样对于测交群体 SSSL×郑 58、SSSL×浚9058表现出杂种优势,不同SSSL系杂交组合能使群体表现出不同变异,如2013年长葛点2个杂交种穗下第 7节间长的中亲优势值分别为 21.86%和33.19%,第8节间长的中亲优势值分别为20.99%和35.57%,第9节间长的中亲优势值分别为27.55%和42.19%。
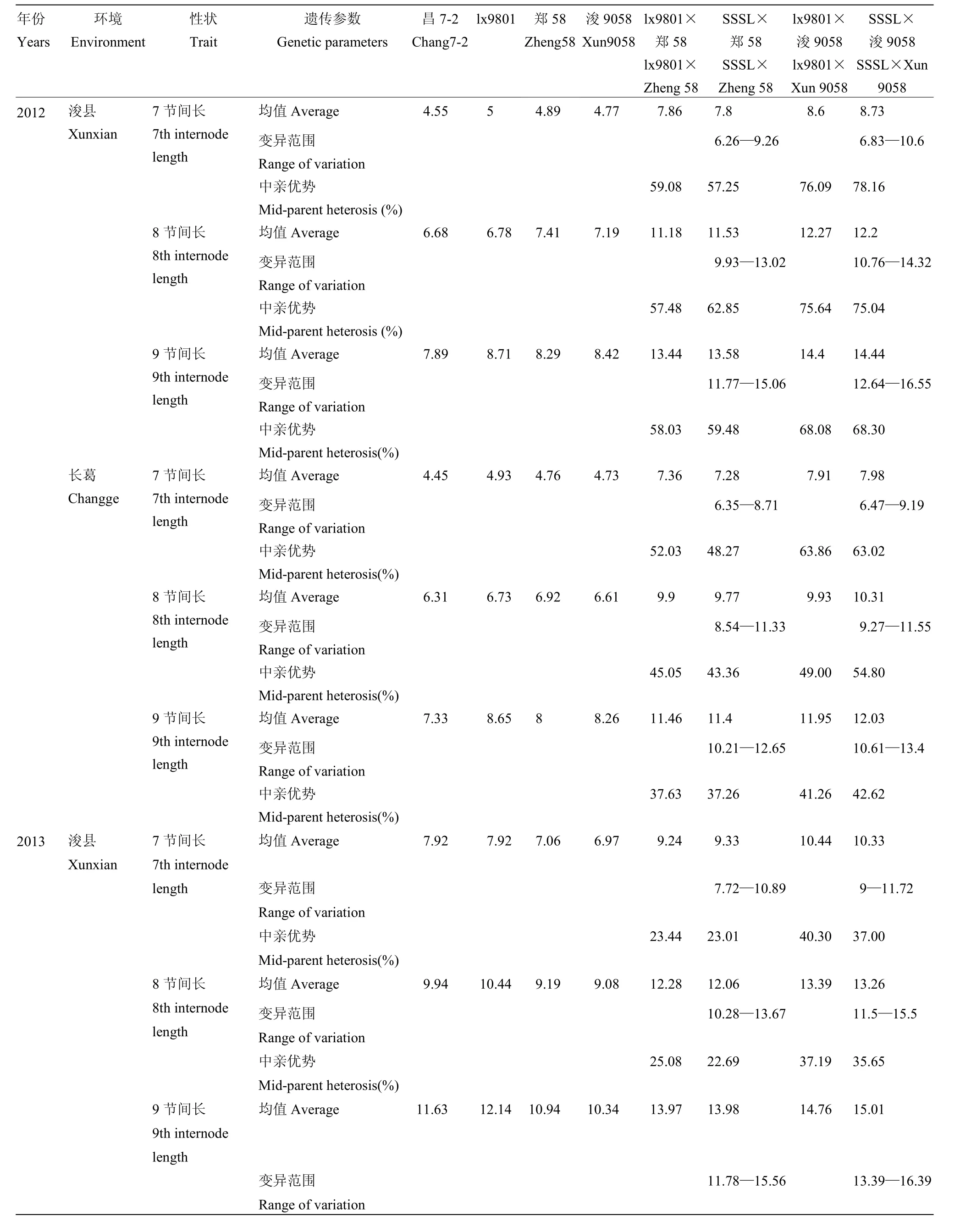
表1 亲本及SSSL测交群体7、8、9节间长田间表现Table 1 Performance of the 7th, 8th, and 9th internode length of parents and SSSL population
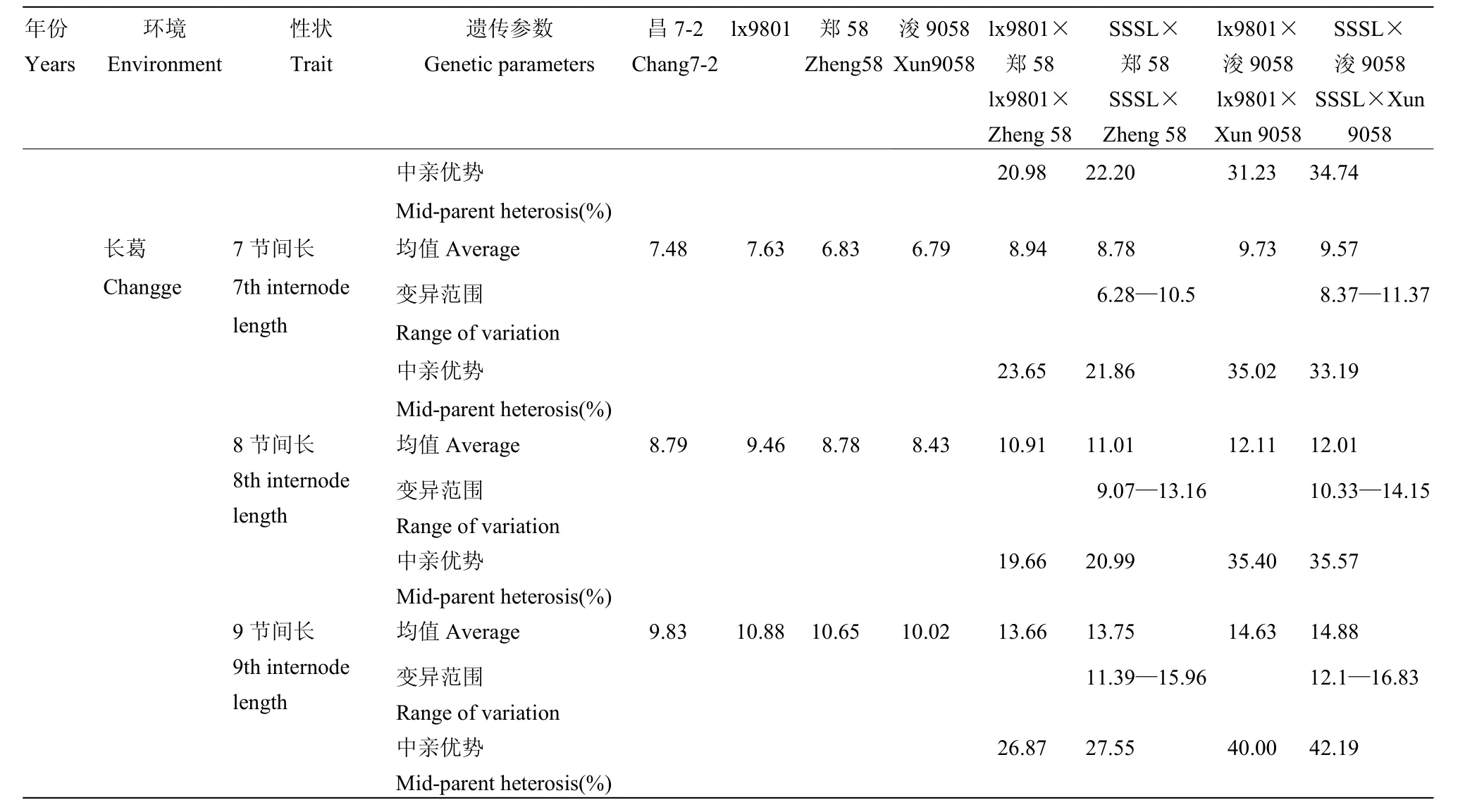
续表1 Continued table 1
2.2 玉米穗下第7、8、9节间长的杂种优势位点分析
在两年两点试验中,利用SSSL×郑58的测交群体共定位了18个玉米穗下第7节间长的HL(表2),其中,2012年浚县和长葛各定位出5个HL,2013年浚县和长葛分别鉴定出6和8个HL,在玉米第1、2、3、4、5、6、7、9染色体上均有分布。单片段代换系为S172 与郑58的测交后代同时在2012年浚县、长葛和 2013年长葛 3个环境检测到一个共同的HLh1SIL9,可以使穗下第7节间长的超标优势分别减低18.62%、14.71%和15.29%。在2012年和2013年浚县点 2个环境条件下同时检测到一个共同的HLh1SIL2a,对应的单片段代换系为s19,超标优势为负,分别减小20.40%和15.87%。对2012年和2013年长葛点 2个环境条件下同时检测到一个共同的HLh1SIL6a,对应的单片段代换系依次为S121,超标优势为负,分别减低 13.63%和 12.68%。h1SIL5b和h1SIL7a同时在2012年浚县及长葛2个环境条件下被鉴定到,对应的单片段代换系为 s42和 s62,其中h1SIL5b超标优势为正,分别增加17.75%和13.54%;而 h1SIL7a的超标优势为负,分别减低 20.12%和12.00%。
在SSSL×郑58测交群体中共定位了20个玉米第8节间长的HL(表2),其中2012年浚县和长葛分别检测到6和5个HL,2013年分别在浚县和长葛鉴定到8和5个HL,分布在第1、3、4、5、6、7、9、10染色体上。在 2012年浚县、2012年长葛和 2013年长葛3个环境中同时检测到一个共同的HLh1EIL4,其对应的单片段代换系为s38,可以使第8节间长超标优势分别减低6.09%、6.08%和7.24%。在2012年长葛和2013年浚县2个环境中同时检测到一个共同的HLh1EIL1c,其对应的单片段代换系为 S32,可以使超标优势分别减低8.33%和10.86%;在2012年和2013年浚县 2个环境中同时检测到一个共同的HLh1EIL9c,其对应的单片段代换系为S172,表现为负的超标优势,分别减低11.12%和7.69%。
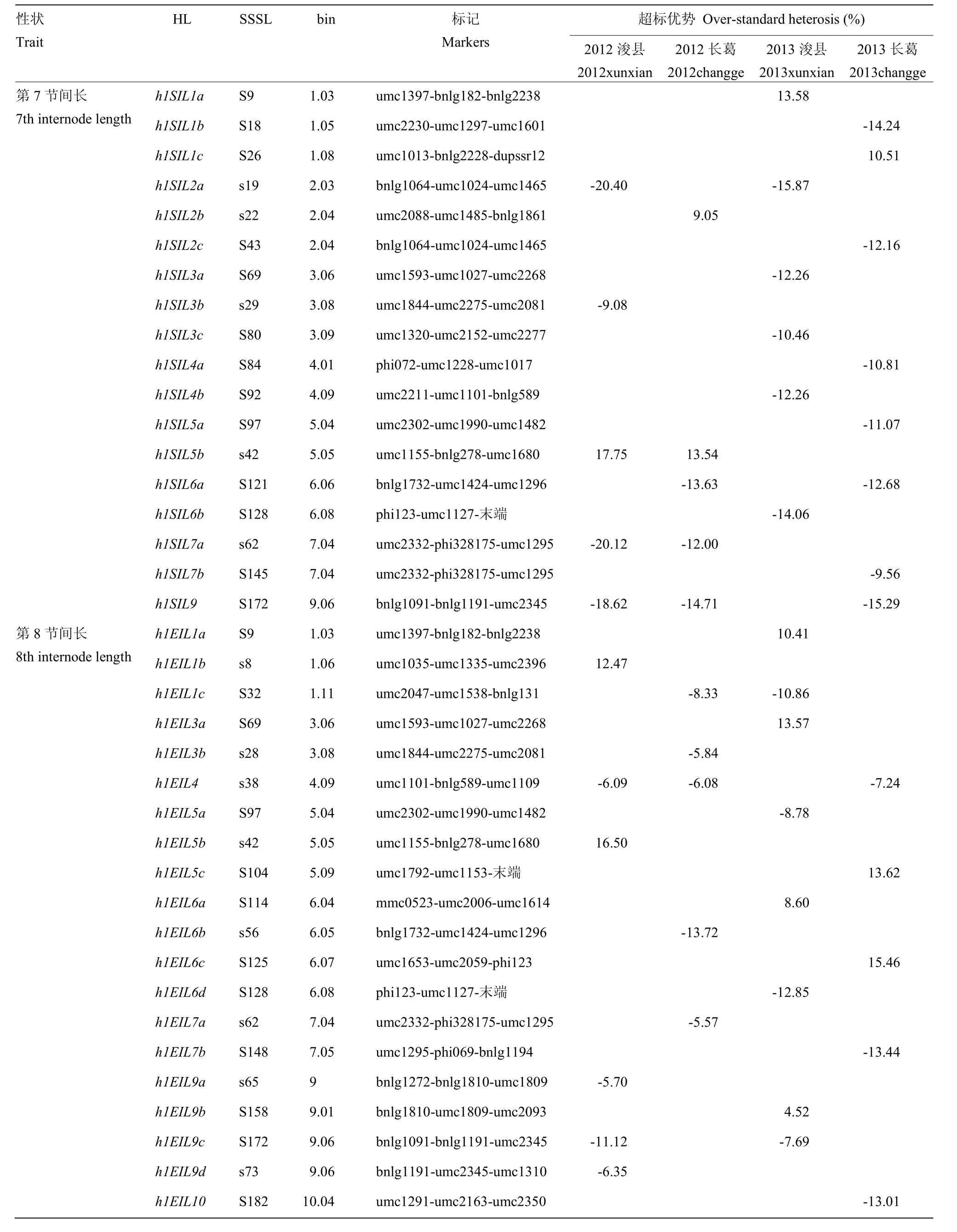
表2 SSSL×郑58测交群体第7、8、9节间长HL分析Table 2 HL analysis for the 7th, 8th, 9th internode length in SSSL×Zheng58 test population

续表2 Continued table 2
第9节间长共定位了17个HL,其中2012年浚县和长葛分别检测到6和4个HL(表2),2013年浚县和长葛分别定位了7和6个HL,主要分布在第1、2、3、4、5、6、7、9染色体上。同时在多个环境条件下鉴定出5个第9节间长HL,即h1NIL1a、h1NIL5a、h1NIL6b、h1NIL7b和h1NIL9b,其中h1NIL1a在2012年、2013年长葛和2013年浚县3个环境中被同时检测,其对应的单片段代换系为S9,可以使第9节间长超标优势分别增加4.77%、10.98%和11.85%;h1NIL5a和h1NIL6b在2012年和2013年浚县2个环境中被同时检测,其对应的单片段代换系分别为s42和s47,可以使超标优势分别减低 10.43%、5.53%和 6.02%、4.73%;h1NIL7b和h1NIL9b在2012年浚县和长葛2个环境中被同时检测,其对应的单片段代换系分别为s62和s73,可以使超标优势分别减低6.48%、7.16%和4.00%、8.67%。
SSSL×郑 58的测交群体在多个环境中共同检测到了第7、8、9节间长的共同杂种优势位点,如h1SIL1a、h1SIL5b和 h1SIL7a,相对应的的单片段代换系为S9、s42和s62;在第7和8节间长共同检测到的杂种优势位点有h1SIL3a、h1SIL5a、h1SIL6b和 h1SIL9,相对应的单片段代换系为 S69、S97、S128和S172;在第7和9节间长共同检测到的杂种优势位点有h1SIL1b、h1SIL2a和h1SIL2c,相对应的单片段代换系为S18、s19和S43;在第8和9节间长共同检测到的杂种优势位点有 h1EIL1b、h1EIL3b和h1EIL9d,相对应的单片段代换系为s8、s28和s73,表明第7、8、9节间长之间存在相同的杂种优势位点。
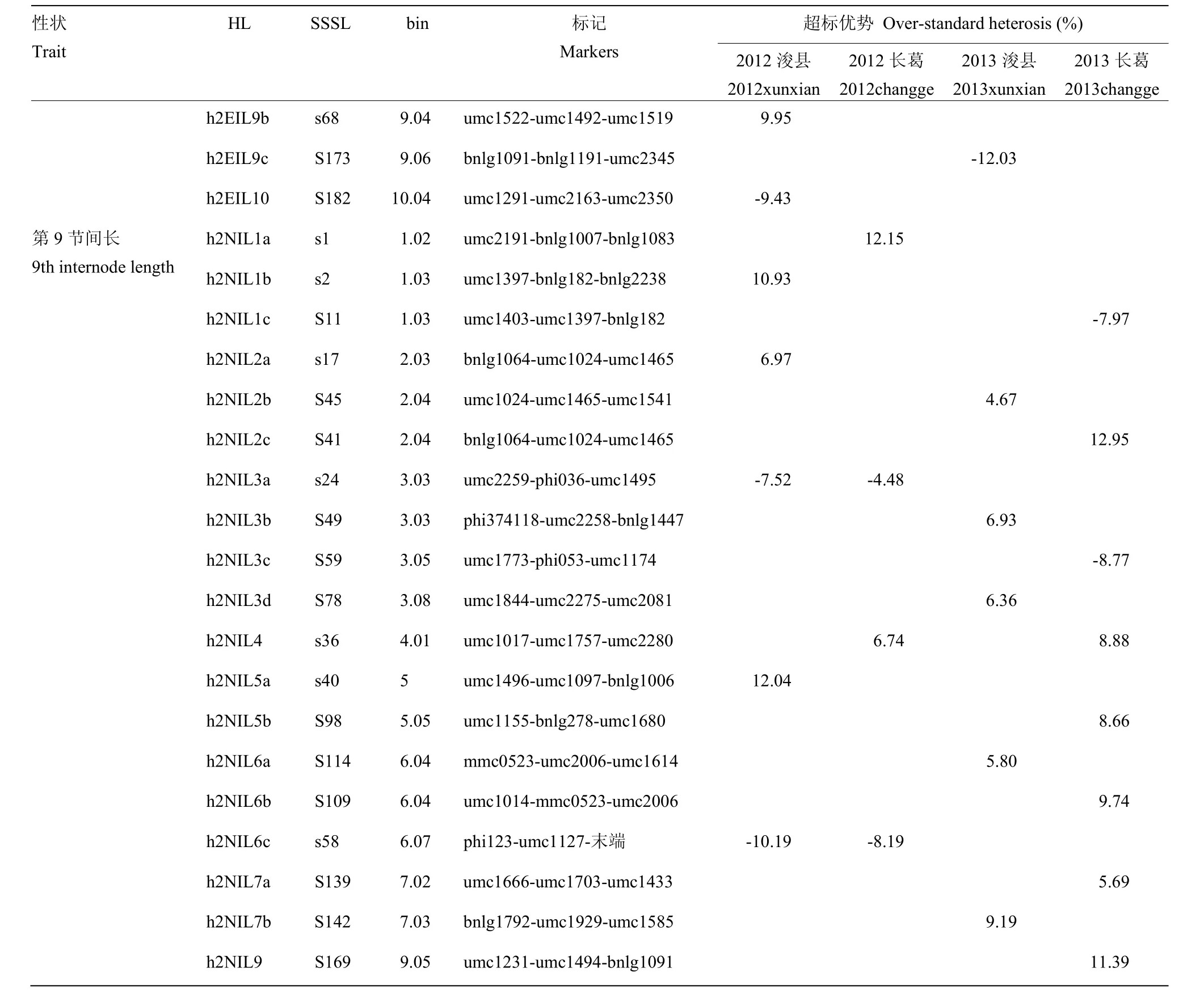
SSSL×浚9058的测交群体在两年两点间共定位了18个玉米穗下第7节间长的不同HL(表3),其中2012年浚县和长葛分别检测到了3和4个HL,2013年浚县和长葛分别鉴定了7和6个HL,分布在第1、2、3、4、5、6、7、8、9染色体上。单片段代换系为S21与浚9058的测交后代同时在2013年浚县和长葛2个环境检测到一个共同的 HLh2SIL1b,可以使穗下第 7节间长超标优势分别减低 11.17%和 7.19%。h2SIL4在2012年和2013年长葛2个环境中被重复鉴定到,其对应的单片段代换系 S86,可以使超标优势分别减低9.86%和8.56%。
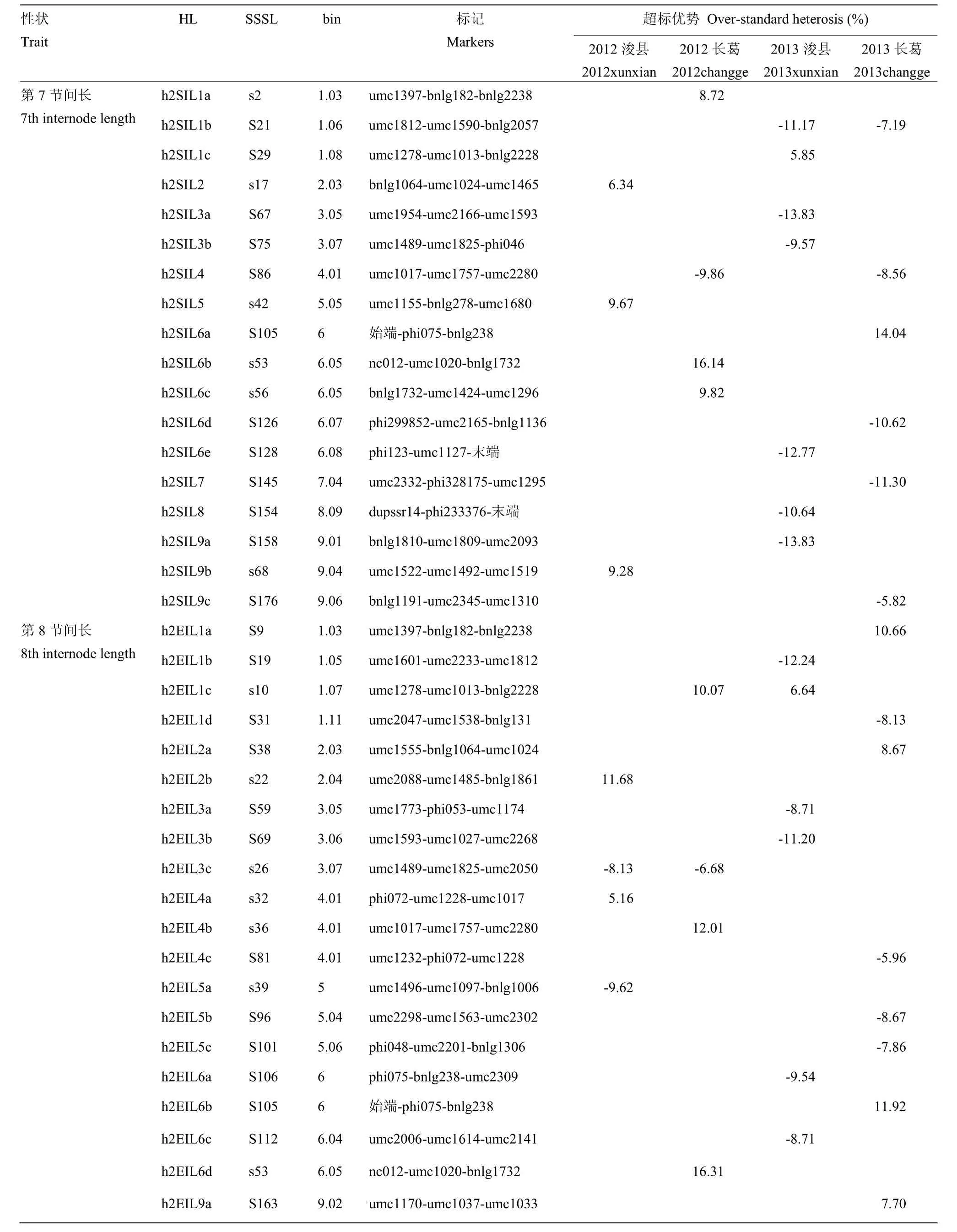
表3 SSSL×浚9058测交群体第7、8、9节间长HL分析Table 3 HL analysis for the 7th, 8th, and 9th internode length in SSSL×xun9058 test population
续表3 Continued table 3
在该群体中共鉴定了23个玉米第8节间长的不同HL(表3),其中2012年在浚县和长葛分别检测到了6和4个HL,2013年浚县和长葛分别鉴定了7和8个HL,分布在第1、2、3、4、5、6、9、10染色体上。h2EIL1c在2012年长葛和2013年浚县2个环境中被重复鉴定,其对应的单片段代换系 s10,超标优势为正值,分别增加10.07%和6.64%;h2EIL3c在2012年浚县和长葛2个环境条件下被同时检测到,其对应的单片段代换系 s26,超标优势为负值,分别减低8.13%和6.68%。
第9节间长共鉴定了19个不同的HL(表3),2012年浚县和长葛分别检测到5和4个HL,2013年浚县和长葛分别鉴定了5和8个HL,主要分布在第1、2、3、4、5、6、7、9染色体上。其中,只有h2NIL3a和h2NIL6c在2012年浚县和长葛2个试验环境中被同时检测到,对应的单片段代换系分别为s24和s58,可以使穗下第9节间长超标优势分别减低7.52%、4.48%和10.19%、8.19%;h2NIL4在2012年和2013年长葛2个试验环境中被同时检测到,对应的单片段代换系s36,超标优势为正值,可以使穗下第9节间长分别增加6.74%和8.88%。
部分单片段代换系与浚 9058组合同时在多个环境中共同检测到了第7、8、9节间长的杂种优势位点,如h2SIL6b,相对应的单片段代换系为s53;在第7和8节间长共同检测到的杂种优势位点有 h2EIL6b、h2EIL6d和h2EIL9b,相对应的单片段代换系为S105、s53和s68;在第7和9节间长共同检测到的杂种优势位点有h2SIL1a和h2SIL2,相对应的单片段代换系为s2和s17;在第8和9节间长共同检测到的杂种优势位点有h2EIL3a和h2EIL4b,相对应的单片段代换系为S59和s36,这些研究结果说明它们之间存在相同的杂种优势位点。
2个测交群体的HL定位结果相比可知,第7节间长相同的 HL对应的单片段代换系有 s42、S145和S128,第8节间长相同的HL对应的单片段代换系有S9、S69和S182,第9节间长相同的HL对应的单片段代换系有S139,共有7个HL相同,分别占总SSSL×郑58测交群体和SSSL×浚9058测交群体中HL数的12.7%和11.6%,说明对同一个性状,不同测交亲本之间杂种优势位点不同,猜测是因为杂种优势位点的复杂性引起的,导致不同群体之间的杂种优势位点是完全不同的,不同遗传类群间组合杂种优势位点不同。
3 讨论
本研究分析了穂下节间长杂种优势位点(HL)的结果,对于相同性状来说大部分 HL位点并不处于相同位点,这与郭小蛟等[33]利用单片段代换系定位产量及相关性状的杂种优势位点的研究结果一致,这说明杂种优势是一个复杂的遗传现象,而许多学者对其遗传机制进行了大量的研究[11,20,34-35],始终围绕着显性和超显性两大遗传假说,而两大假说的前提条件是杂种优势基因座位的存在。HE等[36]精细定位了水稻产量杂种优势相关 QTL位点qGY2-1,发现该座位杂合状态下产量及相关性状表现出超显性效应,qGY2-1具有控制水稻产量的功能,是国际上首次克隆控制水稻产量杂种优势形成的QTL。PEA等[37]认为在玉米的杂种优势QTL研究中,含有杂种优势QTL的NIL可以进一步把杂种优势座位分解为孟德尔遗传因子,更适合于杂种优势QTL的精细定位和相关研究。本研究立足于SSSL的背景一致性及受体亲本lx9801和供体亲本昌7-2的独特性,利用 SSSL分别与郑 58、浚 9058构建SSSL测交群体,通过分析相应各代换片段位置的杂合效应,从单个位点水平定位穗下第7、8、9节间长杂种优势位点。2个SSSL测交群体在多个环境条件下检测到了第7、8、9节间长HL,证实了存在杂种优势位点,且可以作为孟德尔遗传因子进行克隆及功能分析。同时,不同遗传背景的郑58和浚9058第7、8、9节间长田间表现不同,SSSL×郑58和SSSL×浚9058两个测交群体可以分析不同遗传背景组合间的杂种优势位点。
4 结论
以lx9801为遗传背景的昌7-2染色体单片段代换系为基础材料,分别与优良自交系郑58和浚9058分别构建了进行两套测交群体,SSSL及其测交群体的相关分析结果说明第7、8、9节间长是玉米穗位高重要的次级性状。
通过两年两点试验,对SSSL×郑58测交群体和SSSL×浚9058测交群体的穗下第7、8、9节间长的 HL定位结果推测出同一遗传背景不同性状的杂种优势位点可能不同;2个测交组合群体相比较可知,第7、8、9节间长HL同一性状间相比,相同的HL分别有3个、3个和1个,共有7个HL相同,分别占 2个总测交群体中 HL数的 12.7%和11.6%。结果表明,对于穗下节间长这个性状来说,不同群体之间的杂种优势位点大都不同,说明杂种优势与亲本遗传背景之间密切相关,同一性状不同组合间,杂种优势几乎没有相同的位点,推测控制同一性状的杂种优势位点在不同遗传背景下并不相同,在单基因水平上,杂种优势位点是特定杂交组合的等位基因互作表现。
[1] 赵鹏. 玉米穗下节间长杂种优势的组学分析[D]. 郑州: 河南农业大学, 2015.
ZHAO P. Omics analysis of heterosis for internode length under ear in maize [D]. Zhengzhou: Henan Agricultural University, 2015. (in Chinese)
[2] SCHNABLE P S, SPRINGER N M. Progress toward understanding heterosis in crop plants. Annual Review of Plant Biology, 2013, 64: 71-88.
[3] WEI X, WANG B, PENG Q, WEI F, MAO K, ZHANG X, TANG J. Heterotic loci for various morphological traits of maize detected using a single segment substitution lines test-cross population. Molecular Breeding, 2015, 35(3): 1-13.
[4] MARCON C, LAMKEMEYER T, MALIK W A, UNGRUE D, PIEPHO H P, HOCHHOLDINGER F. Heterosis-associated proteome analyses of maize (Zea mays L.) seminal roots by quantitative label-free LC–MS. Journal of Proteomics, 2013, 93: 295-302.
[5] SHANG L, WANG Y, CAI S, WANG X, LI Y, ABDUWELI A, HUA J. Partial dominance, overdominance, epistasis and QTL by environment interactions contribute to heterosis in two upland cottonhybrids. Genes Genomes Genetics, 2016, 6(3): 499-507.
[6] REIF J C, HAHN V, MELCHINGER A E. Genetic basis of heterosis and prediction of hybrid performance. Helia, 2012, 35(57): 1-8.
[7] SHEN G, ZHAN W, CHEN H, XING Y. Dominance and epistasis are the main contributors to heterosis for plant height in rice. Plant Science, 2014, 215: 11-18.
[8] DING H, QIN C, LUO X, LI L, CHEN Z, LIU H, L(U)BBERSTEDT T. Heterosis in early maize ear inflorescence development: A genome-wide transcription analysis for two maize inbred lines and their hybrid. International Journal of Molecular Sciences, 2014, 15(8): 13892-13915.
[9] THIEMANN A, FU J, SEIFERT F, GRANT-DOENTON R T, SCHRAG T A, POSPISIL H, SCHOLTEN S. Genome-wide meta-analysis of maize heterosis reveals the potential role of additive gene expression at pericentromeric loci. BMC Plant Biology, 2014, 14(1): 88.
[10] ZHAO P, DING D, ZHANG F, ZHAO X, XUE Y, LI W, TANG J. Investigating the molecular genetic basis of heterosis for internode expansion in maize by microRNA transcriptomic deep sequencing. Functional & Integrative Genomics, 2015, 15(3): 261-270.
[11] CHEN Z J. Genomic and epigenetic insights into the molecular bases of heterosis. Nature Reviews Genetics, 2013, 14(7): 471-482.
[12] VIRMANI S S. Heterosis and hybrid rice breeding. Springer Science & Business Media, 2012.
[13] SRAN R S, PANDEY D P. Combining ability and heterosis for yield and its component traits in rice. ORYZA-an International Journal on Rice, 2015, 52(2): 105-110.
[14] NAYAK P G, SREEDHAR M, VANISREE S. Heterosis studies of aromatic lines for yield and grain quality traits in rice. 2015.
[15] AMIRI-OGHAN H, FOTOKIAN M H, JAVIDFAR F, ALIZADEH B. Genetic analysis of grain yield, days to flowering and maturity in oilseed rape (Brassica napus L.) using diallel crosses. International Journal of Plant Production, 2012, 3(2): 19-26.
[16] ZOU J, ZHU J, HUANG S, TIAN E, XIAO Y, FU D, MENG J. Broadening the avenue of intersubgenomic heterosis in oilseed Brassica. Theoretical and Applied Genetics, 2010, 120(2): 283-290.
[17] TWUMASI-AFRIYIE S, FRIESEN D, PIXLEY K. Quality protein maize: Progress and prospects. Plant Breeding Reviews, 2011, 34: 83.
[18] RIEDELSHEIMER C, CZEDIK-EYSENBERG A, GRIEDER C, LISEC J, TECHNOW F, SULPICE R, MELCHINGER A E. Genomic and metabolic prediction of complex he terotic traits in hybrid maize. Nature Genetics, 2012, 44(2): 217-220.
[19] KO D K, ROHOZINSKI D, SONG Q, TAYLOR S H, JUENGER T E, HARMON F G, CHEN Z J. Temporal shift of circadian-mediated gene expression and carbon fixation contributes to biomass heterosis in maize hybrids. PLoS Genetics, 2016, 12(7): e1006197.
[20] PAN T C F, APPLEBAUM S L, MANAHAN D T. Genetically determined variation in developmental physiology of bivalve larvae (Crassostrea gigas). Physiological and Biochemical Zoology, 2015, 88(2): 128-136.
[21] 王玉民, 席章营, 尚爱兰, 王帮太. 作物单片段代换系的构建及应用. 中国农学通报, 2008, 24(3): 67-71.
WANG Y M, XI Z Y, SHANG A L, WANG B T. The building and application of single segment substitution system in crop. Chinese Agricultural Science Bulletin, 2008, 24(3): 67-71. (in Chinese)
[22] 尚爱兰. 玉米单片段代换系的构建及产量性状杂种优势分析[D].郑州: 河南农业大学, 2009.
SHANG A L. The construction of a single segment substitution lines and heterosis of yield characters analysis [D]. Zhengzhou: Henan Agricultural University, 2009. (in Chinese)
[23] 贾桂平, 边大红, 蔡丽君, 杜雄, 牛海峰, 崔彦宏. 土壤耕作方式对夏玉米抗茎倒伏能力的影响. 华北农学报, 2013, 28(4): 163-168.
JIA G P, BIAN D H, CAI L J, DU X, NIU H F, CUI C H. Soil Tillage practices on maize stem Lodging resistance. North of Agronomy Journal, 2013, 28(4): 163-168. (in Chinese)
[24] TENG F, ZHAI L, LIU R, BAI W, WANG L, HUO D, ZHANG Z. ZmGA3ox2, a candidate gene for a major QTL, qPH3. 1, for plant height in maize. The Plant Journal, 2013, 73(3): 405-416.
[25] TANG Z, YANG Z, HU Z, ZHANG D, LU X, JIA B, XU C. Cytonuclear epistatic quantitative trait locus mapping for plant height and ear height in maize. Molecular Breeding, 2013, 31(1): 1-14.
[26] CAI H, CHU Q, GU R, YUAN L, LIU J, ZHANG X, ZHANG F. Identification of QTLs for plant height, ear height and grain yield in maize (Zea mays L.) in response to nitrogen and phosphorus supply. Plant Breeding, 2012, 131(4): 502-510.
[27] LI Z Q, ZHANG H M, WU X P, SUN Y, LIU X H. Quantitative trait locus analysis for ear height in maize based on a recombinant inbred line population. Genetics and Molecular Research, 2014, 13(1): 450.
[28] 张君, 库丽霞, 张伟强, 杨爽, 刘海英, 赵瑞芳, 陈彦惠. 玉米穗上节间距的QTL定位. 玉米科学, 2010, 18(4): 45-48.
ZHANG J, KU L X, ZHANG W Q, YANG S, LIU H Y, ZHAO R F, CHEN Y H. Internodes of QTL location on the ear of corn. Corn Science, 2010, 18(4): 45-48. (in Chinese)
[29] Meghji M R, Dudley J W, Lambert R J, SPRAGUE G F. Inbreeding depression, inbred and hybrid grain yields, and other traits of maizegenotypes representing three eras. Crop Science, 1984, 24(3): 545-549.
[30] 赵芳明, 张桂权, 曾瑞珍, 杨正林, 凌英华, 桑贤春, 何光华. 利用单片段代换系研究水稻产量相关性状QTL加性及上位性效应. 作物学报, 2012, 38(11): 2007-2014.
ZHAO F M, ZHANG G Q, ZENG R Z, YANG Z L, LING Y H, SANG X C, HE G H. Using single segment substitution lines research yield related traits QTL additive and epistatic effect in rice. Acta Agronomica Sinica, 2012, 38(11): 2007-2014. (in Chinese)
[31] 王召辉. 玉米株型穗部性状的QTL定位及分析[D]. 重庆: 西南大学, 2011.
WANG Z H. QTL mapping and analysis plant type panicle traits in maize [D]. Chongqing: Southwest University, 2011. (in Chinese)
[32] 王铁固, 张怀胜, 马娟, 佘宁安, 陈士林. 玉米产量及相关性状的杂种优势分析. 江苏农业科学, 2012, 40(8): 88-90.
WANG T G, ZHANG H S, MA J, SHE N A, CHEN S L. Yield heterosis analysis and related traits in maize. Jiangsu Agricultural Science, 2012, 40(8): 88-90. (in Chinese)
[33] 郭小蛟, 张涛, 蒋开锋, 杨莉, 曹应江, 杨乾华, 高磊. 水稻籼粳交F8, F2群体穗长 QTL比较分析. 中国农业科学, 2013, 46(23): 4849-4857.
GUO X J, ZHANG T, JIANG K F, YANG L, CAO Y J, YANG Q H, GAO L. Comparison of panicle length QTL based on F2and F8populations derived from rice subspecies cross. Scientia Agricultura Sinica, 2013, 46(23): 4849-4857. (in Chinese)
[34] WALLACE J G, LARSSON S J, BUCKLER E S. Entering the second century of maize quantitative genetics. Heredity, 2014, 112(1): 30-38.
[35] HUFFMAN R D, EDWARDS J W, POLLAK L M, SCOTT M P. Interaction of genetic mechanisms regulating methionine concentration in maize grain. Crop Science, 2016, 56(5): 2379-2389.
[36] HE G M, LUO X J, TIAN F, LI K G, ZHU Z F, SU W, YANG J S. Haplotype variation in structure and expression of a gene cluster associated with a quantitative trait locus for improved yield in rice. Genome Research, 2006, 16(5): 618-626.
[37] PEA G, PAULSTEPHENRAJ P, CANÈ M A, SARDARO M L S, LANDI P, MORGANTE M, FRASCAROLI E. Recombinant nearisogenic lines: A resource for the mendelization of heterotic QTL in maize. Molecular Genetics and Genomics, 2009, 281(4): 447-457.
[38] DUVICK D N. Theory, empiricism and intuition in professional plant breeding. Integrating Knowledge and Practice, 2002: 189-212.
(责任编辑 李莉)
Heterosis Analysis of Internode Length Under Ear in Maize
LI HuiMin, LI WeiHua, GUO HaiPing, LIU Kun, ZHANG XiangGe, ZHANG XiaoXiang, XIE HuiLing, TANG JiHua, DING Dong
(Agronomy of Henan Agricultural University/ State Key Laboratory of Wheat and Maize Crop Science, Zhengzhou 450002)
【Objective】The under-ear internode length determines maize seedling height and ear height, which are two agronomic traits associated with yield and lodging resistance. Heterosis, a wild-spread genetic phenomenon, is widely applied in crop yield and quality improvement. In a previous study, the lengths of the 7th, 8th and 9th internodes were found to have a decisive effect on ear height and showed a high degree of heterosis. The aim of this study is to resolve the molecular mechanism of heterosis for comprehensive understanding and utilization of heterosis.【Method】 In this study, the chromosome single segment substitution lines (Single segment substitution lines, SSSLs) derived from continually cross of lx9801 and Chang7-2 were used as the basic materials. Test-crossing populations were constructed by crossing the SSSLs with inbred lines Zheng58 and Xun9058, respectively. The HL(Heterosis loci) of the 7th, 8th, and 9th internode length were detected through two-year and two-point tests.【Result】By using the SSSL×Zheng58 test-cross group and SSSL× Xun9058 test-cross group, the heterosis loci (HL) of the 7th, 8th, and 9thinternode length were detected through two-year and two-point tests. In 2012, the mid parent heterosis values of the 7th, 8th, and 9th internode length in Xunxian were 57.25% and 78.16%, 68.30% and 75.04%, 59.48% and 62.85%, respectively, and that in Changge were 48.27% and 63.02%, 43.36% and 54.80%, 37.26% and 42.62%, respectively. In 2013, the mid parent heterosis values of the 7th, 8th, and 9th internode length in Xunxian were 23.01% and 37%, 22.69% and 35.65%, 22.20% and 34.74%, respectively, and that in Changge were 21.86% and 33.19%, 20.99% and 35.57%, 27.55% and 42.19%, respectively. A total of 18 and 18 length heterosis loci were obtained from the 7th internode, 20 and 23 were obtained from the 8th internode, 17 and 19 were obtained from the 9th internode. Compared the same HL of the two test-crossing groups, there are 3, 3 and 1 same HL of 7th, 8th, 9th internode length, respectively. These same HL occupied 12.7% and 11.6% of the total HL numbers, respectively. 【Conclusion】There were only 7 (6%) same HL sites had same location between SSSL×Zheng58 group and SSSL×Xun9058 group of the 7th, 8th, and 9th internode length, which indicated that the heterotic loci among different groups may be different. It was speculated that under different genetic backgrounds there are different genes controlling the same heterosis traits. The performance of heterotic loci at single gene level should be crossing group (genetic background) specific.
maize; single segment substitution lines; the length of 7th, 8th and 9th internodes; heterosis
2016-10-12;接受日期:2016-11-24
国家自然科学基金(31201216,31271732)、河南省科技攻关项目(152102110062)
联系方式:李慧敏,Tel:15981815387;E-mail:lihuimin19890520@163.com。通信作者丁冬,Tel:0371-63558122;E-mail:dingdong0216@hotmail.com

