不同茶类中挥发性萜类化合物的对映异构体
邵晨阳,吕海鹏,朱荫,张悦,林智
(1中国农业科学院茶叶研究所/农业部茶树生物学与资源利用重点实验室,杭州 310008;2中国农业科学院研究生院,北京 100081)
不同茶类中挥发性萜类化合物的对映异构体
邵晨阳1,2,吕海鹏1,朱荫1,张悦1,林智1
(1中国农业科学院茶叶研究所/农业部茶树生物学与资源利用重点实验室,杭州 310008;2中国农业科学院研究生院,北京 100081)
【目的】挥发性萜类化合物是茶叶香气的重要成分,大多数具有手性结构,存在香气特性完全不同的对映异构体。查明不同茶类中挥发性萜类化合物的立体构型分布特征,为深入研究茶叶香气的形成机理及提高茶叶的香气品质提供科学的理论依据。【方法】采用顶空固相微萃取法结合手性气相色谱-质谱联用技术,以Supelco β-DEX110为手性气相色谱柱,以萜类化合物的不同手性异构体标准品为定性和定量分析的依据,建立茶叶中挥发性萜类化合物的对映异构体分析方法,并对代表性绿茶、红茶、乌龙茶、白茶及黑茶样品中萜类化合物的对映异构体组成及含量进行分析。【结果】建立了9种萜类化合物的对映异构体的检测方法,发现所有茶样中均能检测到芳樟醇、芳樟醇氧化物B的对映异构体:大部分茶样中芳樟醇的主导构型为S型,但英德红茶、云南滇红和印尼白茶中以罕见的R-(-)-芳樟醇为主;芳樟醇氧化物B在绿茶、红茶、白茶及黑茶中的构型完全一致,而部分乌龙茶(岭头单枞、文山包种)中该物质的主导构型与之相反。芳樟醇氧化物A在绿茶及黑茶中主导构型一致,而在祁门红茶、印度大吉岭红茶、水仙乌岽单枞及铁观音中构型相反;芳樟醇氧化物C和D在所有茶样中的构型均保持一致,且大部分仅检测到单一构型。其他重要萜类化合物在茶样中分布情况各异:α-蒎烯仅在正山小种红茶中以高比例的S-(-)-α-蒎烯被检测出;α-松油醇的主导构型及对映异构体过量值在不同种类的茶叶中各不相同;4-萜品醇在所有可测得的茶样中均以R构型为主导,且除六堡茶(黑茶)外,其他茶样中均未检测到S-(+)-4-萜品醇;α-紫罗兰酮在除了绿茶以外的茶样中均能被检测到,且均以单一的R构型存在。定量分析结果表明,芳樟醇在大部分茶样中都具有最高的含量,平均含量白茶>红茶>乌龙茶>绿茶>黑茶;芳樟醇氧化物B的含量在茶叶中往往仅次于芳樟醇,呈现红茶>白茶>乌龙茶>黑茶>绿茶的规律性;而其他萜类化合物在茶样中的含量普遍低于100 ng·g-1,且在不同茶类中含量分布迥异。【结论】明确了不同种类茶叶中 9种重要挥发性萜类化合物对映异构体的变化情况,有助于从更深层次上了解茶叶香气品质的化学实质,为今后茶叶香气品质调控、茶叶品种、产地判别以及质量认证等提供了新思路。
茶叶;挥发性萜类化合物;对映异构体;气相色谱-质谱联用技术;对映异构体过量值
0 引言
【研究意义】茶叶香气是多种挥发性成分的混合物,其基本组成可以分为脂肪族、芳香族及挥发性萜类化合物3大类[1]。其中,挥发性萜类化合物常具有怡人的香气,并具有较低的香气阈值,故而对茶叶香气品质有着重要影响[2]。目前已鉴定出的茶叶中的挥发性萜类化合物已有上百种之多,其中含量较高的有芳樟醇(Linalool)、芳樟醇氧化物(Linalool oxide A、B、C、D)、橙花叔醇(Nerolidol)、α-紫罗兰酮(α-Ionone)、α-松油醇(α-Terpineol)、α-蒎烯(α-Pinene)、柠檬烯(Limonene)、4-萜品醇(4-Terpineol)等。挥发性萜类化合物往往含有1个甚至多个手性碳原子,存在1对或多对对映异构体(如呋喃型、吡喃型芳樟醇氧化物各有 2个手性中心,分别存在 2对对映异构体),且同一萜类化合物对映异构体的香气特征、阈值甚至生物活性差异极大,以致活性可能明显不同。如S-(+)-芳樟醇具有甜香、橙花香,香气阈值为7.4 μg·L-1[3],R-(-)-芳樟醇具有木香和类似薰衣草的香气特征,香气阈值为 0.8 μg·L-1[4],且R-(-)-芳樟醇具有S-(+)-芳樟醇所不具备的镇静效果[5];S-α-紫罗兰酮具有类似木材的香气,阈值为 20—40 μg·L-1,R-α-紫罗兰酮具有紫罗兰芬芳,阈值为 0.5—5 μg·L-1,它们的消旋体(即等量的对映异构体构成的不具备光学活性的混合物)则呈现强烈的甜花香气味[6];S-(-)-柠檬烯有似鲜花的清淡香气,而R-(+)-柠檬烯则具有愉快的新鲜橙子香气[7]。由此可见,挥发性萜类化合物的立体构型对其香气品质的影响很大,其不同组成比例引发的致香效果也有所差异,而且这种差异极可能对茶叶香气的形成产生重要影响。因此,研究茶叶中萜类化合物的对映异构体具有重要的理论意义及显著的应用价值。【前人研究进展】挥发性萜类化合物的对映异构体分析在草莓[8]、咖啡[9]、葡萄[10]、蜂蜜[11]、覆盆子[12]及百香果萃取物[13]等食品中已被广泛研究。大量研究结果表明挥发性萜类化合物对映异构体间的比例值与植物品种、食品类别有着重要的联系,目前手性分析技术已被应用于植物的产地判别、风味食品的真伪辨析等领域[14-15]。此外,在极端的理化条件下(如强酸性介质、高温环境等),部分萜类化合物的对映异构体会发生消旋化,如 R-(-)-芳樟醇在 pH<4时光学纯度明显降低[16],葡萄酒酿造过程中呋喃型芳樟醇氧化物会发生消旋化[10]等,所以食品原料的加工过程也可能对萜类化合物的立体构型分布产生一定影响。虽然挥发性萜类化合物的对映异构体研究在食品化学领域已取得重要进展,但是在茶学领域却至今未被系统研究,仅有少数芳樟醇及芳樟醇氧化物的对映异构体研究报道[17-19]。笔者研究团队的前期工作表明[18-19],芳樟醇的2种对映异构体均存在于茶鲜叶及成品茶茶叶中,且不同种类茶叶中芳樟醇对映异构体的组成有较大差异,甚至主导的立体构型也不尽相同。【本研究切入点】鉴于前期的研究结果,不同种类茶叶中存在的其他挥发性萜类化合物对映异构体的种类、组成及含量等也可能存在较大差异,具有重要的研究价值。然而,由于茶叶香气成分复杂繁多、化学性质各异,导致萜类化合物与不同手性固定相间的作用力强弱不一,往往难以在一个手性气相色谱体系中同时分离出多种挥发性萜类化合物的对映异构体,因此,有必要开展相关研究。【拟解决的关键问题】采用顶空固相微萃取法(Headspace Solid Phase Microextraction,HS-SPME)-手性气相色谱质谱联用技术(Gas chromatography-mass spectrometry,GC-MS)建立茶叶香气中多种挥发性萜类化合物的对映异构体分析方法,并查明不同种类茶叶中主要萜类化合物对映异构体的含量分布情况,旨在从立体化学层面了解不同种类茶叶关键香气成分的化学实质,为今后茶叶香气品质调控、茶叶产地判别以及质量认证等提供科学的理论依据。
1 材料与方法
1.1 试验时间、地点
试验于 2015—2016年在中国农业科学院茶叶研究所进行。
1.2 试验材料与仪器
茶叶样品为各地市场采集,并通过《GB/T 23776—2009茶叶感官审评方法》筛选出 22个具有代表性香气品质的各类别茶样,分别为:4个绿茶样品:西湖龙井、安吉白茶、信阳毛尖、日照绿茶;6个红茶样品:正山小种、祁门红茶、英德红茶、云南滇红、印度大吉岭红茶、锡兰乌瓦红茶;4个乌龙茶样品:铁观音、岭头单枞、水仙乌岽单枞、文山包种;4个白茶样品:寿眉、白牡丹、白毫银针、印尼白茶;4个黑茶样品:普洱饼茶、普洱散茶、六堡茶、茯砖茶。
挥发性萜类化合物标准品:(±)-芳樟醇、R-(-)-芳樟醇;芳樟醇氧化物(呋喃型,A、B混合体)、芳樟醇氧化物(吡喃型,C、D混合体);(±)-4-萜品醇、R-(-)-4-萜品醇、S-(+)-4-萜品醇;(±)-α-松油醇、R-(+)-α-松油醇;(±)-α-蒎烯、R-(+)-α-蒎烯、S-(-)-α-蒎烯;(±)-α-紫罗兰酮;以上试剂购自 J&K 百灵威公司(北京)或Sigima-Aldrich公司(上海)。
化学试剂:无水乙醚(色谱级,美国Tedia公司);正己烷(色谱级,德国Meker公司),纯净水(杭州娃哈哈集团)。
仪器:顶空固相微萃取收集装置为自制密封萃取瓶(250 mL);萃取装置为手动 SPME手柄(美国Supelco公司);萃取头为50/30 μm聚二甲基硅烷-二乙烯基苯涂层纤维(DVB/CAR/PDMS)萃取头(美国Supelco公司);HH-2数显恒温水浴锅(上海精宏实验设备有限公司);PL202-L-电子天平(梅特勒-托利多仪器(上海)有限公司);气相色谱-质谱联用仪,型号:Agilent 7890A-5975C(美国Agilent公司);手性毛细管色谱柱 β-DEX110(30 m×0.25 mm×0.25 μm,美国Supelco公司)。
1.3 试验方法
1.3.1 样品前处理 准确称取样品1.00 g至自制的250 mL顶空萃取瓶中,加入6.0 mL沸水冲泡,放入60℃水浴锅平衡 5.0 min,然后插入装有 DVB/CAR/ PDMS萃取头(试验前先将此萃取头在GC-MS进样口250℃老化30 min)的手动SPME手柄在60℃水浴条件下顶空萃取,萃取时间为60 min,取出后立即插入GC-MS进样口中解吸附3.0 min,同时启动仪器收集数据。每个茶样均重复测试3次。
1.3.2 色谱分析条件 色谱柱选用β-DEX110;进样口温度为250℃;分流进样,分流比为10﹕1,载气为高纯度氦气,纯度≥99.99%;柱箱温度采用程序升温:50℃保持2 min,然后以2℃·min-1升到150℃保持10 min,再以4℃·min-1升到200℃保持5 min,流速为1.2 mL·min-1,进样量为1.0 μL(仅指标准品,茶样全部为手动进样),总分析时间为79.5 min。
1.3.3 质谱分析条件 电子轰击离子源;电子能量-70 eV;传输线温度 250℃;离子源温度220℃;质量扫描范围m/z 33—600 u[20]。
1.3.4 茶叶中挥发性萜类化合物对映异构体的定性分析 首先根据各标准品的保留时间选定茶样中挥发性萜类化合物大致的出峰时间范围,再提取出在保留时间范围内与标准品具有相同特征离子的色谱峰,比对其与标准品质谱谱图的相似度,相似度大于95%以上则最终鉴定为相应萜类化合物对映异构体在茶样中的色谱峰。
1.3.5 茶叶中挥发性萜类化合物对映异构体的定量分析 配置一系列浓度范围的萜类化合物消旋体的乙醚溶液,根据气相谱图上相应峰面积的比例关系(仅含一个手性碳原子的萜类化合物的 2个对映异构体的峰面积基本均等;呋喃型或吡喃型芳樟醇氧化物因具有 2个手性碳原子,存在非对映异构体,需计算 4个峰之间的比例)计算出各对映异构体的相应浓度,通过绘制标准曲线获得各萜类化合物对映异构体浓度与峰面积的线性方程;茶样中各萜类化合物对映异构体的含量为色谱图中相应峰面积带入线性方程计算后所得的数值。萜类化合物对映异构体的比例组成采用有机立体化学中通用的对映异构体过量值(enantiomeric excess,ee)来表达[21],计算公式如下:ee (%) = [(A1-A2)/(A1+A2)]×100;式中:A1为萜类化合物某一种特定的对映异构体的色谱峰面积,A2为另一对映异构体的色谱峰面积;正负ee值代表了相反立体构型的萜类化合物,ee值(绝对值)越高,代表A1对应的该立体构型的萜类化合物在茶样中的比例也越高;当ee=0时,代表两种异构体在茶样中的比例相同,为消旋体;反之,当 ee= ±100%时,代表在茶样中仅存在单一立体构型的萜类化合物。
1.3.6 萜类化合物对映异构体的回收率测定 选取在浓度线性范围内的两个不同等级浓度的萜类化合物标准品溶液,分别添加到代表性茶样(若无特殊说明则为英德红茶)中,对萜类化合物对映异构体进行回收率测定。回收率测定公式如下:Recovery(%)=[(加料茶样中目标物质的浓度-茶叶中目标物质的浓度)/添加的萜类化合物标准品浓度]×100。重复测量3次,取平均值并计算相对标准偏差(relative standard deviation,RSD)。
1.3.7 数据分析 对原始数据进行标准化处理,采用Excel 2010(美国微软公司)进行RSD计算。用Excel 2010(美国微软公司)或OriginPro 9.0(美国OriginLab公司)进行数据分析,绘制相关谱图及柱状图。化学方程式采用ChemBio Ultra 14.0(美国CambridgeSoft公司)绘制。
2 结果
2.1 茶叶中挥发性萜类化合物对映异构体分析方法
2.1.1 茶叶中 9种挥发性萜类化合物对映异构体的分离 收集文献中已报道的茶叶中常见的 10余种挥发性萜类化合物的各构型及混合构型标准品,分别将10.0 μL (±)-萜类化合物加至10 mL容量瓶中,并用无水乙醚稀释至10 mL,振荡混匀后存放于-20℃冰箱静置待用。取1.0 μL的(±)-萜类化合物的乙醚稀释液分别进行手性GC-MS分析,试验结果表明芳樟醇、芳樟醇氧化物(A—D)、α-蒎烯、α-松油醇、4-萜品醇及α-紫罗兰酮等9对手性异构体可被β-DEX110成功分离,且分离效果理想。将可分离的9种(±)-萜类化合物的乙醚稀释液等量混合并进行手性 GC-MS分析,发现18个色谱峰之间均呈现较好的分离度,无峰重叠现象(图1),说明该手性分析方法具有较强的可行性。
选取英德红茶为代表性茶样,采用HS-SPME提取茶叶香气成分,并在相同的GC-MS分析条件下对香气成分进行分析,获得的总离子流图如图2-A所示。通过1.3.4的鉴定手段,在英德红茶样品中共可检测到芳樟醇(linalool,提取的特征峰离子:71、93、121、55、136,图2-B)、芳樟醇氧化物A、B(linalool oxides A、B,提取的特征峰离子:59、68、94、111,图2-C)、4-萜品醇(4-Terpineol,提取的特征峰离子:71、93、111、136、154,图2-D)、芳樟醇氧化物C、D(linalool oxides C、D,提取的特征峰离子:68、59、94、81、109,图2-E)及α-紫罗兰酮(α-ionone,提取的特征峰离子:121、93、136、192,图2-F)等萜类化合物的1—2个对映异构体(具体分布情况见图2-A),其中芳樟醇的含量远高于其他萜类化合物,而α-蒎烯及α-松油醇对映异构体未被检测出,猜测可能是由于上述化合物在英德红茶香气成分中含量过低、未达到其检测限所致。
2.1.2 9种挥发性萜类化合物对映异构体的定量标准曲线绘制、最低检测限、定量限及回收率测定 为了精确定量,对一系列浓度梯度的(±)-萜类化合物标准品溶液进行手性GC-MS分析,并绘制了色谱峰面积与萜类化合物浓度的标准曲线。如表1所示,所有标准曲线在极广的浓度范围内均呈现较好的线性关系,相关系数(correlation coefficient,R2)基本高于 0.9990,很好地验证了分析方法的精确性和操作的准确性。此外,为了确保定量结果在可靠的检测浓度之内,考察了各萜类化合物对映异构体的最低检测限(limit of determination,LOD)及最低定量限(limit of quantitation,LOQ)。结果表明,各萜类化合物对映异构体的LOD及LOQ在数量级上无明显差异,均可低至ng·g-1级别,其中LOD介于1.27—4.86 ng·g-1,LOQ介于4.24—15.35 ng·g-1,充分说明该仪器的灵敏度较为理想。
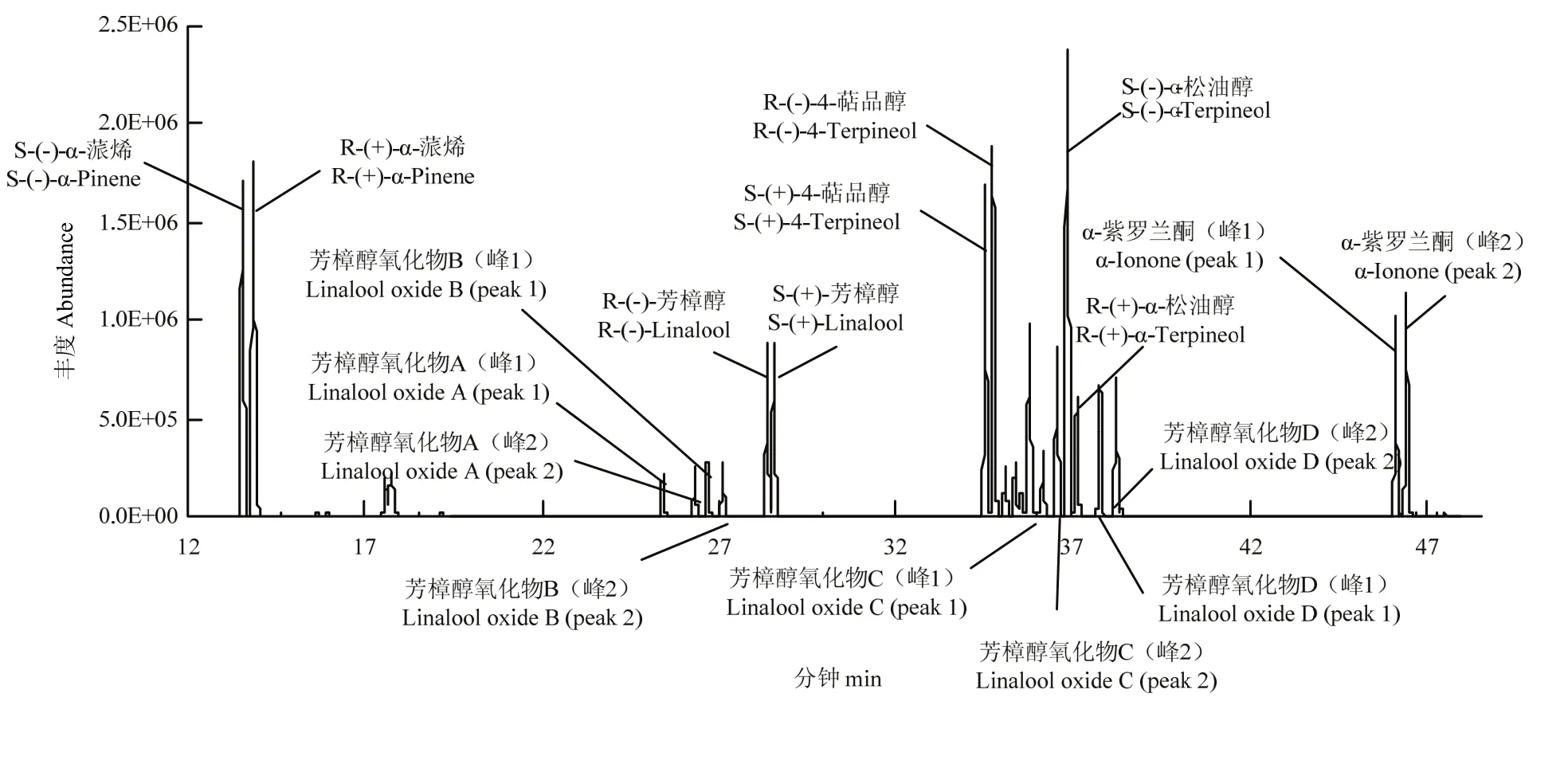
图1 混合萜类化合物标准品的总离子流图Fig. 1 The total ion chromatorgraphy of the mixture of terpenoid standards

图2 A) 英德红茶香气成分的总离子流图; B-F) 各萜类化合物(B:芳樟醇,C:芳樟醇氧化物A、B,D:4-萜品醇,E:芳樟醇氧化物C、D,F:α-紫罗兰酮)的标准质谱结构图(左)及在茶样中的特征峰离子提取图(右)Fig. 2 A) The total ion chromatography of aroma components in Yingde black tea; B-F) mass spectra of the authentic standards (the corresponding figure in the left) and the corresponding ion chromatography after extracting the ion characteristic peaks (the corresponding figure in the right) of each terpenoid enantiomer (B: linalool; C: linalool oxides A and B; D: 4-terpineol; E: linalool oxides C and D; F: α-ionone)
为了进一步验证该分析方法的可靠性,对各萜类化合物的回收率进行测定(参考1.3.6方法)。如表2所示,在茶样中添加了较高浓度的萜类化合物对映异构体标准品后,所计算出的加标回收率介于83.91%—99.20%,RSD值介于8.81%—14.31%;添加了较低浓度的萜类化合物标准品后,加标回收率介于 79.85%—99.78%,RSD值介于 8.53%—15.28%。以上结果充分表明了分析方法具有较强可靠性。
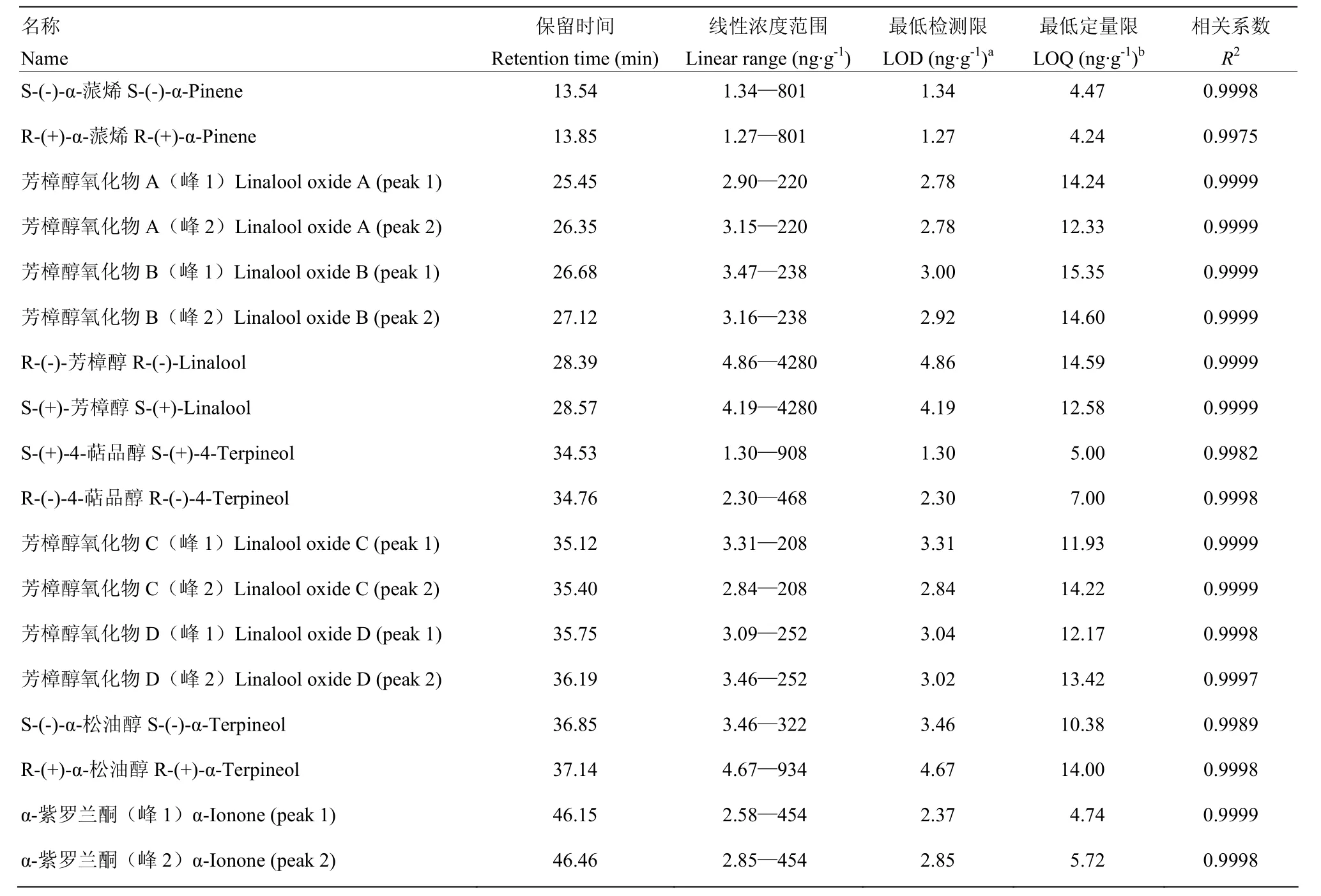
表1 萜类化合物的线性浓度范围、检测限与定量限Table 1 Linear ranges of concentration and limits of detection and quantitation of terpenoids
2.2 不同种类茶叶中挥发性萜类化合物对映异构体的定性定量分析
为查明挥发性萜类化合物的立体构型及含量的分布特征与茶叶种类、产地等因素之间的联系,对不同种类的代表性名优茶的香气成分进行分析,分析结果如表3、4所示。试验结果表明,所有可分离的萜类化合物对映异构体均可在不同茶叶样品中被检测出,且主导立体构型与含量在茶样之间差异较大。每次样品分析均重复3次以上,获得的试验结果RSD介于1%—25%,较好地验证了结果的准确性。
2.2.1 代表性绿茶样品中挥发性萜类化合物对映异构体的定性定量分析 选定4个代表性的中国名优绿茶作为研究对象,其代表性茶样总离子流图(西湖龙井)及可测得萜类化合物对映异构体如图3所示。所有绿茶样品中均可以检测到芳樟醇、芳樟醇氧化物B及芳樟醇氧化物D对映异构体:芳樟醇在所有样品中均以S构型为主,ee值介于4.4%—85.7%:其中安吉白茶中R-(-)-芳樟醇的比例最高(4.4% ee),几乎与S-(+)-芳樟醇比例相当;而信阳毛尖(85.7% ee)和日照绿茶(84.3% ee)中S-(+)-芳樟醇比例较高且ee值十分接近(表3)。芳樟醇氧化物B和芳樟醇氧化物D在茶样中均以同样的单一构型存在,但芳樟醇氧化物D的含量均较低,仅能检测到色谱峰,而无法定量。在西湖龙井中可检测出单一构型的芳樟醇氧化物A及芳樟醇氧化物C,但由于含量过低,未达到检测限;安吉白茶中可检测到单一构型的芳樟醇氧化物A,其构型与西湖龙井中的一致,含量同样未达到检测限(表4)。南方绿茶和北方绿茶在萜类化合物的含量上具有较明显的区别,南方绿茶中芳樟醇和芳樟醇氧化物B的含量均远高于北方绿茶,推测南、北方茶树不同的生长环境、栽培品种与加工工艺等[2,22]可能是导致南、北方绿茶品质特征差异形成的重要因素,后续工作将扩大样本量并深入研究。
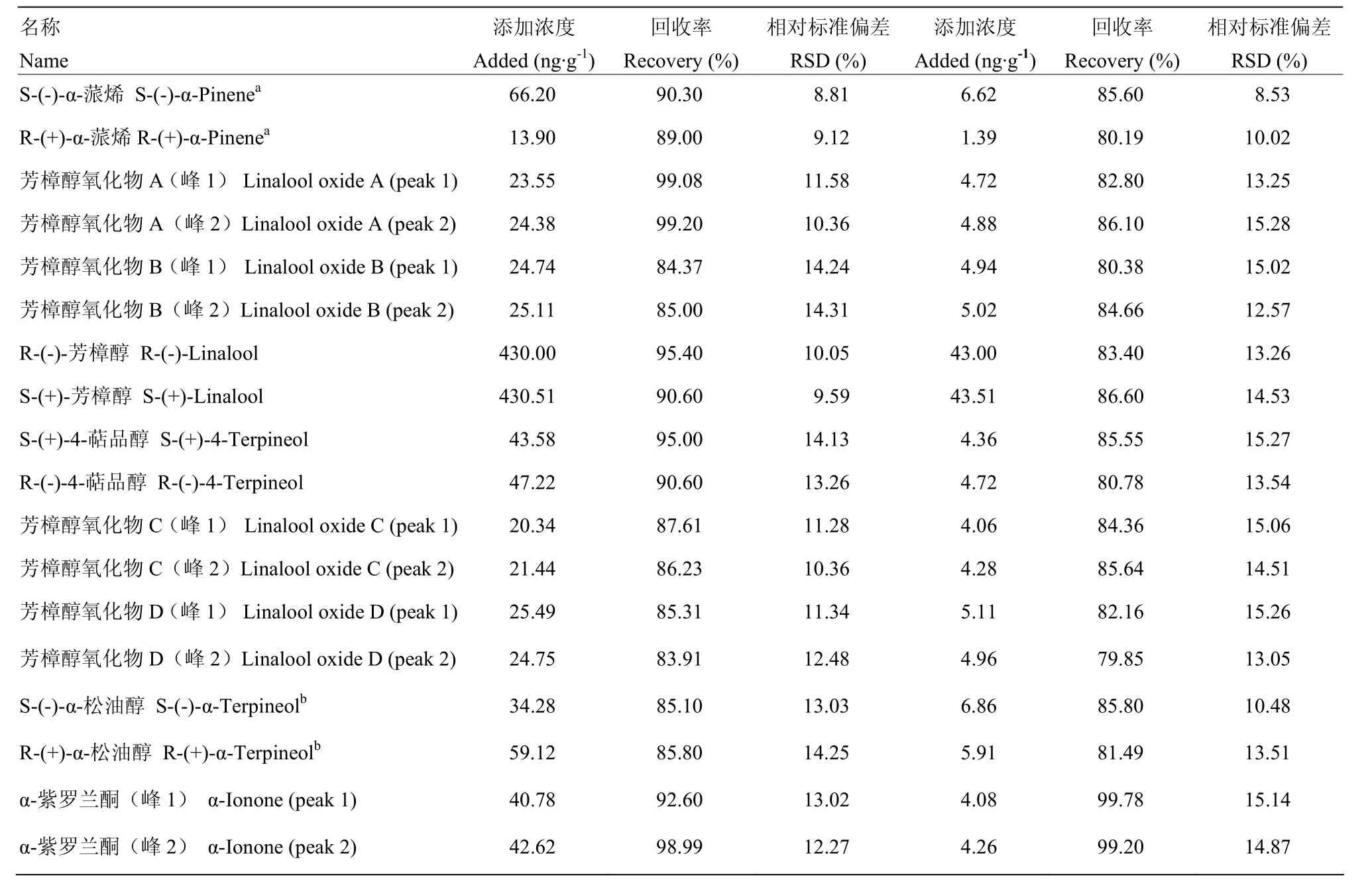
表2 萜类化合物对映异构体的回收率及RSD值(%)测定Table 2 Recoveries and RSDs (%) of terpenoid enantiomers
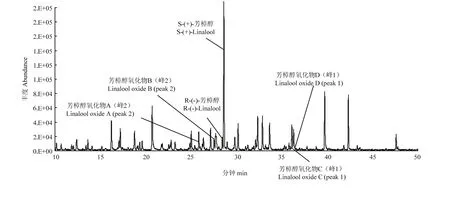
图3 西湖龙井茶香气成分的总离子流图Fig. 3 The total ion chromatorgraphy of aroma components in Xihu Longjing tea
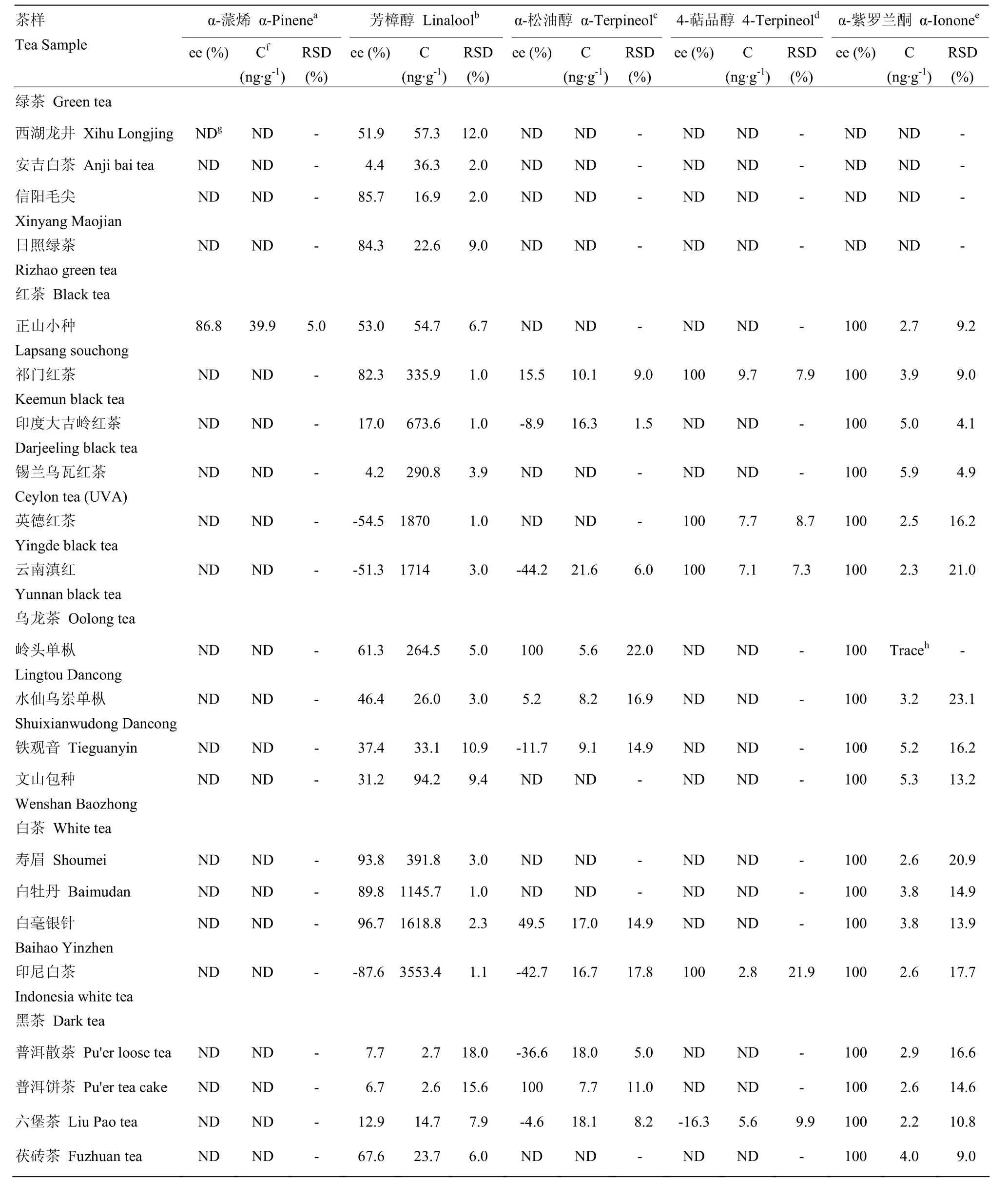
表3 茶叶中萜类物质的含量及其对映异构体组成Table 3 The contents of terpenoids and the compositions of their enantiomers in tea aroma
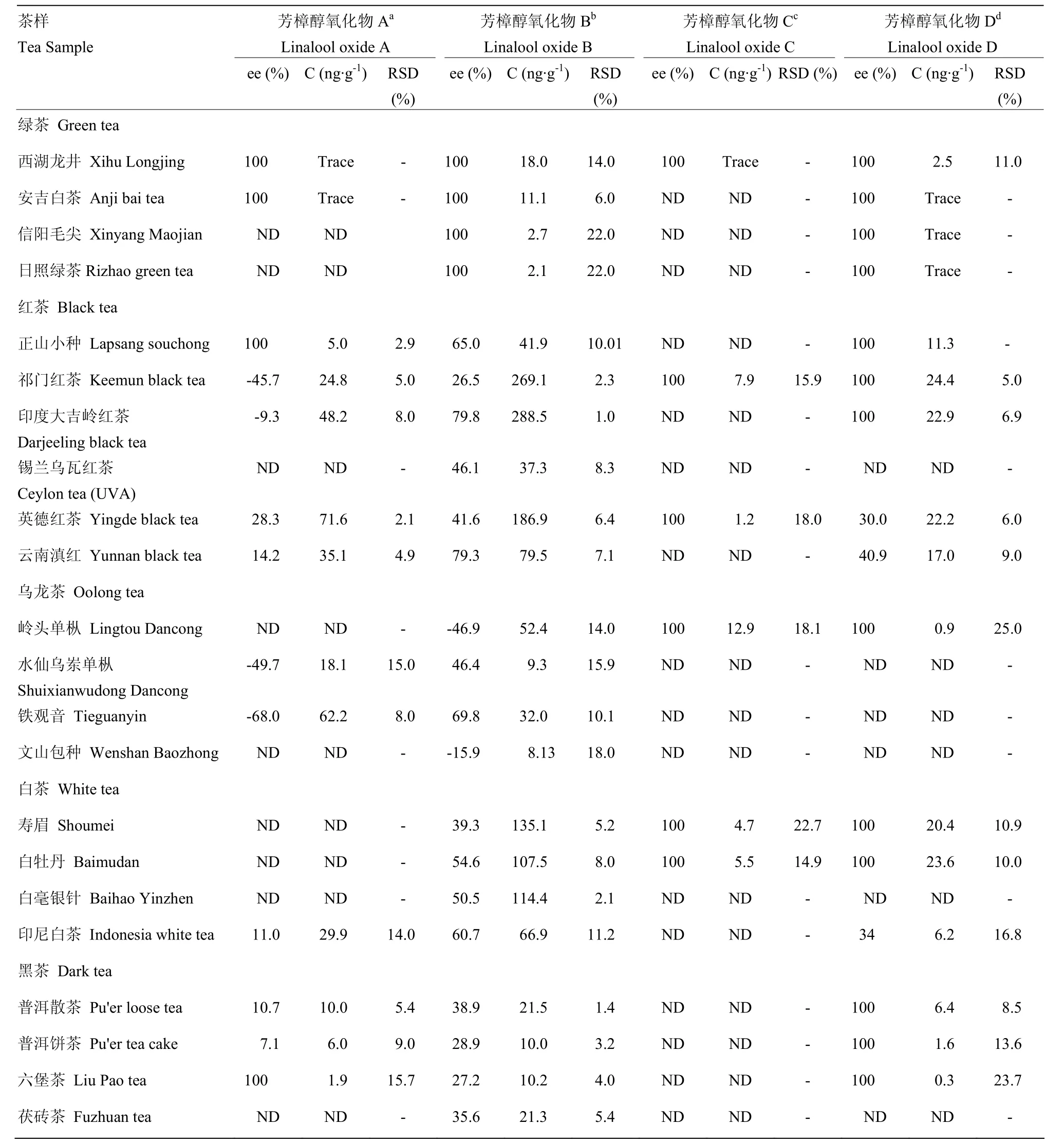
表4 茶叶中芳樟醇氧化物A—D的含量及其对映异构体组成Table 4 The contents of linalool oxides A-D and the compositions of their enantiomers in tea aroma
2.2.2 代表性红茶样品中挥发性萜类化合物对映异构体的定性定量分析 选定世界3大红茶及中国名优红茶为研究对象,检测结果如表3、4所示。所有红茶样品均可以检测到芳樟醇、芳樟醇氧化物B及α-紫罗兰酮:英德红茶及滇红中的芳樟醇以罕见的R构型为主,且ee值相近(-54.5%,-51.3%),其他红茶样品中以S-(+)-芳樟醇为主(4.2%—82.3% ee),其中祁门红茶 S-(+)-芳樟醇比例最高,锡兰乌瓦红茶中 S-(+)-芳樟醇与 R-(-)-芳樟醇的含量接近;芳樟醇氧化物 B(26.5%—79.8% ee)及α-紫罗兰酮(100% ee)在所有茶样中的主导构型均一致。其他可分离的萜类化合物对映异构体均可在不同红茶样品中被检测到:正山小种是唯一能检测到α-蒎烯两种对映异构体的红茶样品,且以S构型为主;芳樟醇氧化物A在除锡兰乌瓦红茶以外的红茶样品中均以较高含量被检测出,但主导立体构型各不相同,祁门红茶及印度大吉岭红茶中的主导构型与正山小种、英德红茶及滇红中的构型相反;芳樟醇氧化物C可在祁门红茶及英德红茶中被检测出,且以同样的单一立体构型存在;芳樟醇氧化物D可在大部分红茶样品中以一致的单一或主要构型被检测出;祁门红茶、印度大吉岭红茶及滇红中可检测到 α-松油醇的两种对映异构体,其中祁门红茶中 α-松油醇以S构型为主,而其他两种红茶中α-松油醇以R构型为主;此外,祁门红茶、英德红茶及滇红样品中还可检测到R-(-)-4-萜品醇。
在含量分布上,芳樟醇的含量在所有茶样中均最高,芳樟醇氧化物B次之,而α-紫罗兰酮的含量最低,仅在其定性限及定量限范围内浮动。如图4所示,大叶种的英德红茶和云南滇红中芳樟醇的含量均达到了μg级以上,而小叶种的正山小种及祁门红茶的芳樟醇含量相近,远低于前两者;芳樟醇氧化物B的含量在印度大吉岭红茶及祁门红茶中最高,英德红茶次之,而云南滇红及正山小种中该物质含量并不显著,锡兰乌瓦红茶中其含量最低。长期的茶叶审评实践表明,大叶种红茶香气高、独特、香型单一,而小叶种香气细幽、香型丰富[23],结合本试验结果,推测芳樟醇的含量及主导构型可能与红茶的香气品质密切相关:低阈值(0.8 μg·L-1)、极高含量的木香及薰衣草香型的R-(-)-芳樟醇致使大叶种红茶的香气浓烈高长且独特[4];而小叶种红茶中甜香、花香型的S-(+)-芳樟醇虽含量高,但阈值也相对更高(7.4 μg·L-1)[3],与其他香气活性成分的香气互作效应可能更加显著,致使茶叶的香气特征细幽、清爽且香型丰富。此外,其他萜类化合物的立体构型及含量组成也可能与红茶不同香气特征的形成密切相关,尚有待进一步研究。

图4 红茶中芳樟醇及芳樟醇氧化物B的含量变化情况Fig. 4 The content variations of linalool and linalool oxide B in black teas
2.2.3 代表性乌龙茶样品中挥发性萜类化合物对映异构体的定性定量分析 选取4个不同产地的代表性乌龙茶为研究对象。手性分析结果表明(表3、4),所有乌龙茶样中均可检测到的萜类化合物有芳樟醇、芳樟醇氧化物B及α-紫罗兰酮:芳樟醇的两种异构体在所有茶样中均可被检测到,且主导构型均为S构型(31.2%—61.3% ee),其中岭头单枞中S-(+)-芳樟醇比例最高;芳樟醇氧化物B的两种异构体也可被同时检测出,但不同茶样中主导构型不一,岭头单枞和文山包种的主导构型一致,水仙乌岽单枞与铁观音构型一致;α-紫罗兰酮以单一构型存在于所有茶样中,且绝对构型均一致。芳樟醇氧化物A在水仙乌岽单枞与铁观音中构型一致,在其余两个茶样中未被检测出。芳樟醇氧化物C和D均只在岭头单枞中被检测出,且以单一构型存在。α-松油醇在岭头单枞、水仙乌岽单枞和铁观音中可被检测出,但主导构型不一:岭头单枞中仅存在 S-(+)-α-松油醇;水仙乌岽单枞中以S-(+)-α-松油醇为主导构型,但R-(+)-α-松油醇的比例也较高(5.2% ee);铁观音中以R-(+)-α-松油醇为主导构型(-11.7% ee)。α-蒎烯及4-萜品醇在所有乌龙茶茶样中均未被检测出。
定量分析结果表明,芳樟醇及芳樟醇氧化物A、B具有较显著的含量,4-萜品醇及α-紫罗兰酮的含量仅接近定量限或定性限,而芳樟醇氧化物D的含量最低,未达到定性限(图 5)。岭头单枞中含有的萜类化合物最多且总含量最高,尤其是芳樟醇的含量远高于其他茶类,芳樟醇氧化物B的含量也较为显著。水仙乌岽单枞中所含的萜类化合物总含量最低,推测其香气品质的形成与其他香气活性化合物有更紧密的联系。铁观音中芳樟醇氧化物A具有最高含量,芳樟醇及芳樟醇氧化物B的含量也具有较高的含量,推测以上3种化合物对铁观音香气的形成具有重要影响。文山包种中芳樟醇的含量远高于其他萜类化合物,推测S-(+)-芳樟醇对该茶叶清香幽雅似花香的香气品质具有直接的促进作用。
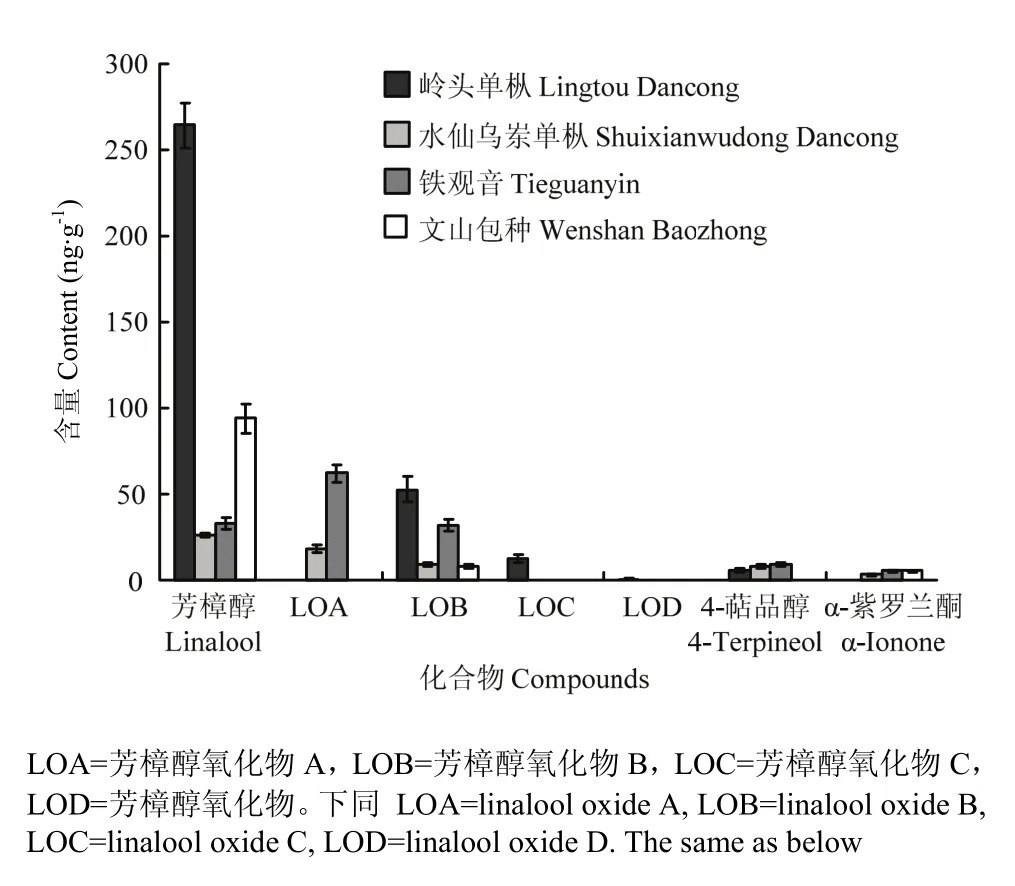
图5 乌龙茶中各萜类化合物的含量变化情况Fig. 5 The content variations of terpenoids in oolong teas
2.2.4 代表性白茶样品中挥发性萜类化合物对映异构体的定性定量分析 选取代表性中国白茶及香气品质浓烈似甘草香的印尼白茶为研究对象。手性分析结果表明(表3、4),白毫银针、白牡丹及寿眉中可测得的萜类化合物的主导构型一致,而印尼白茶则在萜类化合物的手性分布上有一定差异。所有茶样中均可检测到芳樟醇、芳樟醇氧化物B及α-紫罗兰酮:白毫银针、白牡丹及寿眉中芳樟醇中S构型的比例极高,ee值介于 89.8%—96.7%;反之,印尼白茶中芳樟醇主要以高比例的R构型为主(-87.6% ee),与中国白茶呈现巨大的差异;芳樟醇氧化物B在所有茶样中的主导构型一致,ee值介于39.3%—60.7%;α-紫罗兰酮在所有茶样中均以单一构型存在。芳樟醇氧化物A仅在印尼白茶中被检测到,两种立体构型存在的比例差异较小(11.0% ee)。芳樟醇氧化物C在寿眉及白牡丹中以单一构型存在,而芳樟醇氧化物D可在寿眉、白牡丹及印尼白茶中以一致的单一或主要构型被检测到。α-松油醇的两种对映异构体均可在白毫银针及印尼白茶中被检测出,白毫银针中以S构型为主(49.5% ee),印尼白茶以R构型为主(-42.7% ee)。4-萜品醇仅在印尼白茶中以极低的含量被检测出,且仅存在R-(-)-4-萜品醇。此外,所有白茶样品中均未检测到α-蒎烯。分析结果表明,中国白茶中萜类化合物的手性构型分布较为相似,其中白牡丹及寿眉中萜类化合物的主导构型不仅完全一致,且对映异构体的比例相近,而白毫银针中可检测到的萜类化合物相对较少,推测可能与白茶的原料鲜叶采摘标准差异相关:白毫银针为单芽茶,化学成分相对单一,而白牡丹与寿眉为叶茶,所含化学物质更加丰富。印尼白茶与中国白茶中萜类化合物的手性构型分布差异主要体现在芳樟醇与α-松油醇的主导构型上,低阈值而高含量的 R-(-)-芳樟醇可能是导致印尼白茶香气浓烈而特殊的主要原因。
在含量分布上,白牡丹、白毫银针及印尼白茶中芳樟醇的含量可达 μg级以上。在中国白茶中,芳樟醇的含量随着白茶香气品质的提升而逐渐提升,在白毫银针达到最高含量,然而印尼白茶中芳樟醇的含量更甚,是白毫银针中的两倍,说明芳樟醇对白茶香气品质的形成具有至关重要的影响。中国白茶中芳樟醇氧化物B的含量也较高,且含量相近;印尼白茶中芳樟醇氧化物B的含量略低于中国白茶,其含量仅次于芳樟醇。其他萜类化合物在不同白茶中的含量分布如图 6所示,含量最高的萜类化合物为芳樟醇氧化物 A,在印尼白茶中被检测到;而芳樟醇氧化物D及α-松油醇在部分白茶中也有较高的含量,前者在寿眉及白牡丹中含量较高,而 α-松油醇含量在白毫银针及印尼白茶中较高;芳樟醇氧化物C、4-萜品醇及α-紫罗兰酮的含量差异不大,仅略高于定量限或定性限,但由于萜类化合物往往具有较低的香气阈值,所以对白茶香气品质的形成也具有一定影响。
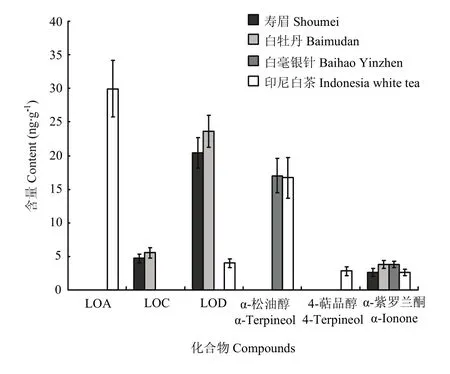
图6 白茶中各萜类化合物的含量变化情况Fig. 6 The content variations of terpenoids in white teas
2.2.5 代表性黑茶样品中挥发性萜类化合物对映异构体的定性定量分析 黑茶因其在原料选用、加工工艺(发酵发花)等方面有别于其他茶,从而导致生化成分的组成和比例与其他茶类有较大差异[24]。手性分析结果表明(表3、4),所有茶样中均可以检测到的手性萜类化合物有:芳樟醇、芳樟醇氧化物B及α-紫罗兰酮。芳樟醇在所有茶样中均以S-构型为主,但普洱茶(饼茶、散茶)及六堡茶中 R-构型占有较大比例(6.7%—12.9% ee),反之茯砖茶中S-(+)-芳樟醇比例较高(67.6% ee);芳樟醇氧化物B在所有茶样中的主导构型也基本一致,ee值较为相近,介于27.2%—38.9%;与其他茶类类似,α-紫罗兰酮在所有茶样中均以单一构型存在。芳樟醇氧化物 A在茯砖茶中未被检测出,在六堡茶里以极微量的单一构型存在(100% ee),在两个普洱茶样品中 ee值较为接近,且两种对映异构体比例差异不大(10.7%,7.1% ee)。芳樟醇氧化物D在普洱茶及六堡茶中均以单一构型被检测出,且构型保持一致。α-松油醇在各茶样中构型比例差异悬殊,在普洱饼茶中以单一S构型存在,在普洱散茶及六堡茶中以R构型为主导构型,其中六堡茶中 S构型比例较高(-4.6% ee);此外,在茯砖茶中未检测到α-松油醇对映异构体。4-萜品醇仅在六堡茶中被检测到,且以S-构型为主。α-蒎烯及芳樟醇氧化物 C中在所有茶样中均未被检测到。
在含量分布上,如图7所示,与其他茶类差异较大的是,黑茶中芳樟醇的含量普遍处于较低的水平,尤其是在普洱茶中,芳樟醇的含量仅介于定性限与定量限之间,而六堡茶和茯砖茶中芳樟醇的含量虽略高于其他萜类化合物,但也不超过30 ng·g-1。芳樟醇氧化物B在所有茶样中均具有较高含量,其中普洱散茶中芳樟醇氧化物B含量最高。α-松油醇在普洱散茶和六堡茶中具有较高且相近的含量。芳樟醇氧化物A及D在普洱茶中含量相对较高,而其他茶类中几乎无法被检测到。此外,相比其他萜类化合物,4-萜品醇及α-紫罗兰酮在茶样中的含量普遍较低,均低于 10 ng·g-1。分析结果表明:不同种类的黑茶中萜类化合物的手性分布及含量上差异较大,甚至普洱散茶与饼茶之间也有极大的差别,这可能与黑茶特有的后发酵工艺有关,具体的影响情况有待进一步研究。
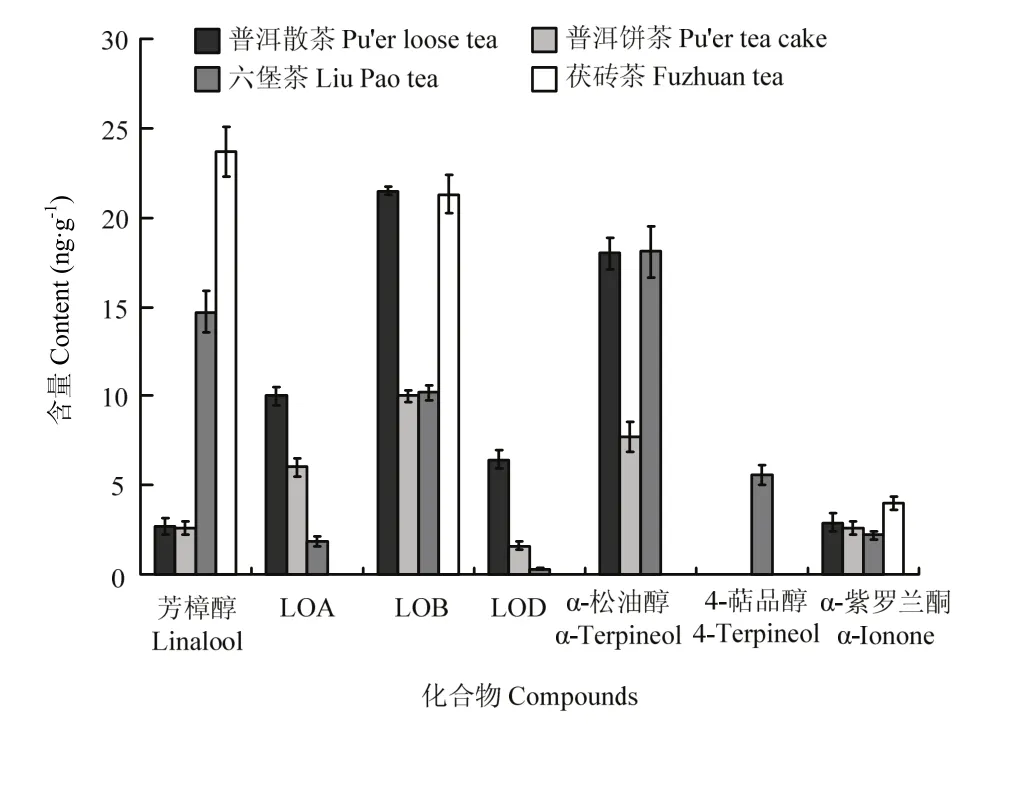
图7 黑茶中各萜类化合物的含量变化Fig. 7 The content variations of terpenoids in dark teas
2.2.6 不同茶类间挥发性萜类物化合物的立体构型分布异同性分析 试验结果充分表明(表3、4),不同茶类间挥发性萜类化合物的立体构型分布迥异。所有茶样中均能检测到芳樟醇、芳樟醇氧化物B的对映异构体:大部分茶类中芳樟醇的主导构型为S型,但英德红茶、云南滇红及印尼白茶以罕见的 R-(-)-芳樟醇为主,推测可能与茶叶的品种、产地有一定关系,值得深入研究;芳樟醇氧化物B在绿茶、红茶、白茶及黑茶中的构型完全一致,且ee值(平均值):绿茶(100% ee)>红茶(56.4% ee)>白茶(51.3% ee)>黑茶(32.6% ee),而非同一产地的乌龙茶(岭头单枞、文山包种)中该物质的主导构型与其他茶样相反,说明芳樟醇氧化物B的手性分布可能与产地的联系不大。α-蒎烯是检出率最低的萜类化合物,仅在红茶(正山小种)中被检测到,其主导构型为S。芳樟醇氧化物A在绿茶及黑茶中构型一致,而在部分红茶、乌龙茶中构型相反,说明其构型比例与茶样类别有一定关联。芳樟醇氧化物C和D在所有类别的茶样中的构型均保持一致,且大部分仅检测到单一构型,为所有茶类中萜类化合物的手性分布共同点。α-松油醇在茶样中的主导构型及ee值在不同种类、不同产地的茶叶中各不相同,推测其主导构型的形成与多方面因素相关。4-萜品醇在所有可测得的茶样中均以R构型为主导,且除六堡茶之外,其他茶样中均未检测到S-(+)-4-萜品醇。α-紫罗兰酮在除了绿茶以外的茶样中均能被检测到,且均以相同的单一构型存在,然而,由于无市售的 α-紫罗兰酮对映异构体的标准品,所以无法通过标准品确定其构型,但据文献报道,通过与泪杉醇绝对构型的比对可在红茶的香气成分中鉴定出 R-α-紫罗兰酮[25],结合本试验结果,推测茶叶中存在的α-紫罗兰酮应为单一的R构型,在本研究的后续工作中将通过合成标准品的方法对该结果进行验证。
2.2.7 不同茶类间挥发性萜类物化合物的含量分布差异性分析 不同茶类中挥发性萜类化合物的含量分布也有较大差异,芳樟醇在大部分茶样中都具有最高的含量,其中平均含量白茶(1 677 ng·g-1)>红茶(823.2 ng·g-1)>乌龙茶(104.4 ng·g-1)>绿茶(33.3 ng·g-1)>黑茶(10.9 ng·g-1),白茶与黑茶中芳樟醇的含量具有巨大的差异,猜测与茶类的加工工艺有密切关系:白茶萎凋过程是茶叶内含物发生活跃变化的重要过程,有利于芳樟醇等萜烯类化合物的形成[26];黑茶在后发酵过程中,有微生物参与,使茶叶内的化学物质大量分解或转化,从而使芳樟醇的含量降低[24]。本试验中芳樟醇氧化物B的含量在茶叶中仅次于芳樟醇,各茶样含量平均值红茶(150.5 ng·g-1)>白茶(106.0 ng·g-1)>乌龙茶(25.4 ng·g-1)>黑茶(15.8 ng·g-1)>绿茶(8.4 ng·g-1),推测茶叶的萎凋和发酵过程可能对芳樟醇氧化物B的含量影响更为显著;芳樟醇氧化物A在除绿茶以外的茶类中具有相对较高的含量,分布规律为:乌龙茶(40.2 ng·g-1)>红茶(36.9 ng·g-1)>白茶(29.9 ng·g-1)>黑茶(6.0 ng·g-1);红茶、白茶及黑茶中芳樟醇氧化物D的含量较高,而乌龙茶中芳樟醇氧化物C的含量远高于芳樟醇氧化物D,推测可能与乌龙茶特有的做青过程有一定关系。其他挥发性萜类化合物在茶样中的含量普遍较低,尤其在绿茶样品中,几乎无法被检测出,推测是由于绿茶在高温炒制过程中低沸点的萜类化合物会大量挥发而造成,而其他茶类加工过程中发酵或长时间的萎凋有利于挥发性萜类化合物的合成或转化;α-松油醇及4-萜品醇在红茶、白茶及黑茶中的含量差异不显著,而在乌龙茶中含量偏低;α-紫罗兰酮在除绿茶以外的茶样中均可被检测到,但含量在所有挥发性萜类化合物中最低,且茶样间无明显差异。
3 讨论
正如引言所述,部分挥发性萜类化合物的对映异构体在极端的理化条件下会发生消旋化现象,所以茶叶加工过程对萜类化合物的立体构型分布也可能有一定影响。然而,笔者研究团队的前期研究表明,在红茶的加工过程中,R及S型芳樟醇的含量变化趋势基本保持一致[19];且来自食品其他领域的研究也表明在温和的pH条件及一定的温度范围内,萜类化合物对映异构体较少会发生相互转化的现象[27-28]。因此,初步推测在茶叶的加工过程中,虽然萜类化合物对映异构体的含量会随着加工进程的推进而发生明显变化,但其立体构型发生相互转化的可能性相对较小。鉴于茶叶加工过程中发生的生化反应繁多且复杂,环境因素(如温度、水分、pH等)多样化,且萜类化合物的稳定性也不尽相同,故具体影响情况还有待深入研究。
在含量分布上,芳樟醇氧化物在大部分茶叶中的含量往往仅次于芳樟醇,它们的形成与茶叶的加工过程有着紧密联系。芳樟醇氧化物主要由茶鲜叶中以糖苷形式存在的结合态香气化合物在β-葡萄糖苷酶及β-樱草糖苷酶等水解酶的催化作用下水解形成(图 8-A)[29]:杀青过程中温度的升高、萎调过程中由于失水和呼吸作用导致的鲜叶细胞增透性增大,以及做青过程中鲜叶碰撞导致的细胞组织机械损伤,均会使水解酶的活性增强,从而使芳樟醇氧化物从糖苷结合态逐渐游离出;在茶叶揉捻及发酵阶段,在外力作用的推动下,茶叶组织及细胞得到充分破碎,使酶和糖苷态化合物更好地结合在一起,从而生成了大量游离态的芳樟醇氧化物[2,30]。此外,也有报道表明,芳樟醇氧化物可能部分来源于芳樟醇的氧化作用(图 8-B):芳樟醇在加工过程中首先被氧化为环氧化物中间体,经过重排反应(中间体的C3-羟基与C-6或C-7形成醚键)形成呋喃型芳樟醇氧化物(A、B)以及吡喃型芳樟醇氧化物(C、D)[31]。由于糖苷态化合物自身含量差异、转化反应的化学选择性及位阻效应等因素[32],茶叶中呋喃型芳樟醇氧化物的含量往往高于吡喃型氧化物,这与本试验的分析结果较为吻合。其他萜类化合物在茶叶加工过程中亦有类似图8-A的形成过程,此外,来自鲜叶中的其他化合物也会在加工过程中发生复杂化学反应转化形成具有宜人香气的萜类化合物,也正是这些丰富的化学反应对茶叶香气的形成起着重要的推动作用[2]。
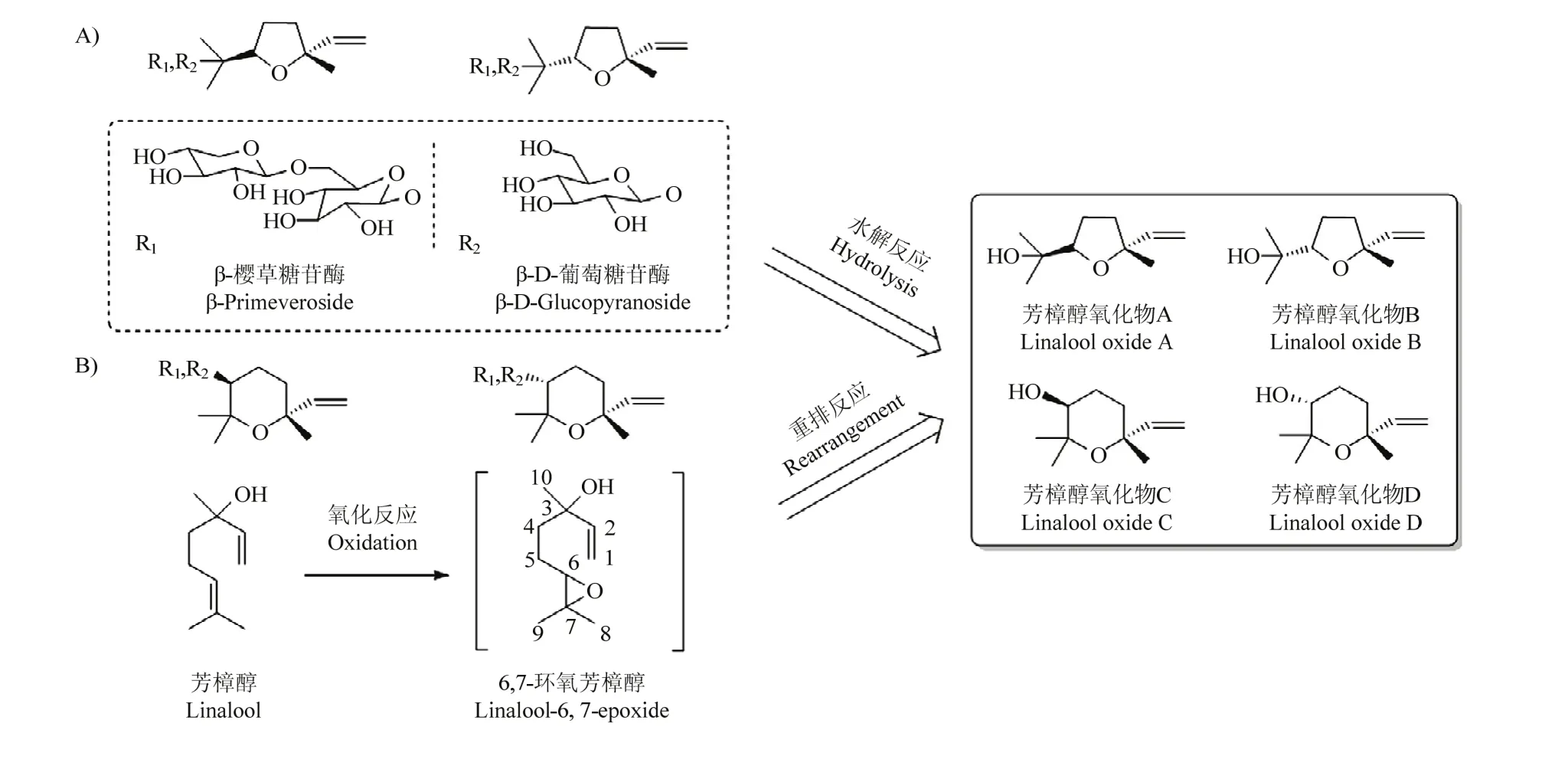
图8 A)[29]芳樟醇氧化物糖苷前体的水解反应;B)[32]芳樟醇的氧化、重排反应Fig. 8 A) The hydrolysis reactions of glycoside precursors of linalool oxides; B) The oxidation and rearrangement reactions of linalool
此外,本研究中部分萜类化合物(如芳樟醇氧化物、α-紫罗兰酮)的绝对构型由于缺乏标准品而无法确定,在后续工作中也将化学合成相应标准品,并结合各构型的萜类化合物的香气特征及阈值对其进行深入分析,进而明确挥发性萜类化合物对茶叶香气的具体贡献。
4 结论
采用HS-SPME技术结合手性GC-MS法首次建立了茶叶中9种常见挥发性萜类化合物对映异构体的手性分析及定量分析方法,查明了不同种类的代表性茶样中挥发性萜类化合物的对映异构体组成及含量值。本研究从立体化学及精确定量层面上深入分析茶叶香气的化学实质,为今后茶叶香气品质调控、茶叶产地判别以及质量认证等奠定了科学理论基础。然而,由于茶样来源、类别不同,试验结果未有明显规律性,后续研究中将扩大样本量,针对特定的茶叶种类、不同茶树品种及加工方式的茶叶进行系统且深入的研究,以阐明萜类化合物对映异构体的分布规律及形成转化机理等。
[1] 张正竹, 施兆鹏, 宛晓春. 萜类物质与茶叶香气(综述). 安徽农业大学学报, 2000, 27(1): 51-54.
ZHANG Z Z, SHI Z P, WAN X C. Terpenes and tea aroma (Summary). Journal of AnHui Agricultural University, 2000, 27(1): 51-54. (in Chinese)
[2] 宛晓春. 茶叶生物化学. 北京: 中国农业出版社, 2003. WAN X C. Tea Biochemistry. Beijing: China Agriculture Press, 2003. (in Chinese)
[3] OHLOFF G, KLEIN E. Die absolute konfiguration des linalools durch verknüpfung mit dem pinansystem. Tetrahedron, 1962, 18(1): 37-42.
[4] PADRAYUTTAWAT A, YOSHIZAWA T, TAMURA H, TOKUNAGA T. Optical isomers and odor thresholds of volatile constituents in Citrus sudachi. Food Science and Technology International, 1997, 3(4): 402-408.
[5] KURODA K, INOUE N, ITO Y, KUBOTA K, SUGIMOTO A, KAKUDA T, FUSHIKI T. Sedative effects of the jasmine tea odor and(R)-(−)-linalool, one of its majorodor components, on autonomic nerve activity and mood states. European Journal of Applied Physiology, 2005, 95: 107-114.
[6] QUATTRINI F, BIRESSI, G, JUZA M, MAZZOTTI M, FUGANTIC C, MORBIDELLIA M. Enantiomer separation of α-ionone using gas chromatography with cyclodextrin derivatives as chiral stationary phases. Journal of Chromatography A, 1999, 865: 201-210.
[7] 王秀红, 贾崇荣, 万宏, 欧庆瑜. 多维气相色谱用于手性对映体的分离. 分析化学, 1993, 21(5): 495-499.
WANG X H, JIA C R, WAN H, Ou Q Y. Multidimensional gas chromatography for chiral separation of enantiomers. Analytical chemistry, 1993, 21(5): 495-499. (in Chinese)
[8] SCHIPILLITI L, DUGO P, BONACCORSI I, MONDELLO L. Headspace-solid phasemicroextraction coupled to gas chromatographycombustion-isotope ratio mass spectrometer and to enantioselective gas chromatography for strawberry flavoured food quality control. Journal of Chromatography A, 2011, 1218: 7481-7486.
[9] BONNLÄNDER B, CAPPUCCIO R, LIVERANI F S, WINTERHALTER P. Analysis of enantiomeric linalool ratio in green and roasted coffee. Flavour and Fragrance Journal, 2006, 21(4): 637-641.
[10] LUANA F, MOSANDL A, GUBESCH M, WÜSTM M. Enantioselective analysis of monoterpenes in different grape varieties during berry ripening using stir bar sorptive extraction- and solid phase extractionenantioselective-multidimensional gas chromatography-mass spectrometry. Journal of Chromatography A, 2006, 1112: 369-374.
[11] ŠPÁNIK I, PAŽITNÁ A, ŠIŠKA B, SZOLCSÁNYI P. The determination of botanical origin of honeys based on enantiomer distribution of chiral volatile organic compounds. Food Chemistry, 2014, 158: 497-503.
[12] WINTER M, SUNDT E. Recherches sur les arǒmes. 5e communication. Analyse de I'arǒme des framboises. I. Les constituants carbonylés volatils. Helvetica Chimica Acta, 1962, 45(6): 2195-2211.
[13] BICCHI C, D’AMATO A, RUBIOLO P. Cyclodextrin derivatives as chiral selectors for direct gas chromatographic separation of enantiomers in the essential oil, aroma and flavour fields. Journal of Chromatography A, 1999, 843: 99-121.
[14] MOSANDL A. Authenticity assessment: A permanent challenge in food flavor and essential oil analysis. Journal of Chromatographic Science, 2004, 42: 440-449.
[15] CAGLIERO C, BICCHI C, CORDERO C, RUBIOLO P, SGORBINI B, LIBERTO E. Fast headspace-enantioselective GC-mass spectrometricmultivariate statistical method for routine authentication of flavoured fruit foods. Food Chemistry, 2012, 132: 1071-1079.
[16] CASABIANCA H, GRAFF J B, FAUGIER V, FLEIG F, GRENIER C. Enantiomeric distribution studies of linalool and linalyl Acetate: a powerful tool for authenticity control of essential oils. Journal of High Resolution Chromatography, 1998, 21(2): 107-112.
[17] WANG D, ANDO K, MORITA K, KUBOTA K, KOBAYASHI A. Optical isomers of linalool and linalool oxides in tea aroma. Bioscience Biotechnology and Biochemistry, 1994, 58(11): 2050-2053.
[18] 杨停, 朱荫, 吕海鹏, 马成英, 张悦, 施江, 刘爽, 林智. 茶叶香气成分中芳樟醇旋光异构体的分析. 茶叶科学, 2015, 35(2): 137-144.
YANG T, ZHU Y, LV H P, MA C Y, SHI J, LIU S, LIN Z. Analysis of optical isomers of linalool in tea aromatic components. Tea Science, 2015, 35(2): 137-144. (in Chinese)
[19] YANG T, ZHU Y, SHAO C. Y, ZHANG Y, SHI J, LV H P, LIN Z. Enantiomeric analysis of linalool in teas using headspace solidphasemicroextraction with chiral gas chromatography. Industrial Crops and Products, 2016, 83: 17-23.
[20] 朱荫, 杨停, 施江, 余方林, 戴伟东, 谭俊峰, 郭丽, 张悦, 彭群华,吕海鹏, 林智. 西湖龙井茶香气成分的全二维气相色谱-飞行时间质谱分析. 中国农业科学, 2015, 48(20): 4120-4146.
ZHU Y, YANG T, SHI J, YU F L, DAI W D, TAN J F, GUO L, ZHANG Y, PENG Q H, LV H P, LIN Z. Analysis of aroma components in Xihu Longjing tea by comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry. Scientia Agricultura Sinica, 2015, 48(20): 4120-4146. (in Chinese)
[21] 尤田耙. 手性化合物的现代研究方法. 合肥: 中国科技大学出版社, 1993: 4.
YOU T B. Modern Methods of Chiral Compounds. Hefei: University of Science and Technology of China Press, 1993: 4. (in Chinese)
[22] 龙立梅, 宋沙沙, 李柰, 樊琛, 李小波, 曹学丽. 3种名优绿茶特征香气成分的比较及种类判别分析. 食品科学, 2015, 36(2): 114-119.
LONG L M, SONG S S, LI N, FAN C, LI X B, CAO X L. Comparisons of characteristic aroma components and cultivar discriminant analysis of three varieties of famous green tea. Food Science, 2015, 36(2): 114-119. (in Chinese)
[23] 方维亚, 陈萍. 不同地区红茶特异性香气成分比较研究. 茶叶, 2014, 40(3): 138-145.
FANG W Y, CHEN P. A comparative study of specific areas of blacktea aroma components. Tea, 2014, 40(3): 138-145. (in Chinese)
[24] 何华锋, 朱宏凯, 董春旺, 叶阳, 桂安辉, 高明珠. 黑茶香气化学进展. 茶叶科学, 2015, 35(2): 121-129.
HE H F, ZHU H K, DONG C W, YE Y, GUI A H, GAO M Z. Progress of black tea aroma chemical. Tea Science, 2015, 35(2): 121-129. (in Chinese)
[25] BRICOUT J, VIANI R, MÜGGLER-CHAVAN F, MARION J P, REYMOND D, EGLI R H. Sur la composition de l'arôme de thé noir II. Helvetica Chimica Acta, 1967, 50: 1517-1522.
[26] 俞少娟, 李鑫磊, 王婷婷, 金心怡. 白茶香气及萎凋工艺对其形成影响的研究进展. 茶叶通讯, 2015, 42(4): 14-18.
YU S J, LI X L, WANG T T, JIN X Y. Advances white tea aroma and withering influence their formation process. Tea Communication, 2015, 42(4): 14-18. (in Chinese)
[27] SCHMARR H, ENGEL K. Analysis and stereodifferentiation of linalool in Theobroma cacao and cocoa products using enantioselective multidimensional gas chromatography. European Food Research & Technology, 2012, 235(5): 827-834.
[28] DEMYTTENAERE J C R, VANOVERSCHELDE J, KIMPE N D. Biotransformation of (R)-(+)- and (S)-(-)-citronellol by Aspergillus sp. and Penicillium sp., and the use of solid-phase microextraction for screening. Journal of Chromatography A, 2004, 1027(1/2): 137-146.
[29] HO C T, ZHENG X, LI S M. Tea aroma formation. Food Science and Human Wellness, 2015, 4(1): 9-27.
[30] 王华夫, 竹尾忠一, 伊奈和夫, 李名君. 祁门红茶的香气特征. 茶叶科学, 1993, 13(1): 61-68.
WANG H F, ZHU W Z Y, YI N H F, LI M J. The aroma characteristics of Keemun Black Tea. Tea Science, 1993, 13(1): 61-68. (in Chinese)
[31] YANG Z, BALDERMANN S, WATANABE N. Recent studies of the volatile compounds in tea. Food Research International, 2013, 53(2): 585-599.
[32] 谷运璀, 钱莉群, 李步详, 宦月琴. 芳樟醇氧化物的合成. 香料香精化妆品, 2013(S1): 28-31.
GU Y C, QIAN L Q, LI B X, HUAN Y Q. Synthesis of linalool oxide. Flavour Fragrance Cosmetics, 2013(S1): 28-31. (in Chinese)
(责任编辑 赵伶俐)
Enantiomeric Analysis of Volatile Terpenoids in Different Teas
SHAO ChenYang1,2, LÜ HaiPeng1, ZHU Yin1, ZHANG Yue1, LIN Zhi1
(1Tea Research Institute, Chinese Academy of Agricultural Sciences/Key Laboratory of Tea Biology and Resource Utilization of Ministry of Agriculture, Hangzhou 310008;2Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081)
【Objective】 Volatile terpenoids are important components of tea aroma, and most of them contain chiral carbon structure which lead to the existence of corresponding enantiomers with different aroma characteristics. Identifying the terpenoid enantiomers among different teas can result in a better understanding of the mechanisms underlying tea aroma formation for tea quality improvement. 【Method】 An analytical approach for enantiomeric analysis of volatile terpenoids in tea was firstlyestablished by headspace solid phase microextraction combined with chiral gas chromatography-mass spectrometry. The chiral capillary column of Supelco β-DEX110 was used for terpenoid enantiomer analyses with corresponding authentic standards. And the compositions of enantiomers of terpenoids in representative green teas, black teas, oolong teas, white teas and dark teas were then investigated. 【Result】 Nine pairs of terpenoids enantiomers were successfully separated. The data of experiment indicated that linalool and linalool oxide B enantiomers were detected in all tea samples with high contents: S-linalool was considered as the major configuration of linalool in most kinds of teas, except for Yingde and Yunnan black teas and Indonesia white tea, which contained R-(-)-linalool as the major configuration of linalool; linalool oxide B presented the same stereo configuration in green tea, black tea, white tea and dark tea, whereas in some oolong teas (Lingtou Dancong and Wenshan Baozhong) a higher proportion of opposite configuration existed. Linalool oxide A was detected in green and dark teas with the same major stereo configuration, while it presented reverse major configuration in some black teas (Keemun and Darjeeling black teas) and oolong teas (Shuixianwudong Dancong and Tieguanyin). The single and consistent configurations of linalool oxides C and D were observed in most tea samples. The other important terpenoids distributed in various situations among different tea samples: α-pinene was only detected in the Lapsang Souchong tea, and the major configuration was S. Different configurations and various enantiomeric excess values of α-terpineol were observed in different teas. R-(-)-4-terpineol was the major configurations of 4-terpineol in all tea samples, and S-(+)-4-terpineol could only be detected in the Liu Pao tea (dark tea), and a single R-configuration of α-ionone could be detected in most teas (except green teas). The quantitative results indicated that the highest contents in tea aroma of most tea samples were contributed by linalool, and the ranking order of mean contents of linalool was white tea>black tea>oolong tea>green tea>dark tea. The contents of linalool oxide B frequently second to those of linalool, and the ranking order of mean contents was black tea>white tea>oolong tea>dark tea>green tea. The contents of other terpenoids were generally lower than 100 ng·g-1, and the content distributions were widely different among various tea samples. 【Conclusion】This study investigated the content variations of the nine pairs of important terpenoid enantiomers in different kinds of tea for the first time. The present research result could contribute to get a deeper understanding of the chemical substances of tea aroma, and provide a new thought for the quality control of tea aroma, the discrimination of tea cultivars and origins and quality certification of tea.
tea; volatile terpenoids; enantiomers; gas chromatography-mass spectrometry; enantiomeric excess
2016-07-22;接受日期:2016-12-08
浙江省自然科学基金(LQ15C160007,LY14C160002)、现代农业产业技术体系建设专项(CARS-23)、中国农业科学院创新工程(CAASASTIP-2014-TRICAAS)
联系方式:邵晨阳,Tel:0571-86593701;E-mail:shaocy@tricssa.com。通信作者朱荫,Tel:0571-87967281;E-mail:zhuy_scu@tricaas.com。通信作者林智,Tel:0571-86650617;E-mail:linzhi@caas.cn

